Chinese Journal of Tissue Engineering Research ›› 2019, Vol. 23 ›› Issue (2): 317-322.doi: 10.3969/j.issn.2095-4344.0650
Previous Articles Next Articles
Collagen as a medical biomaterial in tissue repair, regeneration and reconstruction
Hu Kang1, Zhang Wei2
- 1Guangdong Guanhao Biomedical Materials Development Co., Ltd., Guangzhou 510530, Guangdong Province, China; 2Guanhao Biotech Co., Ltd., National Engineering Laboratory for Regenerative and Implantable Medical Devices, Guangzhou 510530, Guangdong Province, China
-
Received:2018-07-11Online:2019-01-18Published:2019-01-18 -
Contact:Zhang Wei, Mid-level engineer, Guanhao Biotech Co., Ltd., National Engineering Laboratory for Regenerative and Implantable Medical Devices, Guangzhou 510530, Guangdong Province, China -
About author:Hu Kang, Master, Guangdong Guanhao Biomedical Materials Development Co., Ltd., Guangzhou 510530, Guangdong Province, China -
Supported by:the Major Project of the National Key Research Plan for Biomedical Materials Development and Tissue Organ Repair, Replacement, No. 2016YFC1103202
CLC Number:
Cite this article
Hu Kang, Zhang Wei. Collagen as a medical biomaterial in tissue repair, regeneration and reconstruction[J]. Chinese Journal of Tissue Engineering Research, 2019, 23(2): 317-322.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks

2.1 胶原蛋白的来源 2.1.1 天然胶原 胶原蛋白来源广泛,主要存在于动物的肌腱、骨、皮肤、韧带等组织中。目前应用较广的还是以天然获取的胶原为主,一般从牛、猪、鼠、鱼类等动物的肌腱、真皮和尾巴中提取[4]。胶原蛋白的提取方法有酸法、碱法、盐法、酶法等。碱法提取易导致胶原蛋白变性且会发生消旋反应,一般医用胶原蛋白不采用此法。因组织材料中可溶性胶原蛋白含量较少,提取率不高,盐法提取也较少使用。有研究发现碱法和盐法提取的胶原蛋白三级结构被破坏,没有完整的三螺旋结 构[5]。目前,采用酸法和酶法结合提取胶原蛋白的应用较多。酸性溶剂如乙酸等,可使组织溶胀,打开其交联键,利于胶原蛋白的提取;同时,酶制剂如胃蛋白酶、胰蛋白酶、木瓜蛋白酶等具有专一性,可切断胶原分子N及C端的非胶原性肽,而不改变三螺旋结构[6-7]。受动物疾病如疯牛病、口蹄疫等影响,鱼类等水产类胶原蛋白的研究应用越来越受到关注。黄雯[8]选取淡水鱼斑点叉尾鮰和海水鱼鲅鱼皮作为原料,在pH值为6、提取温度为100 ℃、料水比为1∶10条件下得到最佳胶原蛋白得率17.59%。目前,天然胶原仍是胶原蛋白原料的主要来源。 2.1.2 人工合成胶原 虽然天然来源的胶原蛋白应用广泛,但其难以修饰,并可能产生致病和免疫不良反应及其批次间的差异性问题,人工重组合成胶原蛋白成为一种新的途径。重组类人胶原蛋白是采用生物基因工程技术将胶原蛋白的基因片段,借助工具酶拼接到适合的载体然后转移到宿主细胞中诱导表达得到,具有质量可控、加工性强、水溶性好、周期性短、较低排斥反应等优点,常见的宿主表达系统有大肠杆菌、酵母菌等。He等[9]将羟基化Ⅲ型胶原蛋白通过基因重组技术以pPIC9K质粒为载体,成功地在毕赤酵母GS115表达;通过优化菌体培养条件,在22 L发酵罐中进行大规模诱导表达,发酵培养60 h,胶原蛋白表达量最高可达 4.71 g/L[10]。此外,人工化学合成胶原蛋白也是一种来源。Kumar等[11]采用36个氨基酸残基胶原模拟多肽自组装设计,形成具有三螺旋结构的纳米胶原纤维,研究发现这种人工合成仿生胶原纤维可以黏附和激活血小板,形成凝块,促进愈合,不引起炎症反应,具有作为止血剂的潜力。 2.2 胶原蛋白的生物学特性 2.2.1 免疫原性 胶原蛋白的氨基酸为(Gly-X-Y)n周期排列,分子结构重复性高,因此虽然是大分子物质,但其抗原性较低,免疫排斥反应较少。但胶原蛋白仍然会引起免疫反应,研究发现牛跟腱来源的Ⅰ型胶原蛋白连续注射BALB/c小鼠3周,66.8 mg/kg剂量即可引起脾淋巴细胞免疫反应,可能导致偶发肝、肺损伤[12]。目前降低胶原蛋白抗原性的方法主要有酶法和超低温冻存等。酶法主要是采用蛋白酶消化去除胶原蛋白中具有抗原性的终端肽结构[13-14]。李晓辉等[15]研究超高压及酶对虹鳟鱼Ⅰ型胶原蛋白抗原性的影响,结果表明在200 MPa、25 ℃条件下处理10 min,胶原蛋白抗原性降低了42.66%;胰蛋白酶在37 ℃、pH=8.0,酶与底物质量比为1∶10时,胶原蛋白抗原性减少97.69%。超低温冻存可使抗原结构发生改变及丢失,显著降低组织抗原性和免疫原性。有研究比较了液氮冻存中不同保护剂及降温方式对心脏瓣膜组织免疫原性的影响,结果发现同时含有二甲基亚砜和硫酸软骨素冻存液中的组织免疫原性最低,此外程序控温比直接降温方式能获得更低免疫原性[16]。胶原蛋白的免疫原性去除,仍然是材料专家和临床医生关注的重点内容之一。 2.2.2 生物相容性和降解性 胶原蛋白因其组成和生物特性表现出了良好的生物相容性,与细胞周围环境有着和谐的相互作用机制,可较好地促进人体缺损组织的修复并能够参与新生组织的重建过程。将酸-酶法提取的牛跟腱胶原蛋白进行生物安全性研究,动物实验发现纯化的胶原蛋白无全身毒性,未引起接触性皮肤过敏反应,无热源反应,细胞毒性为Ⅰ级,此方法提取的胶原蛋白具有较高的安全性[17]。有研究发现,重组人胶原纳米纤维血液相容性良好,无细胞毒性;细胞支架复合培养体外实验发现,支架材料能促进成纤维细胞的黏附与增殖,细胞相容性良好;体内实验表现出低的炎症反应,具有促进创面愈合的作用[18]。同时,胶原蛋白具有稳定的三螺旋结构,多数蛋白酶仅能切断胶原蛋白侧链,但胶原蛋白酶等则能破坏胶原蛋白的螺旋结构,将其水解为小分子的多肽和氨基酸。胶原蛋白在体内降解主要受基质金属蛋白酶影响,关乎到组织的发育、形成、重塑与修复等重要过程[19]。研究发现受植入部位复杂的组织微环境和宿主反应影响,胶原蛋白在不同植入部位的降解速率有明显差异,这对平衡生物支架降解率与机体组织再生速度具有重要意义[20]。有研究制备了一种薄的机械性能稳定的非交联胶原蛋白细胞载体,植入大鼠皮下42 d,胶原蛋白载体完全被降解吸收,被自体组织替代,创面愈合过程中没有发现包囊、瘢痕形成或长期血管化和炎症[21]。 2.3 胶原蛋白的功能优化 胶原蛋白作为天然细胞外基质的主要成分,其独特的三螺旋结构和胶原纤维对(干)细胞起到较好的支持作用,为细胞的增殖、迁移等创造适宜的微环境。但是在提取过程中,胶原蛋白原有的天然交联结构会受到不同程度的破坏,缺乏足够的机械强度,在植入体内很容易被体内蛋白酶水解。为了更好地为体内缺损组织提供必要的力学支撑,通常需要在胶原分子中引入外在交联或其他材料,以保证胶原材料具有一定的机械强度和保持对蛋白酶的“惰性”。 2.3.1 交联改性 交联可影响生物材料的力学性能、吸收动力学和生物相容性与降解性。常用的交联方法有物理交联和化学交联。物理交联包括紫外光照射、高温脱水、光敏剂氧化交联等方法。研究发现,紫外线照射胶原蛋白可提供较低水平的交联度,胶原蛋白无生物功能丧失,不影响细胞的附着、铺展和增殖[22]。Bellincampi等[23]发现成纤维细胞能很好地黏附在经紫外辐射和干热处理交联的胶原纤维上,并沿着胶原纤维长轴扩散排列。张义[24]研究了将核黄素作为光敏剂用于紫外诱导鱼皮胶原蛋白交联反应,交联后的胶原膜水接触角增大,拉伸强度与拉伸系数显著提升,断裂延伸率降低。 化学交联剂主要有戊二醛、京尼平、碳二亚胺等。戊二醛是使用较早的一种醛类交联剂,能在较低浓度下与胶原交联,改善其亲水性和力学性能。研究表明,戊二醛交联可提高胶原蛋白支架机械强度而不降低其孔径或孔隙率[25]。京尼平是从栀子果实中提取的化合物,具有羟基、酯键等多种活性基团,可直接与氨基酸或蛋白质反应。Zhou等[26]采用京尼平交联Ⅱ型胶原蛋白,发现0.1%浓度的京尼平能较好地维持胶原支架的基本结构,同时提高其生物稳定性;交联后的支架能促进脂肪干细胞增殖并分化成髓核样细胞。碳化二亚胺属于酰胺型交联剂,可促进胶原蛋白的谷氨酸或天冬氨酸的羧基与氨基连接形成酰胺键。Gao等[27]比较了戊二醛和碳二亚胺交联胶原蛋白的微观结构、孔隙率、生物降解性和细胞毒性,结果发现1.2 mol/L碳二亚胺交联后,胶原支架孔隙率与水吸收率显著变小,两种交联剂交联后支架抗降解性均增强,且力学性能均得到改善;细胞毒性实验发现,浓度在1%及以上的的戊二醛对细胞有明显毒性,碳二亚胺则未表现出细胞毒性。 2.3.2 共混改性 引入其他生物材料,与胶原蛋白制成复合材料,是改进胶原蛋白力学性能的有效途径之一,常用的共混材料有羟基磷灰石、β-磷酸三钙、生物活性玻璃、壳聚糖等。羟基磷灰石是骨骼的主要无机组成成分,对骨质增生有刺激或诱导作用,能促进缺损组织的修复。Cholas等[28]采用喷雾干燥法制得平均粒径6 μm的羟基磷灰石微球,将其混合嵌入到多孔胶原蛋白基质中得到复合支架,研究发现复合支架在低应变和高应变值下的压缩模量分别为纯胶原支架的1.7倍和2.8倍,有效改善了胶原支架的力学性能。β-磷酸三钙具有较好的生物相容性和生物活性,植入体内可逐渐降解,是理想的硬组织修复和替代材料。研究发现,将β-磷酸三钙粉末引入多孔胶原基质中,有效改善了胶原支架的力学和生物学性能,能有效激活骨髓间充质干细胞分化为成骨细胞,促进血管化,并与周围组织结合良好[29]。生物玻璃是由SiO2、Na2O、CaO和P2O5组成的硅酸盐玻璃,具有骨生成性和骨引导作用,与骨和软组织都有良好的结合性。Long等[30]通过加入生物玻璃材料,解决了胶原蛋白支架在骨组织工程中力学性能不足、多孔结构在湿态下不稳定等问题,制备出骨合成所必须的生物活性和机械稳定性的复合支架,体外细胞实验表明该支架具有良好的生物相容性,有利于人骨髓基质细胞的伸展和增殖。壳聚糖是天然高分子物质,其生物相容性良好,具有抑菌、止血等功能。Raftery等[31]在胶原蛋白支架中添加壳聚糖,改善了支架的机械性能,提高了抗压强度、溶胀率,降低了降解率;当壳聚糖和胶原蛋白质量比为25∶75时,间充质干细胞的附着和增殖显著提高。 2.4 胶原蛋白在医用生物材料方面的应用 2.4.1 软组织修复材料 胶原蛋白材料具有天然的多孔网状结构,与创面接触可迅速吸附血液,促进血小板凝聚,同时吸收组织渗透液,营造良好创面微环境,促进创面愈合。目前,临床上胶原蛋白类软组织修复产品有较多,主要有胶原蛋白敷料、硬脑(脊)膜补片、人工角膜、口腔补片、疝气补片、乳房整形补片等,见表1。"

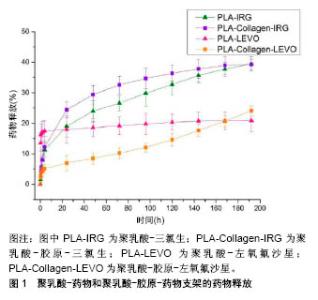
有研究比较了可吸收胶原蛋白止血海绵在腔镜甲状腺手术中的止血疗效,采用止血海绵的观察组术后12,24,48 h的甲状腺残腔引流量较对照组分别减少了122%,91%,350%,具有良好的止血效果;同时具有一定的支撑塑形和修复作用,可促进甲状腺组织修复、保持颈部外观等[32]。研究发现,胶原蛋白基三维复合活性材料敷料具有较高的生物相容性、溶胀性、孔隙率和抗菌性能,促进细胞黏附和增殖,避免伤口部位感染,加速创面愈合,是潜在的真皮替代材料[33]。雷静等[34]采用动物实验研究凝胶型活性胶原辅料对糖尿病皮肤缺损愈合的影响,结果表明胶原凝胶能明显缩小创面面积,促进血管新生,加快创面愈合;术后4周,与外敷重组人表皮生长因子凝胶的阳性对照组疗效相当。罗心凯等[35]研究发现,免缝胶原海绵人工硬脑膜在颅脑损伤修补手术中具有减压、保护脑功能等作用,且与缝合的人工硬脑膜修补术效果相当,更有利于二期颅骨修补术的开展。 2.4.2 硬组织修复材料 骨组织缺损或病变是临床上常见的一种病症,自体骨缺损过大则无法自愈,治疗方法主要包括自体骨、异体骨和人工骨移植。自体骨移植供给有限且会造成二次伤害,异体骨有感染疾病风险及免疫排斥等,因此人工骨材料具有广阔的应用前景。胶原蛋白是天然骨组织的主要有机成分,广泛应用于人工骨组织工程材料。目前临床上使用的胶原基骨组织修复材料主要为羟基磷灰石、β-磷酸三钙、生物活性玻璃与胶原蛋白等的复合物,具有良好的生物相容性及降解性,对骨缺损部位进行填充与修复,诱导自体骨再生。研究发现γ射线辐照交联可以诱导羟基磷灰石在胶原蛋白纤维上的高度矿化[36],矿化胶原与天然骨结构成分相似,相比于单纯的羟基磷灰石,可以减轻植入骨假体的炎症反应,是一种更理想的生物修复材料[37]。研究者采用可注射纳米晶磷酸钙/胶原基骨材料对老年膝关节软骨损伤进行修复,术后疼痛与膝关节功能情况均显著优于注射骨水泥的对照组;并且,术后3个月观察组的血栓栓塞、肺部感染、下肢肿胀等并发症发生率显著低于对照组,这充分表明胶原基骨修复材料能有效修复及改善膝关节软骨损伤[38]。 此外,胶原蛋白在引导骨组织再生过程中也发挥着积极作用,可在骨缺损部位形成生物屏障膜,为再生组织细胞的增殖创造良好条件。Wang等[39]研究表明,矿化胶原膜能更好地促进间充质干细胞的黏附、增殖和成骨分化,在骨诱导和骨传导方面表现优异。目前,胶原基骨修复材料产品已被成功用于人体骨缺损及骨缝充填重建等,表现出了良好的临床治疗效果。 2.4.3 药物释放载体材料 研究者们通过控制胶原材料的结构实现对药物的缓慢释放,延长药物在体内的作用时间,以达到更好的药物治疗效果。Hall等[40]研制胶原-聚乳酸基纳米纤维控制三氯生和左氧氟沙星抗菌药的释放,实验表明胶原蛋白有助于药物的持续释放达192 h,避免了药物在最初24 h内的突释现象,见图1。 图1对大肠杆菌和金黄色葡萄球菌的抑制效果显著。Chen等[41]以胶原蛋白和磷酸钙纳米颗粒制备的多孔复合材料为载体,控制地塞米松缓释,材料具有高机械强度和可控互连的孔结构,在用于人骨髓间充质干细胞的三维培养,复合支架材料具有良好的生物相容性和促进人骨髓间充质干细胞的成骨分化,支架植入裸鼠背部皮下能促进异位骨组织再生。Sun等[42]用胶原蛋白复合壳聚糖、透明质酸钠制备的多孔支架控制kartogenin诱导因子释放,支架材料具有良好的生物相容性,有促进骨髓基质细胞增殖、软骨组织再生和修复软骨与周围软骨融合的能力。 2.4.4 组织工程支架 随着组织工程技术的发展,将传统的支架材料与种子细胞和生长因子结合起来,能够对一些复杂的缺损组织进行修复,甚至整个组织器官的替代移植。胶原蛋白用作组织工程支架材料,主要是为种子细胞提供良好的生存空间和微环境,细胞可按预制形态的三维支架生长并可分泌出新的细胞外基质,最终在体外制得具有一定形状和三维结构的组织或器官。Chan等[43]以Ⅰ型胶原为原料合成胶原支架,体外接种原代人血管内皮细胞,形成了清晰的CD31阳性毛细血管样结构;在小鼠体内植入支架后,促进新生血管形成,同时支架在8周后逐渐降解。Hoogenkamp等[44]采用一次铸造法生产无缝大型中空胶原基支架,模拟整个膀胱的形状,并与输尿管和尿道吻合口部位集成;发现其利于体内细胞浸润,上皮细胞和平滑肌细胞能够附着在支架上并保持其表型,细胞按照所提供的支架模板排列。有研究发现,在向成骨方向分化的人间充质干细胞与血管内皮细胞共培养体系中,胶原水凝胶支架的微环境有助于内皮细胞预血管化和早期骨组织的形成,有助于术后患者植入物与宿主血管吻合[45]。 此外,随着3D打印技术在生物医疗领域的快速发展,能精确控制生物材料、细胞、生长因子等在整体3D结构中的位置、组合与相互作用;并且3D打印技术可为患者制备出个性化的医用器械,而胶原蛋白因其来源广泛、结构稳定、可与其他材料复合使用等优点,也是3D打印中常用的原材料之一[46]。目前,3D打印技术已可制备出多种人工组织器官,如髋关节、颅骨、具有仿生结构的血管、完整耳郭,甚至肝脏、心脏、肾脏等复杂器官,但仍然存在可供打印原材料种类偏少、制作成本高、制备周期长等问题。Yang等[47]研究发现,以海藻酸钠和胶原为生物墨水,基于3D细胞打印软骨组织工程复合支架,复合支架能明显促进细胞黏附,促进细胞增殖和增强软骨特异性基因的表达,有效抑制软骨细胞去分化和维持表型。 "
| [1] Pawelec KM, Best SM, Cameron RE. Collagen: a network for regenerative medicine. J Mater Chem B Mater Biol Med. 2016; 4(40):6484-6496. [2] Sellem PH, Caranzan FR, Bene MC, et al. Immunogenicity of Injectable Collagen Implants. Dermatol Surg. 2013;13(11): 1199-1203. [3] Delgado L, Bayon Y, Pandit A, et al. To cross-link or not to cross-link? Cross-linking associated foreign body response of collagen-based devices. Tissue Eng Part B Rev. 2015;21(3):298. [4] Avila RM, Rodriguez BL, Sanchez ML. Collagen: A review on its sources and potential cosmetic applications J Cosmet Dermatol. 2018;17(1):20-26. [5] 温慧芳,陈丽丽,白春清,等.基于不同提取方法的鮰鱼皮胶原蛋白理化性质的比较研究[J].食品科学,2016,37(1):74-81.[6] 刘迪,王利强,任莹.猪跟腱胶原蛋白酶法提取工艺的研究[J].食品工业,2017,39(10):72-77.[7] 冯文婕,赵粼,阙斐.酸酶复合法优化鱼鳞胶原蛋白的提取工艺[J].湖北农业科学,2016,55(5):1242-1246.[8] 黄雯.鮰鱼鱼皮和鲅鱼鱼皮胶原蛋白的提取与性质研究[D]. 上海:上海海洋大学,2015.[9] He J, Ma X, Zhang F, et al. New strategy for expression of recombinant hydroxylated human collagen α1(III) chains in Pichia pastoris GS115. Biotechnol Appl Biochem. 2015;62(3):293-299. [10] 李伟娜,尚子方,段志广,等.毕赤酵母高密度发酵产Ⅲ型类人胶原蛋白及其胃粘膜修复功能[J].生物工程学报, 2017,33(4):672-682.[11] Kumar VA, Taylor NL, Jalan AA, et al. A nanostructured synthetic collagen mimic for hemostasis. Biomacromolecules. 2014;15(4): 1484-1490. [12] 雷静,李奕恒,刘旭昭,等.动物源Ⅰ型胶原蛋白可引起BALB/c小鼠细胞免疫反应和组织免疫毒性[J].中国组织工程研究, 2015,19(34): 5506-5512.[13] 王建华,贺超龙,程娘梅,等.无花果蛋白酶去除牛腱Ⅰ型胶原蛋白末端肽的工艺研究[C].第六届全国组织工程与再生医学大会, 2013.[14] Peng YY, Glattauer V, Ramshaw JA, et al. Evaluation of the immunogenicity and cell compatibility of avian collagen for biomedical applications. J Biomed Mater Res Part A. 2010; 93(4):1235. [15] 李晓辉,倪赛巧,王翀,等.超高压及酶解对虹鳟鱼Ⅰ型胶原蛋白抗原性的影响[EB/OL]. http://kns.cnki.net/kcms/detail/11.2206.TS.20180323.1016.088.html.2018-03-23.[16] 宫妍婕,王龙,董来东,等.不同冻存液及降温方式对心脏瓣膜组织学及免疫原性的影响[J].山东大学学报(医学版), 2016,54(8):44-49.[17] 李毅,王洪瑾.牛跟腱胶原蛋白提取工艺的生物安全性研究[J].中国美容整形外科杂志,2017,28(10):623-626.[18] 盛嘉隽.重组人胶原纳米纤维支架的制备及其生物相容性检测[D].上海:第二军医大学,2017.[19] Jab?ońskatrypu? A, Matejczyk M, Rosochacki S. Matrix metalloproteinases (MMPs), the main extracellular matrix (ECM) enzymes in collagen degradation, as a target for anticancer drugs. J Enzyme Inhib Med Chem. 2016;23(sup1):177-183. [20] 符锋,秦喆,李晓红,等.胶原/壳聚糖复合支架植入大鼠不同部位降解速率的变化[J].中国组织工程研究,2017,21(6):864-870.[21] Rahmanian-Schwarz A, Held M, Knoeller T, et al. In vivo biocompatibility and biodegradation of a novel thin and mechanically stable collagen scaffoldJ Biomed Mater Res A. 2014;102(4):1173-1179. [22] Davidenko N, Bax DV, Schuster CF, et al. Optimisation of UV irradiation as a binding site conserving method for crosslinking collagen-based scaffolds. J Mater Sci Mater Med. 2016;27(1):14. [23] Bellincampi LD, Dunn MG. Effect of crosslinking method on collagen fiber‐fibroblast interactions. J Appl Polym Sci. 2015; 63(11):1493-1498. [24] 张义.不同交联剂对胶原蛋白可食膜性能的影响[D]. 天津:天津科技大学,2016.[25] Perez-Puyana V, Romero A, Guerrero A. Influence of collagen concentration and glutaraldehyde on collagen-based scaffold properties. J Biomed Mater Res A. 2016;104(6):1462-1468. [26] Zhou X, Tao Y, Chen E, et al. Genipin-cross-linked type II collagen scaffold promotes the differentiation of adipose-derived stem cells into nucleus pulposus-like cells. J Biomed Mater Res A. 2018; 106(5):1258-1268. [27] Gao S, Yuan Z, Guo W, et al. Comparison of glutaraldehyde and carbodiimides to crosslink tissue engineering scaffolds fabricated by decellularized porcine menisci. Mater Sci Eng C. 2017;71: 891-900. [28] Cholas R, Kunjalukkal P S, Gervaso F, et al. Scaffolds for bone regeneration made of hydroxyapatite microspheres in a collagen matrix Mater Sci Eng C. 2016, 63:499-505. [29] Baheiraei N, Nourani MR, Mortazavi S, et al. Development of a bioactive porous collagen/beta-tricalcium phosphate bone graft assisting rapid vascularization for bone tissue engineering applications. J Biomed Mater Res A. 2018;106(1):73-85. [30] Long T, Yang J, Shi SS, et al. Fabrication of three-dimensional porous scaffold based on collagen fiber and bioglass for bone tissue engineering. J Biomed Mater Res B Appl Biomater. 2015;103(7):1455-1464. [31] Raftery RM, Woods B, Marques ALP, et al. Multifunctional Biomaterials from the Sea: Assessing the effects of Chitosan incorporation into Collagen Scaffolds on Mechanical and Biological Functionality. Acta Biomaterialia. 2016;43:160-169. [32] 鲁瑶.可吸收胶原蛋白止血海绵在腔镜甲状腺手术中的止血疗效[J].中国医药科学,2014,4(17):196-197.[33] Ramanathan G, Singaravelu S, Muthukumar T, et al. Design and characterization of 3D hybrid collagen matrixes as a dermal substitute in skin tissue engineering Mater Sci Eng C Mater Biol Appl. 2017;72:359-370. [34] 雷静,刘旭昭,陈淡嫦,等.凝胶型胶原敷料修复糖尿病皮肤缺损及促进血管再生[J].中国组织工程研究,2014,18(52):8456-8462.[35] 罗心凯,陈治标,陈谦学.免缝胶原海绵人工硬脑膜在颅脑损伤大骨瓣减压术中的应用[J].中国临床神经外科杂志, 2016,21(6):357-358.[36] Du T, Niu X, Li Z, et al. Crosslinking induces high mineralization of apatite minerals on collagen fibers. Int J Biol Macromol. 2018;113: 450-457. [37] Shi XD, Chen LW, Li SW, et al. The observed difference of RAW264. 7 macrophage phenotype on mineralized collagen and hydroxyapatite. Biomed Mater. 2018;13(4):041001. [38] 芶印尧,祝少博.可注射性生物复合材料修复老年膝关节软骨损伤的应用分析[J].实用药物与临床,2017,20(3):280-283.[39] Wang Y, Hua Y, Zhang Q, et al. Using biomimetically mineralized collagen membranes with different surface stiffness to guide regeneration of bone defects. J Tissue Eng Regen Med. 2018; 12(7):1545-1555. [40] Hall BI, Paladino E, Szabo P, et al. Electrospun collagen-based nanofibres: A sustainable material for improved antibiotic utilisation in tissue engineering applicationsInt J Pharm. 2017; 531(1):67-79. [41] Chen Y, Kawazoe N, Chen G. Preparation of dexamethasone- loaded biphasic calcium phosphate nanoparticles/collagen porous composite scaffolds for bone tissue engineering. Acta Biomater. 2017;67:341-353. [42] Sun X, Wang J, Wang Y, et al. Collagen-based porous scaffolds containing PLGA microspheres for controlled kartogenin release in cartilage tissue engineering. Artif Cells Nanomed Biotechnol. 2017:1-10. [43] Chan EC, Kuo SM, Kong AM, et al. Three Dimensional Collagen Scaffold Promotes Intrinsic Vascularisation for Tissue Engineering Applications. PLoS One. 2016;11(2):e0149799. [44] Hoogenkamp HR, Pot MW, Hafmans TG, et al. Scaffolds for whole organ tissue engineering: Construction and in vitro evaluation of a seamless, spherical and hollow collagen bladder construct with appendices. Acta Biomater. 2016;43:112-121. [45] Nguyen BB, Moriarty RA, Kamalitdinov T, et al. Collagen hydrogel scaffold promotes mesenchymal stem cell and endothelial cell coculture for bone tissue engineering. J Biomed Mater Res A. 2017;105(4):1123-1131. [46] Lee H, Yang GH, Kim M, et al. Fabrication of micro/nanoporous collagen/dECM/silk-fibroin biocomposite scaffolds using a low temperature 3D printing process for bone tissue regeneration Mater Sci Eng C Mater Biol Appl. 2018;84:140-147. [47] Yang X, Lu Z, Wu H, et al. Collagen-alginate as bioink for three-dimensional (3D) cell printing based cartilage tissue engineering. Mater Sci Eng C Mater Biol Appl. 2018;83:195-201. [48] 唐洪,刘俊利,朱长宝,等.碳化二亚胺作为胶原蛋白交联剂的生物安全性评价[J].中华实验外科杂志,2015,32(10):2510-2513.[49] 谢玥,王晨,邱东.戊二醛对成骨细胞毒性的研究[J].明胶科学与技术, 2014,34(3):130-135.[50] Casali DM, Yost MJ, Matthews MA. Eliminating Glutaraldehyde from Crosslinked Collagen Films using Supercritical CO2. J Biomed Mater Res Part A. 2017;106(1):86-94. [51] 夏磊磊,毅陈,门福民,等.不同组织来源的胶原蛋白生物材料物理性能对比研究[J].材料科学,2017,7(4):431-439.[52] 阮功成,曹慧,徐斐,等.不同来源胶原蛋白抗冻活性的研究[J].食品科学,2014,35(17):22-26.[53] Drzewiecki KE, Malavade JN, Ahmed I, et al. A thermoreversible, photocrosslinkable collagen bio-ink for free-form fabrication of scaffolds for regenerative medicine Technology (Singap World Sci). 2017;5(4):185-195. |
| [1] | Zhang Tongtong, Wang Zhonghua, Wen Jie, Song Yuxin, Liu Lin. Application of three-dimensional printing model in surgical resection and reconstruction of cervical tumor [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(9): 1335-1339. |
| [2] | Shen Jinbo, Zhang Lin. Micro-injury of the Achilles tendon caused by acute exhaustive exercise in rats: ultrastructural changes and mechanism [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1190-1195. |
| [3] | Liang Xueqi, Guo Lijiao, Chen Hejie, Wu Jie, Sun Yaqi, Xing Zhikun, Zou Hailiang, Chen Xueling, Wu Xiangwei. Alveolar echinococcosis protoscolices inhibits the differentiation of bone marrow mesenchymal stem cells into fibroblasts [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 996-1001. |
| [4] | Duan Liyun, Cao Xiaocang. Human placenta mesenchymal stem cells-derived extracellular vesicles regulate collagen deposition in intestinal mucosa of mice with colitis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1026-1031. |
| [5] | Zeng Yanhua, Hao Yanlei. In vitro culture and purification of Schwann cells: a systematic review [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1135-1141. |
| [6] | Xu Dongzi, Zhang Ting, Ouyang Zhaolian. The global competitive situation of cardiac tissue engineering based on patent analysis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(5): 807-812. |
| [7] | Wu Zijian, Hu Zhaoduan, Xie Youqiong, Wang Feng, Li Jia, Li Bocun, Cai Guowei, Peng Rui. Three-dimensional printing technology and bone tissue engineering research: literature metrology and visual analysis of research hotspots [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 564-569. |
| [8] | Chang Wenliao, Zhao Jie, Sun Xiaoliang, Wang Kun, Wu Guofeng, Zhou Jian, Li Shuxiang, Sun Han. Material selection, theoretical design and biomimetic function of artificial periosteum [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 600-606. |
| [9] | Liu Liu, Zhou Qingzhu, Gong Zhuo, Liu Boyan, Yang Bin, Zhao Xian. Characteristics and manufacturing techniques of collagen/inorganic materials for constructing tissue-engineered bone [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 607-613. |
| [10] | Liu Fei, Cui Yutao, Liu He. Advantages and problems of local antibiotic delivery system in the treatment of osteomyelitis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 614-620. |
| [11] | Li Xiaozhuang, Duan Hao, Wang Weizhou, Tang Zhihong, Wang Yanghao, He Fei. Application of bone tissue engineering materials in the treatment of bone defect diseases in vivo [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 626-631. |
| [12] | Zhang Zhenkun, Li Zhe, Li Ya, Wang Yingying, Wang Yaping, Zhou Xinkui, Ma Shanshan, Guan Fangxia. Application of alginate based hydrogels/dressings in wound healing: sustained, dynamic and sequential release [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 638-643. |
| [13] | Chen Jiana, Qiu Yanling, Nie Minhai, Liu Xuqian. Tissue engineering scaffolds in repairing oral and maxillofacial soft tissue defects [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 644-650. |
| [14] | Li Jun, Zuo Xinhui, Liu Xiaoyuan, Zhang Kai, Han Xiangzhen, He Huiyu, . Effect of over expression of miR-378a on osteogenic and vascular differentiation of bone marrow mesenchymal stem cell sheet [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(31): 4939-4944. |
| [15] | Xing Hao, Zhang Yonghong, Wang Dong. Advantages and disadvantages of repairing large-segment bone defect [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(3): 426-430. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||