Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (19): 3111-3116.doi: 10.12307/2024.164
Interaction between autophagy and mesenchymal stem cells in treatment of neurodegenerative diseases
Xiao Yi1, Lu Shuo1, Ge Lite2, Lu Ming1
- 1Second Affiliated Hospital of Hunan Normal University (921 Hospital), Hunan Provincial Key Laboratory of Neurorestoratology, Changsha 410003, Hunan Province, China; 2Department of Neurology, Second Xiangya Hospital, Central South University, Changsha 410003, Hunan Province, China
-
Received:2023-04-14Accepted:2023-06-05Online:2024-07-08Published:2023-09-26 -
Contact:Lu Ming, Chief physician, Doctoral supervisor, Second Affiliated Hospital of Hunan Normal University (921 Hospital), Hunan Provincial Key Laboratory of Neurorestoratology, Changsha 410003, Hunan Province, China Ge Lite, Assistant researcher, Department of Neurology, Second Xiangya Hospital, Central South University, Changsha 410003, Hunan Province, China -
About author:Xiao Yi, Master candidate, Second Affiliated Hospital of Hunan Normal University (921 Hospital), Hunan Provincial Key Laboratory of Neurorestoratology, Changsha 410003, Hunan Province, China -
Supported by:Key Research and Development Project of Hunan Province, No. 2020SK2102 (to LM); Graduate Research and Innovation Project of Hunan Education Department, No. CX20220528 (to XY)
CLC Number:
Cite this article
Xiao Yi, Lu Shuo, Ge Lite, Lu Ming. Interaction between autophagy and mesenchymal stem cells in treatment of neurodegenerative diseases[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(19): 3111-3116.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
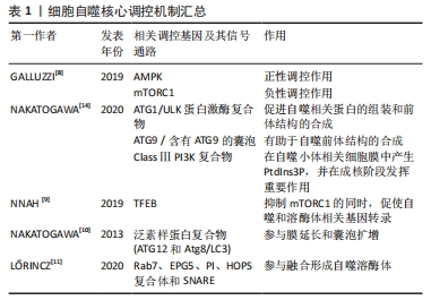
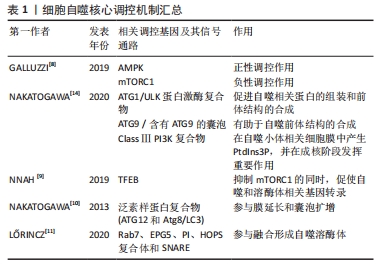
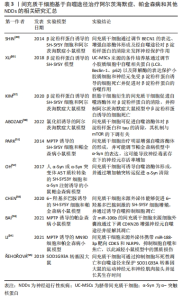
2.1 细胞自噬及其分子机制 自噬是由比利时生物化学家Christian de Duve于1963年提出,字面意思为“自我吞噬”,是一种进化保守的细胞内降解过程,可将螯合在双膜囊泡内的细胞质货物输送到溶酶体中进行降解。根据将细胞内容物转运到溶酶体的不同方式,分为3种类型的自噬过程:巨自噬、微自噬及伴侣介导的自噬(chaperone-mediated autophagy,CMA)[4]。巨自噬是针对细胞内外刺激的主要途径,将细胞质内容物经自噬体的双膜囊泡递送至溶酶体中进行降解[5]。微自噬则直接由溶酶体内陷或突出来隔离并降解自噬货物[6]。在CMA中,常借助伴侣热休克同源物来特异性识别含有KFERQ样基序的靶蛋白,通过溶酶体相关膜蛋白2(lysosomal associated membrane protein2,LAMP2A)寡聚形成的通道转移到溶酶体进行降解[7]。 巨自噬的形成包括多个步骤,受一系列自噬相关基因(autophagy-related gene,ATG)的调节。巨自噬的过程可以分为诱导自噬、自噬体形成、自噬体与溶酶体融合及底物降解,主要受到雷帕霉素复合物1(mammalian target of rapamycin complex 1,mTORC1)和AMP激活的蛋白激酶(AMP-dependent protein kinase,AMPK)这2种信号分子来调节自噬活性。以低能量状态为例,细胞通过抑制mTORC1和激活AMPK,产生一系列磷酸化事件正性调节ULK1/2-ATG13-FIP200复合物,随后激活VPS34-VPS15-Beclin1复合物,有利于促进自噬相关蛋白的组装和前体结构的合成,从而形成自噬前体[8]。此外,在抑制mTORC1时,伴随着核转录因子EB(transcription factor EB,TFEB)易位至细胞核,促使大量自噬和溶酶体相关基因转录,确保该途径中关键成分的合成和自噬底物的有效降解[9]。 自噬体膜的延伸涉及到2个泛素样结合系统。一方面,ATG12通过ATG7和ATG10介导的泛素样活化途径与ATG5进行共价连接后,ATG16L1与ATG5进行非共价结合,形成ATG12-ATG5-ATG16L1复合物。另一方面,由半胱氨酸蛋白酶ATG4裂解微管相关蛋白1-轻链3 (light chain3,LC3)的C-末端,生成LC3-Ⅰ,与ATG7、ATG3和ATG12-ATG5-ATG16L1发生级联反应,形成与磷脂酰乙醇胺偶联的LC3-Ⅱ,并被招募到自噬体膜上[10]。当自噬受体识别特定货物将其转运到自噬小体后,成熟的自噬体被运输到溶酶体附近,由一些融合因子如单体GTP酶7(targeting GTPase7,Rab7)、异位P颗粒自噬蛋白5同源物(ectopic P-granules 5,EPG5)、HOPS复合体(homotypic fusion and vacuole protein sorting,HOPS)、可溶性N-乙基马来酰亚胺敏感因子附着蛋白受体(soluble N-ethylmaleimide–sensitive factor attachment protein receptor,SNARE)以及磷酸肌醇(phosphatidylinositol,PI)等参与融合形成自噬溶酶体来降解自噬溶酶体中的内容物[11]。 微自噬与巨自噬不同,该类型不涉及转运中间体,是直接由溶酶体降解物质的过程。目前,对微自噬的分子调控机制的研究主要集中在底物识别、吞噬和降解方面。其中,泛素化和ATG8主要参与底物的识别过程。泛素化是微自噬一种上游信号,而 ATG8酰化则有助于将蛋白质和细胞器传递给内溶酶体。识别后,通过SNARE复合体、ESCRT复合体以及细胞器之间的膜接触位点等方式对货物进行吸收隔离,最后被溶酶体水解酶降解,该过程主要由mTORC1和TFEB调控[12]。 CMA是一种选择性的自噬降解形式,其选择性取决于底物蛋白中的靶向基序,即一种与KFERQ具有生化相似性的五肽序列。因此,也可通过翻译后修饰使底物蛋白去除或携带KFERQ样基序来调节CMA的水平。在CMA过程中,该序列首先在细胞质基质中被伴侣蛋白HSCP70识别,靶向触发该自噬途径中溶酶体外膜上的LAMP2A多聚化形成易位复合物,并与内膜上的Lys-HSP90结合,维持复合体的稳定性。这种蛋白复合体允许底物蛋白质被摄入到溶酶体腔中进行降解。随后,由Lys-Hsc70和延伸因子1α诱导LAMP2A多聚体分解为单体形式,允许新底物的结合。LAMP2A作为转运底物蛋白的中间体,在溶酶体中的状态很大程度上决定溶酶体水解酶降解的速率[13]。 细胞自噬核心调控机制汇总见表1。"
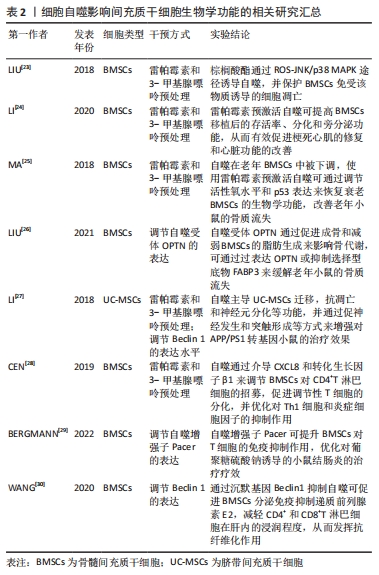
2.2 细胞自噬与MSCs的联系 2.2.1 MSCs的生物学特性 MSCs被定义为具有自我更新能力的贴壁成纤维样细胞群体,即在特定条件下实现体外扩增且不改变其细胞表型[15]。最早在骨髓中被发现,也可在脂肪、脐血、牙髓、滑膜、鼻黏膜和毛囊等其他生物组织中提取。由于MSCs表现出极低的免疫原性和多功能生物学特征,受到密切关注[16-18]。 作为一种具有跨系分化能力的细胞,MSCs可在特定微环境下向不同类型的神经细胞分化,这提示使用MSCs来源的细胞类型来替换受损的神经组织,可促进再生修复[19]。此外,MSCs具有优先迁移到损伤区域的特性,通过旁分泌效应对损伤区域中的驻留细胞产生营养支持作用,有利于神经再生及其组织功能恢复[20]。此外,MSCs具有很强的免疫调节能力,能够通过细胞间接触、分泌多种可溶性细胞因子和释放细胞外囊泡(extracellular vesicles,EVs)等方式调控免疫反应,抑制神经炎症级联反应,减少体内斑块负荷和细胞死亡,同时为神经细胞的修复与再生提供良好微环境,有望成为NDDs的有效治疗方法[21]。 2.2.2 细胞自噬对MSCs的影响 在过去的20多年里,MSCs已经广泛应用于治疗各类疾病,包括NDDs,但其大部分功能在体外长期扩增或移植后暴露于恶劣微环境时会不可避免地受到影响[22]。有研究显示,在应激条件下,MSCs的自噬活性会有所增加,这可能是应对环境压力的一种保护机制。棕榈酸酯是一种常见的饱和脂肪酸,该物质在致使骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)发生凋亡的同时,伴随着信号通路ROS-JNK/p38 MAPK的激活和自噬通量的改变,并且将其与自噬激活剂雷帕霉素共培养后,能够显著减少由棕榈酸酯诱导的细胞凋亡[23]。后续有研究者将经雷帕霉素处理后的MSCs移植到心肌梗死的大鼠模型中,发现可有效提高MSCs在移植后的存活率;与未处理的MSCs相比,心肌梗死面积和心脏功能也得到明显恢复,可能归因于旁分泌因子的增加[24]。因此,使用雷帕霉素预激活自噬可能是改善MSCs移植效率的可行策略。 MSCs的干性被认为是一种多潜能状态,主要包括自我更新和多分化潜能这两大部分,但细胞内外应激和衰老等因素似乎会损害 MSCs 的特征。有证据表明,来源于老年供体的BMSCs自我更新和三系分化能力呈现出下降趋势,自噬受体OPTN缺陷也会导致BMSCs发生衰老,使体内骨质流失增加,然而对BMSCs进行自噬激活后可逆转上述现象,并恢复衰老MSCs的生物学特性,这提示经自噬途径维持MSCs的干性成为一种可能[25-26]。同时,LI等[27]已证实MSCs也需要自噬来保证基本治疗特性。该学者发现自噬能够主导MSCs的迁移、抗凋亡和神经元分化等功能,且抑制自噬会减弱MSCs促神经发生、突触形成以及清除β淀粉样蛋白等效应,使其丧失对APP/PS1转基因小鼠原有的治疗效果,这有助于进一步明确自噬与MSCs之间的功能关联。 已有证据表明自噬参与MSCs的免疫调控过程,进而强化对各种疾病的治疗疗效,但当前对其机制的研究主要集中在对T淋巴细胞的调节作用方面。CEN等[28]采用雷帕霉素和3-甲基腺嘌呤预调节自噬,以探究自噬在MSCs免疫调节上的作用,结果显示雷帕霉素预处理MSCs可有效促进调节性T细胞的分化及对CD4+T淋巴细胞的招募,并优化对Th1细胞和炎症细胞因子抑制作用,这一过程与CXCL8和转化生长因子β1介导的自噬活化密切相关。Pacer是一种新型自噬增强子,BERGMANN等[29]证实Pacer敲除会导致MSCs免疫调节的关键因子PTGS表达水平降低,从而减弱对T细胞的抑制作用;反之,过表达该基因则能够提升MSCs的免疫抑制效果,说明刺激自噬有利于增强MSCs的免疫调节特性。然而,最近一项涉及肝纤维化的研究报道,自噬会导致MSCs的免疫抑制和抗纤维化能力有所减弱,通过沉默基因Beclin1抑制自噬反而可以增加MSCs分泌免疫抑制递质前列腺素E2,减少CD4+和CD8+T淋巴细胞在纤维化肝脏中的浸润,使免疫抑制功能得到恢复[30]。DANG等[31]在不同疾病背景下通过敲低 MSCs中的Beclin 1后也得出类似的实验结果。由此可见,自噬对MSCs的生物学功能的影响并不唯一,调节方式和反应的信号通路不同会导致调控结果出现较大差异性。 综上所述,自噬作为细胞适应应激的机制之一,在MSCs的迁移、存活、分化、抗凋亡和免疫调控等方面发挥着显著的调节作用,通过使用基因修饰、特异性激活剂或抑制剂等方式预调节自噬,可改善MSCs在机体内外环境中的再生能力,有助于提高移植的MSCs在组织损伤中的治疗效果,但由于细胞内自噬过程及其通路较为复杂,明确细胞自噬的最佳水平范围和确切机制,并根据需要精确调控MSCs的自噬水平使其治疗效果达到最优化,对MSCs的应用研究具有重要意义,见表2。"
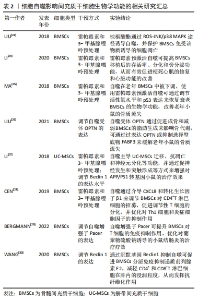
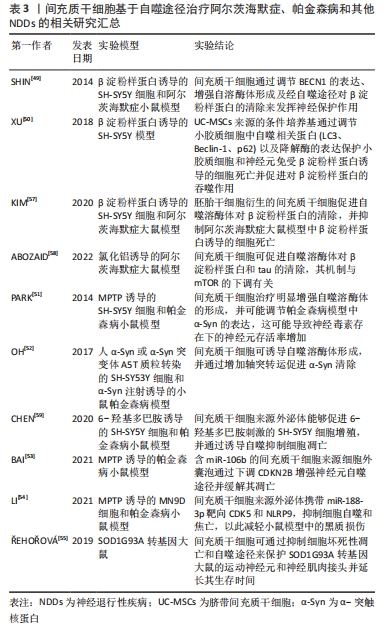
2.3 细胞自噬与神经退行性疾病的联系 2.3.1 自噬在中枢神经系统中的生理学作用 在中枢神经系统中,其主要功能依赖于神经元中蛋白质和细胞器的稳态调节和质量控制,而神经元作为有丝分裂后的细胞,并不能简单地通过细胞分裂来丢弃功能失调的细胞成分。因此,神经元需要强大的调控机制来维持体内平衡并保证细胞活性和功能[32]。自噬作为一种溶酶体降解途径,既可以选择性地吞噬异常蛋白质和受损的细胞器,将其递送到溶酶体中进行降解,防止可能导致细胞损伤和死亡的有害成分的积累,也可以通过回收利用葡萄糖、氨基酸和脂质,为细胞的生命活动提供能量,应对应激状态[33]。 研究报道,小鼠体内自噬核心基因丧失会导致胚胎或新生鼠死亡,由此已经建立多个神经系统特异性敲除小鼠模型来分析自噬在神经功能中的确切作用。已证明自噬参与神经元的存活发育、信息处理、记忆编码和认知功能等,对神经元中的核心自噬基因进行敲除则会导致轴突肿胀、受损细胞器和泛素阳性聚集体的积累、神经元发育异常以及进行性变性死亡[34-35]。例如,KUIJPERS等[36]在缺乏ATG5的小鼠中发现神经元自噬丧失会使内质网在轴突中选择性地积累,并证明自噬能够通过控制轴突内质网中的钙储存来调节健康神经元和突触前神经传递。 神经胶质细胞是神经组织中与神经元有着紧密联系的另一类细胞,神经胶质细胞的自噬障碍也会对神经元功能和健康产生影响。多发性硫酸酯酶缺乏症(multiple sulfatase deficiency,MSD)是一种严重的溶酶体储存障碍疾病,由硫酸酯酶修饰因子1基因(sulfatase modifying factor1,SUMF1)突变引起,DI MALTA 等[37]发现缺乏该基因的星形胶质细胞中有严重的溶酶体储存和自噬功能障碍,后续在与神经元共培养的实验中,发现该细胞失去支持神经元生存和功能的能力。小胶质细胞是大脑中常驻的免疫细胞,在神经系统发生炎症等应激状态时被激活,用于维持大脑稳态。XU等[38]证明ATG7的特异性缺失会使该细胞在体内过渡成促炎状态,出现脂质稳态缺陷并增加神经元中tau 蛋白扩散。同时,选择性自噬可以通过降解炎性小体NLRP3调节白细胞介素1β和白细胞介素18的产生来影响小胶质细胞活化[39]。此外,由BNIP3L介导的线粒体自噬可减轻少突胶质细胞前体细胞的氧化应激,并有效促进其向成熟少突胶质细胞分化,有利于促进中枢神经系统中的髓鞘生成[40]。 由此可见,神经胶质细胞的自噬功能是否正常决定着神经元的状态。 2.3.2 细胞自噬对神经退行性疾病的影响 衰老是神经退行性变最常见的危险因素。STAVOE等[41]发现与年轻小鼠相比较,来自老年小鼠神经元中的自噬体生物发生事件大多数表现出明显停滞,自噬囊泡也出现明显的形态学差异。这些停滞的结构遵循大部分自噬机制,但未能发展成具有LC3B阳性的自噬体。因此,年龄依赖性的自噬活性及功能降低被认为与NDDs的发生与进展有关。 早期就有文献报道,NDDs的神经组织内会出现具有潜在毒性的蛋白质累积,并导致神经细胞的生理功能逐渐丧失甚至死亡。大脑和脊髓等器官中错误折叠蛋白质的聚集或原纤维的异常积累已成为各种NDDs的病理标志,例如阿尔茨海默症中的β淀粉样蛋白、帕金森病中的SNCA/α-突触核蛋白(synuclein,α-Syn)、亨廷顿病中突变亨廷顿蛋白(mutant huntingtin,mHTT)、肌萎缩侧索硬化症中的突变型超氧化物歧化酶1(superoxide dismutase,SOD1)和TAR-DNA 结合蛋白43(TAR DNA binding protein-43,TDP-43)等[2]。许多科学家研究了自噬在NDDs中的作用,发现这些异常蛋白聚集体可作为自噬底物被清除,且自噬降解效率与聚集蛋白数量和毒性有关[42]。另外有研究报道,细胞外的α-Syn可通过Toll样受体4和下游信号P38以及 Akt-mTOR信号的级联反应破坏溶酶体和小胶质细胞的自噬活性,加剧神经炎症和帕金森病发展[43-44]。 在亨廷顿病小鼠模型中,mHTT则与线粒体自噬途径中的蛋白质产生异常相互作用,例如ULK1、BECN1、OPTN、NDP52、SQSTM1/p62和NBR1,降低神经元线粒体自噬效率,导致受损线粒体积累和氧化应激增加[45]。由此可见,这些NDDs相关缺陷蛋白可以反向损害自噬功能,加重异常物质的累积和毒性作用,形成一种恶性循环促进病情发展。 细胞自噬的水平与生物学功能同时受到多种因素的调节,部分与NDDs发病机制相关的基因显示与自噬功能有密切联系。富含亮氨酸的重复蛋白激酶2(leucine-rich repeat kinase 2,LRRK2)基因突变是家族性和散发性帕金森病最常见的原因。有学者发现在LRRK2突变小鼠胚胎的成纤维细胞中出现溶酶体功能障碍和CMA底物降解受损,导致SNCA寡聚物随年龄增长在大脑中进行性积累,这种细胞缺陷可以通过使用CMA特异性激活剂AR7矫正[46]。同样,阿尔茨海默症中PSEN1缺陷可使神经干细胞TFEB的表达降低,导致自噬溶酶体途径相关蛋白转录和翻译水平下调,这提示与NDDs有关的危险基因可破坏并抑制机体自噬反应[47]。 近来,NDDs和p62、NBR1、Ubqln2、OPTN等聚集性受体蛋白的相关性也越来越明显,这些受体蛋白的突变最终会导致选择性自噬在大脑中缺失,与在NDDs中出现的自噬功能失调一致[48]。 简而言之,自噬是各种有害聚集蛋白的主要降解途径,由于各种原因引起的自噬异常和错误折叠蛋白质沉积作为NDDs重要发病机制已经得到证实,通过调控自噬环节靶向聚集蛋白分子可能是缓解神经元死亡的一种策略。 2.4 间充质干细胞基于自噬途径治疗神经退行性疾病的作用 2.4.1 阿尔茨海默症 阿尔茨海默症是第一大神经系统变性疾病,主要表现为β淀粉样蛋白斑块沉积和Tau蛋白异常磷酸化造成的大量神经元死亡,以及大脑多个区域内突触缺失引发的认知障碍。早期MSCs已被证明能够调节阿尔茨海默症模型中的自噬溶酶体功能,由此增加β淀粉样蛋白的清除率。SHIN等[49]在β淀粉样蛋白处理后的神经母细胞瘤细胞SH-SY5Y中发现细胞活力显著下降,但自噬信号却表现为增高趋势且胞浆中出现大量未与溶酶体融合的自噬液泡。这些结果表明,细胞死亡可能与继发于自噬溶酶体形成失败的自噬功能障碍有关。然而,MSCs可通过上调Beclin-1诱导该细胞中自噬溶酶体形成来减少β淀粉样蛋白的产生,从而提高神经元的存活率。由此可见,MSCs具有重新激活自噬途径来达到神经保护效应的能力。其他研究则描述MSCs通过调节组织细胞的自噬机制来发挥其治疗作用。小胶质细胞作为大脑的第一道防线,参与受体介导的吞噬和降解,因此部分研究将β淀粉样蛋白清除效率低下归因于小胶质细胞异常。此外,β淀粉样蛋白斑块虽然会被周围激活的小胶质细胞从细胞外环境中摄取,但最终会导致该细胞死亡且释放胞内累积的寡聚蛋白体,助长斑块形成。研究结果显示脐带间充质干细胞来源的条件培养基可以保护小胶质细胞和神经元免受β淀粉样蛋白诱导的细胞死亡并促进对β淀粉样蛋白的吞噬作用,这与小胶质细胞中自噬相关蛋白以及降解酶的表达上调有关[50]。 2.4.2 帕金森病 一些报告表明自噬在帕金森病的发病机制中占据重要地位,自噬系统功能紊乱可能导致α-Syn在细胞内异常聚集,调节细胞本身的自噬可针对大脑受损区域内的选择性破坏机制延缓帕金森病进展。其研究初期主要认为MSCs在干预帕金森病细胞和动物模型后,可以通过显著增强晚期自噬空泡的成熟并与溶酶体融合形成自噬溶酶体,降低α-Syn的异常表达,并且显示MSCs的神经保护作用在很大程度上依赖于自噬溶酶体形成介导的溶酶体活性[51-52]。近年来,该方向的研究开始逐渐涉及到MSCs的旁分泌效应产物,即EVs对自噬水平的调控。 miR-106b是帕金森病患者EVs中下调的miRNAs之一,被证实与自噬有密切相互作用。因此,BAI等[53]利用神经毒素MPTP 诱导帕金森病模型,探究脐带间充质干细胞释放的EVs是否能作为载体将miR-106b传递到神经元中,由此对机体自噬调控产生正向效应,结果显示含miR-106b的Evs可挽救帕金森病小鼠中多巴胺能神经元的损失,其LC3Ⅱ/LC3Ⅰ比值和Bcl-2具有更高的表达趋势。CDKN2B是miR-106b下游的结合因子,在帕金森病神经元中呈现过表达状态,导致神经元自噬被抑制并加剧细胞凋亡。EVs-miR-106b则通过负调控CDKN2B来改善帕金森病小鼠的病理状态和行为缺陷。另外一项研究却在上述帕金森病模型中发现自噬水平出现病理性升高,导致神经炎症加重致使大量细胞死亡。来源于脂肪间充质干细胞的外泌体则携带miR-188-3p直接靶向帕金森病发病机制相关的CDK5和NLRP9,抑制细胞自噬和焦亡,以此减轻小鼠模型中的黑质损伤[54]。在同一疾病条件下所观察到的这种现象差异,可能是MSCs作为类似于一种负反馈机制来调节机体中的自噬稳态来达到治疗目的,这提示机体需要保持一种基本的自噬平衡才能维持正常运行,其干预效应呈现反差,原因可能是特定条件下的影响机制不同。 2.4.3 其他神经退行性疾病 目前,MSCs通过调节细胞自噬对亨廷顿病和肌萎缩侧索硬化症等其他NDDs的影响和保护作用机制的相关研究报道较少,但这些疾病同样存在上述自噬稳态严重失调的情况。有学者将MSCs经鞘内和肌肉内移植至出现症状的SOD1G93A大鼠体内后,发现MSCs能够通过抑制细胞坏死性凋亡和自噬途径来保护运动神经元和神经肌肉接头并延长其生存时间。然而,该结果与其他研究中所提出的上调自噬达到治疗效果的研究相悖,是否与该领域崇尚的自噬平衡有关尚不可知[55]。由于文献中针对MSCs调控细胞自噬的水平高低和具体机制未阐明,以上结论仍需进一步证实。但鉴于自噬失调在这些NDDs中产生的不利影响可被其他类型的自噬调节剂抑制,且MSCs被陆续测定存在一种启动细胞自噬的内在调节机制,可能会为这类疾病的个性化疗法开辟新途径[56]。 MSCs基于自噬途径治疗阿尔茨海默症、帕金森病和其他NDDs的研究汇总见表3。"
| [1] SHARIATI A, NEMATI R, SADEGHIPOUR Y, et al. Mesenchymal stromal cells (MSCs) for neurodegenerative disease: A promising frontier. Eur J Cell Biol. 2020;99(6):151097. [2] DJAJADIKERTA A, KESHRI S, PAVEL M, et al. Autophagy Induction as a Therapeutic Strategy for Neurodegenerative Diseases. J Mol Biol. 2020;432(8):2799-2821. [3] CECCARIGLIA S, CARGNONI A, SILINI AR, et al. Autophagy: a potential key contributor to the therapeutic action of mesenchymal stem cells. Autophagy. 2020;16(1):28-37. [4] PARK H, KANG JH, LEE S. Autophagy in Neurodegenerative Diseases: A Hunter for Aggregates. Int J Mol Sci. 2020;21(9):3369. [5] GRIFFEY CJ, YAMAMOTO A. Macroautophagy in CNS health and disease. Nat Rev Neurosci. 2022;23(7):411-427. [6] ABDRAKHMANOV A, GOGVADZE V, ZHIVOTOVSKY B. To Eat or to Die: Deciphering Selective Forms of Autophagy. Trends Biochem Sci. 2020;45(4):347-364. [7] KAUSHIK S, CUERVO AM. The coming of age of chaperone-mediated autophagy. Nat Rev Mol Cell Biol. 2018;19(6):365-381. [8] GALLUZZI L, GREEN DR. Autophagy-Independent Functions of the Autophagy Machinery. Cell. 2019;177(7):1682-1699. [9] NNAH IC, WANG B, SAQCENA C, et al. TFEB-driven endocytosis coordinates MTORC1 signaling and autophagy. Autophagy. 2019;15(1):151-164. [10] NAKATOGAWA H. Two ubiquitin-like conjugation systems that mediate membrane formation during autophagy. Essays Biochem. 2013;55:39-50. [11] LŐRINCZ P, JUHÁSZ G. Autophagosome-Lysosome Fusion. J Mol Biol. 2020;432(8): 2462-2482. [12] SCHUCK S. Microautophagy - distinct molecular mechanisms handle cargoes of many sizes. J Cell Sci. 2020;133(17):jcs246322. [13] LIAO Z, WANG B, LIU W, et al. Dysfunction of chaperone-mediated autophagy in human diseases. Mol Cell Biochem. 2021;476(3):1439-1454. [14] NAKATOGAWA H. Mechanisms governing autophagosome biogenesis. Nat Rev Mol Cell Biol. 2020;21(8):439-458. [15] OKOLICSANYI RK, CAMILLERI ET, OIKARI LE, et al. Human Mesenchymal Stem Cells Retain Multilineage Differentiation Capacity Including Neural Marker Expression after Extended In Vitro Expansion. PLoS One. 2015;10(9):e0137255. [16] NAJI A, EITOKU M, FAVIER B, et al. Biological functions of mesenchymal stem cells and clinical implications. Cell Mol Life Sci. 2019;76(17):3323-3348. [17] XIAO C, LU D, CHEN J, et al. Human Olfactory Mesenchymal Stem Cells Are a Novel Candidate for Neurological Autoimmune Disease. Front Pharmacol. 2021; 12:770884. [18] WANG B, LIU XM, LIU ZN, et al. Human hair follicle-derived mesenchymal stem cells: Isolation, expansion, and differentiation. World J Stem Cells. 2020;12(6): 462-470. [19] ZHUO Y, WANG L, GE L, et al. Hypoxic Culture Promotes Dopaminergic-Neuronal Differentiation of Nasal Olfactory Mucosa Mesenchymal Stem Cells via Upregulation of Hypoxia-Inducible Factor-1α. Cell Transplant. 2017;26(8):1452-1461. [20] SUMARWOTO T, SUROTO H, MAHYUDIN F, et al. Role of adipose mesenchymal stem cells and secretome in peripheral nerve regeneration. Ann Med Surg (Lond). 2021;67:102482. [21] CONE AS, YUAN X, SUN L, et al. Mesenchymal stem cell-derived extracellular vesicles ameliorate Alzheimer’s disease-like phenotypes in a preclinical mouse model. Theranostics. 2021;11(17):8129-8142. [22] HU C, LI L. Preconditioning influences mesenchymal stem cell properties in vitro and in vivo. J Cell Mol Med. 2018;22(3):1428-1442. [23] LIU Y, WANG N, ZHANG S, et al. Autophagy protects bone marrow mesenchymal stem cells from palmitate‑induced apoptosis through the ROS‑JNK/p38 MAPK signaling pathways. Mol Med Rep. 2018;18(2):1485-1494. [24] LI ZH, WANG YL, WANG HJ, et al. Rapamycin-Preactivated Autophagy Enhances Survival and Differentiation of Mesenchymal Stem Cells After Transplantation into Infarcted Myocardium. Stem Cell Rev Rep. 2020;16(2):344-356. [25] MA Y, QI M, AN Y, et al. Autophagy controls mesenchymal stem cell properties and senescence during bone aging. Aging Cell. 2018;17(1):e12709. [26] LIU ZZ, HONG CG, HU WB, et al. Autophagy receptor OPTN (optineurin) regulates mesenchymal stem cell fate and bone-fat balance during aging by clearing FABP3. Autophagy. 2021;17(10):2766-2782. [27] LI W, LI K, GAO J, et al. Autophagy is required for human umbilical cord mesenchymal stem cells to improve spatial working memory in APP/PS1 transgenic mouse model. Stem Cell Res Ther. 2018;9(1):9. [28] CEN S, WANG P, XIE Z, et al. Autophagy enhances mesenchymal stem cell-mediated CD4+ T cell migration and differentiation through CXCL8 and TGF-β1. Stem Cell Res Ther. 2019;10(1):265. [29] BERGMANN CA, BELTRAN S, VEGA-LETTER AM, et al. The Autophagy Protein Pacer Positively Regulates the Therapeutic Potential of Mesenchymal Stem Cells in a Mouse Model of DSS-Induced Colitis. Cells. 2022;11(9):1503. [30] WANG HY, LI C, LIU WH, et al. Autophagy inhibition via Becn1 downregulation improves the mesenchymal stem cells antifibrotic potential in experimental liver fibrosis. J Cell Physiol. 2020;235(3):2722-2737. [31] DANG S, XU H, XU C, et al. Autophagy regulates the therapeutic potential of mesenchymal stem cells in experimental autoimmune encephalomyelitis. Autophagy. 2014;10(7):1301-1315. [32] KULKARNI A, CHEN J, MADAY S. Neuronal autophagy and intercellular regulation of homeostasis in the brain. Curr Opin Neurobiol. 2018;51:29-36. [33] LEVINE B, KROEMER G. Biological Functions of Autophagy Genes: A Disease Perspective. Cell. 2019;176(1-2):11-42. [34] SUMITOMO A, TOMODA T. Autophagy in neuronal physiology and disease. Curr Opin Pharmacol. 2021;60:133-140. [35] KUMA A, KOMATSU M, MIZUSHIMA N. Autophagy-monitoring and autophagy-deficient mice. Autophagy. 2017;13(10):1619-1628. [36] KUIJPERS M, KOCHLAMAZASHVILI G, STUMPF A, et al. Neuronal Autophagy Regulates Presynaptic Neurotransmission by Controlling the Axonal Endoplasmic Reticulum. Neuron. 2021;109(2):299-313.e9. [37] DI MALTA C, FRYER JD, SETTEMBRE C, et al. Astrocyte dysfunction triggers neurodegeneration in a lysosomal storage disorder. Proc Natl Acad Sci U S A. 2012;109(35):E2334-E2342. [38] XU Y, PROPSON NE, DU S, et al. Autophagy deficiency modulates microglial lipid homeostasis and aggravates tau pathology and spreading. Proc Natl Acad Sci U S A. 2021;118(27):e2023418118. [39] HOUTMAN J, FREITAG K, GIMBER N, et al. Beclin1-driven autophagy modulates the inflammatory response of microglia via NLRP3. EMBO J. 2019;38(4):e99430. [40] YAZDANKHAH M, GHOSH S, SHANG P, et al. BNIP3L-mediated mitophagy is required for mitochondrial remodeling during the differentiation of optic nerve oligodendrocytes. Autophagy. 2021;17(10):3140-3159. [41] STAVOE AK, GOPAL PP, GUBAS A, et al. Expression of WIPI2B counteracts age-related decline in autophagosome biogenesis in neurons. Elife. 2019;8:e44219. [42] RAHMAN MA, RHIM H. Therapeutic implication of autophagy in neurodegenerative diseases. BMB Rep. 2017;50(7):345-354. [43] TU HY, YUAN BS, HOU XO, et al. α-synuclein suppresses microglial autophagy and promotes neurodegeneration in a mouse model of Parkinson’s disease. Aging Cell. 2021;20(12):e13522. [44] HOFFMANN AC, MINAKAKI G, MENGES S, et al. Extracellular aggregated alpha synuclein primarily triggers lysosomal dysfunction in neural cells prevented by trehalose. Sci Rep. 2019;9(1):544. [45] FRANCO-IBORRA S, PLAZA-ZABALA A, MONTPEYO M, et al. Mutant HTT (huntingtin) impairs mitophagy in a cellular model of Huntington disease. Autophagy. 2021;17(3):672-689. [46] HO PW, LEUNG CT, LIU H, et al. Age-dependent accumulation of oligomeric SNCA/α-synuclein from impaired degradation in mutant LRRK2 knockin mouse model of Parkinson disease: role for therapeutic activation of chaperone-mediated autophagy (CMA). Autophagy. 2020;16(2):347-370. [47] CHONG CM, KE M, TAN Y, et al. Presenilin 1 deficiency suppresses autophagy in human neural stem cells through reducing γ-secretase-independent ERK/CREB signaling. Cell Death Dis. 2018;9(9):879. [48] DENG Z, PURTELL K, LACHANCE V, et al. Autophagy Receptors and Neurodegenerative Diseases. Trends Cell Biol. 2017;27(7):491-504. [49] SHIN JY, PARK HJ, KIM HN, et al. Mesenchymal stem cells enhance autophagy and increase β-amyloid clearance in Alzheimer disease models. Autophagy. 2014;10(1):32-44. [50] XU Z, NAN W, ZHANG X, et al. Umbilical Cord Mesenchymal Stem Cells Conditioned Medium Promotes Aβ25-35 phagocytosis by Modulating Autophagy and Aβ-Degrading Enzymes in BV2 Cells. J Mol Neurosci. 2018;65(2):222-233. [51] PARK HJ, SHIN JY, KIM HN, et al. Neuroprotective effects of mesenchymal stem cells through autophagy modulation in a parkinsonian model. Neurobiol Aging. 2014;35(8):1920-1928. [52] OH SH, LEE SC, KIM DY, et al. Mesenchymal Stem Cells Stabilize Axonal Transports for Autophagic Clearance of α-Synuclein in Parkinsonian Models. Stem Cells. 2017;35(8):1934-1947. [53] BAI X, DONG Q, ZHAO L, et al. microRNA-106b-containing extracellular vesicles affect autophagy of neurons by regulating CDKN2B in Parkinson’s disease. Neurosci Lett. 2021;760:136094. [54] LI Q, WANG Z, XING H, et al. Exosomes derived from miR-188-3p-modified adipose-derived mesenchymal stem cells protect Parkinson’s disease. Mol Ther Nucleic Acids. 2021;23:1334-1344. [55] ŘEHOŘOVÁ M, VARGOVÁ I, FOROSTYAK S, et al. A Combination of Intrathecal and Intramuscular Application of Human Mesenchymal Stem Cells Partly Reduces the Activation of Necroptosis in the Spinal Cord of SOD1G93A Rats. Stem Cells Transl Med. 2019;8(6):535-547. [56] LUO F, SANDHU AF, RUNGRATANAWANICH W, et al. Melatonin and Autophagy in Aging-Related Neurodegenerative Diseases. Int J Mol Sci. 2020;21(19):7174. [57] KIM DY, CHOI SH, LEE JS, et al. Feasibility and Efficacy of Intra-Arterial Administration of Embryonic Stem Cell Derived-Mesenchymal Stem Cells in Animal Model of Alzheimer’s Disease. J Alzheimers Dis. 2020;76(4):1281-1296. [58] ABOZAID OAR, SALLAM MW, AHMED ESA. Mesenchymal Stem Cells Modulate SIRT1/MiR-134/ GSK3β Signaling Pathway in a Rat Model of Alzheimer’s Disease. J Prev Alzheimers Dis. 2022;9(3):458-468. [59] CHEN HX, LIANG FC, GU P, et al. Exosomes derived from mesenchymal stem cells repair a Parkinson’s disease model by inducing autophagy. Cell Death Dis. 2020;11(4):288. |
| [1] | Chen Kaijia, Liu Jingyun, Cao Ning, Sun Jianbo, Zhou Yan, Mei Jianguo, Ren Qiang. Application and prospect of tissue engineering in treatment of osteonecrosis of the femoral head [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1450-1456. |
| [2] | Qi Xue, Li Jiahui, Zhu Yuanfeng, Yu Lu, Wang Peng. Abnormal modification of alpha-synuclein and its mechanism in Parkinson’s disease [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1301-1306. |
| [3] | Wang Ji, Zhang Min, Li Wenbo, Yang Zhongya, Zhang Long. Effect of aerobic exercise on glycolipid metabolism, skeletal muscle inflammation and autophagy in type 2 diabetic rats [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1200-1205. |
| [4] | Zhou Bangyu, Li Jie, Ruan Yushang, Geng Funeng, Li Shaobo. Effects of Periplaneta americana powder on motor function and autophagic protein Beclin-1 in rats undergoing spinal cord hemisection [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1223-1228. |
| [5] | Sheng Siqi, Xie Lin, Zhao Xiangyu, Jiang Yideng, Wu Kai, Xiong Jiantuan, Yang Anning, Hao Yinju, Jiao Yun. Involvement of miR-144-3p in Cbs+/- mouse hepatocyte autophagy induced by high-methionine diet [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1289-1294. |
| [6] | Huang Yuxin, Liang Wenzi, Chen Xiuwen, Ni Na, Zhao Yinglin, Lin Changmin. Role of autophagy in hair regeneration [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1112-1117. |
| [7] | Ma Shuwei, He Sheng, Han Bing, Zhang Liaoyun. Exosomes derived from mesenchymal stem cells in treatment of animals with acute liver failure: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1137-1142. |
| [8] | Feng Ruiqin, Han Na, Zhang Meng, Gu Xinyi, Zhang Fengshi. Combination of 1% platelet-rich plasma and bone marrow mesenchymal stem cells improves the recovery of peripheral nerve injury [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 985-992. |
| [9] | Qiu Xiaoyan, Li Bixin, Li Jingdi, Fan Chuiqin, Ma Lian, Wang Hongwu. Differentiation of insulin-producing cells from human umbilical cord mesenchymal stem cells infected by MAFA-PDX1 overexpressed lentivirus [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1000-1006. |
| [10] | Liu Qiwei, Zhang Junhui, Yang Yuan, Wang Jinjuan. Role and mechanism of umbilical cord mesenchymal stem cells on polycystic ovary syndrome [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1015-1020. |
| [11] | Li Longyang, Zhang Songjiang, Zhao Xianmin, Zhou Chunguang, Gao Jianfeng. Electroacupuncture intervention on the proliferation and differentiation of hippocampal neurons and oligodendrocytes in Alzheimer’s disease model mice [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1029-1035. |
| [12] | Pan Xiaolong, Fan Feiyan, Ying Chunmiao, Liu Feixiang, Zhang Yunke. Effect and mechanism of traditional Chinese medicine on inhibiting the aging of mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1091-1098. |
| [13] | Zhang Kefan, Shi Hui. Research status and application prospect of cytokine therapy for osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(6): 961-967. |
| [14] | Xue Jingwen, Wang Fangfang, Zhang Xin, Pang Ruifeng, Wang Xiaoye, Ma Xiaoru. Effect of ganoderma spore on mitochondrial autophagy and apoptosis in testicular tissue of diabetic rats [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 562-568. |
| [15] | Wei Yuanxun, Chen Feng, Lin Zonghan, Zhang Chi, Pan Chengzhen, Wei Zongbo. The mechanism of Notch signaling pathway in osteoporosis and its prevention and treatment with traditional Chinese medicine [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 587-593. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||