Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (3): 419-425.doi: 10.12307/2023.971
Previous Articles Next Articles
Strategy and significance of Chinese medicine combined with medical hydrogel for disease treatment
Bi Yujie1, 2, Ma Dujun1, 2, Peng Liping1, Zhou Ziqiong1, Zhao Jing1, Zhu Houjun1, Zhong Qiuhui1, Yang Yuxin1
- 1The Fourth Clinical Medical College of Guangzhou University of Chinese Medicine, Shenzhen 518033, Guangdong Province, China; 2Guangzhou University of Chinese Medicine, Guangzhou 510006, Guangdong Province, China
-
Received:2022-12-07Accepted:2023-01-16Online:2024-01-28Published:2023-07-10 -
Contact:Ma Dujun, Master, Associate chief physician, Master’s supervisor, The Fourth Clinical Medical College of Guangzhou University of Chinese Medicine, Shenzhen 518033, Guangdong Province, China; Guangzhou University of Chinese Medicine, Guangzhou 510006, Guangdong Province, China -
About author:Bi Yujie, Master candidate, The Fourth Clinical Medical College of Guangzhou University of Chinese Medicine, Shenzhen 518033, Guangdong Province, China; Guangzhou University of Chinese Medicine, Guangzhou 510006, Guangdong Province, China -
Supported by:National Natural Science Foundation of China, No. 81804124 (to MDJ); Shenzhen Sanming Engineering Team Hospital Project, No. SMGC20220704 (to MDJ)
CLC Number:
Cite this article
Bi Yujie, Ma Dujun, Peng Liping, Zhou Ziqiong, Zhao Jing, Zhu Houjun, Zhong Qiuhui, Yang Yuxin. Strategy and significance of Chinese medicine combined with medical hydrogel for disease treatment[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 419-425.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks

2.2 医用水凝胶类型及其应用 水凝胶的分类方式多种多样,可以根据水凝胶的制作原料、制作方法、水凝胶的物理状态、水凝胶的特性等方式进行分类,不同的分类方式有不同的结果,以下为较为代表性的综合分类方式。 2.2.1 可注射水凝胶 是具有一定的流动性、能够通过注射的方法应用的一种水凝胶,在给药前处于流动的溶胶状态,可分为物理水凝胶和化学水凝胶。化学水凝胶通过光聚合、二硫键形成等化学反应发生溶胶向凝胶的转变,在此过程中会发生显著的体积变化。而物理水凝胶则是由聚合物在温度和pH值等环境刺激下表现出溶胶向凝胶的转变,但体积变化不明显[7]。凭借着水凝胶提供微创治疗的条件特性,可注射性水凝胶广泛应用在生物医学中,包括药物传递、组织工程和再生医学[8-9]。通过原位注射与温敏凝胶形成药物释放系统,能够靶向、持续释放药物,特别适合关节内给药、瘤内给药、镇痛、局部麻醉和微创治疗,具有使心脏修复的潜力[10-11]。有研究使用携带胰岛素和成纤维细胞的可注射水凝胶用于糖尿病大鼠的伤口,可加速伤口修复[12]。 2.2.2 互穿网络结构水凝胶 该水凝胶分为半互穿网络结构水凝胶和互穿网络结构水凝胶,前者可以有效地保持随pH值和温度的快速响应速率,后者更容易控制凝胶性能,应用更加有效方便。互穿网络结构水凝胶与血液相容性良好,具有更好的力学性能,从而在负载细胞和组织工程方面应用较多。互穿网络结构在作为软骨再生支架方面有着高潜力[13],在研究中应用互穿网络结构水凝胶支架作为软骨细胞培养的生物材料,使软骨细胞间的活动加强并发展成为成纤维细胞形态。 2.2.3 纳米复合水凝胶 将纳米材料如二氧化硅、二氧化钛和纳米碳管等添加到凝胶中就形成了纳米复合凝胶[14]。纳米凝胶不仅保持了纳米材料自身的功能性质,而且还将纳米材料的刚性、尺寸稳定性和热稳定性与水凝胶的软湿性能相融合,避免了纳米材料突然释放及生物黏附性差等缺点,同时也赋予水凝胶材料更好的机械性能和更灵敏的反应性,是一种极具发展前景的新材料[15-16]。使用纳米磁性颗粒三氧化二铁与纳米水凝胶交融形成磁性纳米水凝胶,可以赋予纳米水凝胶较强的力学性能,增加纳米水凝胶诱导软骨细胞分化的作用[17]。纳米复合水凝胶是具有良好生物相容性和骨传导性能的仿生材料,在神经组织工程、皮肤组织工程、软骨组织工程及骨组织工程中应用广泛。 2.2.4 智能水凝胶 是指对环境刺激具有可逆响应性,在水中可以溶胀的凝胶,当水凝胶所处的环境刺激因素,如温度、pH值、光和磁场等发生变化时,水凝胶的形状、力学、光学、渗透速率及识别性能随之发生敏锐响应,即突跃性变化,并随着刺激因素可逆性变化,水凝胶的突跃性变化也具有可逆性,可应用于医用敷料、药物缓释及组织工程等方面[18-19]。有研究制造出氧化还原和pH双响应性可注射的水凝胶,实现水凝胶的溶胶-凝胶的转变[20]。还有研究利用水凝胶递送控释治疗性重组腺病毒,不仅实现了基因载体递送,而且能填充软骨缺损,使软骨修复成为可能[21]。"

2.3 医用水凝胶制备原料 医用水凝胶制备原料可分为两个方面,分别是天然原料和合成类原料。天然水凝胶原料包括明胶、海藻酸盐、胶原、纤维蛋白、透明质酸盐、琼脂糖和壳聚糖等。人工合成聚合物包括聚丙烯酸及其衍生物、聚氧化乙烯及其衍生共聚物、聚乙烯醇、聚磷睛和多肽等。为实现水凝胶具备更优异的特性,可将人工合成高分子与天然多糖类共混形成半合成水凝胶。 2.3.1 天然水凝胶原料 海藻酸盐:海藻酸钠是碘和甘露醇从褐藻类海带或马尾藻提取之后的多糖碳水化合物,是一种具有毒性低和生物相容性好特点的天然高分子材料[22]。海藻酸盐水凝胶可以通过多种方法制备,包括离子相互作用、共价交联、热凝胶化和细胞交联。通过改变交联的类型和密度,海藻酸盐水凝胶的物理和化学性质可以为各种生物医学应用而定制[23]。海藻酸盐水凝胶有较强的功能适应性可以作为生物打印墨水,组合活细胞进行3D生物打印出的组织器官可与成熟器官等效,能够应用于组织工程,使软骨、骨骼、皮肤、血管、肌肉、心脏瓣膜和神经元等组织器官的再生[24]。一项多中心随机对照临床试验结果显示,使用海藻酸盐水凝胶对晚期心力衰竭进行左心室增强可以改善患者的运动能力和症状[25]。 壳聚糖:又名N-脱乙酞几丁质,其中含有不到40%的N-乙酞基-D-氨基葡萄糖,是甲壳素经过脱乙酰过程得到的,是一种具有生物相容性的阳离子多糖。壳聚糖通过与离子的相互作用,或用戊二醛交联可形成凝胶,壳聚糖的叠氮衍生物用紫外光引发交联可形成凝胶。壳聚糖与聚阴离子电解质海藻酸钠结合形成聚电解质复合物,聚电解质复合物可用于负载电荷药物的药物缓释系统。有研究制造出的仿生壳聚糖基水凝胶可使细胞具有良好的生存率,还具有良好的力学性能,可以满足软组织工程的许多基本要求[26]。在一项壳聚糖水凝胶的生物相容性实验中,研究发现壳聚糖水凝胶作为植入物并未引起严重的炎症反应,表明壳聚糖水凝胶适合作为软骨修复的生物材料,具有作为组织工程细胞载体的巨大潜力[27]。 透明质酸盐:透明质酸是一种非硫酸化的阴离子亲水糖胺聚糖,广泛存在于脊椎动物的表皮和结缔组织中,是细胞外基质的主要成分,可提供润滑作用并在细胞增殖、分化等过程中发挥重要作用。透明质酸水凝胶可通过物理及化学途径制备,形成透明质酸化学水凝胶和透明质酸物理水凝胶。在透明质酸水凝胶基质中加入石墨烯纳米片可以延长水凝胶的降解时间,从而达到持续释放的作用[28]。原位注射携带凋亡体的透明质酸水凝胶在小鼠宫腔粘连的治疗中可以减少纤维化,促进子宫内膜的再生,这种新疗法有治疗子宫粘连疾病的巨大潜力[29]。 纤维素:是广泛存在于植物和细菌等生物中的天然多糖聚合物,纤维素分子链上存在大量羟基,易生成分子间氢键,从而使纤维素具备出色的化学稳定性及力学性能,可满足人体组织的生物力学要求,因此非常适合作为组织工程中的支架材料[30]。目前研究已制造出具有高效自修复能力与双重环境响应能力的纤维素基可注射水凝胶,还制备出可满足生物体承重组织的力学性能要求的半互穿网络水凝胶。纤维素基水凝胶性能不断发展,与多功能高分子材料结合,可形成多功能纤维素水凝胶从而具有自修复、高强度及导电等新性[31]。 其他天然高分子材料:天然高分子多糖按来源可分为植物源、动物源、微生物源、海藻胶源,其中纤维素、壳聚糖、海藻酸盐、透明质酸是目前医用水凝胶研究中比重较大的天然水凝胶原料。除此之外水凝胶原料依然多种多样,例如胶原和明胶、琼脂糖、果胶、葡聚糖及核酸分子等依然有研究应用[32-33]。虽然水凝胶在制作材料上有差异,但制作出的水凝胶在性能和应用上也有重合,见表1。"


2.3.2 人工合成聚合物 聚丙烯酸类及其衍生物:聚甲基丙烯酸2-羟乙酯(PHEMA)自在20世纪60年代被用于隐形眼镜的制作以后,现如今作为隐性眼睛材料和用于药物缓释系统广泛应用在医疗领域。聚(N-异丙基丙烯酰胺)[Poly (N-isopropylacrylamide)]简称PNIPAm,是另一类聚丙烯酸类化合物,其分子链上具有亲水基和疏水基使交联后的PNIPAm水凝胶具有温度敏感性。但PNIPAm是人工合成的高分子材料,其生物降解性较为有限,一定程度上限制了它在水凝胶领域所达到的高度,而通过与透明质酸、海藻酸盐等其他类型水凝胶原料交联的组合可以形成新形式水凝胶,改善其物理性质,比如结晶度、热灵敏度、溶胀比和机械强度等[35]。 聚乙烯醇和其他人工聚合物:聚乙烯醇分子链上包含大量的羟基,因而具有良好的水溶性。聚乙烯醇水凝胶可以通过辐射交联、化学试剂交联、反复冷冻解冻等方法制备,具有毒性低、机械性能优良、吸水量高和生物相容性好等优点。多肽、聚磷腈和聚氧化乙烯也是可以制作水凝胶的人工合成材料,合成多肽因其具有生物降解性、生物相容性和与天然蛋白的结构相似性而受到广泛关注,它通过静电相互作用和π-π堆积等非共价相互作用形成凝胶,并且通过一定的聚合方式形成响应性可注射水凝胶[36]。聚磷腈和聚氧化乙烯虽然也有研究表明有可用于组织工程的潜力,但在研究中出现率较低。"

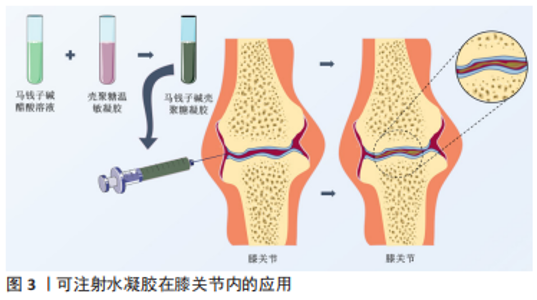
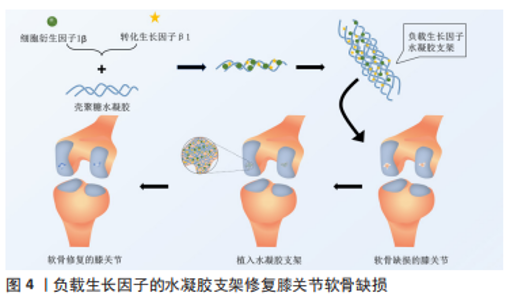
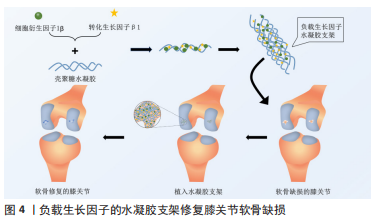
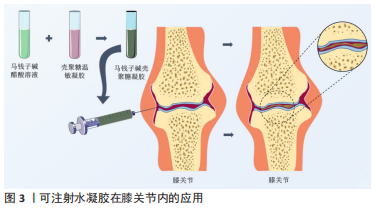
2.4 中医药与医用水凝胶的联合应用及研究策略 在传统中医药治疗疾病时,应用较为广泛的方式有中药饮片煎煮取汁口服给药、传统膏药敷贴和针灸推拿等,随着中药的创新发展,中医药不但出现了小柴胡颗粒和六味地黄丸等中成药制剂,还出现了中药注射剂,如参麦注射液等剂量精准、给药简单的新型中药剂型。生物样本分析技术的发展使阐述中药提取物多成分的药动学特征不再是难点,中药治疗疾病的成分、作用机制逐渐清晰,越来越多的中药提取物被发掘并应用于临床。由于医用水凝胶具有良好的生物相容性及高度可调等特性,近年来研究人员对医用水凝胶的探索度也逐渐增高,中医药联合水凝胶的应用很快涌现在临床和实验研究中,比如田悦等[37]以人参提取物联合三乙醇胺等物质研制出载药稳定的水凝胶。以下为中医药联合水凝胶在软组织损伤、组织器官、关节及组织工程方面论述。 2.4.1 中医药与医用水凝胶在关节内给药中的应用 骨关节炎又称骨关节病,是老年人的常见疾病,也是关节内较为主要的病变,以关节软骨的退变、破坏以及关节边缘和软骨下骨反应性增生为发病特点。中医在治疗骨关节炎方面有许多行之有效的方法,比如中药的内服外敷、针灸、推拿和练功运动等,而中医药在联合水凝胶应用于关节病的探索中同样取得了不错的成果。陈志鹏等[38]利用壳聚糖-甘油-饱和硼砂溶液与马钱子碱结合构建了具有良好的温敏凝胶系统用于大鼠关节腔注射,利用水凝胶的药物缓释性相比直接注射马钱子碱溶液降低了关节内的炎性反应,见图3。"
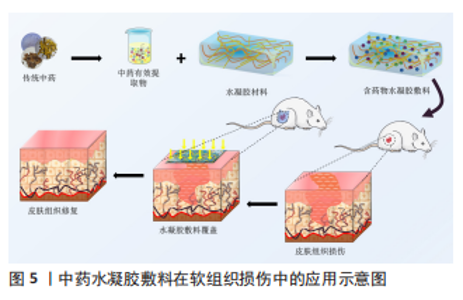
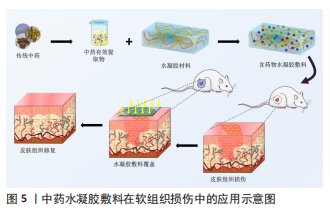
有研究者通过对针灸针的加工,制造出有螺纹结构的针灸针,螺纹针和具有黏附金属功能的水凝胶构成了螺纹针头药物递送系统,实现了软骨和皮质板物理障碍的突破,并将药物精确定位在软骨下[40]。从软骨方面着手是骨关节炎临床治疗有效途径之一,而水凝胶的应用为软骨修复提供了可能。 中医药联合水凝胶在关节内应用尚且处于实验探索阶段,根据目前的实验结论而言,智能水凝胶尤其是对温度、pH敏感的水凝胶在关节内使用较为便捷,能够在环境的变化下快速达到具有力学性能的凝胶状态,进而更好地黏附在所需用药部位,持续释放有效药用成分,但在应用的过程中需要注意水凝胶的降解环境和降解速率,争取在所负载药物完全释放或医用水凝胶在完成特定功能的同时完成降解。 2.4.2 中医药与医用水凝胶在软组织伤口修复中的应用 软组织包括全身器官、肌腱、韧带、皮肤、脂肪、肌肉及血管等,软组织内部的主要成分是水、胶原蛋白和弹性蛋白。传统中医药在治疗软组织损伤时较为常用的就是中药散剂和膏剂,水凝胶的出现为中药与水凝胶的外用联合提供了良好的材料,见图5。"

徐炜华等[41]将双柏散经水提取后制备成浸膏粉与水凝胶基质融合制备成双柏水凝胶,不仅比传统双柏散起效更快而且具有使用更加便捷、剂量更加准确的特点。中药硼砂内服可以清肺化痰,外用可以清热解毒,具有防腐、抗菌、抗病毒的作用,将硼砂与水凝胶结合可以达到水凝胶的预定凝胶时间,作为组织粘合剂使用可用于软组织和器官的缺口封闭治疗[42]。华皎等[43]将由黄柏、乳香、冰片和接骨木等八味有效中药纳入以羧甲基纤维素和海藻酸盐为主要成分水凝胶敷料中,用于临床上治疗糖尿病足取得了良好疗效,不仅加速创面的愈合而且具有镇痛效果好等优点,使中药外敷应用更加便捷。时军等[44]采用薄膜分散-探头超声法加研磨法制备丹皮酚阳离子脂质体凝胶剂,负载牡丹皮活性成分丹皮酚,使其直达真皮层,表现出脂质体凝胶可加速组织创伤修复和愈合、消除破损皮肤炎症的特点,为中药凝胶剂在皮肤病方面的治疗提供了有益的探索。在肌腱组织工程中,通过制造高度排列的水凝胶丝组成肌腱仿生三维支架,将干细胞载入水凝胶纱支架中,通过静态机械力的刺激,可以诱导干细胞向肌腱细胞的分化,证明了水凝胶在肌腱组织工程中的潜力[45]。 中医药在治疗机体软组织损伤时多应用活血化瘀之类的中医复方,再配合中药的熏洗、膏药的贴敷、手法的按摩和针灸等操作。为了避免中药熏洗的繁琐,以及由于膏药杂质引起机体发生过敏反应的弊端,在应用中医药熏洗及膏药贴敷时可进行中药有效成分与医用水凝胶敷料或其他类型水凝胶结合。研究发现水凝胶敷料具有可调节的物理和化学性能、可功能化、具有与细胞外基质类似的结构特点,并且通过改变原料、改进制备方法,可以制备出多种功能复合的新型水凝胶敷料[46],为中医药外治法提供新的应用思路。 2.4.3 中医药与医用水凝胶在组织器官疾病治疗中的应用 传统中医药治疗组织器官的功能性或实质性病变一般以口服给药为主,起效时间较为缓慢,这也与中医无创治疗的观念有关。传统中药提取物姜黄素、丹参酮ⅡA及秋水仙碱对心肌梗死有治疗作用,但是其口服给药生物利用率低或者中毒风险较高的弊端不利于在临床应用,研究人员制造出相应的敏感性水凝胶负载药物形成药物缓释系统[47],通过原位注射给药治疗心肌梗死,该系统不仅改善了药物的输送能力,避免药物毒性,还借助其良好的力学性能为受损的心脏组织提供支持。在大鼠体内实验表明负载中药的可注射水凝胶系统,能够持续稳定释放药物,保护药物不被快速降解,在改善心脏功能等方面具有良好效果[48]。 张建武[49]成功制备葛根素水凝胶,其成分只有葛根素,是现今发现的第一种能自组装形成水凝胶的天然药物,不仅具有良好的力学强度负载骨髓间充质干细胞,而且进行干细胞移植时可以提高细胞的存活率,减少细胞凋亡。利用可注射性心肌组织工程,将可注射性支架材料通过心内膜或心外膜局部注射到心肌病变位置治疗疾病,在动物心肌梗死模型中,负载骨髓间充质干细胞的葛根素水凝胶相较于对照组而言,在改善梗死后室壁厚度、减少梗死面积、减少心肌纤维化程度等方面效果更加明显,这种联合方式对未来组织工程和中医药联合水凝胶在临床中应用有重要的指导意义,见图6。"
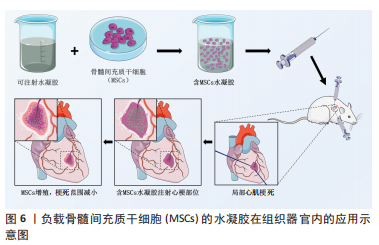
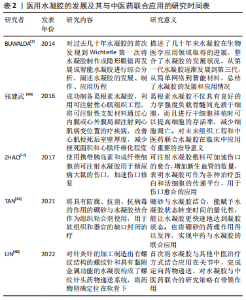
基于水凝胶载体的中药有效成分缓释给药系统的研究[50],中医药联合水凝胶在组织器官内的应用,可利用有特定疾病治疗作用的中药单体、中药复方成分与适用的医用水凝胶联合,以原位注射或有创植入等方式弥补传统中医不便的给药方式和频繁的给药次数的不足。在既有的临床研究和动物研究的基础上进行二者的结合可以更加快速的开展中医药与水凝胶的联合试验,LEE等[51]研究表明在可注射水凝胶改善心肌病患者的心脏功能的首次男性临床试验中,可注射水凝胶在心脏应用可与心肌兼容,具有可行性与安全性。贺港[52]利用可注射水凝胶负载化疗药物阿霉素,通过近红外激光响应的药物控制释放实现肿瘤微环境,通过小鼠4T1肿瘤模型验证了其通过热化疗联合治疗治愈肿瘤的能力,实现肿瘤的局部热化疗联合治疗。DUONG等[53]设计的携带癌症疫苗的可注射智能水凝胶,通过皮下注射可在身体局部募集免疫细胞,增强局部免疫反应,对小鼠的黑色素瘤提供了明显的预防效果,这种方式可能是治疗晚期癌症强有力的替代方案。因医用水凝胶具有良好的生物相容性和载药性,以此类方法实现病变部位微环境进而治疗疾病,中医药联合医用水凝胶应用会有更广阔的发展空间。 2.4.4 中医药与医用水凝胶在组织工程方面的应用 凭借着良好的基因、细胞负载能力,医用水凝胶在组织工程中的探索也越来越多,并取得一定的实验成果。由葛根素制造的葛根素水凝胶通过负载骨髓间充质干细胞,在葛根素抗氧化等作用下为骨髓间充质干细胞提供了良好的增殖环境,提高了细胞存活率,改善了心肌梗死模型动物的心脏功能,见图6。 黄芪多糖可以促进组织工程骨的快速血管化和骨化[54],鹿茸多肽可以促进骨髓间充质干细胞的增殖和成骨分化[55]。红景天苷可以保护细胞免受缺氧损伤,在结合骨髓间充质干细胞的实验中可以提高骨髓间充质干细胞的存活率,修复损伤的脊髓神经元[56]。补肾中药黄芪、丹参、淫羊藿、荆芥制备的血清可以诱导骨髓间充质干细胞增殖[57]。淫羊藿提取物淫羊藿苷,可以增强软骨细胞的活性,促进相关基因表达以促进软骨生长。这些中医药联合水凝胶在组织工程方面的应用,表现出了中医药和水凝胶在组织工程方面联合的可行性,为中医药应用于组织工程、破损组织修复方面提供了研究基础。 传统中医在组织工程的方面应用不足,而联合医用水凝胶为其提供了新的方法。在应用时可以结合中药类别、水凝胶类型、细胞组织在搭配方式、搭配顺序方面思考。中药提取物对细胞的影响可谓是多方面的,比如研究发现牛膝醇提物能够诱导兔骨髓间充质干细胞软骨定分化[58],黄芩苷可促进成骨诱导的骨髓间充质干细胞增殖和成骨分化[59],葛根素为骨髓间充质干细胞提供了良好的增殖环境,提高了细胞存活率等都为临床应用提供了思路。不同的水凝胶类型也有各自优点,可注射的智能水凝胶应用前景也较为广泛。水凝胶作为生物支架与3D打印技术结合制造出可自定义性状的水凝胶支架应用在软骨组织工程中提供物理支撑,凭借水凝胶阳离子特性,募集促进软骨再生物质阴离子的聚集,为骨髓间充质干细胞提供良好的环境[60],这也为软骨组织再生和中医药的联合应用提供另一条策略。选择医用水凝胶负载中药干预后的细胞这种组合方式,或者选用同时负载中药成分和细胞组织的组合方式也各有优劣,但都为中医药联合医用水凝剂在组织工程方面提供了研究策略。医用水凝胶逐渐发展为中医药与水凝胶的联合奠定了基础,中医药药理研究的逐渐深入也使二者的结合更具有可行性和安全性,医用水凝胶的发展及其与中医药联合应用的研究时间表见表2。"


2.5 中医药与医用水凝胶联合应用的优劣 在中医药联合医用水凝胶的联合应用中,目前应用较多的为中药单体提取物与水凝胶的联合,在软组织、关节、器官和组织工程中都有较多的联合应用。在中药单体与水凝胶的联合应用中,中药单体提取物与水凝胶的作用互补,水凝胶可以作为生物支架、药物载体为中药单体提供媒介,有些中药则可以使水凝胶的理化性质更容易量化,比如在水凝胶中加入硼砂就可以量化水凝胶溶胶向凝胶转变的时间。由于中药提取物的便捷使用性,二者联合的优点是可以结合不同种类的水凝胶应用范围较广,作用机制清晰,可搭配的水凝胶种类丰富。二者联合的缺点是在二者的联合应用中水凝胶的理化性质较难把握。中药复方与水凝胶的联合方面,目前联合应用在外科软组织损伤方面效果较好,比如糖尿病患者伤口不愈合、软组织损伤后中药外敷治疗,经典复方取得的研究成果较为理想。在外用方面,中医复方的制作也相对简便,与相应的水凝胶结合可以制作成使用较为简便的外用品,缺点也表现在水凝胶的理化性质无法精确把握,中药复方在制作过程中分子种类较多,化学反应复杂,无法充分把握复方提取物的种类含量,这也就限制了其应用范围的宽度,对中药进行生物分析和化学分析对中医的科学验证和标准化具有重要意义。中药复方和中药单体的联合应用优势和不足见表3。"


在中医药与水凝胶联合应用在组织、器官、组织工程中有较为丰富的动物实验研究,但二者的作用机制尚未完全明了。在水凝胶方面,虽然水凝胶有着较好的生物相容性,对人体组织的损害较小,但是其在制作过程中将水凝胶的理化性质进行量化时较难掌握其工艺,为满足对水凝胶可量化性质如:凝胶时间、转换时间、机械强度和降解时间的精确把握,需要进行大量的研究来决定凝胶材料的选择、材料的制作工艺以及量化指标的方式方法,与此同时还应注意其在与中医药联合过程中作用不会受到影响。KIM等[61]将溶菌酶进行修饰固定在水凝胶中,可以加速水凝胶的降解,这些尝试可以为创造出可调控降解行为的水凝胶在组织工程中提供一个新的策略。 在中医药方面,由于中医学是在中医基础理论下的各科项目的整合,因此在联合过程中需要多角度和多方式的进行联合。目前中医药联合水凝胶在软组织方面的应用取得了较为成功的进展,但在组织工程中,中药提取物可以影响骨髓干细胞的分化增殖,但在与水凝胶的联合应用中临床试验较少,还需在明了中药对干细胞影响的机制上深度研究,提高中药的药理活性和生物利用度,进而保证二者联合的可行性与安全性。"

| [1] BUWALDA SJ, BOERE KWM, DIJKSTRA PJ, et al. Hydrogels in a historical perspective: from simple networks to smart materials. J Control Release. 2014; 190:254-273. [2] MAHMOOD A, PATEL D, HICKSON B, et al. Recent progress in biopolymer-based hydrogel materials for biomedical applications. Int J Mol Sci. 2022;23(3):1415. [3] KANG X, CHEN L, YANG S, et al. Zuogui Wan slowed senescence of bone marrow mesenchymal stem cells by suppressing Wnt/β-catenin signaling. J Ethnopharmacol. 2022;294:115323. [4] CAO H, DUAN L, ZHANG Y, et al. Current hydrogel advances in physicochemical and biological response-driven biomedical application diversity. Signal Transduct Target Ther. 2021;6(1):426. [5] ZHANG Y, YU T, PENG L, et al. Advancements in hydrogel-based drug sustained release systems for bone tissue engineering. Front Pharmacol. 2020;11:622. [6] DURAN-MOTA JA, YANI JQ, ALMQUIST BD, et al. Polyplex-loaded hydrogels for local gene delivery to human dermal fibroblasts. ACS Biomater Sci Eng. 2021; 7(9):4347-4361. [7] NGUYEN MK, LEE DS. Injectable biodegradable hydrogels. Macromol Biosci. 2010;10(6):563-579. [8] LI Y, YANG HY, LEE DS. Advances in biodegradable and injectable hydrogels for biomedical applications. J Control Release. 2021;330:151-160. [9] THAMBI T, LI Y, LEE DS. Injectable hydrogels for sustained release of therapeutic agents. J Control Release. 2017;267:57-66. [10] 齐学洁,刘香云,邱峰.温度敏感型水凝胶载药系统的最新研究与应用[J].中国新药杂志,2017,26(21):2533-2540. [11] PEÑA B, LAUGHTER M, JETT S, et al. Injectable hydrogels for cardiac tissue engineering. Macromol Biosci. 2018;18(6):e1800079. [12] ZHAO L, NIU L, LIANG H, et al. pH and glucose dual-responsive injectable hydrogels with insulin and fibroblasts as bioactive dressings for diabetic wound healing. ACS Appl Mater Interfaces. 2017;9(43):37563-37574. [13] ZHANG J, WANG J, ZHANG H, et al. Macroporous interpenetrating network of polyethylene glycol (PEG) and gelatin for cartilage regeneration. Biomed Mater. 2016;11(3):35014. [14] 刘壮,谢锐,巨晓洁,等.环境刺激响应型高强度智能水凝胶研究进展[J]. 化工进展,2016,35(6):1812-1819. [15] HUANG S, HONG X, ZHAO M, et al. Nanocomposite hydrogels for biomedical applications. Bioeng Transl Med. 2022;7(3):e10315. [16] ASADI N, ALIZADEH E, SALEHI R, et al. Nanocomposite hydrogels for cartilage tissue engineering: a review. Artif Cells Nanomed Biotechnol. 2018;46(3):465-471. [17] HUANG J, LIANG Y, JIA Z, et al. Development of magnetic nanocomposite hydrogel with potential cartilage tissue engineering. ACS Omega. 2018;3(6):6182-6189. [18] ZHANG Y, HUANG Y. Rational design of smart hydrogels for biomedical applications. Front Chem. 2020;8:615665. [19] LIU Z, LIU J, CUI X, et al. Recent advances on magnetic sensitive hydrogels in tissue engineering. Front Chem. 2020;8:124. [20] XU Y, LU G, CHEN M, et al. Redox and pH dual-responsive injectable hyaluronan hydrogels with shape-recovery and self-healing properties for protein and cell delivery. Carbohydr Polym. 2020;250:116979. [21] DENG S, ISCARO A, ZAMBITO G, et al. Development of a new hyaluronic acid based redox-responsive nanohydrogel for the encapsulation of oncolytic viruses for cancer immunotherapy. Nanomaterials (Basel). 2021;11(1):144. [22] 高春梅,柳明珠,吕少瑜,等.海藻酸钠水凝胶的制备及其在药物释放中的应用[J].化学进展,2013,25(6):1012-1022. [23] ZHANG H, CHENG J, AO Q. Preparation of alginate-based biomaterials and their applications in biomedicine. Mar Drugs. 2021;19(5):264. [24] GAO Q, KIM BS, GAO G. Advanced strategies for 3D bioprinting of tissue and organ analogs using alginate hydrogel bioinks. Mar Drugs. 2021;19(12):708. [25] MANN DL, LEE RJ, COATS AJ, et al. One-year follow-up results from AUGMENT-HF: a multicentre randomized controlled clinical trial of the efficacy of left ventricular augmentation with Algisyl in the treatment of heart failure. Eur J Heart Fail. 2016;18(3):314-325. [26] LATIFI N, ASGARI M, VALI H, et al. A tissue-mimetic nano-fibrillar hybrid injectable hydrogel for potential soft tissue engineering applications. Sci Rep. 2018;8(1): 1047. [27] MARTINS EA, MICHELACCI YM, BACCARIN RY, et al. Evaluation of chitosan-GP hydrogel biocompatibility in osteochondral defects: an experimental approach. BMC Vet Res. 2014;10:197. [28] PATIL R, KANSARA V, RAY D, et al. Slow degrading hyaluronic acid hydrogel reinforced with cationized graphene nanosheets. Int J Biol Macromol. 2019; 141:232-239. [29] XIN L, WEI C, TONG X, et al. In situ delivery of apoptotic bodies derived from mesenchymal stem cells via a hyaluronic acid hydrogel: a therapy for intrauterine adhesions. Bioact Mater. 2022;12:107-119. [30] 张润婧,陈玉洁,蔡超,等.天然多糖基可注射水凝胶在组织工程中的研究进展[J].中国材料进展,2021,40(5):374-383. [31] ZOU P, YAO J, CUI YN, et al. Advances in cellulose-based hydrogels for biomedical engineering: a review summary. Gels. 2022;8(6):364. [32] 尹高威,范治平,程萍,等.天然高分子多糖基载药水凝胶研究进展[J].聊城大学学报(自然科学版),2021,34(3):83-90. [33] LIU T, QIU C, LU H, et al. A novel recombinant human collagen hydrogel as minced split-thickness skin graft overlay to promote full-thickness skin defect reconstruction. Burns. 2023;49(1):169-181. [34] 王笑,王路,王振宇.微生物多糖透明质酸生物医用水凝胶研究[J].卫生研究,2019,48(4):683-688. [35] KHIABANI SS, AGHAZADEH M, RAKHTSHAH J, et al. A review of hydrogel systems based on poly (N-isopropyl acrylamide) for use in the engineering of bone tissues. Colloids Surf B Biointerfaces. 2021;208:112035. [36] TURABEE MH, THAMBI T, LYM JS, et al. Bioresorbable polypeptide-based comb-polymers efficiently improves the stability and pharmacokinetics of proteins in vivo. Biomater Sci. 2017;5(4):837-848. [37] 田悦,姚红玉,苑晋铭.以人参为原料水凝胶的制备[J].人参研究,2021, 33(5):9-11. [38] 陈志鹏,刘文,陈洪轩,等.用于关节腔注射的马钱子碱壳聚糖温敏凝胶的研究[J].药学学报,2012,47(5):652-656. [39] 张弩,吴宇.温敏性壳聚糖水凝胶复合细胞因子修复兔关节软骨缺损[J].中国组织工程研究,2012,16(34):6298-6302. [40] LIN F, WANG Z, XING L, et al. Transporting hydrogel via chinese acupuncture needles for lesion positioning therapy. Adv Sci (Weinh). 2022;9(17):e2200079. [41] 徐炜华,许慧玲.双柏水凝胶治疗急性软组织损伤临床观察[J].中国医药导报,2010,7(11):39-40. [42] TAN H, JIN D, SUN J, et al. Enlisting a Traditional Chinese Medicine to tune the gelation kinetics of a bioactive tissue adhesive for fast hemostasis or minimally invasive therapy. Bioact Mater. 2021;6(3):905-917. [43] 华皎,徐志萍,胡荣,等.冰黄药凝胶在2型糖尿病足溃疡创面处理中的应用研究[J].护士进修杂志,2010,25(1):8-9. [44] 时军,黄嗣航,王小燕,等.Z-综合评分法优化丹皮酚阳离子脂质体凝胶剂制备工艺[J].中国实验方剂学杂志,2012,18(3):32-35. [45] RINOLDI C, COSTANTINI M, KIJEŃSKA-GAWROŃSKA E, et al. Tendon tissue engineering: effects of mechanical and biochemical stimulation on stem cell alignment on cell-laden hydrogel yarns. Adv Healthc Mater. 2019;8(7):e1801218. [46] 常聪,陈圣杰,段书霞,等.生物医用水凝胶敷料的研究现状与应用前景[J].纺织导报,2018,(5):47-51. [47] 丁维莲.药物缓释载体材料的研究进展[J].广东化工,2022,49(11): 107-108 [48] 柳成荫,蒋学俊.水凝胶负载药物治疗心肌梗死[J].心血管病学进展,2021, 42(6):496-498. [49] 张建武.葛根素水凝胶在MSCs移植治疗心肌梗死中的作用及机制研究[D].广州:南方医科大学,2016. [50] 徐和.基于水凝胶复合织物新载体的中药有效成分缓释给药系统的研究[D].成都:成都中医药大学,2014. [51] LEE RJ, HINSON A, BAUERNSCHMITT R, et al. The feasibility and safety of Algisyl-LVR™ as a method of left ventricular augmentation in patients with dilated cardiomyopathy: initial first in man clinical results. Int J Cardiol. 2015;199:18-24. [52] 贺港.可注射型水凝胶用于肿瘤热化疗的研究[D].合肥:合肥工业大学,2019. [53] DUONG H, THAMBI T, YIN Y, et al. Degradation-regulated architecture of injectable smart hydrogels enhances humoral immune response and potentiates antitumor activity in human lung carcinoma. Biomaterials. 2020;230:119599. [54] QIU H, ZHANG L, HE X, et al. Promotion of angiogenesis in vitro by Astragalus polysaccharide via activation of TLR4 signaling pathway. J Food Biochem. 2022; 46(10):e14329. [55] WANG P, SUN TF, LI G, et al. The separation of antler polypeptide and its effects on the proliferation and osteogenetic differentiation of bone marrow mesenchymal stem cells. Evid Based Complement Alternat Med. 2020;2020:1294151. [56] HA XQ, YANG B, HOU H J, et al. Protective effect of rhodioloside and bone marrow mesenchymal stem cells infected with HIF-1-expressing adenovirus on acute spinal cord injury. Neural Regen Res. 2020;15(4):690-696. [57] CAI B, ZHANG AG, ZHANG X, et al. Promoting effects on proliferation and chondrogenic differentiation of bone marrow-derived mesenchymal stem cells by four “Kidney-Tonifying” Traditional Chinese herbs. Biomed Res Int. 2015; 2015:792161. [58] 马笃军,彭力平,王立新,等.牛膝醇提物诱导兔骨髓间充质干细胞软骨定向分化的实验研究[J].中国中医骨伤科杂志,2017,25(2):6-11. [59] 李博乐,江长青,刘振鹏,等.黄芩苷通过Ebf3基因调控骨髓间充质干细胞成骨分化[J].中国老年学杂志,2022,42(10):2456-2459. [60] LI P, FU L, LIAO Z, et al. Chitosan hydrogel/3D-printed poly (ε-caprolactone) hybrid scaffold containing synovial mesenchymal stem cells for cartilage regeneration based on tetrahedral framework nucleic acid recruitment. Biomaterials. 2021; 278:121131. [61] KIM S, CUI ZK, KOO B, et al. Chitosan-lysozyme conjugates for enzyme-triggered hydrogel degradation in tissue engineering applications. ACS Appl Mater Interfaces. 2018;10(48):41138-41145. |
| [1] | Lin Feng, Cheng Ling, Gao Yong, Zhou Jianye, Shang Qingqing. Hyaluronic acid hydrogel-encapsulated bone marrow mesenchymal stem cells promote cardiac function in myocardial infarction rats (III) [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 355-359. |
| [2] | Gu Mingxi, Wang Changcheng, Tian Fengde, An Ning, Hao Ruihu, Guo Lin. Preparation and in vitro evaluation of a three-dimensional porous cartilage scaffold made of silk fibroin/gelatin/chitosan [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 366-372. |
| [3] | Wang Xinmin, Yan Wenkai, Song Yahui, Liu Fei. Leukocyte- and platelet-rich fibrin with autologous hamstring tendon for traumatic patella dislocation [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 404-410. |
| [4] | Wang Xinyi, Xie Xianrui, Chen Yujie, Wang Xiaoyu, Xu Xiaoqing, Shen Yihong, Mo Xiumei. Electrospun nanofiber scaffolds for soft and hard tissue regeneration [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 426-432. |
| [5] | Gao Xueyu, Zhang Wentao, Sun Tianze, Zhang Jing, Li Zhonghai. Application of metal ions in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 439-444. |
| [6] | Yang Jie, Hu Haolei, Li Shuo, Yue Wei, Xu Tao, Li Yi. Application of bio-inks for 3D printing in tissue repair and regenerative medicine [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 445-451. |
| [7] | Chen Pinrui, Pei Xibo, Xue Yiyuan. Function and advantages of magnetically responsive hydrogel in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 452-457. |
| [8] | Chen Junyan, Meng Qingqi, Li Siming. Cartilage targeting function in the drug delivery system by intra-articular injection for the treatment of osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 458-463. |
| [9] | Long Zhirui, Huang Lei, Xiao Fang, Wang Lin, Wang Xiaobei. Characteristics of hydrogel microspheres in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 472-478. |
| [10] | Kong Xiangyu, Wang Xing, Pei Zhiwei, Chang Jiale, Li Siqin, Hao Ting, He Wanxiong, Zhang Baoxin, Jia Yanfei. Biological scaffold materials and printing technology for repairing bone defects [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 479-485. |
| [11] | Xu Jing, Lyu Huixin, Bao Xin, Zhang Yi, Wang Yihan, Zhou Yanmin. Application of near infrared responsive hydrogels in tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 486-492. |
| [12] | Wei Yurou, Tian Jiaqing, He Xianshun, Zhan Zhiwei, Wei Tengfei, Lin Tianye, He Wei, Wei Qiushi. Effect of lentiviral silencing of Piezo1 on osteogenic differentiation and TAZ expression in human bone marrow mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(1): 12-19. |
| [13] | Zhang Yuanshu, He Xu, Xue Yuan, Jin Yesheng, Wang Kai, Shi Qin, Rui Yongjun. Irisin alleviates palmitic acid-induced osteogenic inhibition in bone marrow mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(1): 26-31. |
| [14] | Zheng Rongjiong, Deng Zerun, Han Dan, Sun Lihua. Mechanism underlying rat hepatocyte apoptosis regulated by exosomes derived from bone marrow mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(1): 44-49. |
| [15] | Fan Yongjing, Wang Shu, Jin Wulong. Characteristics, advantages and application of osteogenic differentiation of jaw bone marrow mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(1): 100-106. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||