Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (3): 458-463.doi: 10.12307/2023.879
Previous Articles Next Articles
Cartilage targeting function in the drug delivery system by intra-articular injection for the treatment of osteoarthritis
Chen Junyan1, Meng Qingqi2, Li Siming1, 2
- 1Guizhou Medical University, Guiyang 550025, Guizhou Province, China; 2Guangzhou Red Cross Hospital, Jinan University, Guangzhou 510220, Guangdong Province, China
-
Received:2022-12-20Accepted:2023-02-04Online:2024-01-28Published:2023-07-10 -
Contact:Li Siming, MD, Chief physician, Doctoral supervisor, Guizhou Medical University, Guiyang 550025, Guizhou Province, China; Guangzhou Red Cross Hospital, Jinan University, Guangzhou 510220, Guangdong Province, China -
About author:Chen Junyan, Master candidate, Physician, Guizhou Medical University, Guiyang 550025, Guizhou Province, China
CLC Number:
Cite this article
Chen Junyan, Meng Qingqi, Li Siming. Cartilage targeting function in the drug delivery system by intra-articular injection for the treatment of osteoarthritis[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 458-463.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
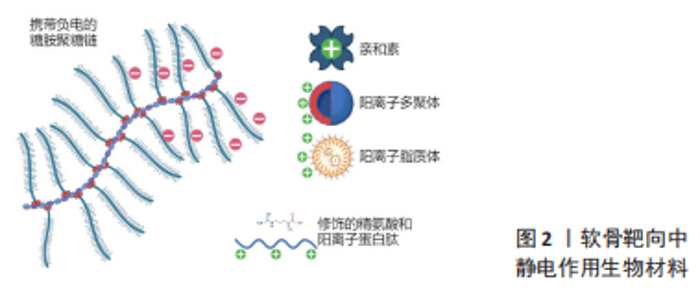
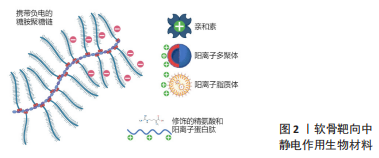
2.1 静电作用 糖胺聚糖又称黏多糖,是软骨细胞外基质的组要成分之一,成分包括透明质酸、硫酸软骨素、硫酸角质素等几种物质,各自发挥不同作用[7]。这些黏多糖大多都含有一定量的羧基,这将天然带来一定的弱酸性,而在中性环境下,这种弱酸性多糖又表现为弱的表面负电,这种交织生成的负电黏多糖网络是阻碍药物载体进入软骨深层的因素之一。近年来针对这种弱负电,静电作用相关的靶向软骨结合载体被大量研发[1,8-9]。此文将静电作用为主的软骨靶向研究分为以下几类,包括靶向递送药物方面应用最早研究最广泛的亲和素修饰形式,修饰于其他载药系统上的简单碱性氨基酸与复杂阳离子肽,以及拥有直接包裹药物能力的树枝状大分子聚合物和脂质体结构,见图2。"
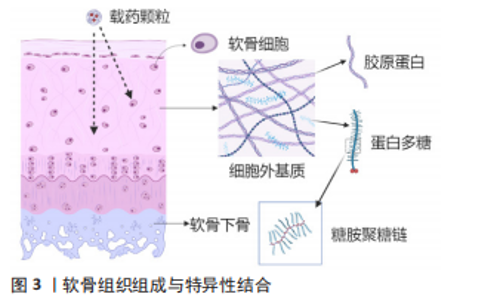
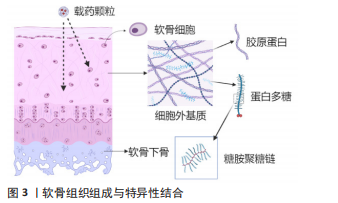
2.1.1 亲和素 亲和素是一种分子质量为60 kD的糖蛋白,由4个可以与生物素紧密结合的亚基构成,等电点在10-10.5,在中性溶液中呈明显正电性,因其与生物素之间的特异性结合能力,常被用作生物放大效应。BAJPAYEE团队[10-12]首次研究了亲和素在软骨基质中的穿透作用,这种直径为7 nm且携带强正电荷的阳离子糖蛋白能穿透和扩散到正常软骨和酶处理过后的软骨组织,并与软骨基质中的负电糖胺聚糖结合;对比同等粒径大小的中性对照组,亲和素的正电荷为其带来了接近400倍的软骨基质渗透和留存的优势;并且在50%糖胺聚糖缺失的软骨外基质中同样呈现较高的吸收,意味着亲和素可以向中晚期关节炎软骨组织输送药物。值得注意的是,亲和素与地塞米松的比值影响了最终GAG的修复效果,过多的亲和素反而导致了明显的GAG丢失,表明需要提高载药比例来降低亲和素的一些不良作用[13]。为了避免过量亲和素的注射带来进一步的软骨损伤,HE团队[14]将八臂聚乙二醇与生物素进行化学结合,再利用亲和素与生物素之间的高亲和力特点,将八臂聚乙二醇附着到亲和素分子上,形成了多臂亲和素纳米聚合物(multi-arm cationic nano-construct of avidin,mAv)。该聚合物mAv净尺寸在7.0-8.1 nm之间,同时zeta电位达到(25.3±0.7) mV,提供28个药物结合位点;可大量携带地塞米松进入骨关节炎软骨基质,其中50%的地塞米松在38.5 h内释放,而后续的持续药物释放长达2周,使得骨关节炎的激素治疗只需一次低剂量的药物注射。药物动力学显示mAv在软骨中半衰期是53.4 h,半月板中是59.7 h,关节韧带中是43.3 h,均小于股四头肌肌腱中的79.9 h,说明mAv在组织中的渗透和留滞不仅仅受GAG含量的影响,还包括其他因素包括组织厚度、组织的位置、与关节液的接触面积和组织在挤压下的压缩程度等[8]。同时mAV也可以搭载疏水性药物Kartogenin(KGN)进入软骨基质。KGN是一种人类间充质干细胞分化成软骨细胞诱导剂,在骨关节炎治疗中已被证实可以发挥作用,然而这种治疗需要维持一定的局部药物浓度,该纳米聚合物使KGN在带负电的软骨内部形成药库,对比单次关节腔注射游离药物疗效有明显改善[15]。 2.1.2 阳离子聚合物 GEIGER等[16]对纳米级阳离子树枝状大分子物质聚酰胺-胺(polyamidoamine,PAMAM)上进行静电屏蔽修饰,其中分别对第4代(gen4,14 kD,64个NH2端基)与第6代(gen6,58 kD,256个NH2端基)进行0-60%的聚乙二醇(polyethylene glycol,PEG)化共价结合以调控载体的电荷量,并与胰岛素样生长因子(insulin-like growth factors -1,IGF-1)以巯基马来酰胺键稳定结合;最终通过软骨组织对载体的摄取筛选、软骨细胞毒性筛选、软骨组织穿透和留存时间筛选和对最终动物骨关节炎治疗效果评价,得到了45%PEG修饰的PAMAM gen6,使软骨内生长因子保持较高水平30 d;值得关注的是,仅20% PEG修饰的gen4在大鼠膝关节滑膜中引起严重的炎症,这意味着超量的正电荷会引起组织的炎症递质增加,这对未来的静电作用类靶向材料提供了参考。HU团队[17]将KGN用PEG连接到PAMAM上,改善了KGN的软骨分化和关节保留的时间。 树枝状聚甘油磷酸脂可以结合白细胞上的L-选择素和血管内皮的P-选择素,减少白细胞黏附,同时也能抑制补体活性,关节腔注射高剂量树枝状聚甘油磷酸脂不影响软骨细胞活性且能通过白细胞介素10发挥抑制炎症作用,树枝状聚甘油磷酸脂表面有多个硫酸基团因此易于被修饰,关节腔注射树枝状聚甘油磷酸脂后可以在24 h达到离软骨层表面50 μm处,7 d后仍有留存[18]。树枝状聚甘油磷酸脂本身有抑制骨关节炎进展的机制,也有穿透软骨层的能力,但目前暂未有其相关的聚合体载药研究。 聚β-氨基酯颗粒带有一定的正电荷,可以用来包封药物,在众多亚型中端封剂e2拥有额外的仲胺使得软骨吸收率高达8倍于游离药物,这与静电作用本身的机制相符合[19]。 2.1.3 碱性氨基酸 VEDADGHAVAMI等[20]通过比较富含精氨酸的软骨靶向的肽载体的亲水、疏水修饰物在软骨滑膜液中的吸收情况,证实疏水基团和非电荷之间相互作用是滑膜液和肽载体竞争性结合从而抑制软骨吸收的主要因素,其中短程氢键在正电荷载体与软骨基质紧密的结合中发挥关键作用,这种巩固增强结合的功能同样适用于电荷密度降低的软骨基质,比如骨关节炎晚期软骨内GAG大量丢失的情况。该团队将碱性氨基酸精氨酸和赖氨酸与中性氨基酸进行一定比例的排列组合,设计了一系列不同电位和分子质量的多肽;其中精氨酸除了本身更高的等电点外还有短程氢键和疏水作用,这使其比起赖氨酸在软骨吸收上发挥更强作用,为未来碱性氨基酸修饰材料靶向软骨的相关研究奠定了基础[21]。通过修饰阳离子的肽载体搭载胰岛素样生长因子1达到缓释效果,单次注射1 000 ng/mL达到和连续100 ng/mL注射同等的抑制GAG损失的效果[22]。LIN等[23]将聚赖氨酸修饰至水凝胶微球外表面,同时在微球内部搭载正电荷的PAMAM,包载KGN穿透运输到软骨基质中,延长了药物释放至21 d,抑制软骨基质和软骨下骨的降解,延缓了骨关节炎的进展。 2.1.4 阳离子蛋白及多肽 KRISHNAN等[24]对不同正电荷/表面电荷分布的绿色荧光蛋白(supercharged-green fluorescent proteins,S-GFP)在软骨组织中的穿透能力进行测试,其中电荷为(+9与+15)的S-GFP在软骨中的吸收程度和吸收速率都优于更大电荷的(+25与+37)S-GFP,说明并非越大的电荷携带能带来更好的组织穿透;越高电荷的S-GFP在滑膜溶液中更易被结合从而减缓了蛋白运输进软骨组织。而后对两者的软骨摄取、留存的结果建立了预测数学模型,模型可以预测临床环境下GFP溶液蛋白被注射到关节腔内后的运输过程;考虑关节滑液每小时更新的前提下预测了单位剂量注射的载体在软骨内和逃逸到血液循环中的数量,为其他载体的药动学研究提供思路[25]。 PEP-1肽是一种富含色氨酸和亲水赖氨酸的两亲性细胞穿膜肽,将其与内源性抗氧化酶Glutaredoxin-1结合,这种融合蛋白可以明显穿透人软骨细胞和小鼠软骨细胞,抑制脂多糖与白细胞介素1β激活的MAPK与NF-κB通路从而减少软骨细胞的分解代谢反应[26]。 阳离子两亲肽p5RHH已经被研究作为递送短干扰RNA (small interfering RNA,siRNA)的良好载体,在低细胞毒性的同时高效进行siRNA转染。P5RHH构建的纳米颗粒可以自由穿透无血管的软骨700 μm,停留在表层和深层的软骨陷窝中至少2周,这将大幅度提高针对软骨细胞的转染效率[27-28]。 2.1.5 阳离子脂质体 WANG团队[29]测试了一种阳离子脂质纳米颗粒递送干扰RNA到软骨层内细胞,其粒径大小约为60 nm,在活体转移和载体转移中转染率远超直接注射游离siRNA。在大型动物中,采用猪胫骨全层软骨组织与阳离子脂质体共同孵育48 h,在软骨浅层和深层均可检测到标记的红色荧光。阳离子脂质体也可以用于药物和微小RNA(microRNA,miRNA)的共同递送,包裹了miRNA-140和氯诺昔康的脂质体进入软骨层保证24 h内不被快速降解,达到促进软骨细胞Ⅱ型胶原基因col2a1的表达并修复软骨的作用[30]。阳离子脂质体还可以搭载水溶性较差的雷帕霉素,增加自噬维持软骨细胞的稳态并起到润滑作用,避免了为了达到治疗剂量而反复进行关节腔注射[31]。EBADA等[32]对固体脂质纳米颗粒(solid lipid nanoparticles,SLN)进行硬脂胺修饰,作为络合剂增加了其对药物大黄酸的载药能力,也增加了SLN的表面电荷,组成的大黄酸载药颗粒载药率达(90.04±1.62)%-(99.87±0.23)%,其中大黄酸被疏水阳离子修饰使得最终的表面电荷达到(41.83±5.63) mV。载药粒子在健康软骨中保留比GAG丢失的炎症软骨中更久更多,说明阳离子脂质载体有被动靶向的特点即静电作用受软骨内GAG含量影响。 2.1.6 其他阳离子修饰 BROWN团队[33]在聚乳酸-羟基乙酸共聚物(poly lactico-glycolic acid,PLGA)上修饰一种阳离子表面活性剂双十二烷基二甲基溴化铵(didodecyldimethylammonium bromide,DMAB),对比修饰阴离子聚乙烯醇,其zeta电荷从-17 mV上升到+24.6 mV;软骨层中的留置能力比较中阳离子DMAB纳米颗粒是聚乙烯醇颗粒的6倍,组织渗透距离分别为距软骨表层330 μm和130 μm;DMAB粒子软骨留置能力在阴离子滑液中下降而聚乙烯醇粒子没有变化,原因是富含透明质酸的滑液的包裹影响了纳米粒子表面电荷,改变了其本身的静电作用;该实验同时测试季铵盐与伯胺盐修饰类似的纳米颗粒,相似的粒径大小和zeta电位下不同的软骨滞留能力显示界面化学和亲水等属性也会影响软骨靶向的功能。 二氧化锰可以催化过氧化氢的分解,减少活性氧自由基,清除关节硬化和糖尿病情况下的炎症氧自由基,在酸性条件下可形成Mn2+而被清除,作为金属颗粒它还有易被塑形成纳米颗粒的潜能[34]。二氧化锰制备的纳米粒子粒径为12.85 nm,zeta电位+52.12 mV,但这种粒子胶体不稳定,用聚乙二醇修饰表面后保持15 nm粒径同时,将zeta电位降低维持至+29.11 mV,这将有助于减少二氧化锰在滑液中的损失更多地发挥抗氧化作用[35]。 WEI团队[36]观测到分泌型磷脂酶A2在人类以及小鼠的骨关节炎软骨组织中增加,于是将其抑制剂包裹到特定构建的磷脂胶束中,在表面添加阳离子基团修饰达深层软骨治疗的目的;胶束包埋的方式对于那些无法修饰的简单结构药物或抑制剂是一种可行的方案,因为这不需要药物本身有非配体区域的活性基团存在。 总结静电作用机制相关的软骨靶向材料的研究可见,适量的正电荷可推动载药颗粒穿透软骨浅层的胶原网络,同时提供了细胞穿膜功能。但这类材料本身依赖软骨组织完好的糖蛋白,导致在晚期骨关节炎时常常表现不佳。同时静电作用结合是一种非特异性的结合,关节腔内的关节滑液和其他组织成分干扰了载药颗粒的靶向运输。大多数静电作用的载药颗粒易于合成和修饰,便于工业化生产,未来对于静电机制类载药颗粒的研究可以着重于选择一些拥有抑制骨关节炎进展的生物材料,或者将正电荷基团修饰于支架表面,既利于软骨支架在缺损部位的稳定黏附,也可以借此搭载药物达到缓释治疗目的。 2.2 靶向胶原蛋白 除静电结合外,特异性结合的软骨靶向载药颗粒是近年来的研究热点,其机制在于和软骨内各成分的特异稳定的结合,同样达到了缓释递送药物的功效,见图3。胶原蛋白是软骨基质中的主要组成部分,其中Ⅱ型胶原占软骨细胞外基质胶原蛋白的90%,并以光蛋白聚糖、软骨低聚物基质蛋白与其他类型的胶原如Ⅵ,Ⅸ型胶原等形成胶原纤维网络[37]。因此针对胶原蛋白的特异性结合,可以促使载药颗粒与软骨紧密结合。BROWN团队[33,38]测试了胶原主动靶向与静电被动靶向能力,其中在载体保留的测试中,静电靶向的颗粒与非靶向颗粒在骨关节炎软骨中的表现没有差异,突出了蛋白多糖的损失对静电靶向作用的影响;胶原主动靶向在骨关节炎发生时反而因为接触更多的暴露胶原蛋白而结合更加稳定,并且受滑液的影响也小于静电作用。"

2.2.1 WYRGRL肽 ROTHENFLUH等[39]利用FUSE5噬菌体展示文库表达6个单位的线性随机肽链,用分离的牛软骨组织进行亲和生物筛选,第5轮测序后从96个克隆中得到3个不同的噬菌体克隆体,其中WYRGRL肽与其他的噬菌体克隆相比在与Ⅱ型胶原的特异性结合上表现更为优异,并通过与构建的对照YRLGRW肽序列(拥有同样数量和类型的氨基酸,仅一级序列不同)对比说明了这种结合能力是序列特异的;再将这种短肽修饰到泊洛沙姆上,构建了关节软骨内靶向的纳米颗粒,而这种靶向粒子能与软骨基质层中的主要成分Ⅱ型胶原蛋白特异性结合,表现强大的软骨组织穿透能力与在软骨组织中长期留存的能力。 WYRGRL可以直接与地塞米松结合,特异性地结合和地塞米松自身的电荷作用,增加了地塞米松的给药深度,能显著降低炎症标志物水平[40]。WYRGRL肽序列还可以在许多熟悉的传统药物载体上修饰,如PLGA、脂质体聚合物等[41-42],也可以用于对比剂的递送优化MRI的软骨成像[43]。HU团队[44]用固相肽合成法在1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸酰胺(1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid amide,DOTAM)载药平台的4个修饰点上连接不同数量的AcWYRGRL肽,空余的修饰点位用非结合肽AcYRLGRW或氨基填补,其中一个修饰点固定修饰cy5.5作为荧光标记。在猪软骨组织的体外结合实验中,1-SP(含有1个靶向肽和2个氨基)的荧光强度是1-TP(1个非结合肽带2个氨基)的6倍;而3-SP(含有3个靶向肽)比3-TP(含有3个对照肽)的合成物增加了1.8倍,比1-SP多了3.1倍,比CP(没有靶向功能)多了36.6倍;在与小鼠膝关节软骨的结合中,3-TP在关节腔注射8 d后保留40%的信号,而CP的信号被减到20%以下,1-TP与3-TP分别比对照的1-SP与3-SP在48 h后的信号强度强;在组织学研究中,在1-TP处理的膝关节切片中,胶原密集区与cy5.5信号区域高度重合,但在半月板、滑膜、脂肪组织、肌肉和骨骼组织中没有信号,说明WYRGRL肽有助于DOTAM平台靶向Ⅱ型胶原;抑肽素在DOTAM靶向肽合成物的帮助下有效延长了作用时间至48 h,这不仅仅是静电作用的结果,意味着该肽可以同时在骨关节炎的早期以及晚期GAG丢失状态下发挥作用。 LAN等[45]以聚(2-乙基-2恶唑啉) -聚(ε-己内酯)[Poly(2-ethyl-2-oxazoline)-Poly(ε-caprolactone),PPL]为基础,加上Ⅱ型胶原靶向肽WYRGRL和MMP-13酶特定的肽底物,装载补骨脂素(psoralidin,PSO)制备了MRC-PPL@PSO纳米胶束聚合物,再以Ⅱ型胶原结合肽为链接结合到软骨上,以关节腔中MMP-13酶浓度为调控,靶向调控释放补骨脂素,通过PI3K/AKT、MAPK和NF-κB通路发挥抗骨关节炎作用。这种修饰酶底物作为药物释放扳机的方式,可以迁移到其他降解酶上。AI等[42]用电荷作用为基础的纳米沉淀法制备了Ⅱ型胶原肽修饰的脂质-聚合物复合纳米颗粒,该颗粒和非靶向的对照组颗粒相比直径没有明显变化,表面电荷从-40 mV下降至-20 mV附近;且在股骨头的渗透深度达到100 μm, 大于对照组的37 μm;而且ctLP-NPs在小鼠膝关节24 h后仍有接近50%的留置,而非靶向颗粒只有接近25%;在携带AMPK激动剂后明显降低骨关节炎小鼠内肿瘤坏死因子α和白细胞介素6等炎症指标,证实负电性颗粒修饰Ⅱ型胶原结合肽后依然拥有一定的软骨穿透效果。 软骨靶向肽还可以设计到铁蛋白纳米笼上,递送二甲双胍到软骨中,延长了药物3周保留时间[46]。LU团队[47]以超小级CuO纳米颗粒为基础,制备了多层肽修饰调控的纳米颗粒,其中CuO通过PI3K/AKT/mTOR通路促进间充质干细胞软骨分化的能力;在CuO表层从里到外分层修饰间充质干细胞靶向肽、MMP-2酶敏感序列和Ⅱ型胶原靶向肽构成多层肽修饰的纳米粒子,三层修饰分别为该药物载体带来了软骨渗透靶向、骨关节炎微环境金属酶响应和间充质干细胞靶向招募功能,极大提高了小剂量CuO关节腔注射发挥的促软骨修复作用。 2.2.2 其他胶原靶向载体 高亲和性多聚体Avimers来自于人类细胞表面蛋白天然a结构域,介导了许多蛋白-蛋白之间的相互作用。HULME团队[48]通过噬菌体文库筛选和优化,发现了特异性结合Ⅱ型胶原蛋白的高亲和的Avimers。其中一种代号为M26 的Avimers对人源的Ⅱ型胶原(0.18 nmol/L)和人体软骨(1.51 nmol/L)表现高亲和力,也选择性地结合大鼠的Ⅱ型胶原(0.05 nmol/L)。M26与人体Ⅰ型胶原、Ⅵ型胶原、Ⅸ型胶原以及蛋白多糖没有特异结合;在与人体软骨共同孵育时,M26集中在软骨陷窝中;在关节腔注射28 d后在胫骨和股骨的软骨中仍能检测到M26。M26与白细胞介素1受体拮抗剂(interleukin-1 receptor antagonist,IL-1Ra)的结合基团影响了M26的靶向功能,当M26结合到IL-1Ra的N端时其与胶原的结合能力较弱,当连接到IL-1Ra的C端时其胶原结合能力较强,这表明M26与胶原结合的结构域与IL-1Ra的N端结合的结构域有重复的地方,当某个M26的特异性结构域被占用后影响了其靶向功能。 半胱氨酸密集肽(cystine-dense peptides,CDPs)是一类小蛋白物质,定义是在一个长度20-60个氨基酸的蛋白质中至少含有3个二硫键,在全身给药后会迅速地聚集在软骨中,可与类固醇激素化学结合逆转关节炎症。CDP在靶向肿瘤手术辅助药物中研究较多,COOK SANGAR 团队[49]首次发现全身的软骨区段包括滑膜关节的透明软骨和椎间盘的纤维软骨有多种不同序列的CDPs积累,膝关节的CDP浓度显著高于血液、肌肉和肝脏,并能停留96 h后主要通过肾脏代谢出去,并在大鼠和人关节软骨中验证了其良好的穿透效率。不足的是,地塞米松与CDPs的结合并不能降低本身的毒性作用,静脉注射载有地塞米松的CDPs后大鼠的脾脏和胸腺发生萎缩,因为这两个器官对血液中活性地塞米松浓度非常敏感,但对于另一种药物曲安奈德,CDPs能减少其血液毒副作用,说明对于特定的类固醇药物,CDPs可以满足软骨的靶向递送并且降低其生物毒性。 骨关节炎时,软骨基质遭受磨损和降解,其内部胶原蛋白更多地接受暴露[50],有研究利用骨关节炎时基质内部的胶原暴露情况反映骨关节炎的严重程度,Ⅱ型胶原单克隆抗体特异性识别溴化氰肽并与人、鼠等物种的Ⅱ型胶原发生反应,发挥靶向结合作用,因此可以作为检测骨关节炎发生时软骨状况的造影剂成分[51]。BEDINGFIELD等[52]将Ⅱ型胶原的单克隆抗体修饰到siRNA纳米颗粒聚合物表面,特异性地递送MMP-13的siRNA到软骨层中,显著降低了MMP-13的表达,与非靶向修饰颗粒相比,修饰后的纳米颗粒在肝脏分布更少,在关节表面和软骨陷窝中保留,这与WYRGRL肽的功能相似。目前针对修饰抗体相关的载药颗粒研究较少,而且根据相关思路,针对其他软骨层面的单克隆抗体的靶向结果和是否能应用到生物材料上需要进一步的研究。 总结针对Ⅱ型胶原的靶向功能研究,主要集中在将一段高亲和软骨的肽序列修饰到载药颗粒上。这些靶向Ⅱ型胶原肽序列和小蛋白物质结合软骨的能力强,且在晚期骨关节炎时,软骨磨损发生胶原纤维大量破损暴露于关节腔中,靶向胶原的肽仍能发挥作用。但胶原靶向肽和单克隆抗体本身属于蛋白质,修饰和储存条件需要考虑蛋白质变性以及修饰对靶向肽结构域的影响,这对有机合成技术提出一定要求。 2.3 靶向蛋白多糖 除静电作用外,研究发现存在和负电性的蛋白多糖特异性结合的物质,这将是一种新的靶向形式。CHEUNG等[53]在噬菌体的第3轮筛选中挑出与小鼠软骨细胞最大结合的2个肽序列,分别是RLDPTSYLRTFW和HDSQLEALIKFM,两支肽链在与软骨外基质的结合能力测试中表现相似,用ELISA法对筛选出的肽链进行鉴定,发现与蛋白多糖高度特异性结合。 硫酸软骨素是软骨细胞外基质的主要成分之一,这种酸性黏多糖在临床上也常作为治疗骨关节炎的药物,与氨基葡萄糖配合使用可以促进软骨组织的再生修复[54]。近年来有发现证实硫酸软骨素有靶向关节软骨的作用,修饰了硫酸软骨素的纳米颗粒在靶向区域高度聚集有效地延长了给药时间[55]。MILLER 团队[56]着重研究肝素结合结构域与软骨的靶向作用,这种结构域与软骨中的生长因子定位相关,比如其中的成纤维细胞生长因子就与软骨中的硫酸乙酰肝素蛋白聚糖结合,在软骨中形成储存库,等软骨外基质遭到酶的降解时释放目的药物;作者在实验中发现肝素结合表皮生长因子与硫酸软骨素紧密结合,并把这种靶向能力推测归因为电荷作用,但未做进一步的研究。 BISHNOI等[57]将硫酸软骨素与固体脂质纳米颗粒偶联制备共轭聚合物ChS-SLN,粒径大小为(154.2±1.1) nm,zeta电位从固体脂质纳米颗粒的(+28.4±1.4) mV降到(+19.8±0.5) mV;静脉给药4 h后,注射ChS-SLN组的膝关节药物吸收达到(18.54±0.43)%,远高于注射游离药物的(2.61±0.24)%,也大于未修饰的固体脂质纳米颗粒的(6.65±0.09)%,证明添加了硫酸软骨素后的固体脂质纳米颗粒拥有了靶向膝关节软骨的功能。原因可能有两点:一是带有正电的固体脂质纳米颗粒在血液中易被带有负电的血清蛋白结合消除,在到达膝关节前就已经被消耗;二是硫酸软骨素与CD44的高亲和力促使纳米脂质颗粒软骨细胞外基质上。EBADA团队[58]将大黄酸与十八胺共轭结合并纳入到山嵛酸甘油酯中,制备大黄酸的纳米载体(cassic acid integrated nanoreservoirs,CA-NRs),用不同的浓度进行硫酸软骨素的功能化得到脂质体ChS-CA-NRs,载药脂质体的粒径为(156.8±0.05) nm,多分散系数为(0.27±0.01) nm;其中十八胺在提供良好脂溶性的同时也因自带的氨基有电荷修饰的作用,其电荷从CA-NRs的(-13.82±0.07) mV增加到最多(+41.83±5.63) mV,而硫酸软骨素的表面修饰又极大地改变了表面电荷[0.5%硫酸软骨素为(-28.3±6) mV,1% 硫酸软骨素为(-30.5±4.03) mV],药物包封率在与硫酸软骨素结合后略有竞争性下降至(89.82±0.32)%;在大鼠体内软骨靶向和留存测试中,有硫酸软骨素涂层的脂质体在健康软骨和关节炎软骨中均表现比游离药物和正电荷的CA-NRs更好,表面硫酸软骨素和软骨基质中有重要靶向结合关系,受体可能是软骨层中的Ⅱ型胶原和CD36。 虽然针对蛋白多糖的软骨靶向研究目前主要集中在静电作用,但存在一些依靠CD44、CD36和透明质酸、硫酸软骨素之间的特异性结合,这种特异性结合需要软骨层内的特定蛋白受体高度表达,所以在晚期骨关节炎中靶向蛋白多糖的功能是否存在,需要进一步研究。 2.4 靶向软骨细胞 软骨细胞是软骨中最重要的成分,其健康与否决定了周边基质的情况,而且软骨细胞分布于软骨层内深层,若能够特异性结合软骨细胞,也能使该成分穿透软骨基质层进入软骨深层。PI团队[59]利用噬菌体展示技术经过两轮筛选,挑选出软骨细胞亲和多肽(chondrocyte affinity peptide,CAP),荧光标记肽链后其在人软骨细胞和兔软骨细胞共培养中荧光强度分别是同样长度打乱序列肽链的29.52倍与8.81倍,而滑膜细胞摄取没有差异,表现出该肽对软骨细胞高强度的特异性;这种靶向细胞的物质在基因疗法中发挥作用,可以共轭连接一种基因载体聚乙烯亚胺,将目的基因送入软骨细胞,达到精确治疗的目的。LIANG 团队[60]则将CAP与外泌体表面蛋白Lamp2b结合靶向软骨细胞,通过基因编辑技术敲除MMP-13基因,减少软骨外胶原蛋白的降解,抗骨关节炎治疗作用明显;除MMP-13以外的其他靶点是否同样能通过该类靶向递送载体发挥作用仍待研究。也有学者将这种软骨细胞靶向肽CAP修饰到PAMAM上,用荧光染料示踪,发现纳米颗粒通过小窝蛋白和网格蛋白途径内化到软骨细胞并转运入溶酶体内,这种CAP-PEG-PAMAM拥有较好的关节腔滞留能力和生物相容性,是一种靶向软骨细胞穿透软骨的载体[61]。 LIN等[62]研制出一种能在胞内溶酶体内和低pH值环境下降解的温度敏感纳米颗粒体系,内部包裹抗炎肽KAFAK,通过软骨对纳米颗粒的摄取改变颗粒外环境,通过减少二硫键引发颗粒降解,从而调控治疗肽在目的细胞内部释放,减少了药物在体内被蛋白水解酶降解的机会,达到靶向软骨细胞药物释放的结果。 钆是一种镧系元素,在核磁成像中可增加T1的信号,在此基础上设计形成的Gd2(CO3)3纳米颗粒有良好评估骨关节炎软骨成像的功能。OUYANG等[63]在Gd2(CO3)3纳米颗粒表层修饰聚多巴胺和软骨细胞亲和肽,降低了Gd3+的毒性并赋予了靶向功能,携带橙皮素通过抑制Toll样受体2和相关的NF-κB/Akt信号通路抑制白细胞介素1β诱导的软骨细胞凋亡。 靶向软骨细胞功能的修饰可用于遗传物质的递送,在非电荷作用下穿透软骨层进入软骨细胞内部,也适合一些易受细胞外成分影响的药物的递送,减少了药物在细胞外的停留时间,目前相关研究比靶向胶原的少,在其临床应用上值得进一步研究。 2.5 其他软骨靶向功能 除上述静电作用和特异性结合外,存在一些特殊的靶向软骨的载体形式,其具体机制至今仍未清楚。D’ATRI等[64]以间充质干细胞为基础,去除细胞质后将体量缩小到纳米级制成一种新概念纳米囊泡,经测试粒径约为200 nm,zeta电位为-12 mV,在肿瘤坏死因子α刺激后的人软骨细胞和C-28/I2细胞中聚集程度大于健康细胞,这种纳米囊泡靶向于软骨炎症细胞并同时发挥抗炎作用,是一种理想的有前景的靶向载药体系形式,值得进一步研究其载药能力。间充质干细胞外泌体也是一种有效的关节腔注射药物载体[65]。COLOMBINI等[66]提取脂肪来源间充质干细胞的外泌体作为载体,递送miRNA进入软骨层,其中该提取的外泌体在软骨层中含量大于软骨细胞内含量,尤其为富含胶原的区域与载体发出的荧光强度高度重合。 SACCHETTI团队[67]首次以PEG修饰单壁碳纳米管(single-walled carbon nanotubes,SWCNTS)作为软骨靶向药物载体,PEG-SWCNTS直径小于10 nm,可以进行关节运输与软骨穿透并有效进入软骨上层中的软骨细胞内;该团队成功将吗啉反义寡核苷酸送入到小鼠关节腔软骨细胞内,做到靶向基因表达。有趣的是PEG-SWCNTS表面电荷是-11 mV,这与传统静电作用靶向机制和基因载体的阳离子修饰相反,至于PEG-SWCNTS为何能运输基因进入软骨细胞并没有被报道,因为许多文章描述到仅仅是粒径的匹配合适不能完全替代靶向效应,说明PEG-SWCNTS在软骨层穿透机制仍未清楚,有许多值得研究的空间。"

| [1] BAJPAYEE AG, GRODZINSKY AJ. Cartilage-targeting drug delivery: can electrostatic interactions help?. Nat Rev Rheumatol. 2017;13(3):183-193. [2] MENG H, QUAN Q, YUAN X, et al. Diffusion of neutral solutes within human osteoarthritic cartilage: Effect of loading patterns. J Orthop Translat. 2019;22:58-66. [3] LE MERDY M, MULLIN J, LUKACOVA V. Development of PBPK model for intra-articular injection in human: methotrexate solution and rheumatoid arthritis case study. J Pharmacokinet Pharmacodyn. 2021;48(6):909-922. [4] GONZÁLEZ OSUNA A, ROJAS LF, LAMAS C, et al. Population Pharmacokinetics of Intra-articular and Intravenous Administration of Tranexamic Acid in Patients Undergoing Total Knee Replacement. Clin Pharmacokinet. 2022;61(1):83-95. [5] ZHANG M, HU W, CAI C, et al. Advanced application of stimuli-responsive drug delivery system for inflammatory arthritis treatment. Mater Today Bio. 2022;14:100223. [6] LIMA AC, FERREIRA H, REIS RL, et al. Biodegradable polymers: an update on drug delivery in bone and cartilage diseases. Expert Opin Drug Deliv. 2019;16(8):795-813. [7] ASPBERG A. The different roles of aggrecan interaction domains. J Histochem Cytochem. 2012;60(12):987-996. [8] VEDADGHAVAMI A, ZHANG C, BAJPAYEE AG. Overcoming negatively charged tissue barriers: Drug delivery using cationic peptides and proteins. Nano Today. 2020;34: 100898. [9] BROWN S, KUMAR S, SHARMA B. Intra-articular targeting of nanomaterials for the treatment of osteoarthritis. Acta Biomater. 2019;93:239-257. [10] BAJPAYEE AG, WONG CR, BAWENDI MG, et al. Avidin as a model for charge driven transport into cartilage and drug delivery for treating early stage post-traumatic osteoarthritis. Biomaterials. 2014;35(1):538-549. [11] BAJPAYEE AG, SCHEU M, GRODZINSKY AJ, et al. Electrostatic interactions enable rapid penetration, enhanced uptake and retention of intra-articular injected avidin in rat knee joints. J Orthop Res. 2014;32(8):1044-1051. [12] BAJPAYEE AG, DE LA VEGA RE, SCHEU M, et al. Sustained intra-cartilage delivery of low dose dexamethasone using a cationic carrier for treatment of post traumatic osteoarthritis. Eur Cell Mater. 2017;34:341-364. [13] BAJPAYEE AG, QUADIR MA, HAMMOND PT, et al. Charge based intra-cartilage delivery of single dose dexamethasone using Avidin nano-carriers suppresses cytokine-induced catabolism long term. Osteoarthritis Cartilage. 2016;24(1):71-81. [14] HE T, ZHANG C, VEDADGHAVAMI A, et al. Multi-arm Avidin nano-construct for intra-cartilage delivery of small molecule drugs. J Control Release. 2020;318:109-123. [15] HE T, SHAW I, VEDADGHAVAMI A, et al. Single-Dose Intra-Cartilage Delivery of Kartogenin Using a Cationic Multi-Arm Avidin Nanocarrier Suppresses Cytokine-Induced Osteoarthritis-Related Catabolism. Cartilage. 2022;13(2):19476035221093072. [16] GEIGER BC, WANG S, PADERA RF JR, et al. Cartilage-penetrating nanocarriers improve delivery and efficacy of growth factor treatment of osteoarthritis. Sci Transl Med. 2018;10(469):eaat8800. [17] HU Q, DING B, YAN X, et al. Polyethylene glycol modified PAMAM dendrimer delivery of kartogenin to induce chondrogenic differentiation of mesenchymal stem cells. Nanomedicine. 2017;13(7):2189-2198. [18] SCHNEIDER T, WELKER P, HAAG R, et al. Effects of dendritic polyglycerol sulfate on articular chondrocytes. Inflamm Res. 2015;64(11):917-928. [19] PERNI S, PROKOPOVICH P. Optimisation and feature selection of poly-beta-amino-ester as a drug delivery system for cartilage. J Mater Chem B. 2020;8(23):5096-5108. [20] VEDADGHAVAMI A, HE T, ZHANG C, et al. Charge-based drug delivery to cartilage: Hydrophobic and not electrostatic interactions are the dominant cause of competitive binding of cationic carriers in synovial fluid. Acta Biomater. 2022;151:278-289. [21] VEDADGHAVAMI A, WAGNER EK, MEHTA S, et al. Cartilage penetrating cationic peptide carriers for applications in drug delivery to avascular negatively charged tissues. Acta Biomater. 2019;93:258-269. [22] VEDADGHAVAMI A, HAKIM B, HE T, et al. Cationic peptide carriers enable long-term delivery of insulin-like growth factor-1 to suppress osteoarthritis-induced matrix degradation. Arthritis Res Ther. 2022;24(1):172 . [23] LIN J, CHEN L, YANG J, et al. Injectable Double Positively Charged Hydrogel Microspheres for Targeting-Penetration-Phagocytosis. Small. 2022;18(40):e2202156. [24] KRISHNAN Y, REES HA, ROSSITTO CP, et al. Green fluorescent proteins engineered for cartilage-targeted drug delivery: Insights for transport into highly charged avascular tissues. Biomaterials. 2018;183:218-233. [25] KRISHNAN Y, YANG YJ, BARNES SK, et al. Predicting transport of intra-articularly injected growth factor fusion proteins into human knee joint cartilage. Acta Biomater. 2022;153: 243-259. [26] HWANG HS, PARK IY, KIM HA, et al. PEP-1-GRX-1 Modulates Matrix Metalloproteinase-13 and Nitric Oxide Expression of Human Articular Chondrocytes. Cell Physiol Biochem. 2017;41(1):252-264. [27] YAN H, DUAN X, PAN H, et al. Suppression of NF-κB activity via nanoparticle-based siRNA delivery alters early cartilage responses to injury. Proc Natl Acad Sci U S A. 2016; 113(41):E6199-E6208. [28] YAN H, DUAN X, PAN H, et al. Development of a peptide-siRNA nanocomplex targeting NF-κB for efficient cartilage delivery. Sci Rep. 2019;9(1):442. [29] WANG S, WEI X, SUN X, et al. A novel therapeutic strategy for cartilage diseases based on lipid nanoparticle-RNAi delivery system. Int J Nanomedicine. 2018;13:617-631. [30] HE K, HUANG X, SHAN R, et al. Intra-articular Injection of Lornoxicam and MicroRNA-140 Co-loaded Cationic Liposomes Enhanced the Therapeutic Treatment of Experimental Osteoarthritis. AAPS PharmSciTech. 2021;23(1):9. [31] LEI Y, WANG Y, SHEN J, et al. Injectable hydrogel microspheres with self-renewable hydration layers alleviate osteoarthritis. Sci Adv. 2022;8(5):eabl6449. [32] EBADA HM, NASRA MM, NASSRA RA, et al. Cationic nanocarrier of rhein based on hydrophobic ion pairing approach as intra-articular targeted regenerative therapy for osteoarthritis. Colloids Surf B Biointerfaces. 2022;211:112285. [33] BROWN S, PISTINER J, ADJEI IM, et al. Nanoparticle Properties for Delivery to Cartilage: The Implications of Disease State, Synovial Fluid, and Off-Target Uptake. Mol Pharm. 2019;16(2):469-479. [34] CHEN L, TIWARI SR, ZHANG Y, et al. Facile Synthesis of Hollow MnO2 Nanoparticles for Reactive Oxygen Species Scavenging in Osteoarthritis. ACS Biomater Sci Eng. 2021; 7(4):1686-1692. [35] KUMAR S, ADJEI IM, BROWN SB, et al. Manganese dioxide nanoparticles protect cartilage from inflammation-induced oxidative stress. Biomaterials. 2019;224:119467. [36] WEI Y, YAN L, LUO L, et al. Phospholipase A2 inhibitor-loaded micellar nanoparticles attenuate inflammation and mitigate osteoarthritis progression. Sci Adv. 2021;7(15): eabe6374. [37] BOTTINI M, BHATTACHARYA K, FADEEL B, et al. Nanodrugs to target articular cartilage: An emerging platform for osteoarthritis therapy. Nanomedicine. 2016; 12(2):255-268. [38] BROWN SB, WANG L, JUNGELS RR, et al. Effects of cartilage-targeting moieties on nanoparticle biodistribution in healthy and osteoarthritic joints. Acta Biomater. 2020; 101:469-483. [39] ROTHENFLUH DA, BERMUDEZ H, O’NEIL CP, et al. Biofunctional polymer nanoparticles for intra-articular targeting and retention in cartilage. Nat Mater. 2008;7(3):248-254. [40] FORMICA FA, BARRETO G, ZENOBI-WONG M. Cartilage-targeting dexamethasone prodrugs increase the efficacy of dexamethasone. J Control Release. 2019;295:118-129. [41] JIANG T, KAN HM, RAJPURA K, et al. Development of Targeted Nanoscale Drug Delivery System for Osteoarthritic Cartilage Tissue. J Nanosci Nanotechnol. 2018;18(4):2310-2317. [42] AI X, DUAN Y, ZHANG Q, et al. Cartilage-targeting ultrasmall lipid-polymer hybrid nanoparticles for the prevention of cartilage degradation. Bioeng Transl Med. 2020;6(1): e10187. [43] 南方医科大学珠江医院. 软骨靶向纳米颗粒及其制备方法和应用: CN202210265953.5[P]. 2022-07-29. [44] HU HY, LIM NH, DING-PFENNIGDORFF D, et al. DOTAM derivatives as active cartilage-targeting drug carriers for the treatment of osteoarthritis. Bioconjug Chem. 2015;26(3): 383-388. [45] LAN Q, LU R, CHEN H, et al. MMP-13 enzyme and pH responsive theranostic nanoplatform for osteoarthritis. J Nanobiotechnology. 2020;18(1):117. [46] HE Y, REN E, LU Z, et al. Rational engineering of ferritin nanocages for targeted therapy of osteoarthritis. Nanomedicine. 2020;28:102210. [47] LU Y, CHEN J, LI L, et al. Hierarchical functional nanoparticles boost osteoarthritis therapy by utilizing joint-resident mesenchymal stem cells. J Nanobiotechnology. 2022;20(1):89. [48] HULME JT, D’SOUZA WN, MCBRIDE HJ, et al. Novel protein therapeutic joint retention strategy based on collagen-binding Avimers. J Orthop Res. 2018;36(4):1238-1247. [49] COOK SANGAR ML, GIRARD EJ, HOPPING G, et al. A potent peptide-steroid conjugate accumulates in cartilage and reverses arthritis without evidence of systemic corticosteroid exposure. Sci Transl Med. 2020;12(533):eaay1041. [50] CHO H, PINKHASSIK E, DAVID V, et al. Detection of early cartilage damage using targeted nanosomes in a post-traumatic osteoarthritis mouse model. Nanomedicine. 2015;11(4):939-946. [51] CHO H, KIM BJ, PARK SH, et al. Noninvasive visualization of early osteoarthritic cartilage using targeted nanosomes in a destabilization of the medial meniscus mouse model. Int J Nanomedicine. 2018;13:1215-1224. [52] BEDINGFIELD SK, COLAZO JM, YU F, et al. Amelioration of post-traumatic osteoarthritis via nanoparticle depots delivering small interfering RNA to damaged cartilage. Nat Biomed Eng. 2021;5(9):1069-1083. [53] CHEUNG CS, LUI JC, BARON J. Identification of chondrocyte-binding peptides by phage display. J Orthop Res. 2013;31(7):1053-1058. [54] ARDEN NK, PERRY TA, BANNURU RR, et al. Non-surgical management of knee osteoarthritis: comparison of ESCEO and OARSI 2019 guidelines. Nat Rev Rheumatol. 2021;17(1):59-66. [55] JAIN A, MISHRA SK, VUDDANDA PR, et al. Targeting of diacerein loaded lipid nanoparticles to intra-articular cartilage using chondroitin sulfate as homing carrier for treatment of osteoarthritis in rats. Nanomedicine. 2014;10(5):1031-1040. [56] MILLER RE, GRODZINSKY AJ, CUMMINGS K, et al. Intraarticular injection of heparin-binding insulin-like growth factor 1 sustains delivery of insulin-like growth factor 1 to cartilage through binding to chondroitin sulfate. Arthritis Rheum. 2010;62(12):3686-3694. [57] BISHNOI M, JAIN A, HURKAT P, et al. Aceclofenac-loaded chondroitin sulfate conjugated SLNs for effective management of osteoarthritis. J Drug Target. 2014;22(9):805-812. [58] EBADA HMK, NASRA MMA, NASSRA RA, et al. Chondroitin sulfate-functionalized lipid nanoreservoirs: a novel cartilage-targeting approach for intra-articular delivery of cassic acid for osteoarthritis treatment. Drug Deliv. 2022;29(1):652-663. [59] PI Y, ZHANG X, SHI J, et al. Targeted delivery of non-viral vectors to cartilage in vivo using a chondrocyte-homing peptide identified by phage display. Biomaterials. 2011; 32(26):6324-6332. [60] LIANG Y, XU X, XU L, et al. Chondrocyte-specific genomic editing enabled by hybrid exosomes for osteoarthritis treatment. Theranostics. 2022;12(11):4866-4878. [61] HU Q, CHEN Q, YAN X, et al. Chondrocyte affinity peptide modified PAMAM conjugate as a nanoplatform for targeting and retention in cartilage. Nanomedicine (Lond). 2018; 13(7):749-767. [62] LIN JB, POH S, PANITCH A. Controlled release of anti-inflammatory peptides from reducible thermosensitive nanoparticles suppresses cartilage inflammation. Nanomedicine. 2016;12(7):2095-2100. [63] OUYANG Z, TAN T, LIU C, et al. Targeted delivery of hesperetin to cartilage attenuates osteoarthritis by bimodal imaging with Gd2(CO3)3@PDA nanoparticles via TLR-2/NF-κB/Akt signaling. Biomaterials. 2019;205:50-63. [64] D’ATRI D, ZERRILLO L, GARCIA J, et al. Nanoghosts: Mesenchymal Stem cells derived nanoparticles as a unique approach for cartilage regeneration. J Control Release. 2021; 337:472-481. [65] KIM YG, CHOI J, KIM K. Mesenchymal Stem Cell-Derived Exosomes for Effective Cartilage Tissue Repair and Treatment of Osteoarthritis. Biotechnol J. 2020;15(12):e2000082. [66] COLOMBINI A, RAGNI E, MORTATI L, et al. Adipose-Derived Mesenchymal Stromal Cells Treated with Interleukin 1 Beta Produced Chondro-Protective Vesicles Able to Fast Penetrate in Cartilage. Cells. 2021;10(5):1180. [67] SACCHETTI C, LIU-BRYAN R, MAGRINI A, et al. Polyethylene-glycol-modified single-walled carbon nanotubes for intra-articular delivery to chondrocytes. ACS Nano. 2014; 8(12):12280-12291. |
| [1] | Bi Yujie, Ma Dujun, Peng Liping, Zhou Ziqiong, Zhao Jing, Zhu Houjun, Zhong Qiuhui, Yang Yuxin. Strategy and significance of Chinese medicine combined with medical hydrogel for disease treatment [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 419-425. |
| [2] | Gao Xueyu, Zhang Wentao, Sun Tianze, Zhang Jing, Li Zhonghai. Application of metal ions in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 439-444. |
| [3] | Yang Jie, Hu Haolei, Li Shuo, Yue Wei, Xu Tao, Li Yi. Application of bio-inks for 3D printing in tissue repair and regenerative medicine [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 445-451. |
| [4] | Kong Xiangyu, Wang Xing, Pei Zhiwei, Chang Jiale, Li Siqin, Hao Ting, He Wanxiong, Zhang Baoxin, Jia Yanfei. Biological scaffold materials and printing technology for repairing bone defects [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 479-485. |
| [5] | Liu Baofang, Xu Bin, Chen Lei. Pueraria decoction in the treatment of osteoarthritis: network pharmacology analysis and animal model validation [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(2): 193-199. |
| [6] | Meng Zhicheng, Qiao Weiping, Zhao Yang, Liu Hongfei, Li Kaijie, Ma Bo. Effects of immune cells and related cytokines in the pathogenesis and treatment of osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(2): 280-287. |
| [7] | Wang Xianfeng, Wang Kun, Sun Han, Sun Xiaoliang, Yan Litao. Mechanism underlying exosomal lncRNA H19 derived from umbilical cord mesenchymal stem cells promotes cartilage injury repair [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(1): 20-25. |
| [8] | Shen Feiyan, Yao Jixiang, Su Shanshan, Zhao Zhongmin, Tang Weidong. Knockdown of circRNA WD repeat containing protein 1 inhibits proliferation and induces apoptosis of chondrocytes in knee osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(在线): 1-6. |
| [9] | He Wanyu, Cheng Leping. Strategies and advance on stem cell transplantation for repair of spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(在线): 1-7. |
| [10] | Li Xiaomin, Tian Xiangdong, Tan Yetong, Zhu Guangyu, Wang Rongtian, Wang Jian, Xue Zhipeng, Ma Sheng, Hu Yuanyi, Huang Ye, Ding Tiansong. Changes of lower limb force line and knee function after high tibial osteotomy in osteoporotic medial ventricular knee osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(9): 1325-1329. |
| [11] | Huang Linke, Wei Linhua, Jiang Jie, Liu Qian, Chen Weiwei. Effects of estrogen combined with treadmill exercise on bone mass and articular cartilage in ovariectomized mice [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(8): 1166-1171. |
| [12] | Xu Xingxing, Wen Chaoju, Meng Maohua, Wang Qinying, Chen Jingqiao, Dong Qiang. Carbon nanomaterials in oral implant [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(7): 1062-1070. |
| [13] | Xu Cong, Zhao He, Sun Yan. Regeneration of facial nerve injury repaired by biomaterial nerve conduits [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(7): 1089-1095. |
| [14] | Chen Shisong, Liu Xiaohong, Xu Zhiyun. Current status and prospects of bioprosthetic heart valves [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(7): 1096-1102. |
| [15] | Yuan Changshen, Guan Yanbing, Li Zhe, Rong Weiming, Liao Shuning, Chen Lewei, Mei Qijie, Duan Kan. Screening and verification of key genes of necroptosis in osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(5): 695-700. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||