Chinese Journal of Tissue Engineering Research ›› 2023, Vol. 27 ›› Issue (34): 5570-5576.doi: 10.12307/2023.887
Manganese-containing bioceramic materials in the field of bone repair
Wang Xinjie1, Wang Guodong2, Zheng Zhongren1, Shao Yiming1, Wang Jialiang1, Ma Hui2, Zhao Xiaowei2
- 1School of Clinical Medicine, Jining Medical University, Jining 272067, Shandong Province, China; 2Department of Joint and Sports Medicine, Affiliated Hospital of Jining Medical University, Jining 272029, Shandong Province, China
-
Received:2022-11-23Accepted:2023-01-10Online:2023-12-08Published:2023-04-23 -
Contact:Zhao Xiaowei, MD, Chief physician, Department of Joint and Sports Medicine, Affiliated Hospital of Jining Medical University, Jining 272029, Shandong Province, China -
About author:Wang Xinjie, Master candidate, School of Clinical Medicine, Jining Medical University, Jining 272067, Shandong Province, China -
Supported by:the National Natural Science Foundation of China, No. 81871814 (to WGD); Jining Key Research and Development Program, No. 2021YXNSO76 (to ZXW)
CLC Number:
Cite this article
Wang Xinjie, Wang Guodong, Zheng Zhongren, Shao Yiming, Wang Jialiang, Ma Hui, Zhao Xiaowei. Manganese-containing bioceramic materials in the field of bone repair[J]. Chinese Journal of Tissue Engineering Research, 2023, 27(34): 5570-5576.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
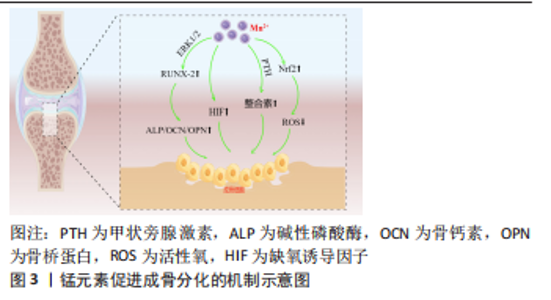
2.1 传统的生物陶瓷材料 作为生物材料的重要组成部分,生物活性陶瓷材料主要包括钙磷基和钙硅基陶瓷,典型的有羟基磷灰石[8]、β-磷酸三钙、硅酸钙、生物活性玻璃等[9]。如果根据陶瓷的生物活性可以将其分为3大类:以氧化铝、氧化锆为代表的生物惰性陶瓷,以生物活性玻璃、羟基磷灰石为代表的生物活性陶瓷,以磷酸三钙为代表的可降解生物陶瓷。 生物陶瓷材料在常温下稳定性好、溶解度小、密度高,具有与人体骨组织相近的成分,抗压强度和弹性模量都比较高,可支持组织细胞附着生长,具有良好的骨传导性,可与骨组织形成稳固的化学结合,同时对人体没有毒副作用,具有良好的生物活性和生物相容性,非常适合作为骨组织的修复材料,已被广泛研究用于骨再生[1,10–13]。尽管如此,生物陶瓷材料也存在诸多局限,首先是力学性能如抗压强度、断裂韧性、机械加工性、硬度等方面较差[2];其次是化学性能稳定导致降解速度极为缓慢且难以控制[14];最后还缺乏骨诱导及抗菌能力等额外的功能特性。这些因素在一定程度上限制了骨修复陶瓷材料的发展[2,15]。为解决上述问题,陶瓷制作工艺的改进和骨组织工程的改性处理势在必行。 2.2 陶瓷3D打印技术研究现状 骨缺损修复需求日益增加,生物陶瓷材料的优异特性决定了它在骨组织替代领域不可忽视的重要地位。传统生物陶瓷材料的应用虽然在一定程度上缓解了骨修复的临床需求,但是仍然存在各种各样的限制。最初,大多陶瓷支架是通过常规制造方法来制备,例如冷冻干燥、相分离/转化、纤维黏合、浇注成型和颗粒沥滤等[16]。然而,传统制造方法不能很好地控制支架的孔形状、孔隙率和几何形状,并且所制造的支架不能有针对性地促进细胞生长和组织再生。为了克服传统生物陶瓷支架制备的不足,骨组织工程的出现为解决陶瓷材料的临床受限提供了一个有效的解决方案。3D打印技术是一种增材制造技术,是新型数字化快速成型技术,可以根据基体材料和支架要求的不同将制造方法大致分为4类:选择性激光烧结打印、光固化打印、熔融沉积打印和生物三维打印制造技术。相较于传统制备工艺而言,3D打印制造工艺在精细调控孔隙形貌、孔径和孔隙率等方面具有明显的优势,可以利用陶瓷作为原材料,通过“分层制造、逐层叠加”的方式快速将生物陶瓷支架构造成由宏观、微观和纳米结构组成的分级结构,这种分级结构能有效提供力学支撑,为细胞附着延伸提供锚定位点,从而允许细胞铺展和生长因子的有效传递,有利于骨组织从支架的外围向内部的连续性生长,实现骨修复而非骨替代。ALMELA等[17]通过3D打印技术制备模拟皮质骨-松质骨双层结构的β-磷酸三钙生物陶瓷支架,在保留较高的孔隙率[(64.8±1.4)%]同时,机械性能有了显著提升,其弹性模量可达到55.5 MPa,同时又具有良好的促进骨缺损修复的能力。WU团队[18]用3D打印技术制备得到孔径高度一致的硅酸钙陶瓷支架,该支架的抗压强度大约是传统方式制备陶瓷支架的120倍。总的来说,生物陶瓷支架的3D打印制备方法具备以下优势:①实现支架的孔形状、孔隙率、孔容积、互连性、空间排列和其他表面特性的可控性,制备可控、规则的多孔结构,利于营养物质的输送并为细胞向支架内部的迁移和增殖提供了生长导向结构;②具有足够的机械强度,满足临床承重要求;③具有良好的生物相容性,可以诱导骨磷灰石的形成;④可以实现支架的快速精准制备,满足个性化要求。总之,3D打印技术可以构建一种能有效提供力学支撑,具有合适的孔隙率促进营养物质交换以及诱导新生骨组织的长入,并可能用于复杂骨缺损的修复与再生的高精度可定制的多孔支架,满足个性化、精准化的医疗需求。 然而,3D打印制造的多孔复合支架仍然具有功能单一和成骨诱导不良等问题,致使陶瓷支架在临床应用和治疗效果上存在限制。因此,迫切需要对生物陶瓷支架进行功能改性。目前,对生物陶瓷支架的本体材料进行功能元素的掺杂改性是一种行之有效的改性方式,这种材料的元素改性可以通过与已经合成的陶瓷材料进行离子交换或者制备陶瓷材料的过程中直接掺杂得以实现。总的来说,生物陶瓷材料开始逐渐由第一代生物惰性陶瓷和第二代生物活性玻璃陶瓷开始逐渐向具有可调控生物响应特性和主动修复功能新型生物活性陶瓷材料所转变。这种新型生物活性陶瓷材料不仅具有良好的生物相容性和力学强度,更关键的是可以在支架材料降解过程中释放活性离子来激发特殊的细胞反应、吸附有关的活性物质和诱导成骨等特性[19]。 2.3 锰的掺杂对陶瓷的影响 锰作为正常机体必需的微量元素之一,是维持人体健康的重要因素,在人体发育、新陈代谢和抗氧化系统中必不可少。锰主要存在于骨骼中,对于骨骼和肌肉的正常发育和新陈代谢是至关重要的[20]。锰已被确定可以作为骨组织工程中局部应用的有益元素[21]。将这种有益元素掺杂的支架植入体内后,会因为支架与周围环境之间的相互作用而被降解腐蚀并释放出具有生物活性的金属离子,释放的活性离子会作为一种调控因子激活相关信号通路,从而改变细胞行为,进而影响支架周围的骨组织再生[22-23]。同时陶瓷的晶体结构是灵活的,它可以被广泛取代,这种特性使得陶瓷材料非常适合作为元素掺入的载体用于骨组织工程。通过将活性离子锰掺入陶瓷网络中,不仅保留了其本身的生物治疗效果,在很多情况下还可以影响陶瓷材料的结构和可加工性,并赋予其额外的功能特性[15,24]。 基于锰元素的有益特性及陶瓷材料良好的生物相容性,科学家们开始利用各种方法将锰元素掺杂进陶瓷材料中,作为改善成骨的治疗离子。制备各种离子取代型陶瓷的方法主要有湿化学方法(例如化学沉淀法、水热合成法、溶胶-凝胶法)、改进的St?ber工艺[25]、固态反应、燃烧、微波和机械化学合成方法,最广泛使用的合成方法是湿化学方法[26-27]。与传统的熔融制备相比,目前常用的溶胶-凝胶工艺制备的陶瓷晶体参数稳定,具有更高的比表面积和介孔结构。通过从钙、磷酸盐和掺杂锰元素的盐溶液中进行共沉淀,可以将具有额外效益的不同元素掺入陶瓷网络之中,掺杂的离子可以在溶解过程中释放,从而增强支架性能和提供更好的生物活性,并且基于制备反应原理,这种方法更适合制备多种元素掺杂的多元陶瓷体系[28-29]。这种掺杂有益元素的陶瓷粉体显著增强蛋白质吸附能力和成骨活性,提高生物相容性和促进成骨相关基因以及整合素的表达,在很大程度上帮助骨与种植体之间实现良好的骨融合。随后在锰元素掺杂陶瓷的基础上,开始利用涂层涂敷和共价结合生物活性肽等方式进一步对陶瓷改性,来赋予了支架更多更全面的有益特性。 锰元素改善了生物陶瓷支架材料的力学性能:通过元素掺杂改变陶瓷原材料的化学组成,可以改变陶瓷的烧结温度与晶格结构,是改善陶瓷支架力学性能的重要方式。可以通过对陶瓷中钙原子的取代来使锰元素掺入其中,磷酸盐生物陶瓷中元素组成的改变会使陶瓷的微观形貌及其晶格缺陷发生变化,降低了其晶相转变温度及晶胞参数,对材料的机械强度产生影响,这种影响具体体现:在一方面,有助于将β-磷酸三钙相稳定在其烧结温度以上,而不会转变为α-磷酸三钙,提高陶瓷热稳定性;另一方面,也有助于保持一定的支架孔隙率,并且锰离子的直径更小更容易进入晶体间隙,从而利于离子的释放和加速支架的降解。有大量实验通过各种分析技术(包括 X射线衍射、傅里叶变换红外光谱、场发射扫描电子显微镜 、透射电子显微镜和X射线光电子能谱)来对一系列温度下的烧结行为、微观结构演变、元素掺杂特征和抗压强度进行了系统研究。LALA等[30]报道锰元素的掺杂可以改善羟基磷灰石陶瓷的断裂韧性,由0.5 MPa·m1/2 显著提升至1.6 MPa·m1/2。邓翠君[31]的研究显示,β-磷酸三钙、含锰元素摩尔百分比2.5%β-磷酸三钙、含锰元素摩尔百分比2.5%β-磷酸三钙和含锰元素摩尔百分比10%β-磷酸三钙的抗压强度分别为 6.947,12.427,13.545和15.055 MPa,孔隙率分别为(79.9±1.29)%,(66.3±1.85)%,(60.7±1.68)%和(50.6±2.56)%,从数据可以看出锰元素的掺杂降低了支架的孔隙率,使支架变得更加致密,提高了支架的力学性能。锰元素掺入陶瓷晶格可以形成较弱的键合网络,同时由于含锰羟基磷灰石的低热稳定性(800 ℃分解)表明含锰元素的支架在体内的降解速率加快[32]。锰元素的掺入赋予支架更高的抗压抗弯曲强度及更优越的降解性能,能够满足人体松质骨修复的抗压强度要求,为骨细胞和新骨纤维的长入提供支架作用[1,31,33-35]。 锰元素的掺杂可以改善生物陶瓷支架的生物相容性:生物相容性是指生物材料与生物组织环境之间相互影响和作用,与生物材料的表面性质(亲水性、表面电荷等)息息相关。对应用于生物医学中的材料进行生物相容性检测是必不可少的,常通过体外细胞培养实验和体内植入实验进行评估,这些检测大致可以分为血液反应、免疫反应和组织反应检测。锰元素的掺杂可以使支架具有更强的亲水性,使支架吸附更多的亲水性蛋白,从而竞争性抑制疏水性纤维蛋白原的表面吸附,抑制表面血小板的吸附和血凝块的形成,使支架具有突出的血液相容性[36]。锰羰基(MnCO)和内源性过氧化氢之间的类芬顿反应触发一氧化碳和锰离子的连续释放[37],通过激活缺氧诱导因子1α途径并上调巨噬细胞的M2表型来显着减轻炎症反应,具有较强的免疫调节性。 锰元素赋予材料额外的抗菌性能:骨科植入物感染是不可忽视的临床难题,研发具有高效抗菌活性、抑制生物膜形成以及促进骨整合的多功能表面生物陶瓷材料引起了广泛关注。RAU等[33]的实验发现,掺杂高浓度锰离子的β-磷酸三钙陶瓷相比于纯β-磷酸三钙陶瓷明显抑制了所有测试细菌物种的生长,表明Mn2+具有显著的抑菌效果尤其是对革兰阳性细菌。据LüTHEN等[38]报道,Mn2+质量浓度高于12.5 μg/mL时可以表现出一定的抗菌活性。Mn2+通过与细菌的硫醇基团结合改变细菌的蛋白质结构,导致其细菌壁的破裂,抑制与细菌分裂增殖有关的DNA功能。因此,锰元素的添加会赋予支架显著的抗菌效果,可以预防植入材料在人体内相关感染的发生,获得具有抗菌和优异成骨功能的均衡生物陶瓷支架,对于治疗骨植入物相关感染和促进骨修复具有重要意义。 锰元素可以进一步增强陶瓷材料诱导成骨的作用:生物陶瓷中锰元素会以剂量依赖性的方式影响间充质干细胞在制备支架中的分化行为。锰可以促进成骨相关基因RUNX2、骨形态发生蛋白2、骨钙素、骨桥蛋白及Ⅰ型胶原蛋白等的表达,促进间充质干细胞向成骨细胞的分化。含锰生物陶瓷支架所释放的Mn2+可以激活细胞外ERK1/2信号通路的磷酸化,上调p-ERK1/2蛋白的表达水平,进一步促进下游RUNX2蛋白表达,而RUNX2蛋白水平的上调又可以升高其下游的功能蛋白碱性磷酸酶活性水平和增加编码细胞外基质的相关蛋白(骨钙素和骨桥蛋白)的基因表达,在此基础上进一步诱导Ⅰ型胶原蛋白的大量表达,从而加速骨矿物质沉积和矿化[15,39-40]。此外,还可以通过甲状旁腺激素相关信号通路,释放的Mn2+作为一种重要的辅因子来提高整合素的配体亲和力来诱导整合素的表达。整合素作为一种参与细胞以及细胞与细胞外基质之间相互作用的细胞黏附分子,可以结合特定的细胞外基质蛋白和充当细胞和细胞外基质之间的桥梁,表达增加的整合素在初期可以促进细胞的黏附和扩散,后期则主要维持细胞的黏附强度,从而促进成骨样细胞(MC3TC细胞)的黏附与增殖[41–44],并诱导人间充质干细胞沿着骨途径分化,改善自体骨或植入体衔接并促进成骨相关蛋白的响应[34],进而提高复合材料的骨修复率。掺锰生物陶瓷支架还具有抗氧化特性,释放的Mn2+可以活化转录因子Nrf2所介导的抗氧化系统来调节活性氧水平,这种受控的活性氧水平可以抑制破骨细胞的形成和功能,促进成骨细胞的分化,加速体内骨质疏松条件下的骨再生[45-46]。邓翠君[31]制备的Mn-磷酸三钙生物陶瓷粉体的离子产物通过激活缺氧诱导因子信号通路诱导软骨细胞进行分化,促进软骨细胞的增殖和成熟,通过Mn2+和Ca2+协同作用诱导骨髓间充质干细胞增殖和成骨分化;并通过抑制关节炎环境下的软骨细胞内降解代谢活动保护软骨细胞。这个实验同样表明,含锰的生物陶瓷上的骨髓间充质干细胞有着丰富的伪足,在支架表面的铺展要优于不含锰的陶瓷。总的来说,锰元素通过多种途径对骨髓间充质干细胞的成骨分化产生积极影响,见图3。"
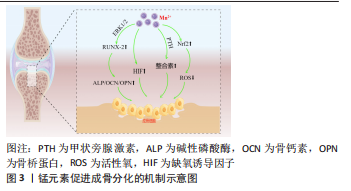
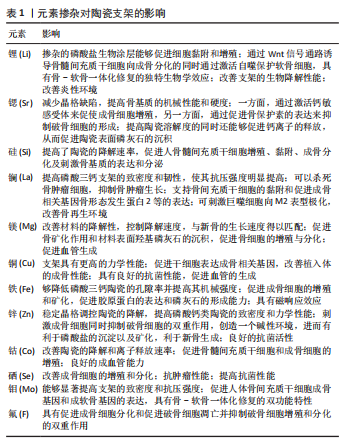
生物陶瓷中的锰元素影响骨和软骨的生长发育。锰元素通过多糖聚合酶及半乳糖转移酶来参与黏多糖的合成[47],而黏多糖是软骨和骨的重要成分;还有研究表明,锰可以通过增加细胞内转化生长因子β结合位点来提高软骨寡聚糖蛋白的生物活性[48],促进硫酸软骨素的合成,而硫酸软骨素是形成骨骼的重要成分。因此,锰元素的缺乏会使成骨细胞活性受到抑制,骨组织力学性能相应下降,引起软骨组织功能异常及骨骼异常[49]。 生物陶瓷中锰元素诱导成骨的其他方式。锰元素使支架具有更强的亲水性,显著提高了蛋白质的吸附能力,聚集的蛋白质又可以影响周围细胞的黏附与增殖,使细胞更容易黏附和分泌基质;二氧化锰(MnO2)具有过氧化氢酶模拟特性,可以催化分解植入部位产生的内源性H2O2产生大量氧气,来缓解骨缺损处因血供不足而导致的缺氧环境[50-52],上调巨噬细胞的M2表型来显著减轻炎症反应,巨噬细胞也分泌血管内皮生长因子以诱导血管形成[37],改善氧化应激下的成骨作用。 2.4 含锰生物陶瓷的进一步改性处理 2.4.1 表面涂层改性 元素改性作为一种有效的改善支架生物和力学性能的策略,常用的方式有两种,一种是在陶瓷支架制备的过程中直接掺杂其中[53],还有一种是作为一种表面改性手段将锰元素与陶瓷结合制备成表面涂层[54]。将掺杂有益元素的陶瓷材料用于构建这些惰性植入材料的表面涂层,可以在金属生物材料优异力学性能的基础上同样利用陶瓷材料和锰元素的良好生物学特性,使支架材料与骨组织之间形成良好的结合并促进新生骨组织的形成,是一种成本较低且十分简单有效的改性方法。通过在金属材料支架表面上涂敷锰修饰的羟基磷灰石复合薄膜作为表面改性剂,可以增强材料的抗腐蚀性能、生物相容性和骨结合能力[55-57]。 增强支架与细胞间的相互作用:将锰元素掺入陶瓷结构中,会以Mn2+和Mn3+存在于涂层中,这种涂层适合细胞的黏附和增殖,增强细胞外基质重塑和骨矿化,并诱导成骨细胞增殖,改善植入物与周围骨组织的结合[25]。 提高机械性能:可以使陶瓷的晶格常数和孔隙率变小,改变支架表面的薄膜形态,使其接近于人体自然骨,实现孔隙率与机械性能之间的平衡,极大改善了涂层的生物相容性和骨传导特性。 提高耐腐蚀性:支架表面涂敷的涂层可以在支架表面形成更致密和更均匀的薄膜,降低了比表面积,影响表面的电化学反应性,增强表面钝化能力[58]。这种薄膜可以作为一种保护膜使材料的腐蚀降解速率显著降低,提高金属材料在生理环境中的耐腐蚀性,有效避免了材料因腐蚀降解释放的有毒金属离子导致术区组织过敏或炎性反应,进而改善了材料的骨整合效应,使植入支架具有较高的生理稳定性[59]。 2.4.2 生物活性肽进行共价结合改性 为了进一步优化含锰陶瓷支架与成骨细胞的有益相互作用,与生物活性肽进行了选择性和特异性共价结合,通过骨形态发生蛋白2肽的醛基团与掺锰生物陶瓷的胺基团之间反应来将其锚定到支架上。CASSARI等[60]利用含锰元素的生物活性玻璃与生物活性肽(骨形态发生蛋白2)进行选择性和特异性共价官能化,之后经测定发现成骨细胞增殖黏附、基因表达和钙盐沉积出现显著改善。骨形态发生蛋白2共价锚定到含锰陶瓷材料,可以避免它们过早释放并通过细胞机械传感器识别来促进更稳定的细胞黏附结构。二者之间的联合修饰可以起到协同作用,以改善骨生物材料性能[61]。 2.4.3 调节锰元素的掺杂价态改性 锰有多种价态,其中作为骨组织工程中的掺杂剂用最多的是Mn2+。但研究发现,高氧化态的Mn3+具有更为出色的抗菌性能。Mn3+在细菌体内通过产生活性氧,导致细菌中DNA的氧化损伤[62],从而诱导有效的抗菌功能。李淼[1]通过水热法制备Mn3+掺杂的羟基磷灰石,并对其进行了细胞毒性检测和抗菌性能实验,发现这种材料对金黄色葡萄球菌和大肠杆菌有90%以上的抗菌能力。此外,Mn3+同样可以改善磷酸钙陶瓷的力学性能和生物相容性,通过将Mn3+引入陶瓷的晶格结构中可以改善原有的晶格缺陷和表面性质。Mn3+通过取代磷酸钙陶瓷里的Ca2+使支架表面携带更多的正电荷,可以吸附更多的蛋白;同时,这种离子取代还可以产生更多的质子空位来增加支架表面的亲水性,进而改善材料表面与周围环境之间的亲和力。Mn3+同样可以具有良好的成骨诱导特性,微量的Mn3+可以通过使成骨相关基因(骨形态发生蛋白2和RUNX2)的表达和碱性磷酸酶活性增加来显著改善成骨细胞的增殖和分化。 2.4.4 多元素掺杂改性 锰元素的掺杂可以给支架带来诸如力学性能、抗菌和诱导成骨等特性,但是人体骨组织成分和生长环境复杂,从仿生学角度来看单一的离子掺杂势必无法满足骨缺损修复临床需求。因此需要在传统陶瓷的基础上引入无机活性离子及调控其释放,探究从单一活性离子到多离子协同促进骨缺损修复的作用机制,制备出具有释放单一或多种活性离子的三维多孔陶瓷支架。目前镁[63-64]、锰、硅、硒[65]、铁[66]、锶[67]、锂等单离子掺杂材料的制备与性能研究已相对成熟[68],这些离子各自具有独特的生物活性(表1),通过将两种或多种结合制成共掺材料或许可以达到取长补短相辅相成的作用[69-70]。张卓俊[2]合成镁锰共掺的陶瓷材料,研究发现镁锰双元素掺杂可以使材料之间的黏结作用加强,热稳定性增加;与此同时,这种双掺的支架既保留了锰离子促进成骨分化的作用,又具有镁离子促进血管生成和改善材料降解性能的作用。MUTHUSAMY等[40]合成的硒锰双元素掺杂陶瓷支架,不仅结合了硒的抗肿瘤特性和锰元素的优异成骨特性,更重要的是硒还可以与细菌胞壁发生反应,诱导微生物细胞死亡,这种抗菌特性与锰元素的抗菌作用机制不同,两者可以使支架的抗菌效果更为显著。"
| [1] 李淼.微量元素掺杂羟基磷灰石的制备及生物学效应研究[D].上海:上海师范大学,2019. [2] 张卓俊.离子掺杂β-磷酸三钙材料制备及3D支架性能研究[D].哈尔滨:哈尔滨工业大学,2020. [3] 武兰.HA/Al_2O_3功能梯度陶瓷材料的制备及其生物活性[D].福州:福建师范大学,2019. [4] FADEEVA IV, KALITA VI, KOMLEV DI, et al. In Vitro Properties of Manganese-Substituted Tricalcium Phosphate Coatings for Titanium Biomedical Implants Deposited by Arc Plasma. Materials (Basel). 2020;13(19): E4411. [5] 王晓亚,常江.生物陶瓷在组织工程中的应用[J].生命科学,2020,32(3):257-266. [6] 孙元艺.锰复合骨修复支架的3D打印及其性能评估[D].深圳:中国科学院大学(中国科学院深圳先进技术研究院),2022. [7] 周欢,杨蒙蒙.掺杂不同离子的羟基磷灰石涂层研究现状[J].国际生物医学工程杂志,2016,39(5):319-320. [8] GEORGE SM, NAYAK C, SINGH I, et al. Multifunctional Hydroxyapatite Composites for Orthopedic Applications: A Review. ACS Biomater Sci Eng. 2022;8(8):3162-3186. [9] HOU X, ZHANG L, ZHOU Z, et al. Calcium Phosphate-Based Biomaterials for Bone Repair. J Funct Biomater. 2022;13(4):187. [10] MA H, FENG C, CHANG J, et al. 3D-printed bioceramic scaffolds: From bone tissue engineering to tumor therapy. Acta Biomater. 2018;79:37-59. [11] 李俊刚.3D打印掺钴生物陶瓷支架介导成骨-成血管偶联促进骨修复的作用研究[D].福州:福建医科大学,2021. [12] MARCACCI M, KON E, MOUKHACHEV V, et al. Stem cells associated with macroporous bioceramics for long bone repair: 6- to 7-year outcome of a pilot clinical study. Tissue Eng. 2007;13(5):947-955. [13] CHEN Y, WANG J, ZHU XD, et al. Enhanced effect of β-tricalcium phosphate phase on neovascularization of porous calcium phosphate ceramics: in vitro and in vivo evidence. Acta Biomater. 2015;11:435-448. [14] LU J, DESCAMPS M, DEJOU J, et al. The biodegradation mechanism of calcium phosphate biomaterials in bone. J Biomed Mater Res. 2002;63(4):408-412. [15] PANTULAP U, ARANGO-OSPINA M, BOCCACCINI AR. Bioactive glasses incorporating less-common ions to improve biological and physical properties. J Mater Sci Mater Med. 2021;33(1):3. [16] MOTA C, PUPPI D, CHIELLINI F, et al. Additive manufacturing techniques for the production of tissue engineering constructs. J Tissue Eng Regen Med. 2015;9(3): 174-190. [17] ALMELA T, BROOK IM, KHOSHROO K, et al. Simulation of cortico-cancellous bone structure by 3D printing of bilayer calcium phosphate-based scaffolds. Bioprinting. 2017;6:1-7. [18] WU C, FAN W, ZHOU Y, et al. 3D-printing of highly uniform CaSiO3 ceramic scaffolds: preparation, characterization and in vivo osteogenesis. J Mater Chem Mater. 2012;22(24):12288-12295. [19] 党文涛.3D打印生物陶瓷支架用于骨组织修复和治疗[D].上海:中国科学院大学(中国科学院上海硅酸盐研究所),2019. [20] WANG C, ZHU Y, LONG H, et al. Relationship between blood manganese and bone mineral density and bone mineral content in adults: A population-based cross-sectional study. PloS One. 2022;17(10):e0276551. [21] WESTHAUSER F, WILKESMANN S, NAWAZ Q, et al. Osteogenic properties of manganese-doped mesoporous bioactive glass nanoparticles. J Biomed Mater Res A. 2020;108(9):1806-1815. [22] ZHOU Y, WU C, CHANG J. Bioceramics to regulate stem cells and their microenvironment for tissue regeneration. Mater Today. 2019;24:41-56. [23] 喻小鹏,吴成铁.3D打印生物陶瓷功能改进的研究进展[J].硅酸盐学报,2021, 49(5):829-843. [24] 张畅,喻正文.锰元素在生物材料中的应用:现状和问题[J].中国组织工程研究,2022,26(34):5504-5511. [25] BARRIONI BR, NARUPHONTJIRAKUL P, NORRIS E, et al. Effects of manganese incorporation on the morphology, structure and cytotoxicity of spherical bioactive glass nanoparticles. J Colloid Interface Sci. 2019;547:382-392. [26] ŠUPOVÁ M. Substituted hydroxyapatites for biomedical applications: A review. Ceram Int. 2015;41(8):9203-9231. [27] TITE T, POPA AC, BALESCU LM, et al. Cationic Substitutions in Hydroxyapatite: Current Status of the Derived Biofunctional Effects and Their In Vitro Interrogation Methods. Materials (Basel). 2018;11(11):E2081. [28] NAWAZ Q, REHMAN MAU, BURKOVSKI A, et al. Synthesis and characterization of manganese containing mesoporous bioactive glass nanoparticles for biomedical applications. J Mater Sci Mater Med. 2018;29(5):64. [29] BARRIONI BR, OLIVEIRA AC, DE FÁTIMA LM, et al. Sol-gel-derived manganese-releasing bioactive glass as a therapeutic approach for bone tissue engineering. J Mater Sci. 2017;52(15):8904-8927. [30] LALA S, MAITY TN, SINGHA M, et al. Effect of doping (Mg,Mn,Zn) on the microstructure and mechanical properties of spark plasma sintered hydroxyapatites synthesized by mechanical alloying. Ceram Int. 2017;43(2):2389-2397. [31] 邓翠君.骨—软骨复杂组织修复生物活性无机材料的制备及性能研究[D].上海:中国科学院大学(中国科学院上海硅酸盐研究所),2018. [32] ZILM M, THOMSON SD, WEI M. A Comparative Study of the Sintering Behavior of Pure and Manganese-Substituted Hydroxyapatite. Materials. 2015;8(9):6419-6436. [33] RAU JV, FADEEVA IV, FOMIN AS, et al. Sic Parvis Magna: Manganese-Substituted Tricalcium Phosphate and Its Biophysical Properties. ACS Biomater Sci Eng. 2019; 5(12):6632-6644. [34] TORRES PMC, VIEIRA SI, CERQUEIRA AR, et al. Effects of Mn-doping on the structure and biological properties of β-tricalcium phosphate. J Inorg Biochem. 2014;136:57-66. [35] KAMARAJ M, ROOPAVATH UK, GIRI PS, et al. Modulation of 3D Printed Calcium-Deficient Apatite Constructs with Varying Mn Concentrations for Osteochondral Regeneration via Endochondral Differentiation. ACS Appl Mater Interfaces. 2022; 14(20):23245-23259. [36] 董少杰,王旭东,沈国芳,等.生物陶瓷支架的功能改性及应用研究进展[J].无机材料学报,2020,35(8):867-881. [37] ZHANG J, TONG D, SONG H, et al. Osteoimmunity-Regulating Biomimetically Hierarchical Scaffold for Augmented Bone Regeneration. Adv Mater. 2022;34(36): e2202044. [38] LÜTHEN F, BULNHEIM U, MÜLLER PD, et al. Influence of manganese ions on cellular behavior of human osteoblasts in vitro. Biomol Eng. 2007;24(5):531-536. [39] YU Y, DING T, XUE Y, et al. Osteoinduction and long-term osseointegration promoted by combined effects of nitrogen and manganese elements in high nitrogen nickel-free stainless steel. J Mater Chem B. 2016;4(4):801-812. [40] MUTHUSAMY S, MAHENDIRAN B, SAMPATH S, et al. Hydroxyapatite nanophases augmented with selenium and manganese ions for bone regeneration: Physiochemical, microstructural and biological characterization. Biomater Adv. 2021;126:112149. [41] ARMULIK A, SVINENG G, WENNERBERG K, et al. Expression of integrin subunit beta1B in integrin beta1-deficient GD25 cells does not interfere with alphaVbeta3 functions. Exp Cell Res. 2000;254(1):55-63. [42] DORMOND O, PONSONNET L, HASMIM M, et al. Manganese-induced integrin affinity maturation promotes recruitment of alpha V beta 3 integrin to focal adhesions in endothelial cells: evidence for a role of phosphatidylinositol 3-kinase and Src. Thromb Haemost. 2004;92(1):151-161. [43] BARRIONI BR, NORRIS E, LI S, et al. Osteogenic potential of sol-gel bioactive glasses containing manganese. J Mater Sci Mater Med. 2019;30(7):86. [44] ZHAO QM, SUN YY, WU CS, et al. Enhanced osteogenic activity and antibacterial ability of manganese-titanium dioxide microporous coating on titanium surfaces. Nanotoxicology. 2020;14(3):289-309. [45] LI J, DENG C, LIANG W, et al. Mn-containing bioceramics inhibit osteoclastogenesis and promote osteoporotic bone regeneration via scavenging ROS. Bioact Mater. 2021;6(11):3839-3850. [46] SÁNCHEZ-DE-DIEGO C, PEDRAZZA L, PIMENTA-LOPES C, et al. NRF2 function in osteocytes is required for bone homeostasis and drives osteocytic gene expression. Redox Biol. 2021;40:101845. [47] BRACCI B, TORRICELLI P, PANZAVOLTA S, et al. Effect of Mg(2+), Sr(2+), and Mn(2+) on the chemico-physical and in vitro biological properties of calcium phosphate biomimetic coatings. J Inorg Biochem. 2009;103(12):1666-1674. [48] HAUDENSCHILD DR, HONG E, YIK JHN, et al. Enhanced activity of transforming growth factor β1 (TGF-β1) bound to cartilage oligomeric matrix protein. J Biol Chem. 2011;286(50):43250-43258. [49] LIU AC, HEINRICHS BS, LEACH RM. Influence of manganese deficiency on the characteristics of proteoglycans of avian epiphyseal growth plate cartilage. Poult Sci. 1994;73(5):663-669. [50] LIU S, LI K, HU T, et al. Zn-doped MnO2 nanocoating with enhanced catalase-mimetic activity and cytocompatibility protects pre-osteoblasts against H2O2-induced oxidative stress. Colloids Surf B Biointerfaces. 2021;202:111666. [51] KUMAR S, ADJEI IM, BROWN SB, et al. Manganese dioxide nanoparticles protect cartilage from inflammation-induced oxidative stress. Biomaterials. 2019;224: 119467. [52] 施吉翔,翟东,朱敏,等.生物活性玻璃–二氧化锰复合支架的制备与表征[J].无机材料学报,2022,37(4):427-435. [53] 王毅,邹德荣.骨缺损修复用生物陶瓷的元素改性研究进展[J].口腔颌面外科杂志,2012,22(6):440-443. [54] 魏永杰.医用金属表面微纳复合结构涂层的制备与应用研究[D].长春:吉林大学,2021. [55] ASRI RIM, HARUN WSW, SAMYKANO M, et al. Corrosion and surface modification on biocompatible metals: A review. Mater Sci Eng C Mater Biol Appl. 2017;77:1261-1274. [56] NAWAZ Q, REHMAN MAU, ROETHER JA, et al. Bioactive glass based scaffolds incorporating gelatin/manganese doped mesoporous bioactive glass nanoparticle coating. Ceram Int. 2019;45(12):14608-14613. [57] 张雪姣,郝敏,乔海霞,等.锰和氟共修饰羟基磷灰石陶瓷涂层的制备与表征[J].光谱学与光谱分析,2016,36(3):686-690. [58] HUANG Y, DING Q, HAN S, et al. Characterisation, corrosion resistance and in vitro bioactivity of manganese-doped hydroxyapatite films electrodeposited on titanium. J Mater Sci Mater Med. 2013;24(8):1853-1864. [59] ANANTH KP, SUN J, BAI J. An Innovative Approach to Manganese-Substituted Hydroxyapatite Coating on Zinc Oxide−Coated 316L SS for Implant Application. Int J Mol Sci. 2018;19(8):E2340. [60] CASSARI L, BRUN P, DI FOGGIA M, et al. Mn-Containing Bioactive Glass-Ceramics: BMP-2-Mimetic Peptide Covalent Grafting Boosts Human-Osteoblast Proliferation and Mineral Deposition. Materials (Basel). 2022;15(13):4647. [61] BULLOCK G, ATKINSON J, GENTILE P, et al. Osteogenic Peptides and Attachment Methods Determine Tissue Regeneration in Modified Bone Graft Substitutes. J Funct Biomater. 2021;12(2):22. [62] WANG M, LI M, WANG Y, et al. Efficient antibacterial activity of hydroxyapatite through ROS generation motivated by trace Mn(iii) coupled H vacancies. J Mater Chem B. 2021;9(15):3401-3411. [63] 张畅.含锰镁合金的生物学活性及其成骨能力初探[D].遵义:遵义医科大学,2022. [64] NABIYOUNI M, BRÜCKNER T, ZHOU H, et al. Magnesium-based bioceramics in orthopedic applications. Acta Biomater. 2018;66:23-43. [65] HE R, DING C, LUO Y, et al. Congener-Induced Sulfur-Related Metabolism Interference Therapy Promoted by Photothermal Sensitization for Combating Bacteria. Adv Mater. 2021;33(44):e2104410. [66] SUCHANICZ J, WĄS M, NOWAKOWSKA-MALCZYK M, et al. Properties of Na0.5Bi0.5TiO3 Ceramics Modified with Fe and Mn. Materials (Basel). 2022;15(18):6204. [67] 穆君宇,侯沙,彭雨,等.微量掺锶材料在骨修复领域的应用[J].医学研究杂志,2022,51(7):15-18. [68] FARMANI AR, SALMEH MA, GOLKAR Z, et al. Li-Doped Bioactive Ceramics: Promising Biomaterials for Tissue Engineering and Regenerative Medicine. J Funct Biomater. 2022;13(4):162. [69] KHAIDUKOV N, PIRRI A, BREKHOVSKIKH M, et al. Time- and Temperature-Dependent Luminescence of Manganese Ions in Ceramic Magnesium Aluminum Spinels. Materials (Basel). 2021;14(2):420. [70] 齐军强,郭超.金属离子掺杂羟基磷灰石骨修复材料的特性及应用[J].中国组织工程研究,2023,27(21):3415. [71] NIK MD NOORDIN KAHAR NNF, AHMAD N, JAAFAR M, et al. A review of bioceramics scaffolds for bone defects in different types of animal models: HA andβ-TCP. Biomed Phys Eng Express. 2022;8(5).doi: 10.1088/2057-1976/ac867f. [72] ZHANG F, LI Z, XU M, et al. A review of 3D printed porous ceramics. J Eur Ceram Soc. 2022;42(8):3351-3373. [73] LAN W, CHEN W, HUANG D. Research progress on osteochondral tissue engineering. Sheng Wu Yi Xue Gong Cheng Xue Za Zhi. 2019;36(3):504-510. [74] SAFIAGHDAM H, NOKHBATOLFOGHAHAEI H, KHOJASTEH A. Therapeutic Metallic Ions in Bone Tissue Engineering: A Systematic Review of The Literature. Iran J Pharm Res. 2019;18(Suppl1):101-118. [75] SADEGHZADE S, LIU J, WANG H, et al. Recent advances on bioactive baghdadite ceramic for bone tissue engineering applications: 20 years of research and innovation (a review). Materials Today Bio. 2022;17:100473. [76] ZHANG J, ZHANG Q, LI S, et al. The effects of Mn(2+) on the proliferation, osteogenic differentiation and adipogenic differentiation of primary mouse bone marrow stromal cells. Biol Trace Elem Res. 2013;151(3):415-423. [77] WESTHAUSER F, WILKESMANN S, NAWAZ Q, et al. Effect of manganese, zinc, and copper on the biological and osteogenic properties of mesoporous bioactive glass nanoparticles. J Biomed Mater Res A. 2021;109(8):1457-1467. [78] ZHANG X, LIU J, WANG H. The cGAS-STING-autophagy pathway: Novel perspectives in neurotoxicity induced by manganese exposure. Environ Pollut. 2022;315:120412. [79] MIOLA M, BROVARONE CV, MAINA G, et al. In vitro study of manganese-doped bioactive glasses for bone regeneration. Mater Sci Eng C Mater Biol Appl. 2014; 38:107-118. [80] 尚文博.锰掺杂β-磷酸三钙多孔仿骨材料性能研究[D].长春:吉林大学,2016. [81] MOSLIM NA, AHMAD N, KASIM SR. Effect of Mg concentrations on the properties of biphasic calcium phosphate (BCP)//MATERIALS CHARACTERIZATION USING X-RAYS AND RELATED TECHNIQUES. Kelantan, Malaysia, 2019:020083. [82] KOLMAS J, GROSZYK E, PIOTROWSKA U. Nanocrystalline hydroxyapatite enriched in selenite and manganese ions: physicochemical and antibacterial properties. Nanoscale Res Lett. 2015;10(1):989. [83] TAKAGI J, PETRE BM, WALZ T, et al. Global conformational rearrangements in integrin extracellular domains in outside-in and inside-out signaling. Cell. 2002; 110(5):599-511. [84] YU L, ROWE DW, PERERA IP, et al. Intrafibrillar Mineralized Collagen-Hydroxyapatite- Based Scaffolds for Bone Regeneration. ACS Appl Mater Interfaces. 2020;12(16): 18235-18249. |
| [1] | Nong Fuxiang, Jiang Zhixiong, Li Yinghao, Xu Wencong, Shi Zhilan, Luo Hui, Zhang Qinglang, Zhong Shuang, Tang Meiwen. Bone cement augmented proximal femoral nail antirotation for type A3.3 intertrochanteric femoral fracturalysis [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(在线): 1-10. |
| [2] | Wang Yanjin, Zhou Yingjie, Chai Xubin, Zhuo Hanjie. Meta-analysis of the efficacy and safety of 3D printed porous titanium alloy fusion cage in anterior cervical discectomy and fusion [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(9): 1434-1440. |
| [3] | Peng Zhixin, Yan Wengang, Wang Kun, Zhang Zhenjiang. Finite element analysis and structural optimization design of 3D printed forearm braces [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(9): 1340-1345. |
| [4] | Pan Zhongjie, Qin Zhihong, Zheng Tiejun, Ding Xiaofei, Liao Shijie. Targeting of non-coding RNAs in the pathogenesis of the osteonecrosis of the femoral head [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(9): 1441-1447. |
| [5] | Cai Zhihao, Xie Zhaoyong. Femoral neck anteversion measurement assessment: how to establish a unified method and standard [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(9): 1448-1454. |
| [6] | He Yinhao, Li Xiaosheng, Chen Hongwen, Chen Tiezhu. 3D printed porous tantalum metal in the treatment of developmental dysplasia of the hip: current status and application prospect [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(9): 1455-1461. |
| [7] | Dang Yi, Du Chengyan, Yao Honglin, Yuan Nenghua, Cao Jin, Xiong Shan, Zhang Dingmei, Wang Xin. Hormonal osteonecrosis and oxidative stress [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(9): 1469-1476. |
| [8] | Wang Ji, Zhang Min, Yang Zhongya, Zhang Long. A review of physical activity intervention in type 2 diabetes mellitus with sarcopenia [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(8): 1272-1277. |
| [9] | Nie Chenchen, Su Kaiqi, Gao Jing, Fan Yongfu, Ruan Xiaodi, Yuan Jie, Duan Zhaoyuan, Feng Xiaodong. The regulatory role of circular RNAs in cerebral ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(8): 1286-1291. |
| [10] | Gao Yu, Han Jiahui, Ge Xin. Immunoinflammatory microenvironment after spinal cord ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(8): 1300-1305. |
| [11] | Zhang Tingting, Liu Juan, Zhang Xu. Bioactivity of phase-transition lysozyme for surface modification of zirconia all-ceramic implant material mediating hydroxyapatite coating [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(7): 1043-1049. |
| [12] | Xu Xingxing, Wen Chaoju, Meng Maohua, Wang Qinying, Chen Jingqiao, Dong Qiang. Carbon nanomaterials in oral implant [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(7): 1062-1070. |
| [13] | Li Cheng, Zheng Guoshuang, Kuai Xiandong, Yu Weiting. Alginate scaffold in articular cartilage repair [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(7): 1080-1088. |
| [14] | Chen Shisong, Liu Xiaohong, Xu Zhiyun. Current status and prospects of bioprosthetic heart valves [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(7): 1096-1102. |
| [15] | Shi Yehong, Wang Cheng, Chen Shijiu. Early thrombosis and prevention of small-diameter blood vessel prosthesis [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(7): 1110-1116. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||

