Chinese Journal of Tissue Engineering Research ›› 2022, Vol. 26 ›› Issue (16): 2613-2617.doi: 10.12307/2022.266
Previous Articles Next Articles
Long-circulating lipsomes: application and mechanism
Cai Xiaoxuan1, 2, Lü Yingnian1, 3, Qi Yi2, 3
- 1School of Pharmacy, 2Institute of Marine Medicine, Guangdong Medical University, Zhanjiang 524023, Guangdong Province, China; 3Southern Marine Science and Engineering Guangdong Laboratory (Zhanjiang), Zhanjiang 510000, Guangdong Province, China
-
Received:2020-12-22Revised:2020-12-25Accepted:2021-01-27Online:2022-06-08Published:2021-12-23 -
Contact:Qi Yi, MD, Institute of Marine Medicine, Guangdong Medical University, Zhanjiang 524023, Guangdong Province, China; Southern Marine Science and Engineering Guangdong Laboratory (Zhanjiang), Zhanjiang 510000, Guangdong Province, China -
About author:Cai Xiaoxuan, Master candidate, School of Pharmacy, and Institute of Marine Medicine, Guangdong Medical University, Zhanjiang 524023, Guangdong Province, China
CLC Number:
Cite this article
Cai Xiaoxuan, Lü Yingnian, Qi Yi. Long-circulating lipsomes: application and mechanism[J]. Chinese Journal of Tissue Engineering Research, 2022, 26(16): 2613-2617.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
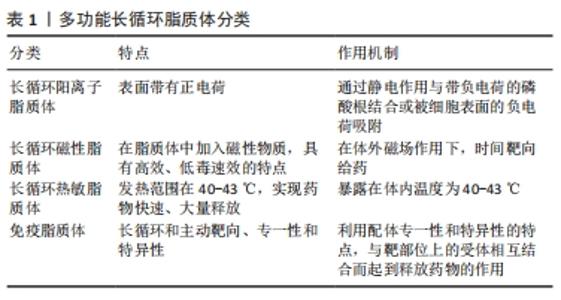
2.1 长循环脂质体的应用领域 传统的注射剂存在许多缺陷,如需要频繁注射给药、容易造成患者疼痛、治疗依从性差,因此新型的注射剂应运而生,如长循环脂质体,其优势在于不易与血浆中的调理素结合,不容易被单核吞噬细胞系统摄取,能长时间保持血药浓度。长循环脂质体主要应用于需长期给药、频繁给药的疾病领域。 2.1.1 抗肿瘤 对肿瘤产生效果的药物,一般认为经过全身给药之后能利用渗漏的肿瘤血管沉积在肿瘤部位将药物递送至癌细胞。在正常组织中,微血管内皮间隙致密、结构完整,使得大分子物质和脂质颗粒难以透过血管壁,实体肿瘤组织中血管丰富、血管壁间隙较宽、结构完整性差、淋巴回流缺失,这种现象被称作实体瘤组织的高通透性和滞留效应[3]。由于肿瘤微环境的高通透性和滞留效应,如何基于肿瘤的微环境特征,通过联合用药进一步增强微环境的渗透性与高通透性和滞留效应,已成为肿瘤靶向研究的新热点。实际上,肿瘤摄取脂质体主要依赖于增强高通透性和滞留效应,然而注射给药之后,大多数脂质体容易被肝脏和脾脏的单核巨噬细胞系统摄取,这可能是由于调理素和补体成分的识别,为脂质体去除循环中巨噬细胞奠定基础。此外,长循环脂质体(平均直径100-200 nm)可以穿透实体肿瘤的血管内皮细胞,并渗入间质,导致比传统脂质体更大的蓄积,达到延长稳定性、降低血液清除率并被单核吞噬细胞系统捕获增加在肿瘤区域积聚的目的。为了实现这一目的,可以通过加入柔性亲水部分,如聚乙二醇与脂质锚结合在脂质体中,可以形成水合立体屏障,降低脂质体与血液中成分的相互作用,延长血循环时间,减少被脾和肝脏的捕获。制备聚乙二醇化的脂质体可以在脂质体制备过程中加入,或将聚乙二醇酯水分散体与即将成型的脂质体混合来制备[4]。有研究将抗肿瘤药物包裹于脂质体中,使其粒径增大、延长药物在体内的半衰期[5-7]。进而在脂质体表面修饰亲水性聚合物,如聚乙二醇;与普通脂质体相比,经过表面修饰的脂质体提高了药物的包封率、肿瘤靶向性、治疗效率及安全性。 2.1.2 抗高血压 心血管疾病的患病率在全球范围内呈上升趋势[8],高血压是一种严重的心血管疾病,需长期用药。抗高血压的药物可以分为以下几类:肾素-血管紧张素系统抑制剂、β肾上腺素受体拮抗剂、利尿剂、钙通道阻滞剂,然而这些药物都伴随着一些不良反应,比如:当患者服用血管紧张素转换酶抑制剂如卡托普利时,会出现一些严重或轻微的不良反应,如刺激性干咳、呕吐、心悸、头晕、头痛、失眠及中性粒细胞减少等。由于目前高血压用药大多是一些合成药,不良反应大,因此天然产物多肽被认为具有良好的抗高血压效果,且天然降压药物安全度高,容易被接受[9],目前多肽有效和强有力的作用使其成为治疗多种疾病的首选药 物[10]。ABACHI等[11]为了避免高血压药物对人体带来的不良影响,开始着手研究海洋来源的生物活性多肽。许多研究表明,海洋来源的生物多肽不仅有利于健康,对高血压也有作用;并且很多体外和(或)体内实验及人体研究表明,不同大小的分子质量、长度和组成的鱼源性生物肽都能成功地抑制了血管紧张素转化酶的活性[11]。LEE等[12]研究表明与合成的血管紧张素转化酶抑制剂比较,从动物产品、鱼产品中分离出的血管紧张素转化酶抑制剂性质稳定、不良反应小。YU等[13]发现了一种源于青蟹胰蛋白酶水解物的血管紧张素转化酶抑制肽,并且将青蟹胰蛋白酶水解物分离成4种相对分子质量不同的组分多肽,发现这4种多肽都有抑制血管紧张素转化酶的活性,其中低分子质量多肽抑制血管紧张素转化酶的活性要高于分子质量大的多肽,原因是分子质量低的多肽更容易进入血管紧张素转化酶活性部位,抑制其催化活性。目前市面上的高血压药物大多为一天服用一到两次,无法达到长效缓释的作用,虽然口服多肽不良反应小,但是生物利用度低,因此研究人员正致力于新型药物递送系统,以增强抗高血压的疗效。 2.1.3 抗病毒 呼吸道病毒是指入侵人类呼吸道并引起呼吸道病变,或仅以呼吸道为侵入门户主要引起呼吸道外组织器官病变的病毒[14]。呼吸道感染主要是由病毒引起,病毒性呼吸道感染有着爆发突然、传播迅速、发病率高等特点,例如2003年的SARS病毒,2009年的全球性的甲型H1N1流感及目前还在全球范围内肆虐的新型冠状病毒(2019-nCoV),严重威胁着公共卫生安全,使人类的生命健康和财产受到了损失。流行性感冒,亦称流感,是一种急性的上呼吸道病毒感染疾病[15],流感病毒是造成呼吸道感染的主要原因之一,可以分为人流感病毒和动物流感病毒,目前预防和治疗流感最常用的方式为疫苗和抗病毒药物。临床上常使用的抗病毒药物有:M2离子通道抑制剂,如金刚烷胺和金刚乙胺;神经氨酸酶抑制剂,如扎那米韦、拉尼米韦及其成酯后的辛酸拉尼米韦、磷酸奥司他韦和帕拉米韦[16]。然而,反复使用这些抗病毒药物很容易产生耐药病株,为了克服这一问题,研究人员对靶向抗病毒药物进行深入研究,将靶向抗病毒药物分类,分为抑制参与流感病毒复制的蛋白和增强流感病毒复制的宿主限制因子。有研究者将抗病毒药物包裹于纳米材料中,采用薄膜水合法制备纳米脂质体,可以提高药物生物利用度和抗病毒作用[17]。 2.1.4 抗糖尿病 糖尿病在世界范围内的患病率正在迅速上升,目前被认为是最常见、最流行的代谢疾病。糖尿病是一种以高血糖为特征的慢性代谢紊乱[18]。糖尿病主要有1型和2型两种类型[19]。1型糖尿病是糖尿病的一个主要亚型,常在年轻时诊断为胰岛素缺乏,通常是由于自身免疫破坏而引起的[20-21]。2型糖尿病是一种遗传性和后天的胰岛素抵抗及定性和定量的胰岛素分泌紊乱[22],一般与其他疾病有关,如代谢综合征[23]。目前治疗糖尿病的药物主要是通过口服给药和注射给药[24-25],口服胰岛素会导致生物利用度低和治疗效果不足,这是由于其在胃肠道内的生理不稳定,以及快速的全身清除;皮下注射胰岛素会导致患者的不适、疼痛、压力和创伤,导致依从性有限,还可能产生局部感染、低血糖、皮肤坏死和神经损伤的风险。因此为了控制糖尿病,人们仍然需要更简单、更无痛的胰岛素给药途径。研究表明,将胰岛素及其他降糖药物装载到纳米材料中已被认为是一种更方便、非侵入性和更安全的方法[26-27]。 2.2 长循环脂质体 在20世纪60年代中叶,脂质体被广泛应用于化妆品行业,直到20世纪70年代,脂质体才应用于药物载体并引起了广泛关注。脂质体具有许多特点,如靶向性、缓释性、降低药物毒性、提高药物稳定性、细胞亲和性和组织相容性等,将脂质体表面进行修饰可以提高脂质体的靶向性。由于大部分脂质体容易被单核吞噬细胞系统摄取,因此当脂质体的靶点是单核吞噬细胞系统之外的部位时,脂质体无法起到治疗疾病的作用。直到20世纪80年代,第二代脂质体即长循环脂质体的出现才解决这一缺陷。近年来,长循环脂质体渐渐向新型多功能长循环脂质体发展,见表1。"
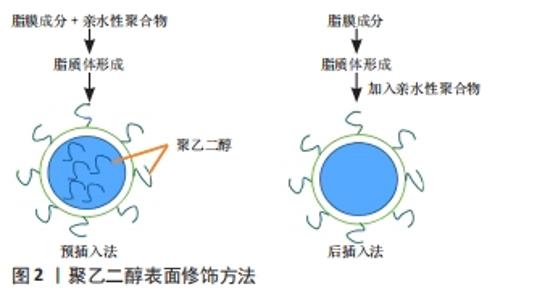
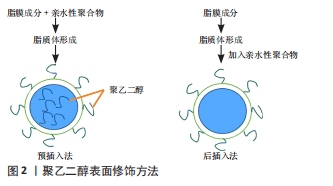
2.2.1 分类 目前,长循环脂质体表面修饰材料有两种:神经节苷脂和唾液酸衍生物(GM1)修饰,如单唾液神经节苷脂;连接亲水聚合物,如聚乙二醇衍生物。具有柔性链的亲水性聚合物或糖脂(如聚乙二醇或GM1),起到占据紧邻脂质体表面的空间(“脂周层”)而倾向于将其他大分子排除在该空间之外的作用。因此,血浆调理素与脂质体表面的接触和结合受到阻碍,从而抑制了单核吞噬细胞系统巨噬细胞与脂质体的相互作用。然而,由于神经节昔脂价格不便宜且不容易合成和提取,因此通过聚乙二醇衍生物表面修饰脂质体被广泛应用。 2.2.2 制备 聚乙二醇是一种两亲性聚合物,具有无免疫原性、无抗原性、无毒、水溶性强、生物相容性强等特性[28]。将聚乙二醇修饰于脂质体表面又称为分子的聚乙二醇化,聚乙二醇可以在脂质体表面形成“构象云”和水化膜,为脂质体提供较大的空间位阻并掩盖其表面疏水性结合位点,使脂质体的理化稳定性得到改善,同时降低单核巨噬细胞系统的识别和摄取,延长脂质体的体内循环时间;然而,聚乙二醇化脂质体也出现了一些问题,这些问题被称为聚乙二醇“窘境”[29]。目前,研究人员对聚乙二醇替代品的研究越来越激烈[30],聚乙二醇连接的脂类和聚乙二醇酯取代连接的脂类。在脂质体表面连接聚乙二醇的方法有两种[31-32]:预插入法,即聚乙二醇脂是在脂质体形成(插入前)之前加入的;另外一种方法为后插入法,即聚乙二醇脂与脂质体分散体混合,见图2。"

目前最常用的脂质体制备方法有被动载药,如薄膜法、反相挥发法、溶剂注射法和复乳法;活性载药采用pH梯度法和硫酸铵梯度法[33]。有研究采用预插入法和后插入法两种方法制备包裹药物的聚乙二醇化脂质体,采用后插入法制备的聚乙二醇化脂质体与预插入法使用一半聚乙二醇酯具有同等药效,并且在体内长循环特性好[34-35]。HWANG等[36]认为通过静脉给药聚乙二醇脂质体并利用成像技术和稳定地标记放射性核素99Tcm-的脂质体,可以清楚地表明,聚乙二醇化显著提高了脂质体在循环中的持久性。同时,负责微粒清除的器官(肝和脾)对聚乙二醇化脂质体的摄取减少。然而,聚合物包衣提供的空间稳定是有限的,甚至隐形脂质体最终也会在体内被单核吞噬细胞系统清除。TRUCILLO等[37]提出了基于超临界辅助过程的实验方案制备聚乙二醇化脂质体,制备出来的脂质体平均粒径为(134±30)-(166±45) nm,稳定时间至少为70 d。对标准脂质体和聚乙二醇包衣脂质体的药物释放进行了比较,结果显示,聚乙二醇化囊泡产生的受控释放时间至少延长了3倍,且没有明显的初始突发释放。因此,通过表面修饰聚乙二醇不仅提高了脂质体结构的稳健性、增强了双层结构,而且达到了延缓和控制药物释放的目的。 2.3 新型长循环脂质体分类 2.3.1 长循环磁性脂质体 长循环磁性脂质体是将磁性材料包裹于脂质体中,由药物、载体材料和磁性材料组成[38]。常用的磁性材料有:Fe3O4磁粉、纯铁粉、铁磁流体或磁赤铁矿(如γ-Fe2O3)、磁性合金材料、铁氧体磁性材料、羧基铁等[39];载体材料有:白蛋白、乳胶、聚乙二醇、中性葡聚糖、淀粉、磷脂酰胆碱、乙基纤维素、聚烷基氰基丙烯酸酯、氨基酸聚合物、聚多糖等[39];在体外磁场作用下,将药物选择性地输送或定位于特定的部位,以达到降低药量、减小毒性、提高治疗效果的目的。磁性脂质体制备方法:先将所需的脂类混合物溶解于有机溶剂中,然后将磁性材料溶解在缓冲液或生理盐水中,再加入到脂类有机溶剂中形成分散体;机械搅拌分散体,使薄膜从烧瓶中分离出来;将分散体加热到略高于脂类转变温度;使用手持挤出机,通过孔径减小(从400-200 nm)的聚碳酸酯过滤器进行分散,形成单层磁性脂质体;在1 000×g的转速下离心15 min;将脂质体保存在4 ℃下使用。张辉等[40]采用化学沉淀法制备Fe3O4颗粒,采用薄膜分散法制备芦丁脂质体,即将卵磷脂、胆固醇和芦丁于37 ℃下溶于无水乙醇中;置于37 ℃恒温水浴的旋转蒸发仪中除去有机溶剂,在瓶壁上会形成薄膜,真空干燥1 h后加入PBS水合0.5 h,超声,得芦丁脂质体。利用水合油酸钠包覆沉淀出的磁性颗粒并加入芦丁脂质体,则可得到芦丁磁性脂质体。与传统磁性脂质体相比,长循环磁性脂质体对药物的释放具有可控性,并有较少的磁性纳米颗粒泄漏,增强了靶细胞对药物的摄取[41-42]。 2.3.2 长循环热敏脂质体 长循环热敏脂质体为一种新型脂质体,通过暴露在发热范围(40-42 ℃)的高温下时实现药物快速、大量释放[43]。热敏脂质体通常静脉注射给药,可延长血浆半衰期,它可以基于两种递送策略中的任何一种来使用:①血管外触发递送,即在肿瘤间质内被动积聚,然后触发释放;②血管内触发递送,热敏脂质体通过加热组织区域的血管系统时释放,然后药物穿透周围的组织间质,最终被细胞吸收。LI等[44]采用反向蒸发法制备奥沙利铂长循环温敏型脂质体,即将脂质溶于有机溶剂中,将奥沙利铂(4 g/L)溶于5%葡萄糖的水相并按体积比3∶1的比例加入有机相中,脂药比为7.5∶1,将混合物超声5 min,然后在旋转蒸发器上除去氯仿,长循环热敏脂质体在血液中停留时间长,长达24 h以上,可在肿瘤部位蓄积并选择性释放。 2.3.3 长循环阳离子脂质体 阳离子脂质体表面带有正电荷,为近球形囊泡[45],能与核酸中带负电荷的磷酸根通过静电作用结合,形成脂复合物的复合体,或与带负电荷的细胞表面吸附,通过阳离子脂质体的介导将核酸结合到细胞膜上。阳离子脂质体通常由阳离子脂类和中性辅助脂类组成,常见的阳离子脂类由亲水的头部、连接键和疏水的尾部组成,辅助脂类一般为中性,如胆固醇、二油酰磷脂酰乙醇胺和聚乙二醇酯等,起到稳定脂质双层膜和降低阳离子脂质的毒性等作用。HE等[46]采用薄膜分散法制备埃美曲塞二钠阳离子脂质体(SA-PMX-Lips),以硬脂胺(SA)作为调节电荷的正极组分,首先将卵磷脂和胆固醇溶于无水乙醇溶液中,置脂质溶液于45 ℃下旋转蒸发仪器中将溶剂完全蒸发,最后将埃美曲塞二钠水溶液于60 ℃下水合30 min,制备出来的SA-PMX-Lips在体外实验中对各组织器官无损伤,具有良好的安全性和生物相容性;组织分布研究表明,SA-PMX-Lips具有肺靶向潜能。HATTORI等[47]采用三种类型的二烷基或三烷基阳离子脂质体制备阳离子脂质体,此外还制备了聚乙二醇化的siRNA脂质体,结果显示,聚乙二醇化siRNA脂质体显著降低了细胞中的基因沉默效应,静脉注射聚乙二醇化的siRNA脂质体能防止血液循环中的凝集、显著减少siRNA在肺中的积聚,而非聚乙二醇化的siRNA脂质体主要聚集在肺部。 2.3.4 免疫脂质体 在脂质体表面连接单克隆抗体、配体或片段形成具有靶向性的传统免疫脂质体,在其表面连接聚乙二醇及其衍生物,形成空间稳定脂质体[48]。空间稳定免疫脂质体是一种新型的长循环脂质体,可以起到长循环和主动靶向的双重作用。免疫脂质体治疗疾病的机制是利用配体专一性和特异性的特点,与靶部位上的受体相互结合而起到释放药物的作用。聚乙二醇衍生物抗体与脂质体的连接方式有[48-49]:①抗体经过硫醇化后与聚乙二醇衍生物进行反应,以共价键的形式将抗体和脂质体进行连接;②聚乙二醇衍生物和抗体分别与脂质体直接相连。张娟等[50]采用薄膜分散法制备空白脂质体,用超声波粉碎法制备阿霉素脂质体,将抗体和聚乙二醇衍生物巯基化,采用后插入法将巯基化的抗体连接到阿霉素脂质体表面,制成的长循环免疫脂质体具有良好的生物靶向性和对癌细胞的杀伤作用。 2.4 脂质体制备技术 传统脂质体的制备技术包括:水合法、电铸法、冷冻干燥法、反向蒸发法和乳化法等,这些方法存在着一些缺点,如制成的脂质体颗粒不均匀、包埋能力差及采用传统电铸法制备的脂质体只适合于离子强度低的情况[51]。目前,一些新的制备方法如微流体技术、超临界流体、乙醇注入法等被应用于脂质体的生产上,这些制备方法可以控制所形成囊泡的大小和片层程度,且重现性高。 2.4.1 微流体技术 微流体技术是一种新型的生产脂质体技术,指精确控制几何体积、微升数量的流体,单位通常是以亚毫米长度为单位,雷诺数低[52],其特点为能精确地分配纳升体积、控制界面位置,以及以扩散为主的轴向混合和在低体积下的连续操作模式。微流体技术通常是脂类(和疏水有效载荷)的有机溶液(例如乙醇)与可混溶的非溶剂(例如水和亲水性有效载荷)混合,当有机溶剂与非溶剂混合时脂质的溶解度降低,脂质浓度最终达到触发沉淀过程的临界浓度,最终脂质的纳米沉淀物长大并接近脂质体。CHEUNG 等[53]制备包载阿霉素的低温敏感脂质体,即将乙醇脂质混合物和硫酸铵溶液注入交错的人字形微混合器微流控装置并快速混合溶液,为脂质体自组装提供了均匀的溶剂环境;收集的脂质体首先退火,然后透析以除去残留的乙醇,利用体积排阻色谱对外液进行缓冲交换,建立了硫酸铵的pH值梯度;接着将阿霉素远程加载到脂质体中,采用微流体制备出的脂质体包封率高、大小均匀,并且在轻度高温(42 ℃)下以温度触发的方式突发释放封装的阿霉素,确保了脂质体的高通量、可重复性和可扩展性。 2.4.2 超临界流体技术 超临界流体是一种化合物,是在临界温度和临界压力以上的条件下形成具有液体和气体性质的单一相。超临界流体可以减少或完全避免有机溶剂的使用,目前CO2是超临界流体最常用的,因为它便宜、无毒、临界压力低、温度低[54],因此超临界流体技术制备脂质体具有环保、快速、简单、能控制脂质体物理化学性质的优点。超临界流体技术的方法为:将胆固醇和其他脂质物质溶解在有机溶剂中,然后放入玻璃容器中;CO2气体通过毛细管喷射到高压沉淀容器中,由于温度和压力的突然变化,CO2气体转变为超临界状态;随后,有机溶剂蒸发,脂类被提取到超临界相中,导致超临界CO2相中脂类的过饱和和脂类物质的沉淀;之后,通过连续向容器中泵入CO2来除去有机溶剂,以获得细小的脂质颗粒,最后加入水溶液形成脂质体。LIM等[55]采用超临界流体技术制备两性霉素脂质体,并与采用薄膜水化法制备的脂质体进行比较,发现经超临界流体技术处理的脂质体包封率高、稳定性好,其包封率可高达90%。MAQBOOL等[56]通过分析表明,阿苯达唑能在超临界CO2溶解,采用超临界流体技术能成功制备纳米级脂质体。超临界流体技术为制备脂质体提供了一种绿色环保的方式,可以作为工业制备脂质体的一种替代方法。 2.4.3 乙醇注射技术 目前制备脂质体通常采用改进的乙醇注射技术。传统的乙醇注射是将乙醇/脂类溶液受控地加入间歇反应器中,反应器中配有缓冲液或在受控搅拌的水,这种方法简单、快速,使用乙醇作为溶剂的危害小;然而乙醇注入法产生的囊泡浓度低,无法确保重复性,需要通过额外的步骤去除乙醇。因此,改进后的乙醇注入法提高了乙醇相中的初始脂质浓度,从而最小化脂质体配方中的乙醇浓度并增加脂质体浓度,即将热脂相(60 ℃)加入到热水相(70 ℃)或水相注入脂相中,然后将乙醇在减压下于旋转蒸发器中蒸发。 有研究采用乙醇注射一步法制备用于基因治疗的阳离子脂质体,该脂质体的粒径和分散度都降低,这可能是因为乙醇的注射流量大[57]。高初始浓度脂质体会导致更大和不均匀的脂质体,需要采取措施减小脂质体的尺寸,且由于脂质体的尺寸和多分散性会根据脂质浓度的增加而增加。因此传统乙醇注入法相比于改进的方法用途更大。"

| [1] LI M, DU C, GUO N, et al. Composition design and medical application of liposomes. Eur J Med Chem. 2019;164:640-653. [2] SHAH S, DHAWAN V, HOLM R, et al. Liposomes: Advancements and innovation in the manufacturing process. Adv Drug Deliv Rev. 2020;154-155:102-122. [3] KALYANE D, RAVAL N, MAHESHWARI R, et al. Employment of enhanced permeability and retention effect (EPR): Nanoparticle-based precision tools for targeting of therapeutic and diagnostic agent in cancer. Mater Sci Eng C Mater Biol Appl. 2019;98:1252-1276. [4] ZHEN S, LI X. Liposomal delivery of CRISPR/Cas9. Cancer Gene Ther. 2020; 27(7-8):515-527. [5] YE H, ZHOU L, JIN H, et al. Sorafenib-Loaded Long-Circulating Nanoliposomes for Liver Cancer Therapy. Biomed Res Int. 2020;2020:1351046. [6] WANG X, WANG Q, LIU Z, et al. Preparation, pharmacokinetics and tumour-suppressive activity of berberine liposomes. J Pharm Pharmacol. 2017;69(6):625-632. [7] DU Y, WANG A, WANG T, et al. Improved anti-tumor activity of novel redox-responsive paclitaxel-encapsulated liposomes based on disulfide phosphatidylcholine. Mol Pharma. 2019;17(1)262-273. [8] Sarzani R, Spannella F, Giulietti F, et al. Cardiac Natriuretic Peptides, Hypertension and Cardiovascular Risk. High Blood Press Cardiovasc Prev. 2017;24(2):115-126. [9] 郭晶莹,高雪萍,李永斌,等.抗高血压药物的研究新进展[J].山东化工,2015,44(22):65-67. [10] JAIN A, JAIN A, GULBAKE A, et al. Peptide and protein delivery using new drug delivery systems. Crit Rev Ther Drug Carrier Syst. 2013;30(4):293-329. [11] ABACHI S, BAZINET L, BEAULIEU L. Antihypertensive and Angiotensin-I-Converting Enzyme (ACE)-Inhibitory Peptides from Fish as Potential Cardioprotective Compounds. Mar Drugs. 2019;17(11):613. [12] LEE SY, HUR SJ. Antihypertensive peptides from animal products, marine organisms, and plants. Food Chem. 2017;228:506-517. [13] YU F, ZHANG Z, LUO L, et al. Identification and Molecular Docking Study of a Novel Angiotensin-I Converting Enzyme Inhibitory Peptide Derived from Enzymatic Hydrolysates of Cyclina sinensis. Mar Drugs. 2018;16(11):411. [14] 艾鑫宇,袁雷.靶向流感病毒相关蛋白的小分子抑制剂研究进展[J].中国药物化学杂志,2020,30(9):549-563. [15] 李曼,李海伟,梁烁斌,等.靶向流感病毒进入(细胞)抑制剂研究进展[J].中国科学:化学,2018,48(11):1347-1364. [16] 蔡岩,丁晓丽,章聚宝,等.抗流感病毒药物合成研究纵览[J].化学教育(中英文),2019,40(12):5-18. [17] TAHARA K, KOBAYASHI M, YOSHIDA S, et al. Effects of cationic liposomes with stearylamine against virus infection. Int J Pharm. 2018;543(1-2):311-317. [18] YARIBEYGI H, ASHRAFIZADEH M, HENNEY NC, et al. Neuromodulatory effects of anti-diabetes medications: A mechanistic review. Pharmacol Res. 2020;152:104611. [19] PETERSMANN A, MÜLLER-WIELAND D, MÜLLER UA, et al. Definition, Classification and Diagnosis of Diabetes Mellitus. Exp Clin Endocrinol Diabetes. 2019;127(S 01):S1-S7. [20] LI W, HUANG E, GAO S. Type 1 Diabetes Mellitus and Cognitive Impairments: A Systematic Review. J Alzheimers Dis. 2017;57(1):29-36. [21] RODRIGUEZ-FERNANDEZ S, PUJOL-AUTONELL I, BRIANSO F, et al. Phosphatidylserine-Liposomes Promote Tolerogenic Features on Dendritic Cells in Human Type 1 Diabetes by Apoptotic Mimicry. Front Immunol. 2018;9:253. doi:10.3389/fimmu.2018.00253. [22] LANDGRAF R, ABERLE J, BIRKENFELD AL, et al. Therapy of Type 2 Diabetes. Exp Clin Endocrinol Diabetes. 2019;127(S 01):S73-S92. [23] LEITNER DR, FRÜHBECK G, YUMUK V, et al. Obesity and Type 2 Diabetes: Two Diseases with a Need for Combined Treatment Strategies - EASO Can Lead the Way. Obes Facts. 2017;10(5):483-492. [24] 季芳.糖尿病药物治疗的研究进展[J].山西医药杂志,2020,49(19): 2582-2584. [25] 王燕丽.糖尿病的药物治疗知多少[J].保健文汇,2020(9):2. [26] SINGH AP, BISWAS A, SHUKLA A, et al. Targeted therapy in chronic diseases using nanomaterial-based drug delivery vehicles. Signal Transduct Target Ther. 2019;4:33. [27] SOUTO EB, SOUTO SB, CAMPOS JR, et al. Nanoparticle Delivery Systems in the Treatment of Diabetes Complications. Molecules. 2019;24(23):4209. [28] CADDEO C, PUCCI L, GABRIELE M, et al. Stability, biocompatibility and antioxidant activity of PEG-modified liposomes containing resveratrol. Int J Pharm. 2018;538(1-2):40-47. [29] 张迪,徐缓,胡美娜,等.脂质体面临的聚乙二醇“窘境”及其解决方法[J].药学学报,2015,50(3):252-260. [30] DEODHAR S, DASH AK. Long circulating liposomes: challenges and opportunities. Ther Deliv. 2018;9(12):857-872. [31] NAG OK, AWASTHI V. Surface engineering of liposomes for stealth behavior. Pharmaceutics. 2013;5(4):542-569. [32] YOSHINO K, TAGUCHI K, MOCHIZUKIET M, et al. Novel analytical method to evaluate the surface condition of polyethylene glycol-modified liposomes. Colloids Surf A Physicochem Eng Asp. 2012;397:73-79. [33] YAN W, LEUNG SS, TO KK. Updates on the use of liposomes for active tumor targeting in cancer therapy. Nanomedicine (Lond). 2020;15(3):303-318. [34] XU H, PAXTON JW, WU Z. Enhanced pH-Responsiveness, Cellular Trafficking, Cytotoxicity and Long-circulation of PEGylated Liposomes with Post-insertion Technique Using Gemcitabine as a Model Drug. Pharm Res. 2015; 32(7):2428-2438. [35] TAKEUCHI I, KANNO Y, UCHIRO H, et al. Polyborane-encapsulated PEGylated Liposomes Prepared Using Post-insertion Technique for Boron Neutron Capture Therapy. J Oleo Sci. 2019;68(12):1261-1270. [36] HWANG H, JEONG HS, OH PS, et al. PEGylated nanoliposomes encapsulating angiogenic peptides improve perfusion defects: Radionuclide imaging-based study. Nucl Med Biol. 2016;43(9):552-558. [37] TRUCILLO P, REVERCHON E. Production of PEG-coated liposomes using a continuous supercritical assisted process. J Supercrit Fluids. 2021;167.doi.org/10.1016/j.supflu.2020.105048 [38] 陈刚,王涌臻,唐晓军,等.磁性纳米脂质体在癌症治疗中的应用[J].现代医学,2020,48(9):1234-1238. [39] 黄海燕.物理化学靶向制剂中磁性靶向研究进展[J].广州化工,2015, 43(1):26-28. [40] 张辉,胡礼军,喻莉萍,等.芦丁磁性脂质体的制备及质量评价[J].湘南学院学报(医学版),2016,18(1):10-13. [41] SU W, WANG H, WANG S, et al. PEG/RGD-modified magnetic polymeric liposomes for controlled drug release and tumor cell targeting. Int J Pharm. 2012 5;426(1-2):170-181. [42] JOSE G, LU YJ, CHEN HA, et al.Hyaluronic acid modified bubble-generating magnetic liposomes for targeted delivery of doxorubicin. J Magn Magn Mater. 2019;474:355-364. [43] 马秋燕,林华庆,张静,等.磁靶向热敏脂质体在抗肿瘤靶向治疗中的新进展[J].中国医药工业杂志,2019,50(12):1405-1412. [44] LI Y, XU P, HE D, et al. Long-Circulating Thermosensitive Liposomes for the Targeted Drug Delivery of Oxaliplatin. Int J Nanomedicine. 2020;15:6721-6734 [45] 华雪莲,张树彪,肖义,等.新型阳离子脂质体制备及应用研究[J].化学研究与应用,2019,31(2):177-183. [46] HE K, LIU J, GAO Y, et al. Preparation and Evaluation of Stearylamine-Bearing Pemetrexed Disodium-Loaded Cationic Liposomes In Vitro and In Vivo. AAPS Pharm Sci Tech. 2020;21(5):193. [47] HATTORI Y, TAMAKI K, SAKASAI S, et al. Effects of PEG anchors in PEGylated siRNA lipoplexes on in vitro gene‑silencing effects and siRNA biodistribution in mice. Mol Med Rep. 2020;22(5):4183-4196. [48] 赖可,赵科,刘源,等.空间稳定免疫脂质体的研究近况[J].中国医药工业杂志,2017,48(2):261-266. [49] 李菲,张娜,郭丰广,等.空间稳定免疫脂质体用于抗肿瘤药物载体的研究进展[J].中国药学杂志,2011,46(24):1865-1868. [50] 张娟,刘雅利,王旻,等.抗体修饰盐酸抗肿瘤药物脂质体、其制备方法及应用[P]CN201810672398.1,2018-11-06 [51] HAS C, SUNTHAR P. A comprehensive review on recent preparation techniques of liposomes. J Liposome Res. 2020;30(4):336-365. [52] FILIPCZAK N, PAN J, YALAMARTY SSK, et al. Recent advancements in liposome technology. Adv Drug Deliv Rev. 2020;156:4-22. [53] CHEUNG CCL, MA G, RUIZ A, et al. Microfluidic Production of Lysolipid-Containing Temperature-Sensitive Liposomes. J Vis Exp. 2020;(157). doi:10.3791/60907. [54] AHMED KS, HUSSEIN SA, ALI AH, et al. Liposome: composition, characterisation, preparation, and recent innovation in clinical applications. J Drug Target. 2019;27(7):742-761. [55] LIM CB, ABUZAR SM, KARN PR, et al. Preparation, Characterization, and In Vivo Pharmacokinetic Study of the Supercritical Fluid-Processed Liposomal Amphotericin B. Pharmaceutics. 2019;11(11):589. [56] MAQBOOL F, MOYLE PM, TAN MSA, et al. Preparation of albendazole-loaded liposomes by supercritical carbon dioxide processing. Artif Cells Nanomed Biotechnol. 2018;46(sup3):S1186-S1192. [57] VITOR MT, BERGAMI-SANTOS PC, ZÔMPERO RHF, et al. Cationic liposomes produced via ethanol injection method for dendritic cell therapy. J Liposome Res. 2017;27(4):249-263. |
| [1] | Zhu Chan, Han Xuke, Yao Chengjiao, Zhou Qian, Zhang Qiang, Chen Qiu. Human salivary components and osteoporosis/osteopenia [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1439-1444. |
| [2] | Jin Tao, Liu Lin, Zhu Xiaoyan, Shi Yucong, Niu Jianxiong, Zhang Tongtong, Wu Shujin, Yang Qingshan. Osteoarthritis and mitochondrial abnormalities [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1452-1458. |
| [3] | Zhang Lichuang, Xu Hao, Ma Yinghui, Xiong Mengting, Han Haihui, Bao Jiamin, Zhai Weitao, Liang Qianqian. Mechanism and prospects of regulating lymphatic reflux function in the treatment of rheumatoid arthritis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1459-1466. |
| [4] | Wang Jing, Xiong Shan, Cao Jin, Feng Linwei, Wang Xin. Role and mechanism of interleukin-3 in bone metabolism [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1260-1265. |
| [5] | Zhu Chan, Han Xuke, Yao Chengjiao, Zhang Qiang, Liu Jing, Shao Ming. Acupuncture for Parkinson’s disease: an insight into the action mechanism in animal experiments [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1272-1277. |
| [6] | Guo Jia, Ding Qionghua, Liu Ze, Lü Siyi, Zhou Quancheng, Gao Yuhua, Bai Chunyu. Biological characteristics and immunoregulation of exosomes derived from mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1093-1101. |
| [7] | Wu Weiyue, Guo Xiaodong, Bao Chongyun. Application of engineered exosomes in bone repair and regeneration [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1102-1106. |
| [8] | Zhou Hongqin, Wu Dandan, Yang Kun, Liu Qi. Exosomes that deliver specific miRNAs can regulate osteogenesis and promote angiogenesis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1107-1112. |
| [9] | Zhang Jinglin, Leng Min, Zhu Boheng, Wang Hong. Mechanism and application of stem cell-derived exosomes in promoting diabetic wound healing [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1113-1118. |
| [10] | Huang Chenwei, Fei Yankang, Zhu Mengmei, Li Penghao, Yu Bing. Important role of glutathione in stemness and regulation of stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1119-1124. |
| [11] | Hui Xiaoshan, Bai Jing, Zhou Siyuan, Wang Jie, Zhang Jinsheng, He Qingyong, Meng Peipei. Theoretical mechanism of traditional Chinese medicine theory on stem cell induced differentiation [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1125-1129. |
| [12] | An Weizheng, He Xiao, Ren Shuai, Liu Jianyu. Potential of muscle-derived stem cells in peripheral nerve regeneration [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1130-1136. |
| [13] | Fan Yiming, Liu Fangyu, Zhang Hongyu, Li Shuai, Wang Yansong. Serial questions about endogenous neural stem cell response in the ependymal zone after spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1137-1142. |
| [14] | Xu Lei, Han Xiaoqiang, Zhang Jintao, Sun Haibiao. Hyaluronic acid around articular chondrocytes: production, transformation and function characteristics [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(5): 768-773. |
| [15] | Li Jiajun, Xia Tian, Liu Jiamin, Chen Feng, Chen Haote, Zhuo Yinghong, Wu Weifeng. Molecular mechanism by which icariin regulates osteogenic signaling pathways in the treatment of steroid-induced avascular necrosis of the femoral head [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(5): 780-785. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||