1.1 设计 动物实验进行二仙丸加减方入血成分分析及含药血清的提取,体外细胞实验进行机制研究,多组间比较采用单因素方差分析。
1.2 时间及地点 实验于2022年8月至2023年11月在山西中医药大学中西医结合基础实验室完成。
1.3 材料
1.3.1 实验动物 SPF级雌性Wistar大鼠32只,10-12周龄,体质量(190±10) g,购于斯贝福(北京)生物技术有限公司,许可证号:SCXK(京)2019-0008,饲养于山西中医药大学实验管理中心动物房,所有动物均可自由获得饲料和水,并在12 h光照/12 h黑暗周期,温度为23-25 ℃,空气湿度为60%的环境下饲养。该研究已通过山西中医药大学实验动物伦理委员会批准(审批号:2021DW214)。
1.3.2 细胞株 J774A.1购自武汉普诺赛生命科技有限公司,使用完全培养基(DMEM高糖培养基+体积分数10%胎牛血清+100 U/mL青霉素+100 μg/mL链霉素)在 37 ℃恒温、体积分数5% CO2条件下培养,细胞传代至处于对数生长期且状态稳定时用于后续实验。
1.3.3 中药 黑木耳(干)、苍术(麸炒)、乳香(醋制)、没药(醋制)、杜仲(盐炒)、牛膝、升麻、六神曲(麸炒)均购自山西中医药大学附属医院中药房。
1.3.4 主要试剂及仪器 胎牛血清(浙江四季青,Cat.No.11011-8611);青霉素-链霉素混合液(Solarbio,Cat.No.P1400);DMEM高糖液体培养基(武汉博士德生物工程有限公司,Cat.No.PYG0073);脂多糖、三磷酸腺苷(MCE,Cat.No.HY-D1056、HY-B2176);小鼠白细胞介素1β ELISA试剂盒、小鼠白细胞介素18 ELISA 试剂盒(上海酶联生物科技有限公司,Cat.No.ml098416、ml002294);乳酸脱氢酶活性检测试剂盒(Solarbio,Cat.No.BC0680);Hoechst 33342/PI染色试剂盒(碧云天,Cat.No.C1056);NLRP3抗体(沈阳万类生物科技有限公司,Cat.No.WL02635);Caspase-1、Gasdermin D抗体(CST,Cat.No.E9R2D、E9S1X);GAPDH抗体(Bio-Swamp,Cat.No.MAB45855)。超高效液相色谱(德国Thermo Scientific,型号:UHPLC vanquish);色谱柱(美国Waters,型号:ACQUITY UPLC);质谱仪(德国Thermo Scientific,型号:Q-Exactive HFX);酶标仪(美国Molecular Devices,型号:SLO-BLO);倒置荧光显微镜(日本Nikon,型号:Eclipse Ts2R);化学发光显影仪(美国Bio-Rad,型号:ChemiDocTM Imaging System);通用电泳仪(美国Bio-Rad,型号:PowerPacTM Basic)。
1.4 实验方法
1.4.1 MEXP样品制备 将黑木耳(干)、苍术(麸炒)、乳香(醋制)、没药(醋制)、杜仲(盐炒)、牛膝、升麻、六神曲(麸炒)各打磨成粉,过200目筛之后按黑木耳粉∶苍术粉∶乳香粉∶没药粉∶杜仲粉∶牛膝粉∶升麻粉∶六神曲粉=30∶5∶2∶2∶1∶1∶1∶1配制,使用研磨机研磨混合均匀即为MEXP样品。
1.4.2 供试品溶液的制备 取MEXP样品0.3 g,置于离心管(5 mL)中,加入3 mL体积分数70%甲醇水溶液,涡旋混合,水浴超声90 min,4 ℃ 16 000×g离心10 min,取600 μL上清液真空冷冻干燥,冻干后样品加入600 μL体积分数40%甲醇水溶液复溶,涡旋混合,4 ℃ 16 000×g离心15 min,取上清液备用。
1.4.3 血清样品的制备 将12只Wistar大鼠适应性喂养1周后随机平均分为2组,分别为空白组(n=6)和MEXP组(n=6),MEXP组给予MEXP药粉加入纯净水混匀灌胃(1.8 g/kg),空白组给予同体积生理盐水灌胃,连续灌胃7 d。末次灌胃1 h后,用异氟烷气体麻醉各组大鼠,经腹主动脉取血,室温静置1 h,全血3 000 r/min离心10 min,抽取上层血清至EP管内,保存至-80 ℃。
1.4.4 血清样品处理 取200 μL血清样品,加入600 μL甲醇,涡旋混合60 s,-20 ℃静置30 min,4 ℃ 16 000×g离心20 min,取上清真空干燥,干燥后的样品加入40%甲醇水溶液100 μL涡旋,16 000×g 4 ℃离心15 min,取上清液备用。
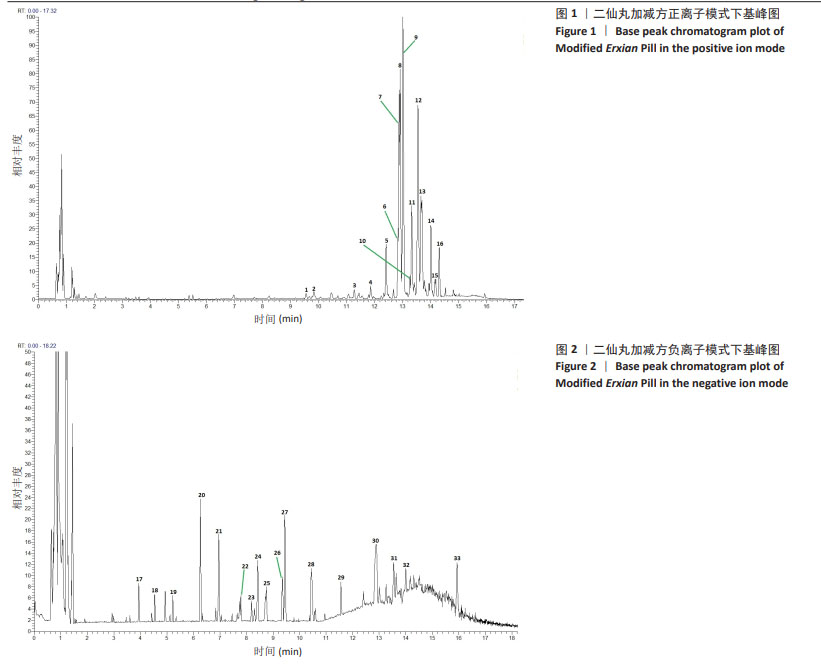
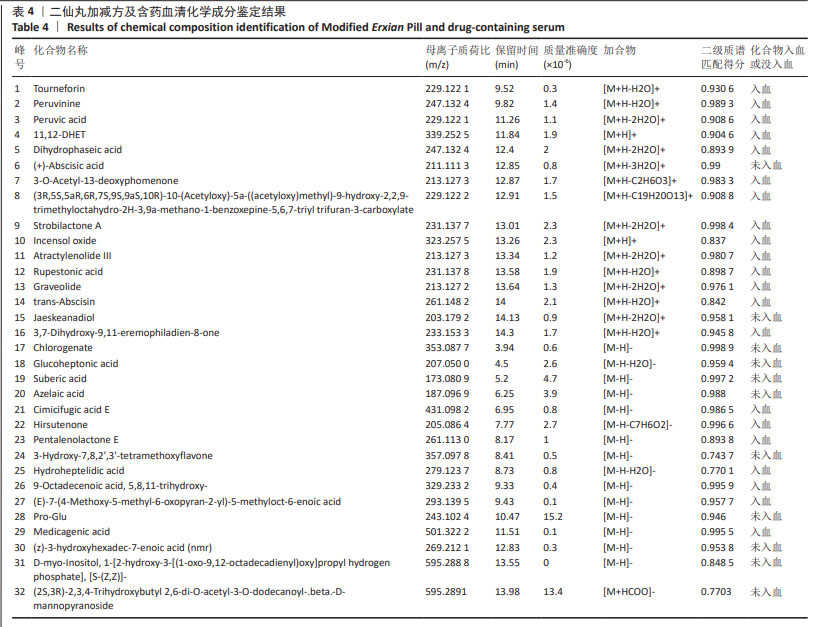
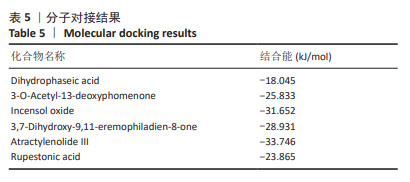
1.4.5 色谱-质谱条件 使用ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 μm)色谱柱;配制流动相A为0.1%甲酸水溶液,流动相B为0.1%甲酸乙腈溶液,按表1中的流动相梯度进行梯度洗脱;流速0.3 mL/min;柱温35 ℃。采用正负离子采集模式,离子源温度为370 ℃,离子喷雾电压正离子模式为3 800 V,负离子模式为-3 000 V,鞘气流速45 arb,辅助器流速20 arb,扫描质量范围为90-1 300 m/z,毛细管温度设置为320 ℃,气化温度设置为370 ℃。采用XCMS软件进行峰对齐、保留时间校正和峰提取,然后对提取得到的数据通过标准谱图数据库匹配进行结构鉴定。

1.4.6 含药血清制备 将20只Wistar大鼠随机分为2组,分别为空白组(n=10)和MEXP组(n=10),灌胃及取血清方法同1.4.3所示,将血清56 ℃水浴30 min灭活,经0.22 μm过滤器过滤后保存至-80 ℃备用。
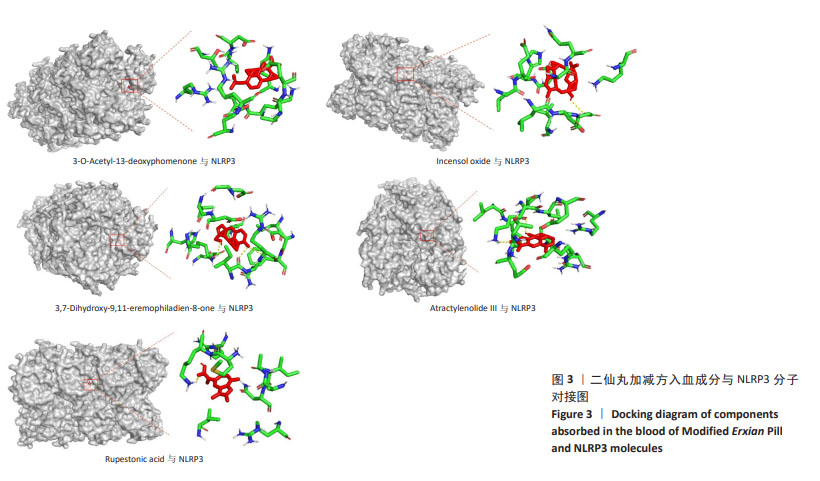
1.4.7 分子对接验证 MEXP入血成分质谱分析显示倍半萜类物质数量居多,因此将MEXP入血成分中倍半萜类物质与NLRP3进行分子对接,以验证MEXP入血成分与NLRP3之间的可能性。通过检索RCSB PDB和Pub Chem数据库,得到NLRP3与各成分的化学及三维结构,使用Pymol 2.3.2软件对蛋白质分子进行分子对接前处理,使用AutoDock 1.5.6软件将化合物与蛋白的pdb格式转为pdbqt格式并运行AutoDockTools进行对接。使用 Pymol 2.3.2软件进行分子对接可视化分析。
1.4.8 CCK-8法检测MEXP含药血清对J774A.1巨噬细胞活力的影响 将J774A.1巨噬细胞悬液以1×108 L-1的细胞浓度接种于96孔板中,每孔100 μL,待细胞贴壁之后,设置6组,分别为完全培养基组(使用完全培养基正常培养)、0% MEXP组、2.5% MEXP组、5% MEXP组、7.5% MEXP组、10% MEXP组。使用DMEM高糖培养基、青霉素-链霉素、空白组血清与MEXP组血清配置体积分数分别为0%,2.5%,5%,7.5%,10% MEXP含药血清培养基,培养基中总血清体积分数为10%,血清具体配制比例如表2所示。观察各体积分数含药血清对细胞活力的影响,每种体积分数加样均设3个复孔,置于细胞培养箱中孵育6,12,24 h后,每孔加入含10% CCK-8试剂的DMEM高糖培养基110 μL,孵育40 min后使用酶标仪在450 nm波长下检测各孔吸光度值。空白孔只加含10% CCK-8试剂的DMEM高糖培养基。独立实验重复6次,计算各组细胞存活率。存活率(%)=(不同含药血清组吸光度值-空白孔吸光度值)/(完全培养基组吸光度值-空白孔吸光度值)×100%。

1.4.9 细胞分组及干预 根据CCK-8实验结果设置含药血清低(2.5%)、中(5%)、高(10%)剂量组。后续实验均设置5个组,分别为:空白对照组、脂多糖+三磷酸腺苷组、2.5% MEXP 组、5% MEXP 组、10% MEXP 组。除空白对照组外,其余各组用脂多糖(0.3 μg/mL)干预4 h后,再用三磷酸腺苷(5 mmol/L)干预0.5 h诱导J774A.1巨噬细胞构建细胞焦亡模型。具体干预条件如表3所示。

1.4.10 检测含药血清对细胞上清中乳酸脱氢酶活性的影响 将J774A.1巨噬细胞按1×108 L-1细胞浓度接种到96孔板,每孔100 μL,贴壁12 h后吸出孔内培养基并开始刺激,刺激结束后收集各组细胞上清液,置冰上待测。设置测定管、对照管、标准管,根据乳酸脱氢酶试剂盒说明书进行加样操作,使用酶标仪在450 nm波长测定吸光度值并计算乳酸脱氢酶活性。
1.4.11 ELISA检测含药血清对细胞上清中白细胞介素1β、白细胞介素18水平的影响 将J774A.1巨噬细胞按1×108 L-1细胞浓度接种到48孔板,每孔300 μL,贴壁12 h后吸出孔内培养基并开始刺激,刺激结束后收集细胞上清,1 000×g离心10 min去除颗粒和聚合物,收集上清液。根据试剂盒说明书进行操作,使用酶标仪在450 nm波长处测定各孔的吸光度值。
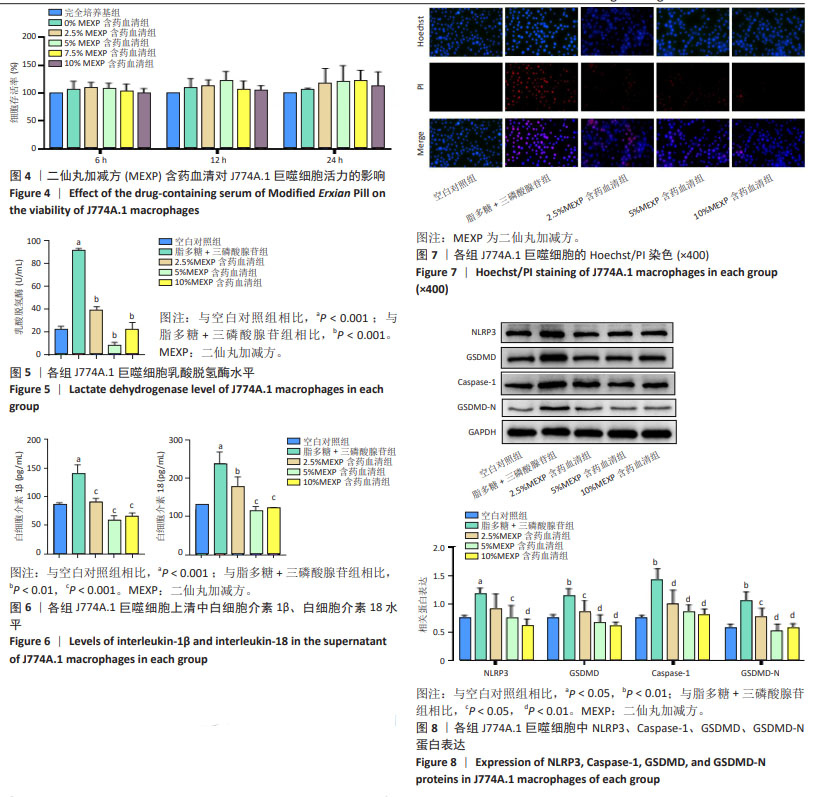
1.4.12 Hoechst/PI染色观察含药血清对细胞膜破裂程度的影响 将J774A.1巨噬细胞按1×108 L-1细胞浓度接种到48孔板,每孔300 μL,贴壁12 h后吸出孔内培养基并开始刺激,刺激结束后加入1 mL细胞染色缓冲液、5 μL Hoechst染色液和5 μL PI染色液,轻柔摇晃混匀,4 ℃避光染色20-30 min,染色后弃去孔中液体,PBS洗涤1次,加入新的PBS后在荧光显微镜下观察并拍照。
1.4.13 Western blot检测含药血清对细胞NLRP3、GSDMD、Caspase-1、GSDMD-N蛋白表达的影响 将对数生长期的J774A.1巨噬细胞按1×108 L-1细胞浓度接种到60 mm培养皿中,每皿接种5 mL,贴壁12 h后吸出孔内培养基并开始刺激,刺激结束后提取细胞蛋白进行电泳,将蛋白转移到PVDF膜上,并用5%脱脂奶粉封闭,洗膜后与一抗NLRP3(1∶1 000)、Caspase-1(1∶1 000)、GSDMD(1∶
1 000)和GAPDH(1∶5 000)在4 ℃下孵育过夜,用TBST洗膜,随后将膜与辣根过氧化物酶IgG二抗(1∶5 000)在室温下孵育2 h,Superstar ECL避光显色后,使用化学发光成像系统进行成像,Image J软件分析蛋白条带灰度值。
1.5 主要观察指标 ①MEXP含药血清对J774A.1巨噬细胞活力的影响;②各组细胞上清中乳酸脱氢酶、白细胞介素1β、白细胞介素18表达水平;③各组细胞的细胞膜破裂程度;④各组细胞中NLRP3、GSDMD、Caspase-1、GSDMD-N蛋白表达。
1.6 统计学分析 采用SPSS 25.0软件进行数据分析,结果以x±s表示,多组间比较采用单因素方差分析,符合方差齐性采用LSD-t检验,不符合方差齐性采用Dunnett T3检验,P < 0.05为差异有显著性意义。作图用GraphPad Prism 9.5.1软件。文章统计学方法已经通过山西中医药大学生物统计学专家审核。
中国组织工程研究杂志出版内容重点:干细胞;骨髓干细胞;造血干细胞;脂肪干细胞;肿瘤干细胞;胚胎干细胞;脐带脐血干细胞;干细胞诱导;干细胞分化;组织工程