Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (34): 5558-5564.doi: 10.12307/2024.829
Previous Articles Next Articles
Role of autophagy in orthodontic tooth movement
Wang Tianqi1, Liao Chengcheng1, 2, 3, Liu Jianguo1, 2, Chen Lulu1, Zhao Piao1, Xiao Linlin1, 2, Guan Xiaoyan1, 2
- 1Affiliated Stomatological Hospital of Zunyi Medical University, Zunyi 563000, Guizhou Province, China; 2Guizhou Provincial Key Laboratory of Oral Disease Research in Colleges and Universities, Zunyi 563000, Guizhou Province, China; 3West China School of Stomatology, Sichuan University, Chengdu 610000, Sichuan Province, China
-
Received:2023-12-15Accepted:2024-01-18Online:2024-12-08Published:2024-03-15 -
Contact:Guan Xiaoyan, Chief physician, Professor, Affiliated Stomatological Hospital of Zunyi Medical University, Zunyi 563000, Guizhou Province, China; Guizhou Provincial Key Laboratory of Oral Disease Research in Colleges and Universities, Zunyi 563000, Guizhou Province, China -
About author:Wang Tianqi, Master candidate, Affiliated Stomatological Hospital of Zunyi Medical University, Zunyi 563000, Guizhou Province, China -
Supported by:Scientific Research Project for Higher Education Institutions, Guizhou Provincial Department of Education, No. (2022)238 (to XLL); Zunyi Science and Technology Program, No. (2022)423 (to GXY)
CLC Number:
Cite this article
Wang Tianqi, Liao Chengcheng, Liu Jianguo, Chen Lulu, Zhao Piao, Xiao Linlin, Guan Xiaoyan. Role of autophagy in orthodontic tooth movement[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(34): 5558-5564.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
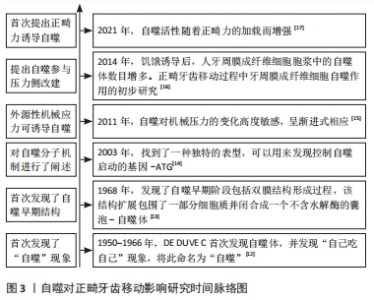
在20世纪50年代初,有研究偶然发现蛋白水解酶被隔离在一种以前未知的膜结构内,随后将其命名为溶酶体[12],该研究发现此结构可消化细胞内部分内容物,并首次提出“自噬”概念。随后研究人员发现了自噬早期阶段双膜结构形成的过程,该结构扩展包围了一部分细胞质并闭合成一个不含水解酶的囊泡-自噬体[13]。20世纪90年代初,KLIONSKY等[14]发现并命名了自噬启动的基因-ATG。在2011年,KING等[15]对真核细胞进行加压,发现外源性机械应力可诱导自噬。在2014年,周云[16]探究饥饿环境下人牙周膜成纤维细胞自噬水平的变化,并提出自噬参与压力侧牙周组织改建过程。在2021年,LI等[17]建立大鼠正畸模型观察牙周组织中的自噬激活情况,首次提出正畸力可诱导自噬,见图3。"

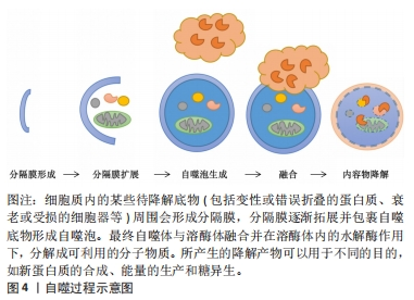
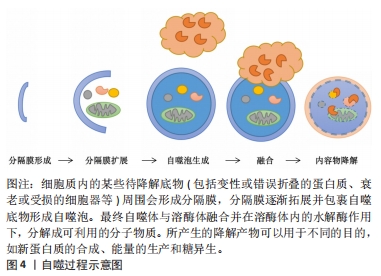
2.1 自噬的介绍 2.1.1 自噬的亚细胞结构 机体一生中都在不断地新陈代谢以保持健康,自噬作为一个动态的循环系统,可为细胞更新和内稳态产生新的构件和能量[18]。自噬是通过产生自噬体和自溶酶体致亚细胞成分大量降解的过程,其生物学过程大体分5步:分隔膜形成、分隔膜扩展、自噬泡生成、融合和内容物降解[19]。电镜下自噬体的粒径为300-900 nm,在刺激作用下,细胞质内的待降解底物周围会形成分隔膜,形成自噬前体,分隔膜逐渐拓展并包裹自噬底物形成自噬泡;随后,自噬泡将自噬底物包裹其中并形成双层膜结构的自噬体,最终自噬体与溶酶体融合,形成自噬溶酶体,并在溶酶体内的水解酶作用下,分解成可利用小分子物质和能量,从而维护细胞自身稳定、代谢平衡及细胞器更新[20]。自噬过程见图4。"
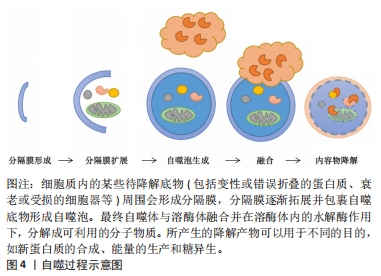
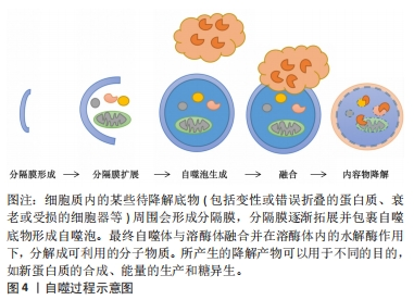
2.1 自噬的介绍 2.1.1 自噬的亚细胞结构 机体一生中都在不断地新陈代谢以保持健康,自噬作为一个动态的循环系统,可为细胞更新和内稳态产生新的构件和能量[18]。自噬是通过产生自噬体和自溶酶体致亚细胞成分大量降解的过程,其生物学过程大体分5步:分隔膜形成、分隔膜扩展、自噬泡生成、融合和内容物降解[19]。电镜下自噬体的粒径为300-900 nm,在刺激作用下,细胞质内的待降解底物周围会形成分隔膜,形成自噬前体,分隔膜逐渐拓展并包裹自噬底物形成自噬泡;随后,自噬泡将自噬底物包裹其中并形成双层膜结构的自噬体,最终自噬体与溶酶体融合,形成自噬溶酶体,并在溶酶体内的水解酶作用下,分解成可利用小分子物质和能量,从而维护细胞自身稳定、代谢平衡及细胞器更新[20]。自噬过程见图4。"
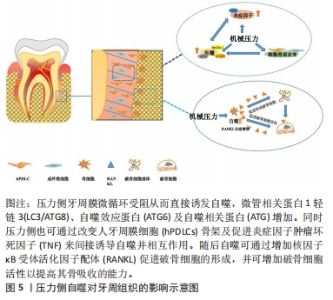
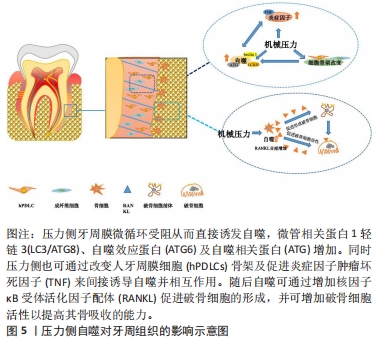
2.1.2 自噬的分子机制 在正常状态下,细胞的自噬处于较低水平,哺乳动物雷帕霉素靶蛋白磷酸化可抑制自噬启动蛋白复合物(包括自噬启动蛋白1、自噬相关蛋白13、黏着斑激酶家族相互作用蛋白和自噬相关蛋白101)形成,减少自噬的发生,从而维持蛋白质和细胞器的周转。在各种生理和病理的应激条件下,细胞内自噬水平将会升高,哺乳动物雷帕霉素靶蛋白C1被腺苷酸活化蛋白激酶抑制,人自噬启动蛋白1活化并迅速诱导自噬发生从而维护细胞内环境的稳定[21]。自噬失调将不利于机体健康和内环境稳定,研究表明自噬体的成熟异常可导致有毒蛋白质聚集体和受损细胞器的累积,引起机体的病理变化[22];自噬溶酶体异常降解则与多种疾病的发生有关,如神经退行性疾病、肿瘤和肌肉疾病等[23];细胞自噬不足/过度可引起骨溶解、细胞损伤及细胞缺氧等,进而造成各种疾病[24]。 2.1.3 自噬的主要标志蛋白 常用的自噬标志物分别为微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3/ATG8)和自噬效应蛋白。LC3是自噬体与溶酶体融合的关键分子[25]。在自噬过程中,LC3被自噬相关蛋白4裂解产生LC3-Ⅰ,随后自噬相关蛋白7以三磷酸腺苷酶依赖的方式激活LC3,最后与磷脂酰乙醇胺结合形成LC3-Ⅱ,LC3-Ⅱ被招募并整合到不断扩张的自噬体中,最终锚定在自噬小体的膜上。自噬发生后,细胞内LC3-Ⅰ的表达下降,而LC3-Ⅱ的表达迅速升高,因此,LC3-Ⅰ及LC3-Ⅱ可用作判断自噬的发生[26]。自噬效应蛋白是磷脂酰肌醇-3-激酶复合物的组成部分,该复合物在自噬体形成早期阶段结合下游自噬相关蛋白蛋白并促进自噬小体成核。自噬效应蛋白在自噬启动过程中起正调控作用,是调节细胞自噬的关键蛋白。自噬效应蛋白的表达的上调同样可作为判断自噬发生的标志物[27]。近期有学者发现一个新的自噬标志物:自噬相关16样蛋白1,该蛋白可与自噬启动蛋白复合物复合物的相对分子质量大小为200 000的黏着斑激酶家族相互作用蛋白亚基结合,从而促进自噬启动蛋白1活化、诱导自噬小体的形成。磷酸化自噬相关16样蛋白1具有选择性定位自噬体的特性,因此能为自噬起始的速率提供一个直观参数[28]。 2.2 正畸力诱导下牙周组织的自噬 机械应力可通过机体内多种应力传导途径诱导自噬,从而差异性调控细胞代谢功能来适应环境变化[29-30]。在正畸牙齿移动过程中,正畸力致使牙周膜形态变化,进而出现两个不同的生物力学作用区域:张力区牙周膜被拉伸,同侧的牙槽骨骨壁表面会出现骨沉积;而压力侧的牙周膜被压缩,同侧牙槽骨骨壁表面骨吸收[31]。徐洁[32]通过四点弯曲细胞力学加载仪,对人牙周膜细胞施加频率为0.5 Hz、单位应变为2 000的周期性应力,随后,实验发现细胞骨架改变后自噬相关蛋白LC3和自噬效应蛋白的mRNA及蛋白水平上升;并且,自噬效应蛋白和肿瘤坏死因子α蛋白表达均随加力时间增加而显著增加。以上研究表明,一方面骨架重排肌动蛋白丝解聚可直接诱导牙周膜细胞的自噬;另一方面骨架改变会通过促进炎症因子的产生间接介导牙周膜细胞自噬的激活[33]。然而,张力侧及压力侧的机械刺激不同,自噬对牙周组织的效应也不尽相同。 2.2.1 压力侧牙周组织的自噬 自噬调控压力侧破骨的分化与成熟:在正畸牙齿移动过程中,牙周膜受压变窄,毛细血管受到压迫出现管腔变窄甚至闭塞。研究发现,SD大鼠正畸模型中,压力侧自噬相关蛋白LC3和自噬效应蛋白的表达随时间延长而逐渐增强,自噬水平在1 h达到峰值后回落,但始终高于基线水平[34]。并且,压力侧牙周组织破骨增强的趋势与牙周膜细胞自噬趋势相似[35]。因此,作者提出自噬可能通过影响牙周组织中的破骨细胞参与了正畸牙齿移动的骨塑建过程。LI等[36]的研究验证了以上猜想,在荧光标记自噬蛋白LC3的转基因小鼠模型上发现,压力侧自噬标志物LC3-Ⅱ和抗酒石酸酸性磷酸酶阳性破骨细胞显著增强,且抗酒石酸酸性磷酸酶染色区和自噬活性细胞区一致。以上表明正畸力可通过增强压力侧牙周组织的自噬来促进破骨细胞的分化成熟,进而影响牙周组织骨重塑。进一步研究表明,自噬可通过多种途径促进破骨细胞的分化或增强其活性。核因子κB受体活化因子配体作为破骨细胞分化和活化的关键因子,在压力侧骨重塑中起到了重要作用[37]。自噬可通过上调核因子κB受体活化因子配体的表达促进其与破骨细胞表面受体核因子κB受体活化因子结合,以诱导破骨前体细胞向破骨细胞分化[38-39];并且自噬还可通过降解蓬乱蛋白DSH同源物2蛋白,抑制破骨前体细胞内的Wnt信号通路,促进破骨细胞分化[40]。此外,自噬标志物如自噬相关蛋白5、自噬相关蛋白7和LC3的上调也可影响破骨细胞的融合,促进骨吸收[41]。同时,自噬可提供破骨细胞分化成熟所需的能量,以确保破骨细胞生物学作用得到正常发挥[42]。综上,牙周自噬可在正畸压力的刺激下被激活,通过介导破骨细胞的分化及功能发挥作用,以促进压力侧牙槽骨的吸收。 自噬促进透明样变区域组织吸收:ZHU等[43]建立大鼠模型,观察压力侧不同时间节点牙槽骨自噬和凋亡的情况,研究发现,7 d后自噬体通量减少并维持在基线水平上,凋亡反应随之逐渐扩大。研究表明,在长期刺激下,自噬相关蛋白4在其羧基末端裂解LC3,并由泛素活化酶-自噬相关蛋白7催化LC3和自噬相关蛋白12泛素化[44]。最后自噬相关蛋白10作为泛素载体进一步结合自噬相关蛋白12,从而结合LC3下调自噬。随后凋亡相关蛋白Bax和caspase-3的水平逐渐升高,牙周膜细胞凋亡反应扩大,最终介导牙周膜出现透明样变区域,此时压力侧骨吸收速度减慢[45]。值得一提的是,该阶段的骨重塑同样有自噬的参与,自噬水平在透明样变区小幅上调,并诱导破骨细胞在此区域周围聚集,从而介导透明样变区组织的吸收从而促进正畸牙齿移动[34]。 典型的正畸牙齿移动过程可分为3期:初始期、迟缓期、迟缓后期。初始期,压力下牙周膜微循环受阻将导致迅速启动牙周膜细胞的自噬,随后,自噬将通过多途径促进压力侧破骨的分化与成熟促进骨吸收。此时,出现在牙周膜细胞及牙槽骨组织的自噬增强现象可以拮抗、延缓牙周膜细胞凋亡作用的出现。长期的正畸力激刺会导致牙周膜细胞自噬水平逐渐降低且凋亡反应扩大,出现透明样变,正畸牙齿移动进入迟缓期。但持续性正畸力使压力侧自噬仍高于基线水平,并可通过介导透明样变区组织的吸收,临床表现为迟缓后期。压力侧自噬对牙周组织的影响见图5。"
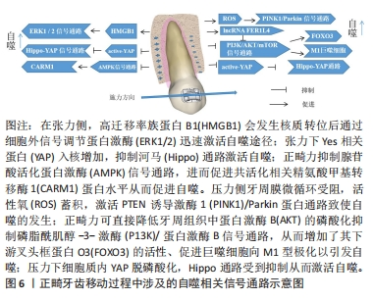
2.2.2 正畸牙齿移动张力侧牙周组织的自噬 正畸力作用下张力侧成骨对牙齿移动和稳定同样具有重要意义[46]。体外实验表明,周期性张应力(cyclic tensile stress,CTS)可诱导人牙周膜干细胞成骨和自噬相关因子LC3和自噬相关蛋白7表达水平升高,并呈相同趋势[47]。当通过基因沉默技术敲低人牙周膜干细胞中自噬相关基因7来抑制自噬后,成骨相关因子如骨桥蛋白、碱性磷酸酶及Runt相关转录因子2蛋白的表达水平也随之降低。提示CTS可以激活牙周膜干细胞的自噬,促进张力侧成骨以维持牙齿移动后的稳定。进一步研究发现,CTS诱导的自噬过程沿着双阶段动力学动态发展,以适应更持久的变化[48]。CTS诱导的自噬被快速激活,达到峰值后略有下降,但随着时间延长,自噬水平再次持续上调。这种CTS诱导的“渐进式自噬潮”现象区别于压力侧自噬流的趋势,且在不同阶段的作用存在差异。 研究发现,CTS初期可迅速激活牙周自噬并促进炎症因子如肿瘤坏死因子α等的上调,进一步加大自噬发生的范围,从而促进清理在张力状态下受损的细胞器及蛋白质[49]。随后,牙周膜细胞通过调节细胞骨架以回归适应性状态,此时自噬水平小幅度下调[50]。但随着CTS周期延长,自噬再次上调,此时自噬是通过抑制炎症反应、驱动牙周组织自噬并介导相关成骨因子-骨细胞成纤维细胞生长因子23以及成骨相关蛋白骨桥蛋白和碱性磷酸酶及Runt相关转录因子2蛋白的分泌从而参与张力侧的骨重塑[51]。进一步研究发现,自噬体还可以作为载体通过将磷灰石晶体分泌到细胞外基质中来促进张力侧骨的矿化,从而促进组织修复以维持正畸牙齿移动后的位置[52]。这一过程可以概括为:在CTS早期,自噬上调,通过重吸收受损组织为牙齿的移动提供能量及空间;在CTS晚期,牙齿移动到新的位置后,自噬再度上调通过促进成骨,从而使牙齿维持在移动后的位置。 2.3 影响正畸牙齿移动自噬过程的相关信号通路 正畸牙齿移动过程中牙周处在复杂的力学环境中,牙周组织是通过一系列的调整来适应力学环境的变化[53]。目前发现细胞膜上初级纤毛、脂筏、离子通道和整合素等结构或分子均能感受到机械应力,改变细胞骨架,激活下游机械转导的相关通路进而调节自噬,最终产生相应的效应[11]。 2.3.1 压力侧相关通路 磷脂酰肌醇-3-激酶/蛋白激酶B信号通路:正畸力可通过抑制磷脂酰肌醇-3-激酶/蛋白激酶B信号通路以促进自噬,从而调节正畸牙齿移动[54]。磷脂酰肌醇-3-激酶/蛋白激酶B信号通路是调节自噬的一条经典通路。生理条件下,磷脂酰肌醇-3-激酶-α催化亚基可通过 NF-E2 P45相关因子2-抗氧化剂反应元件依赖的途径及激活蛋白激酶B对牙周自噬起抑制作用。相反,正畸力可直接降低牙周组织中蛋白激酶B的磷酸化从而抑制哺乳动物雷帕霉素靶蛋白途径促进自噬[55-56]。并且,正畸力对磷脂酰肌醇-3-激酶/蛋白激酶B信号通路的抑制增加了其下游叉头框蛋白O3的活性。叉头框蛋白O3蛋白进一步通过上调自噬相关蛋白包括自噬相关蛋白7、LC3和 Bcl2/腺病毒E1B相互作用蛋白3的转录活性,正向调控牙周压力诱导的自噬[57]。其他研究表明,正畸力诱导的自噬也可通过抑制蛋白激酶B信号通路引导巨噬细胞进入M1表型,从而促进M1分泌NOD样受体蛋白3炎症受体和增加炎症因子的表达,促进压力侧骨吸收[58]。 PTEN诱导激酶1/Parkin蛋白信号通路:近期研究表明,正畸力可通过激活PTEN诱导激酶1/Parkin蛋白信号通路以促进压力侧自噬的发生。线粒体自噬作为自噬的一种方式近年来受到广泛关注,而PTEN诱导激酶1/Parkin蛋白信号通路是目前在线粒体自噬中研究较为成熟信号通路之一。PTEN诱导激酶1/Parkin蛋白信号通路介导的线粒体自噬与许多因素有关,其中以活性氧最具特点[59]。研究表明,正畸牙移动初期的压力侧的缺氧环境会引起牙周膜细胞中活性氧的增加,致使线粒体膜电位下降甚至消失致使PINK1聚集在线粒体外膜[60]。随后,PTEN诱导激酶1通过招募磷酸化Parkin蛋白的泛素样结构域中的Ser65改变自身构像,激活此通路。PTEN诱导激酶1/Parkin蛋白信号通路的激活诱导致了牙周膜细胞线粒体自噬的发生。并且,PTEN诱导激酶1介导的泛素磷酸化,放大了磷酸化信号,致使嵌入外膜的线粒体蛋白等泛素化后,与自噬小体上的LC3和伽马氨基丁酸受体亚型受体相关蛋白结合,进一步引发自噬[61]。但有趣的是,牙周细胞在敲除PTEN诱导激酶1后,活性氧的大量堆积依然可以引起自噬的发生[60],这说明牙周活性氧可能不仅只依赖于PTEN诱导激酶1/Parkin蛋白这一条通路激活自噬,具体机制仍需进一步探索。 河马/Yes相关蛋白信号通路:研究表明,正畸力可作为河马/Yes相关蛋白信号通路的上游输入从而促进压力侧自噬的发生。河马/Yes相关蛋白信号通路可通过两种途径参与正畸牙齿移动的过程:一方面,河马/Yes相关蛋白信号通路可通过监测细胞骨架,从而转导正畸牙移动过程中的机械刺激,促进正畸牙齿移动;另一方面,河马/Yes相关蛋白信号通路参与正畸压力引发的自噬过程并发挥生物学功能[62]。研究表明,机械信号可作为河马/Yes相关蛋白信号通路的上游输入,而自噬则可能是该通路机械转导的下游事件:正畸压力下,细胞质内Yes相关蛋白脱磷酸化,从而溶解与14-3-3蛋白的结合。随后,转录共激活子易位到细胞核中,Yes相关蛋白通过与转录增强子的结合调控基因表达进而通过调控自噬小泡与溶酶体的融合,参与调控压力侧牙周膜细胞的自噬过程[63]。 2.3.2 张力侧相关通路 蛋白激酶1/2信号通路:CTS可通过蛋白激酶1/2信号通路激活自噬,从而促进张力侧成骨。细胞外信号调节蛋白激酶分为细胞外信号调节蛋白激酶1和细胞外信号调节蛋白激酶2,统称为细胞外信号调节蛋白激酶1/2。蛋白激酶1/2信号通路是成骨细胞内应力信号转导过程中一条重要的信号转导通路,且参与了CTS刺激下牙周膜细胞的成骨分化[64]。实验表明,在CTS作用下高迁移率族蛋白B1会发生核质转位后通过细胞外信号调节蛋白激酶信号通路迅速激活自噬途径,调节牙周膜成骨细胞分化并激活成骨相关蛋白Runt相关转录因子2蛋白,使Runt相关转录因子2蛋白在脯氨酸-丝氨酸苏氨酸部位发生磷酸化,从而使Runt相关转录因子2蛋白具有转录活性,具有转录活性的Runt相关转录因子2蛋白通过调控下游靶基因的表达促进成骨细胞分化并抑制炎症反应,从而促进组织修复以维持正畸牙齿移动后的位置[65-66]。上述过程可被肿瘤坏死因子α抑制,从而抑制成骨靶基因的转录表达,发挥抑制牙周膜干细胞成骨分化的作用。 河马/Yes相关蛋白信号通路:河马/Yes相关蛋白信号通路在CTS激活的自噬过程中也发挥了重要作用[62]。当河马/Yes相关蛋白信号通路感知CTS刺激后,其核心激酶-大肿瘤抑制激酶1/2受到抑制,从而对Yes相关蛋白的磷酸化减少,Yes相关蛋白入核增加,与转录增强相关结构域家族转录因子结合,激活下游自噬因子转录水平,上调成骨相关因子表达,促进张力侧成骨。但有趣的是,联合应用大肿瘤抑制激酶1/2抑制剂会降低张力侧Yes相关蛋白入核及自噬水平[67]。因此,CTS下河马/Yes相关蛋白信号通路对自噬调控可能不是单纯的增强或者抑制,二者间可能存在复杂的相互作用,抑或CTS诱导的自噬可能对河马/Yes相关蛋白信号通路存在反向调控作用。 AMPK信号通路:正畸力可通过抑制腺苷酸活化蛋白激酶信号通路以促进自噬,从而调节正畸牙齿移动。腺苷酸活化蛋白激酶可通过诱导自噬调控骨代谢,从而促进骨稳态[68]。研究人员进一步评估了腺苷酸活化蛋白激酶是否参与了张力介导的牙周组织自噬。与预想结果相反的是,CTS依赖性地抑制腺苷酸活化蛋白激酶蛋白表达和磷酸化。并且,在抑制腺苷酸活化蛋白激酶通路后,观察到腺苷酸活化蛋白激酶表达和磷酸化降低,而共活化相关精氨酸甲基转移酶1蛋白水平、自噬相关蛋白7、LC3-Ⅱ和成骨相关蛋白表达水平升高[69]。因此,在张力侧是通过抑制腺苷酸活化蛋白激酶信号通路来驱动骨细胞自噬,进而促进成骨相关蛋白表达从而促进张力侧成骨。前期研究表明,饥饿可激活核腺苷酸活化蛋白激酶以上调共活化相关精氨酸甲基转移酶1蛋白表达,共活化相关精氨酸甲基转移酶1进一步激活因子转录因子EB介导的自噬[70]。但目前腺苷酸活化蛋白激酶作用于正畸骨代谢相关细胞自噬的具体机制尚未完全阐明,有待进一步的研究。 综上所述,正畸牙齿移动中,自噬的机制十分复杂,涉及多种信号通路,但目前研究仅探索了单一通路对正畸牙齿移动过程中自噬的影响。研究表明,在调控自噬过程中存在着2条及2条以上信号通路的交互作用,如Yes相关蛋白可通过转录增强相关结构域家族转录因子结合到磷酸肌醇-3-激酶催化亚基β肽,进而激活磷脂酰肌醇-3-激酶/蛋白激酶B信号通路,以调节心肌细胞的凋亡和自噬[71]。因此,研究者们有理由推测正畸牙齿移动过程中自噬涉及到的各条信号通路可能也寻在相互作用[72-76],需进行深入的实验研究进行探究阐明。正畸牙齿移动过程中涉及的自噬相关信号通路示意图见图6。"

| [1] LI Y, ZHAN Q, BAO M, et al. Biomechanical and biological responses of periodontium in orthodontic tooth movement: up-date in a new decade. Int J Oral Sci. 2021;13(2):129-147. [2] ELSHAZLY TM, BOURAUEL C, ALDESOKI M, et al. Computer-aided finite element model for biomechanical analysis of orthodontic aligners. Clin Oral Investig. 2023;27(1):115-124. [3] SAMARE-NAJAF M, NEISY A, SAMAREH A, et al. The constructive and destructive impact of autophagy on both genders’ reproducibility, a comprehensive review. Autophagy. 2023;19(12):3033-30611. [4] YOUNG SP, SEUNG HC, HWUN KC, et al. Inactivation of PI3K/Akt promotes the odontoblastic differentiation and suppresses the stemness with autophagic flux in dental pulp cells. J Dent Sci. 2022;17(1):145-154. [5] LIU LL, LI XJ, BU WH, et al. Carbon dots enhance extracellular matrix secretion for dentin-pulp complex regeneration through PI3K/Akt/mTOR pathway-mediated activation of autophagy. Mater Today Bio. 2022;16:100344. [6] WANG Q, LIU J, YANG XM, et al. Gold nanoparticles enhance proliferation and osteogenic differentiation of periodontal ligament stem cells by PINK1-mediated mitophagy. Arch Oral Biol. 2023;150:105692. [7] 宋璐,谭静怡,陈莉丽.自噬及其相关蛋白在牙周病发生发展中作用的研究进展[J].中华口腔医学杂志,2019,54(5):339-343. [8] IVAN D, ZVULUN E. Mechanism and medical implications of mammalian autophagy. Nat Rev Mol Cell Biol. 2018;19(6):349-364. [9] SVENJA M, ANNA D, BEATRICE W, et al. Autophagy in periodontal ligament fibroblasts under biomechanical loading. Cell Tissue Res. 2019;378(3):499-511. [10] XU J, ZHAO X, ZENG J, et al. Role of autophagy in the periodontal ligament reconstruction during orthodontic tooth movement in rats. J Dent Sci. 2020; 15(3):351-363. [11] JIANG YK, HU ZA, GUAN YZ, et al. Research progress in mechanotransduction process of mechanical-stress-induced autophagy. Sichuan Da Xue Xue Bao Yi Xue Ban. 2021;52(6):929-935. [12] DE DUVE C, WATTIAUX R. Functions of lysosomes. Annu Rev Physiol. 1966;28: 435-492. [13] ARSTILA AU, TRUMP BF. Studies on cellular autophagocytosis. The formation of autophagic vacuoles in the liver after glucagon administration. Am J Pathol. 1968;53(5):687-733. [14] KLIONSKY DJ, CREGG JM, DUNN WA JR, et al. A unified nomenclature for yeast autophagy-related genes. Dev Cell. 2003;5(4):539-545. [15] KING JS, VELTMAN DM, INSALL RH. The induction of autophagy by mechanical stress. Autophagy. 2011;7(12):1490-1499. [16] 周云.正畸牙齿移动过程中牙周膜成纤维细胞自噬作用的初步研究[D].西安:第四军医大学,2014. [17] LI Y, JACOX LA, COATS S, et al. Roles of autophagy in orthodontic tooth movement. Am J Orthod Dentofacial Orthop. 2021;159(5):582-593. [18] STOJANOVIC O, MIGUEL-ALIAHA I, TRAJKOVSKI M. Intestinal plasticity and metabolism as regulators of organismal energy homeostasis. Nat Metab. 2022; 4(11):1444-1458. [19] CAO WY, LI JH, YANG KP, et al. An overview of autophagy: mechanism, regulation and research progress. Bull Cancer. 2021;108(3):304-322. [20] LIU XC, LU JJ, CHEN YM, et al. Roles of autophagy onself-renewal and differentiation of mesenchymal stem cells. West Chin J Stomatol. 2020;38(6):704-707. [21] SUN YN, WANG HH, QU TQ, et al. mTORC2: a multifaceted regulator of autophagy. Cell Commun Signal. 2023;21(1):4. [22] TU CF, LI HY, LIU XY, et al. TDRD7 participates in lens development and spermiogenesis by mediating autophagosome maturation. Autophagy. 2021; 17(11):3848-3864. [23] ALEX P, LOREDANA B, SABRINA C, et al. Combined inhibition of Hedgehog and HDAC6: in vitro and in vivo studies reveal a new role for lysosomal stress in reducing glioblastoma cell viability. Int J Mol Sci. 2023;24(6):5771. [24] HAN RH, HUANG HM, HAN H, et al. Propofol postconditioning ameliorates hypoxia/reoxygenation induced H9c2 cell apoptosis and autophagy via upregulating forkhead transcription factors under hyperglycemia. Mil Med Res. 2021;8(1):58. [25] KLIONSKY DJ, PETRONI G, AMARAVADI RK, et al. Autophagy in major human diseases. EMBO J. 2021;40(19):e108863. [26] LÖRINCZ P, JUHAÁSZ G. Autophagosome-Lysosome fusion. J Mol Biol. 2020; 432(8):2462-2482. [27] SAWA-MAKARSKA J, BAUMANN V, COUDEVYLLE N, et al. Reconstitution of autophagosome nucleation defines Atg9 vesicles as seeds for membrane formation. Science. 2020;369(6508):eaaz7714. [28] TIAN W, ALSAADI R, GUO Z, et al. An antibody for analysis of autophagy induction. Nat Methods. 2020;17(2):232-239. [29] MARINÕ G, NISO-SANTANO M, BAEHRECKE EH, et al. Self-consumption: the interplay of autophagy and apoptosis. Nat Rev Mol Cell Biol. 2014;15(2):81-94. [30] SHIM MS, LITON PB. The physiological and pathophysiological roles of the autophagy lysosomal system in the conventional aqueous humor outflow pathway: More than cellular clean up. Prog Retin Eye Res. 2022;90:101064. [31] MALTHA JC, KUIJPERS-JAGTMAN AM. Mechanobiology of orthodontic tooth movement: an update. J World Fed Orthod. 2023;12(4):156-160. [32] 徐洁.周期性压力激活人牙周膜细胞自噬的分子机制初步研究[C].2020年中华口腔医学会口腔生物医学专业委员会第十次全国口腔生物医学学术年会暨第六次全国口腔杰青优青论坛论文汇编,2020:46-47. [33] SCHROÖDER A, BAUER K, SPANIER G, et al. Expression kinetics of human periodontal ligament fibroblasts in the early phases of orthodontic tooth movement. J. Periodontal Res. 2018;79:337-351. [34] LV JL, XU J, ZENG J, et al. Expression of autophagy-related protein Beclin-1 and microtubule-associated protein 2 light chain 3 in periodontal ligament cells in orthodontic tooth pressure areas. West Chin J Stomatol. 2019;37(2):168-173. [35] 尹圆圆,马华钰,李昕怡,等.小鼠正畸牙移动中牙周组织自噬相关基因表达的初步研究[J].国际口腔医学杂志,2020,47(6):627-634. [36] LI WL, ZHAO J, SUN W, et al. Osteocytes promote osteoclastogenesis via autophagy-mediated RANKL secretion under mechanical compressive force. Arch Biochem Biophys. 2020;694:108594. [37] HUI JY,BING L,QIONG W, et al. Echinocystic acid inhibits RANKL-induced osteoclastogenesis by regulating NF-κB and ERK signaling pathways. Biochem Biophys Res Commun. 2016;477(4):673-677. [38] SHOJI-MATSUNAGA A, ONE T, HAYASHI M, et al. Osteocyte regulation of orthodontic force-mediated tooth movement via RANKL expression. Sci Rep. 2017;7(1):8753. [39] MONTASERI A, GIAMPIETRI C, ROSSI M, et al. The role of autophagy in osteoclast differentiation and bone resorption function. Biomolecules. 2020;10(10):1398. [40] 杨玉婷.1.LPS介导自噬下调Wnt通路促破骨细胞生成的研究2.GTR联合植骨术治疗下颌第二磨牙远中骨缺损[D].杭州:浙江大学,2021. [41] CAI SZ, CHEN YY, CHEN JW, et al. Rubiadin-1-methyl ether inhibits BECN1 transcription and Beclin1-dependent autophagy during osteoclastogenesis by inhibiting NF-κB p65 activation. Exp Biol Med. 2023;248(17):1518-1526. [42] ZHU L, WANG JH, WU ZP, et al. AFF4 regulates osteogenic potential of human periodontal ligament stem cells via mTOR-ULK1-autophagy axis. Cell Prolif. 2023. doi: 10.1111/cpr.13546. [43] ZHU WY, DONG WR, ZHANG SS, et al. Alterations between autophagy and apoptosis in alveolar bone mesenchymal stem cells under orthodontic force and their effects on osteogenesis. J Hard Tissue Biol. 2022;31(3):147-154. [44] D’ARCY MS. Cell death: a review of the major forms of apoptosis, necrosis and autophagy. Cell Biol Int. 2019;43(6):582-592. [45] WANG MY, ZHANG L, LIN F, et al. Dynamic study into autophagy and apoptosis during orthodontic tooth movement. Exp Ther Med. 2021;21(5):430. [46] SUN YQ, FU JF, LIN FR, et al. Force-induced nitric oxide promotes osteogenic activity during orthodontic tooth movement in mice. Stem Cells Int. 2022;2022: 4775445. [47] ZHENG JY, XU BW, YANG K. Autophagy regulates osteogenic differentiation of human periodontal ligament stem cells induced by orthodontic tension. Stem Cells Int. 2022;2022:2983862. [48] MEMMERT S, NOGUEIRA AVB, DAMANAKI A, et al. Regulation of the autophagy-marker Sequestosome 1 in periodontal cells and tissues by biomechanical loading. J Orofac Orthop. 2020;81(1):10-21. [49] CHEN LY, MO SZ, HUA YM. Compressive force-induced autophagy in periodontal ligament cells downregulates osteoclastogenesis during tooth movement. J Periodontol. 2019;90(10):1170-1181. [50] JACOX LA, TANG N, LI Y, et al. Orthodontic loading activates cell-specific autophagy in a force-dependent manner. Am J Orthod Dentofacial Orthop. 2022; 161(3):423-436.e1. [51] ZHOU ZZ, SSHI GX, ZHENG XF, et al. Autophagy activation facilitates mechanical stimulation-promoted osteoblast differentiation and ameliorates hindlimb unloading-induced bone loss. Biochem Biophys Res Commun. 2018;498(3):667-673. [52] WANG J, ZHANG Y, CAO J, et al. The role of autophagy in bone metabolism and clinical significance. Autophagy. 2023;19(9):2409-2427. [53] CITA N, JOSEF L, MARCOS LG, et al. Mechanical-induced bone remodeling does not depend on Piezo1 in dentoalveolar hard tissue. Sci Rep. 2023;13(1):9563. [54] YANG YQ, LIU Q, LU X, et al. Sanhuang decoction inhibits autophagy of periodontal ligament fibroblasts during orthodontic tooth movement by activating PI3K-Akt-mTOR pathway. Biomed Pharmacother. 2023;166:115391. [55] PAN ZB, TAN ZM, LI HY, et al. Diosmetin induces apoptosis and protective autophagy in human gastric cancer HGC-27 cells via the PI3K/Akt/FoxO1 and MAPK/JNK pathways. Med Oncol. 2023;40(11):319. [56] XU Y, SHEN J, MUHAMMED FK, et al. Effect of orthodontic force on the expression of PI3K, Akt, and P70S6 K in the human periodontal ligament during orthodontic loading. Cell Biochem Funct. 2017;35(7):372-377. [57] HUANG YP, LIU H, GUO RZ, et al. Long Non-coding RNA FER1L4 mediates the autophagy of periodontal ligament stem cells under orthodontic compressive force via AKT/FOXO3 pathway. Front Cell Dev Biol. 2021;9:631181. [58] JIANG N, HE DQ, MA YS, et al. Force-induced autophagy in periodontal ligament stem cells modulates M1 macrophage polarization via AKT signaling. Front Cell Dev Biol. 2021;9:666631. [59] SU L, ZANG JH, GOMEZ H, et al. Mitochondria ROS and mitophagy in acute kidney injury. Autophagy. 2023;19(2):401-414. [60] FAN ZB, JIN K, LI SH, et al. Regulation of reactive oxygen species on the mitophagy of human periodontal ligament cells through the PINK1/Parkin pathway under starvation. West Chin J Stomatoli. 2022;40(6):645-653. [61] PICCOLO S, DUPONT S, CORDENONSI M. The biology of YAP/TAZ: hippo signaling and beyond. Physiol Rev. 2014;94(4):1287-1312. [62] SUN BY, WEN Y, WU X, et al. Expression pattern of YAP and TAZ during orthodontic tooth movement in rats. J Mol Histol. 2018;49(2):123-131. [63] 伍宇婕,晚晓芳,魏绵兴,等.正畸牙移动模型小鼠压力侧牙周膜细胞自噬与Hippo-Yes相关蛋白通路的关系[J].中国组织工程研究,2023,27(5):683-689. [64] PARK KR, LEE JY, CHO M, et al. Ziyuglycoside I upregulates RUNX2 through ERK1/2 in promoting osteoblast differentiation and bone mineralization. Am J Chin Med. 2021;49(4):883-900. [65] 张闵,白书林,李胜鸿,等.高迁移率族蛋白B1及ERK1/2通路对张应力下人牙周膜细胞自噬的影响[J].中国组织工程研究,2023,27(10):1560-1566. [66] 宋京,任大鹏,颜世果,等.细胞外信号调节蛋白激酶1/2在介导周期性牵张力对牙周膜细胞成骨分化中的作用[J].华西口腔医学杂志,2017,35(5):520-526. [67] 晚晓芳,何海燕,吕佳岭,等.周期性张应力作用下Hippo-YAP信号通路调控人牙周膜细胞自噬[J].华西口腔医学杂志,2023,41(3):260-268. [68] 李炎杰,刘旺,和红兵.AMPK通路介导骨代谢相关细胞自噬调控牙周炎骨稳态的研究进展[J].口腔疾病防治,2023,31(7):524-528. [69] XU HY, XIA M, SUN L, et al. Osteocytes enhance osteogenesis by autophagy-mediated FGF23 secretion under mechanical tension. Front Cell Dev Biol. 2022; 9:782736. [70] HU R, WANG MQ, LIU LY, et al. Calycosin inhibited autophagy and oxidative stress in chronic kidney disease skeletal muscle atrophy by regulating AMPK/SKP2/CARM1 signalling pathway. J Cell Mol Med. 2020;24(19):11084-11099. [71] LIN ZQ, ZHOU ZP, VON GISE AG, et al. Pi3kcb links Hippo-YAP and PI3K-AKT signaling pathways to promote cardiomyocyte proliferation and survival. Circ Res. 2015;116(1):35-45. [72] 徐珮琼,郑治国,伍军.正畸牙移动中脂联素调控PI3K/AKt信号通路对牙周组织改建的影响[J].中国临床解剖学杂志,2023,41(5):583-587. [73] 刘安琪.Gli1+细胞在正畸牙移动中的作用研究[D].西安:中国人民解放军空军军医大学,2020. [74] 王玥.机械压力调控破骨细胞分泌miR-146a-5p促进血管形成并影响正畸骨改建的作用和机制研究[D].北京:北京大学医学部,2021. [75] 宋吉玉.杜仲皮纯化多糖通过ERK/BMP-2/Smad通路促进成骨分化抗骨质疏松作用研究[D].长春:吉林大学,2023. [76] 林维龙,吴晓沛,何薇薇,等.重组人转化生长因子β1对大鼠正畸牙移动模型成骨细胞分化及ERK/MAPK信号通路的影响[J].口腔医学研究,2023, 39(2):118-123. |
| [1] | Yang Yifeng, Ye Nan, Wang Lin, Guo Shuaicheng, Huang Jian. Signaling pathway of dexmedetomidine against ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1464-1469. |
| [2] | Yu Weijie, Liu Aifeng, Chen Jixin, Guo Tianci, Jia Yizhen, Feng Huichuan, Yang Jialin. Advantages and application strategies of machine learning in diagnosis and treatment of lumbar disc herniation [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1426-1435. |
| [3] | Wei Juan, Li Ting, Huan Mengting, Xie Ying, Xie Zhouyu, Wei Qingbo, Wu Yunchuan. Mechanism by which static exercise improves insulin resistance in skeletal muscle of type 2 diabetes [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1271-1276. |
| [4] | Sheng Siqi, Xie Lin, Zhao Xiangyu, Jiang Yideng, Wu Kai, Xiong Jiantuan, Yang Anning, Hao Yinju, Jiao Yun. Involvement of miR-144-3p in Cbs+/- mouse hepatocyte autophagy induced by high-methionine diet [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1289-1294. |
| [5] | Lin Zeyu, Xu Lin. Research progress in gout-induced bone destruction mechanism [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1295-1300. |
| [6] | Yue Yun, Wang Peipei, Yuan Zhaohe, He Shengcun, Jia Xusheng, Liu Qian, Li Zhantao, Fu Huiling, Song Fei, Jia Menghui. Effects of croton cream on JNK/p38 MAPK signaling pathway and neuronal apoptosis in cerebral ischemia-reperfusion injury rats [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1186-1192. |
| [7] | Wang Ji, Zhang Min, Li Wenbo, Yang Zhongya, Zhang Long. Effect of aerobic exercise on glycolipid metabolism, skeletal muscle inflammation and autophagy in type 2 diabetic rats [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1200-1205. |
| [8] | Liu Xin, Hu Man, Zhao Wenjie, Zhang Yu, Meng Bo, Yang Sheng, Peng Qing, Zhang Liang, Wang Jingcheng. Cadmium promotes senescence of annulus fibrosus cells via activation of PI3K/Akt signaling pathway [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1217-1222. |
| [9] | Zhou Bangyu, Li Jie, Ruan Yushang, Geng Funeng, Li Shaobo. Effects of Periplaneta americana powder on motor function and autophagic protein Beclin-1 in rats undergoing spinal cord hemisection [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1223-1228. |
| [10] | Pan Xiaolong, Fan Feiyan, Ying Chunmiao, Liu Feixiang, Zhang Yunke. Effect and mechanism of traditional Chinese medicine on inhibiting the aging of mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1091-1098. |
| [11] | Huang Yuxin, Liang Wenzi, Chen Xiuwen, Ni Na, Zhao Yinglin, Lin Changmin. Role of autophagy in hair regeneration [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1112-1117. |
| [12] | Ma Shuwei, He Sheng, Han Bing, Zhang Liaoyun. Exosomes derived from mesenchymal stem cells in treatment of animals with acute liver failure: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1137-1142. |
| [13] | Liu Qiwei, Zhang Junhui, Yang Yuan, Wang Jinjuan. Role and mechanism of umbilical cord mesenchymal stem cells on polycystic ovary syndrome [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1015-1020. |
| [14] | Zhang Kefan, Shi Hui. Research status and application prospect of cytokine therapy for osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(6): 961-967. |
| [15] | Xu Rong, Wang Haojie, Geng Mengxiang, Meng Kai, Wang Hui, Zhang Keqin, Zhao Huijing. Research advance in preparation and functional modification of porous polytetrafluoroethylene artificial blood vessels [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 759-765. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||

