Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (25): 4065-4071.doi: 10.12307/2023.789
Previous Articles Next Articles
Action mechanism and advantages of mesenchymal stem cells for treating flap ischemia-reperfusion injury
He Bo1, He Zhijun2, Liu Tao2, Ma Suilu1, Wei Xiaotao1, Wang Weiwei1
- 1College of Traditional Chinese Medicine, Gansu University of Chinese Medicine, Lanzhou 730030, Gansu Province, China; 2Department of Foot and Ankle Orthopedics, Gansu Hospital of Traditional Chinese Medicine, Lanzhou 730050, Gansu Province, China
-
Received:2022-11-30Accepted:2023-01-13Online:2024-09-08Published:2023-11-24 -
Contact:He Zhijun, Professor, Chief physician, Master’s supervisor, Department of Foot and Ankle Orthopedics, Gansu Hospital of Traditional Chinese Medicine, Lanzhou 730050, Gansu Province, China -
About author:He Bo, Master candidate, College of Traditional Chinese Medicine, Gansu University of Chinese Medicine, Lanzhou 730030, Gansu Province, China -
Supported by:Gansu Province Traditional Chinese Medicine Project, No. GZKZ-2020-2 (to HZJ); National Natural Science Foundation of China, No. 81660802 (to HZJ)
CLC Number:
Cite this article
He Bo, He Zhijun, Liu Tao, Ma Suilu, Wei Xiaotao, Wang Weiwei. Action mechanism and advantages of mesenchymal stem cells for treating flap ischemia-reperfusion injury[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(25): 4065-4071.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks

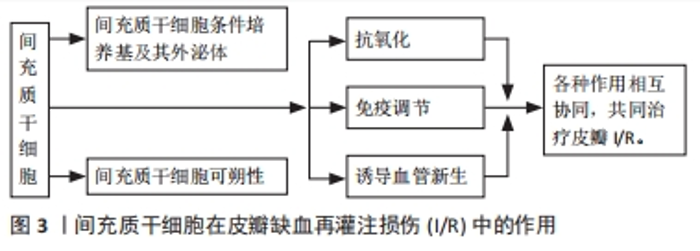
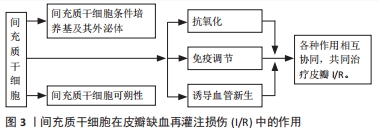
2.1.1 间充质干细胞抗氧化作用与皮瓣I/R 皮瓣I/R涉及复杂的氧化过程,这与皮瓣存活密切相关。在正常代谢过程中,细胞会产生一定量的内源性抗氧化物,例如,过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)和超氧化物歧化酶(SOD)等,它们能够及时有效地清除体内的活性氧,避免组织细胞受到损伤。再灌注后,组织产生大量的活性氧[9],当它们超过机体抗氧化能力后就会造成细胞损伤。氧化水平的高低反映着组织损伤的程度,抗氧化酶的活性以及活性氧数量影响着氧化水平。脂质过氧化的最终产物丙二醛是过氧化损伤的标志之一,其水平不仅能反映细胞的受损情况,而且能反映机体脂质过氧化的强度和速率。超氧化物歧化酶是体内重要的抗氧化酶,是活性氧有效的清除剂。超氧化物歧化酶活性和丙二醛含量通常被来评价氧化应激的水平[10]。 间充质干细胞能够有效调节抗氧化酶的活性及活性氧水平,杨志宏等[11]在骨髓间充质干细胞移植的研究中发现,骨髓间充质干细胞通过显著降低丙二醛含量和乳酸脱氢酶活性以及增强超氧化物歧化酶活性来减轻皮瓣I/R,提高皮瓣的成活率。后来MOUSAVI等[12]在鼠皮瓣缺血再灌注损伤模型中注射骨髓间充质干细胞,发现皮瓣组织中丙二醛含量明显降低,超氧化物歧化酶活性明显提高,皮瓣存活率提高。说明间充质干细胞能够通过提高抗氧化酶的活性或(和)清除过多的活性氧来减轻皮瓣I/R,提高皮瓣的成活率。间充质干细胞抗氧化应激作用见表1。"

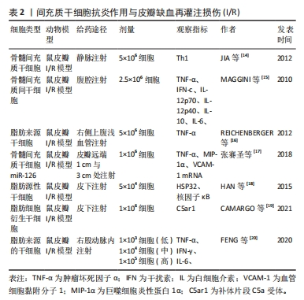
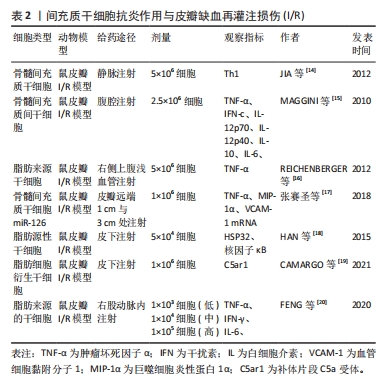
2.1.2 间充质干细胞抗炎作用与皮瓣I/R 大量研究表明,炎症反应程度与皮瓣组织的损伤程度密切相关,而间充质干细胞拥有强大的免疫调节功能。例如,人脐带间充质干细胞移植能够提高移植抑制白细胞介素17(IL-17)和γ干扰素(IFN-γ)的分泌来抑制异体皮肤移植发生的急性免疫排斥反应[13]。骨髓间充质干细胞不仅在体外能显著抑制致病T细胞增殖,在体内也能显著抑制T细胞应答,并调节大鼠模型中的Th1/Th2平衡,同时还能抑制Th1的膨胀;而且术后的注射也能通过减少Th1促炎细胞因子来抑制炎症反应[14]。 肿瘤坏死因子α作为炎症的中枢调节因子,已被证实是内皮细胞凋亡细胞死亡的有效诱导因子,其显著过表达与诱导缺血再灌注损伤相关。一些研究表明,间充质干细胞能够抑制肿瘤坏死因子α的表达,如MAGGINI等[15]研究发现,间充质干细胞能够抑制肿瘤坏死因子α、白细胞介素6、IL-12p70和干扰素c的产生并增加白细胞介素10和IL-12p40的产生。而间充质干细胞抑制细胞因子IL-12p70和干扰素c产生的能力,表明间充质间干细胞不仅可以通过抑制炎症过程早期促炎细胞因子的产生,还可以通过抑制主要依赖于IL-12p70和干扰素c的Th1反应的诱导来抑制炎症。此外还发现,间充质干细胞不仅通过抑制炎症细胞因子的产生来增强白细胞介素10的产生,还能通过刺激凋亡细胞的吞噬作用,从而可以将巨噬细胞转变为抗炎细胞。REICHENBERGER等[16]在大鼠皮瓣I/R模型中研究发现,注射间充质间干细胞可以通过抑制或减少肿瘤坏死因子α表达来保护组织免受肿瘤坏死因子α诱导的I/R。张赛圣等[17]在皮瓣I/R模型中发现,注射骨髓间充质干细胞miR-126能够通过下调肿瘤坏死因子α、血管细胞黏附分子1 mRNA及巨噬细胞炎性蛋白1α的表达来抑制炎症反应。 此外,间充质间干细胞的抑制炎症反应作用还与其它一些细胞因子有关,如HAN等[18]在脂肪源性干细胞预防大鼠皮瓣I/R模型中,发现脂肪源性干细胞移植可以提高热休克蛋白32(HSP32)的表达并抑制核因子κB的表达,显著抑制炎症反应。CAMARGO等[19]研究发现,在小鼠皮瓣I/R模型中,注射脂肪间充质间干细胞后,治疗组的补体片段C5a受体(C5ar1)的水平比对照组下降了50%,皮瓣存活率提升,因此,他们认为脂肪间充质间干细胞可以通过抑制炎症和免疫反应减少组织和细胞的损伤,从而缓解皮瓣I/R。 间充质间干细胞能够抑制炎症反应,那间充质间干细胞注射的剂量是否越多效果就越好?为此,FENG等[20]做了一项研究,他向皮瓣I/R模型大鼠注射了低、中、高3种不同剂量的间充质间干细胞,结果显示3种不同剂量的间充质间干细胞均能降低皮瓣中肿瘤坏死因子α、干扰素γ和白细胞介素6蛋白水平,炎症反应明显被抑制,且中剂量的效果最好。表明,间充质间干细胞通过下调肿瘤坏死因子α、干扰素γ和白细胞介素6水平来抑制炎症反应,提高皮瓣存活率,且注射的间充质间干细胞数量并不是越多效果就越好。 间充质干细胞抗炎作用见表2。"
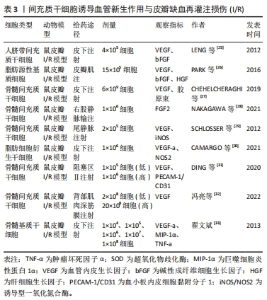
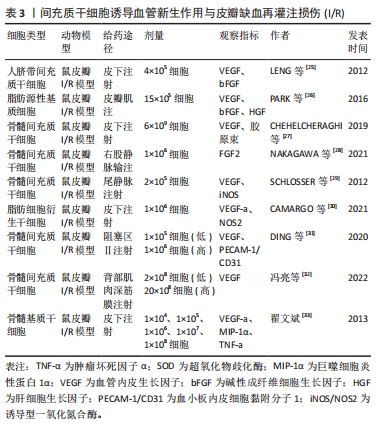
2.1.3 间充质干细胞诱导血管新生作用与皮瓣I/R 氧化应激、炎症、细胞凋亡以及移植过程缺血再灌注时缺氧状态引起的新血管缺乏是游离皮瓣生存的主要威胁[21-22],缺血组织血管修复的主要机制是血管生成和血管新生,而皮瓣移植后的存活主要依赖于血管新生[23]。研究发现,间充质干细胞能够旁分泌血管内皮生长因子(vascular endothelial growth factor,VEGF)、成纤维细胞生长因子、碱性成纤维细胞生长因子以及肝细胞生长因子等促血管新生因子,促进血管新生,改善微循环。其中VEGF具有很强的促内皮细胞增殖作用,与新生血管的关系非常密切,是潜在的血管形成激活物[24],在间充质干细胞的成血管性因子中占主要地位。如LENG等[25]在注射人脐带间充质干细胞的小鼠皮瓣I/R模型中发现,人脐带间充质干细胞能显著提高VEGF和碱性成纤维细胞生长因子的表达,增加毛细血管数量,提高皮瓣的存活率。后来PARK等[26]对脂肪间充质干细胞在鼠皮瓣I/R的作用做了同样研究,发现注射的脂肪间充质干细胞加速了皮瓣的愈合,提升了新生血管的数量和皮瓣的存活率,这与VEGF、碱性成纤维细胞生长因子和肝细胞生长因子等生长因子的高表达有关。 一些学者后来研究发现骨髓间充质干细胞也有类似的作用,如CHEHELCHERAGHI等[27]研究发现,皮下注射骨髓间充质干细胞后,骨髓间充质干细胞组与对照组和安慰剂组相比,胶原束的密度和VEGF显著增加,新血管形成明显增加,随机皮瓣存活率明显提高。此外,骨髓间充质干细胞还能通过提高成纤维细胞生长因子2的表达,增加血液灌注量来提升皮瓣的存活率[28]。 除VEGF等促血管新生因子与新生血管关系密切,有研究表明诱导型一氧化氮合酶(iNOS/Nos2)对毛细血管数量也有显著的促进作用。如SCHLOSSER等[29]在皮瓣缺血再灌注损伤模型大鼠注射骨髓间充质干细胞后,发现骨髓间充质干细胞组的VEGF和诱导型一氧化氮合酶的旁分泌表达提高,毛细血管数量明显增加,皮瓣的存活率提升。后来,CAMARGO等[30]利用注射脂肪细胞衍生干细胞进行研究和验证,结果显示脂肪细胞衍生干细胞组VEGF-a水平明显高于对照组,而诱导型一氧化氮合酶水平增加了4倍,皮瓣存活率显著提升。上述两项研究表明,间充质干细胞能够提高VEGF和诱导型一氧化氮合酶的表达,提高毛细血管数量,改善微循环,进而提升皮瓣的存活率。 间充质干细胞能够诱导血管新生,增加毛细血管数量,那间充质干细胞的注射剂量是否与新生毛细血管数量存在一定关系呢?有学者做了研究,如DING等[31]分别在皮瓣I/R模型大鼠分别注射低剂量和高剂量的骨髓间充质干细胞,高剂量组的阻塞区Ⅱ的阻塞血管广泛扩张,微血管直径和密度、VEGF和血小板内皮细胞黏附分子1(PECAM-1/CD31)水平显著高于对照组和低剂量组,皮瓣存活率明显提升;而低剂量组所有指标的水平也高于对照组,但效果却比高剂量组明显逊色很多。后来,冯亮等[32]也做了相关对比研究,高、低两种不同剂量的骨髓间充质干细胞均能上调VEGF的表达,且高剂量组VEGF蛋白相对表达量高于模型组和低剂量组。上述两个研究表明骨髓间充质干细胞能够提高VEGF的表达来提高皮瓣的存活率,而且骨髓间充质干细胞的剂量与VEGF的表达呈正相关。但上述研究存在一定的缺陷,只有高低两种剂量,没有设置中间参考剂量,高剂量效果较好,但没总结出最佳剂量。翟文斌[33]做了详细研究,他把注射的间充质干细胞剂量分为1×104、1×105、1×106、1×107及1×108细胞 5个组,结果显示:间充质干细胞通过促进VEGF-a分泌及抑制巨噬细胞炎性蛋白1α、肿瘤坏死因子α等炎性因子的表达来提高皮瓣的存活率,且1×107细胞组皮瓣成活面积百分比最高,证明剂量为1×107/mL的间充质干细胞为最佳剂量,这对今后的研究具有一定的参考价值。 间充质干细胞诱导血管新生作用见表3。"
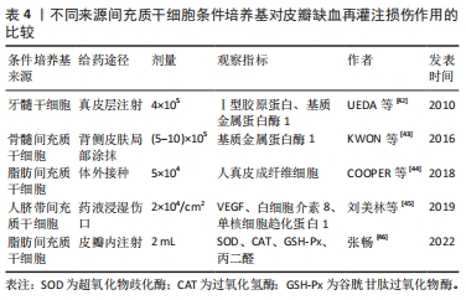
2.2 间充质干细胞条件培养基及其外泌体与皮瓣I/R 尽管间充质干细胞在治疗皮瓣I/R中展现出巨大的潜力,然而近年来发现间充质干细胞的作用效果逐渐下降,而且随着研究的深入,其在治疗中的一些缺陷也逐渐暴露:①移植到新组织中,由于缺血及缺氧的恶劣环境,移植的间充质干细胞存活率非常低[34];②在移植过程中需要大量的间充质干细胞;③间充质干细胞存在不良恶性分化及遗传不稳定等安全性相关并发症尚未解决[35]。如间充质干细胞和癌性干细胞之间存在相似的特征[36],SELL[37]研究表明正常组织中的干细胞是癌性起源。因此,为了保证间充质干细胞治疗的安全性及增强间充质干细胞治疗的有效性,亟需开发一种替代移植干细胞的治疗方法。最近,无细胞疗法间充质干细胞培养的条件培养基(ASC-CM)和间充质干细胞外囊泡引起了学者的兴趣[38]。 2.2.1 干细胞条件培养基与皮瓣I/R 间充质干细胞条件培养基是指培养过细胞的培养基去除细胞后的上清液,里面含有间充质干细胞分泌的大量活性物质,如外泌体、凋亡小体、RNA、DNA及细胞因子等[39],它们装载或存在于外囊泡中[40-41],这些活性物质能够有效治疗皮瓣I/R,见表4。"

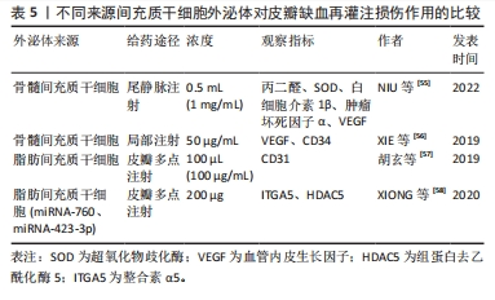
如,UEDA等[42]研究发现牙髓干细胞条件培养基不仅减弱了紫外线-B诱导的人真皮成纤维细胞(HDF)中基质金属蛋白酶1的表达,还抑制了紫外线-B诱导的Ⅰ型胶原蛋白的减少,最终通过激活人真皮成纤维细胞的增殖和迁移活性及增加胶原合成来促进组织的修复。KWON等[43]也发现骨髓间充质干细胞条件培养基能降低皮肤基质金属蛋白酶1的表达并增加前胶原合成,进而促进损伤组织的修复。后来COOPER等[44]发现脂肪间充质干细胞条件培养基也能刺激人真皮成纤维细胞迁移和促进损伤组织的修复。刘美林等[45]研究发现,人脐带间充质干细胞条件培养基可以促进大鼠缺损伤口的修复,而这与VEGF、白细胞介素8和单核细胞趋化蛋白1质量浓度升高有关。 间充质干细胞条件培养基同样具有抗氧化作用,张畅[46]研究发现,脂肪间充质干细胞条件培养基激活并参与抗氧化系统的Keap1-Nrf2-ARE信号通路,提高了细胞内超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶的酶活性并下调了丙二醛的含量,进而减轻血管内皮细胞氧化应激治疗皮瓣缺血再灌注损伤。 因此间充质干细胞条件培养基在治疗皮瓣I/R方面很有前途,而且和间充质干细胞相比,无细胞疗法的间充质干细胞条件培养基不仅同样具有促进组织的修复和愈合的能力,同时还具有无细胞毒性、低免疫原性及高特异性等特点,这些特点弥补了间充质干细胞在治疗上的缺陷,有望成为替代间充质干细胞治疗的新方法。 2.2.2 间充质干细胞外泌体与皮瓣I/R 间充质干细胞的治疗潜力在很大程度上取决于细胞外环境中分子和因子的释放, 包括具有旁分泌活性的可溶性因子(蛋白质、核酸、脂类) 和胞外囊泡[47]。胞外囊泡主要负责间充质干细胞的再生,并保留了其母细胞的归巢特性[48],而胞外囊泡由凋亡小体、微囊泡和外泌体组成[49-50]。其中外泌体是一种直径30-150 nm的膜性囊泡,间充质干细胞所释放的外泌体具有间充质干细胞最基本生物学特性,其不仅是治疗药物,而且是靶向药物输送和治疗的载体[51],也是间充质干细胞与靶细胞之间重要的旁分泌介质。最近,多项研究表明间充质干细胞释放的外泌体通过促进血管生成促进组织修复和再生[52-54],可有效缓解重要器官或组织的缺血再灌注损伤,这表明间充质干细胞来源的外泌体可作为皮瓣移植另一张纸新的替代疗法。 不同源性间充质干细胞外泌体在皮瓣I/R中的作用机制也大不相同,见表5。"
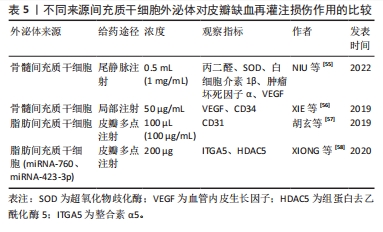
在抗氧化及抑制炎症反应方面,NIU等[55]在大鼠皮瓣I/R模型中发现,间充质干细胞外泌体降低了丙二醛含量并提高超氧化物歧化酶活性,显著降低炎症因子肿瘤坏死因子α和白细胞介素1β的表达水平,结果与对照组相比,静脉注射外泌体的炎症细胞浸润减轻、皮瓣坏死率更低;表明骨髓间充质干细胞外泌体通过缓解缺血再灌注损伤过程中的氧化应激和炎症反应降低皮瓣坏死率。 在诱导血管新生方面,XIE等[56]发现局部注射骨髓间充质干细胞外泌体可提高VEGF和CD34的表达,刺激血管生成,减少皮瓣的坏死面积。胡玄等[57]在大鼠皮瓣I/R模型中发现脂肪间充质干细胞外泌体可以通过上调CD31表达,增加新生毛细血管数量,改善微循环。而且脂肪间充质干细胞外泌体中miRNA-760的上调和miRNA-423-3p的下调分别可以调控整合素α5(ITGA5)和组蛋白去乙酰化酶5(HDAC5)基因的表达,从而促进了皮瓣的血管化,缓解皮瓣I/R,提高皮瓣存活率[58]。 随着对间充质干细胞外泌体研究的不断深入,学者发现间充质干细胞外泌体不仅具有间充质干细胞的抗氧化、抗炎和诱导血管新生等最基本功能,同时与间充质干细胞相比,其还具备以下优势:①更加稳定的生物学特性;②可以减少与细胞治疗相关的潜在风险,包括异位组织形成、免疫排斥反应或不必要的植入[59];③较高的生物相容性,能够很容易地穿透组织,比如血脑屏障[60];④低致癌性、降低免疫相关风险和高靶特异性;⑤储存和输送无需过滤和冷冻,也无需维持细胞的活力和功能。因此,外泌体可能是一种更安全和更有前途的组织再生和重建替代方法[61-62]。 虽然间充质干细胞所释放的外泌体某些功能优于间充质干细胞,然而,目前关于间充质干细胞外泌体治疗皮瓣I/R的理论研究和临床应用还比较少,需要更深一步去探究。此外,除外泌体外,微囊泡和凋亡小体在皮瓣I/R中的作用也值得去开发和利用。 2.3 间充质干细胞可塑性与皮瓣I/R 近年来,有研究表明移植间充质干细胞在缺血组织的炎症和缺血微环境中面临生存挑战,治疗效果降低[63],一些学者为了提高治疗效果开始尝试对间充质干细胞可塑性进行研究,如预处理和基因修饰等,以期打破目前的困境。间充质干细胞不同的可塑性方法见表6。"
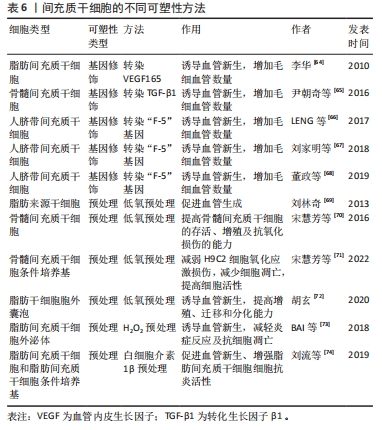

由于基底细胞和成纤维细胞在治疗皮瓣创面愈合过程中存在迁移不足的缺陷,一些学者尝试采用“干细胞-基因”联合疗法来弥补。李华[64]在大鼠皮瓣I/R模型的研究中发现,经转染VEGF165的间充质干细胞组的毛细血管数量和皮瓣存活率高于单纯间充质干细胞组。尹朝奇等[65]研究发现转染转化生长因子β1的间充质干细胞能够显著增加毛细血管数量,提高皮瓣的存活率。LENG等[66]在F-5基因转染人脐带间充质干细胞治疗皮瓣I/R的研究中发现,转染“F-5”基因的人脐带间充质干细胞注射组的毛细血管密度高于其它组,愈合效果更好,愈合时间更短。后来刘家明等[67]和董政等[68]做了同样的研究,而且所得到的结果如上述一致。上述研究表明新的“干细胞-基因”联合疗法效果高于单纯使用间充质干细胞,明显缓解了皮瓣I/R,开创了“干细胞-基因”联合治疗皮瓣I/R的先河。 后来一些学者还尝试对间充质干细胞进行预处理,低氧是影响细胞迁移、增殖、分化和凋亡的重要因素,因此一些学者开始尝试对间充质干细胞进行低氧预处理,如刘林奇[69]在体外实验中发现,低氧预处理脂肪来源干细胞能够分泌更多的VEGF和碱性成纤维细胞生长因子进而促进更多的血管生成。宋慧芳等[70]研究发现低氧预处理能够提高骨髓间充质干细胞的存活、增殖及抗氧化损伤的能力。为了进一步提高间充质干细胞的治疗效果,她又对骨髓间充质干细胞条件培养基进行低氧预处理,发现低氧预处理过的骨髓间充质干细胞条件培养基通过AKT通路减轻H9C2细胞氧化应激损伤[71]。胡玄[72]尝试低氧预处理脂肪干细胞的胞外囊泡,体外实验研究显示低氧预处理脂肪干细胞的胞外囊泡比未处理的脂肪干细胞外囊泡的促增殖、迁移和分化能力更强;体内实验研究显示低氧预处理脂肪干细胞胞外囊泡的VEGF分泌增多且低氧诱导因子1(HIF-1α)的表达增加,新生血管数量更多。 后来,一些学者还尝试其他预处理方法,如BAI等[73]利用低浓度H2O2预处理的脂肪间充质干细胞外泌体,结果发现低剂量H2O2刺激脂肪间充质干细胞外泌体可以促进血管新生,抑制皮瓣I/R的炎症反应并抗细胞凋亡,提高皮瓣的存活率,而且效果比单纯使用脂肪间充质干细胞外泌体更佳。刘流等[74]利用白细胞介素1β预处理脂肪间充质干细胞,发现白细胞介素1β预处理脂肪间充质干细胞能够促进细胞内COX-2-PGE2信号通路激活并提高前列腺素E2 (PGE2)和VEGF的表达,进而促进血管新生。而白细胞介素1β预处理脂肪间充质干细胞条件培养基可以促进PMA-U937细胞M2极化,增强脂肪间充质干细胞的抗炎活性,进而促进组织损伤的修复。 上述的研究结果表明对间充质干细胞进行可塑性后的治疗效果明显优于单纯使用间充质干细胞,主要体现在诱导血管新生、减轻炎症反应及抗细胞凋亡等方面。它不仅提高了间充质干细胞的作用效果,还克服了间充质干细胞的一些缺陷,同时也为间充质干细胞未来的发展提供了新的思路。"

| [1] USLU AB. Effect of dipyridamole on random pattern skin flap viability in rats. J Plast Surg Hand Surg. 2020;54(4):240-247. [2] BOSCÁ MM, ALÓS R, MAROTO N, et al. Recommendations of the Crohn’s disease and ulcerative colitis spanish working group (GETECCU) for the treatment of perianal fistulas of Crohn’s disease. Gastroenterol Hepatol. 2020;43(3):155-168. [3] KALOGERIS T, BAINES CP, KRENZ M, et al. Ischemia/reperfusion. Compr Physiol. 2016;7:113-170. [4] BIAN F, XIAO Y, ZAHEER M, et al. Inhibition of NLRP3 Inflammasome Pathway by Butyrate Improves Corneal Wound Healing in Corneal Alkali Burn. Int J Mol Sci. 2017;18(3):562. [5] SHARMA A, TATE M, MATHEW G, et al. Oxidative Stress and NLRP3-Inflammasome Activity as Significant Drivers of Diabetic Cardiovascular Complications: Therapeutic Implications. Front Physiol. 2018;9:114. [6] SORIA-JUAN B, ESCACENA N, CAPILLA-GONZÁLEZ V, et al. Cost-effective,safe,and personalized cell therapy for critical limb ischemia in type 2 Diabetes Mellitus. Methods Mol Biol. 2009;482:281-294. [7] BROWN C, MCKEE C, BAKSHI S, et al. Mesenchymal stem cells:Cell therapy and regeneration potential. J Tissue Eng Regen Med. 2019;13(9):1738-1755. [8] LEE DE, AYOUB N, AGRAWAL DK. Mesenchymal stem cells and cutaneous wound healing: novel methods to increase cell delivery and therapeutic efficacy. Stem Cell Res Ther. 2016;7:37. [9] OZMEN S, AYHAN S, DEMIR Y, et al. Impact of gradual blood flow increase on ischaemia-reperfusion injury in the rat cremaster microcirculation model. J Plast Reconstr Aesthet Surg. 2008;61:939e48. [10] CAI L, HUANG W, LIN D. Effects of traditional Chinese medicine Shuxuetong injection on random skin flap survival in rats. ScientificWorldJournal. 2014; 2014:816545. [11] 杨志宏,上官守琴,杨萍,等.骨髓基质干细胞移植促进皮瓣缺血再灌注损伤修复的机制初步探讨[J].医学研究杂志,2013,42(2):78-81. [12] MOUSAVI M, KHANIFAR A, MOUSAVI N, et al. Coactivity of Mast Cells and Stem Cells on Angiogenesis and Antioxidants’ Potentials at Inflammation, Proliferation, and Tissue Remodeling Phases of Wound. Arch Plast Surg. 2022;49(3):462-470. [13] WANG Q, LIU T, ZHANG Y, et al. Immunomodulatory effects of human placental-derived mesenchymal stem cells on immune rejection in mouse allogeneic skin transplantation. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi. 2013;27(7):775-780. [14] JIA Z, JIAO C, ZHAO S, et al. Immunomodulatory effects of mesenchymal stem cells in a rat corneal allograft rejection model. Exp Eye Res. 2012;102: 44-49. [15] MAGGINI J, MIRKIN G, BOGNANNI I, et al. Mouse bone marrow-derived mesenchymal stromal cells turn activated macrophages into a regulatory-like profile. PLoS One. 2010;5(2):e9252. [16] REICHENBERGER MA, HEIMER S, SCHAEFER A, et al. Adipose derived stem cells protect skin flaps against ischemia-reperfusion injury. Stem Cell Rev Rep. 2012;8(3):854-862. [17] 张赛圣,程丽霞.骨髓间充质干细胞miR-126高表达在游离皮瓣移植后皮瓣血管新生中的促进作用及机制研究[J].现代医学,2018,46(2):126-130. [18] HAN HH, LIM YM, PARK SW, et al. Improved skin flap survival in venous ischemia-reperfusion injury with the use of adipose-derived stem cells. Microsurgery. 2015;35(8):645-652. [19] CAMARGO CP, KUBRUSLY MS, MORAIS-BESTEIRO J, et al. The influence of adipocyte-derived stem cells (ASCs) on the ischemic epigastric flap survival in diabetic rats. Acta Cir Bras. 2021;36(9):e360907. [20] FENG CJ, PERNG CK, LIN CH, et al. Intra-arterial injection of human adipose-derived stem cells improves viability of the random component of axial skin flaps in nude mice. J Plast Reconstr Aesthet Surg. 2020;73(3):598-607. [21] DU W, ZHANG K, ZHANG S, et al. Enhanced proangiogenic potential of mesenchymal stem cell-derived exosomes stimulated by a nitric oxide releasing polymer. Biomaterials. 2017;133:70-81. [22] HE JB, MA XY, LI WJ, et al. Exenatide inhibits necrosis by enhancing angiogenesis and ameliorating ischemia/reperfusion injury in a random skin flap rat model. Int Immunopharmacol. 2021;90:107192. [23] MAYO JS, KURATA WE, O’CONNOR KM, et al. Oxidative stress alters angiogenic and antimicrobial content of extracellular vesicles and improves flap survival. Plast Reconstr Surg Glob Open. 2019;7(12):e2588. [24] ASHINA K, TSUBOSAKA Y, KOBAYASHI K, et al. VEGF-induced blood flow increase causes vascular hyper-permeability in vivo. Biochem Biophys Res Commun. 2015;464(2):590-595. [25] LENG X, ZHANG Q, ZHAI X, et al. Local transplant of human umbilical cord matrix stem cells improves skin flap survival in a mouse model. Tohoku J Exp Med. 2012;227(3):191-197. [26] PARK IS, CHUNG PS, AHN JC. Angiogenic Synergistic Effect of Adipose-Derived Stromal Cell Spheroids with Low-Level Light Therapy in a Model of Acute Skin Flap Ischemia. Cells Tissues Organs. 2016;202(5-6):307-318. [27] CHEHELCHERAGHI F, CHIEN S, BAYAT M. Mesenchymal stem cells improve survival in ischemic diabetic random skin flap via increased angiogenesis and VEGF expression. J Cell Biochem. 2019;120(10):17491-17499. [28] NAKAGAWA T, SASAKI M, KATAOKA-SASAKI Y, et al. Intravenous Infusion of Mesenchymal Stem Cells Promotes the Survival of Random Pattern Flaps in Rats. Plast Reconstr Surg. 2021;148(4):799-807. [29] SCHLOSSER S, DENNLER C, SCHWEIZER R, et al. Paracrine effects of mesenchymal stem cells enhance vascular regeneration in ischemic murine skin. Microvasc Res. 2012;83(3):267-275. [30] CAMARGO CP, KUBRUSLY MS, MORAIS-BESTEIRO J, et al. The influence of adipocyte-derived stem cells (ASCs) on the ischemic epigastric flap survival in diabetic rats. Acta Cir Bras. 2021;36(9):e360907. [31] DING JP, CHEN B, QIAN WJ,et al. Effect of bone marrow mesenchymal stem cells on perforator skin flap survival area in rats. Br J Oral Maxillofac Surg. 2020;58(6):669-674. [32] 冯亮,樊力.骨髓间充质干细胞通过增加血管生成和血管内皮生长因子表达影响大鼠随意型皮瓣存活实验研究[J].陕西医学杂志,2022, 51(3):298-302. [33] 翟文斌.不同剂量MSCs移植促进大鼠任意皮瓣成活的实验研究[D].延安:延安大学,2013. [34] SCHNEIDER RK, PÜLLEN A, KRAMANN R, et al. Long term survival and characterisation of human umbilical cord‑derived mesenchymal stem cells on dermal equivalents. Differentiation. 2010;79:182‑193. [35] MAZINI L, ROCHETTE L, ADMOU B, et al. Hopes and Limits of Adipose-Derived Stem Cells (ADSCs) and Mesenchymal Stem Cells (MSCs) in Wound Healing. Int J Mol Sci. 2020;21(4):1306. [36] KUCIA M, RECA R, MIEKUS K, et al. Trafficking of normal stem cells and metastasis of cancer stem cells involve similar mechanisms: pivotal role of the SDF-1-CXCR4 axis. Stem Cells. 2005;23(7):879-894. [37] SELL S. On the stem cell origin of cancer.Am J Pathol. 2010;176(6):2584-494. [38] LOMBARDI F, PALUMBO P, AUGELLO FR, et al. Secretome of Adipose Tissue-Derived Stem Cells (ASCs) as a Novel Trend in Chronic Non-Healing Wounds: An Overview of Experimental In Vitro and In Vivo Studies and Methodological Variables. Int J Mol Sci. 2019;20(15):3721. [39] CHOI EW, SEO MK, WOO EY, et al. Exosomes from human adipose-derived stem cells promote proliferation and migration of skin fibroblasts. Exp Dermatol. 2018;27(10):1170-1172. [40] GIANNASI C, NIADA S, DELLA MORTE E, et al. Towards Secretome Standardization: Identifying Key Ingredients of MSC-Derived Therapeutic Cocktail. Stem Cells Int. 2021;2021:3086122. [41] BORN LJ, HARMON JW, JAY SM. Therapeutic potential of extracellular vesicle-associated long noncoding RNA. Bioeng Transl Med. 2020;5(3):e10172. [42] UEDA M, NISHINO Y. Cell-based cytokine therapy for skin rejuvenation. J Craniofac Surg. 2010;21(6):1861-1866. [43] KWON TR, OH CT, CHOI EJ, et al. Conditioned medium from human bone marrow-derived mesenchymal stem cells promotes skin moisturization and effacement of wrinkles in UVB-irradiated SKH-1 hairless mice. Photodermatol Photoimmunol Photomed. 2016;32(3):120-128. [44] COOPER DR, WANG C, PATEL R, et al. Human Adipose-Derived Stem Cell Conditioned Media and Exosomes Containing MALAT1 Promote Human Dermal Fibroblast Migration and Ischemic Wound Healing. Adv Wound Care (New Rochelle). 2018;7(9):299-308. [45] 刘美林,傅松涛,王培森,等.人脐带间充质干细胞条件培养基脂质体修复大鼠皮肤创面损伤[J].中国组织工程研究,2019,23(5):734-740. [46] 张畅.脂肪来源干细胞及其条件培养基在防治血管内皮细胞氧化应激和皮瓣缺血再灌注中的研究[D].北京:北京协和医学院,2022. [47] LA NOCE M, PAINO F, SPINA A, et al. Dental pulp stem cells: state of the art and suggestions for a true translation of research into therapy. J Dent. 2014;42(7):761-768. [48] LENER T, GIMONA M, AIGNER L, et al. Applying extracellular vesicles based therapeutics in clinical trials - an ISEV position paper. J Extracell Vesicles. 2015;4:30087. [49] PALMULLI R, VAN NIEL G. To be or not to be secreted as exosomes, a balance finely tuned by the mechanisms of biogenesis. Essays Biochem. 2018;62(2):177-191. [50] TKACH M, KOWAL J, THÉRY C. Why the need and how to approach the functional diversity of extracellular vesicles. Philos Trans R Soc Lond B Biol Sci. 2018;373(1737):20160479. [51] LI P, KASLAN M, LEE SH, et al. Progress in Exosome Isolation Techniques. Theranostics. 2017;7(3):789-804. [53] NOJIMA H, FREEMAN CM, SCHUSTER RM, et al. Hepatocyte exosomes mediate liver repair and regeneration via sphingosine-1-phosphate. J Hepatol. 2016;64(1):60-68. [53] ZHANG FX, LIU P, DING W, et al. Injectable Mussel-Inspired highly adhesive hydrogel with exosomes for endogenous cell recruitment and cartilage defect regeneration. Biomaterials. 2021;278:121169. [54] GUAN P, LIU C, XIE D, et al. Exosome-loaded extracellular matrix-mimic hydrogel with anti-inflammatory property Facilitates/promotes growth plate injury repair. Bioact Mater. 2021;10:145-158. [55] NIU Q, YANG Y, LI D, et al. Exosomes Derived from Bone Marrow Mesenchymal Stem Cells Alleviate Ischemia-Reperfusion Injury and Promote Survival of Skin Flaps in Rats. Life (Basel). 2022;12(10):1567. [56] XIE L, WANG J, ZHANG Y, et al. The effects of local injection of exosomes derived from BMSCs on random skin flap in rats.Am J Transl Res. 2019; 11(11):7063-7073. [57] 胡玄,易阳艳,朱元正,等.脂肪干细胞来源外泌体促进大鼠皮瓣移植后血管新生的研究[J].中国修复重建外科杂志,2019,33(12):1560-1565. [58] XIONG J, LIU Z, WU M, et al. Comparison of Proangiogenic Effects of Adipose-Derived Stem Cells and Foreskin Fibroblast Exosomes on Artificial Dermis Prefabricated Flaps. Stem Cells Int. 2020;2020:5293850. [59] MERINO-GONZÁLEZ C, ZUÑIGA FA, ESCUDERO C, et al. Mesenchymal Stem Cell-Derived Extracellular Vesicles Promote Angiogenesis: Potencial Clinical Application. Front Physiol. 2016;7:24. [60] ZHENG M, HUANG M, MA X, et al. Harnessing Exosomes for the Development of Brain Drug Delivery Systems. Bioconjug Chem. 2019;30(4): 994-1005. [61] YU B, ZHANG X, LI X. Exosomes derived from mesenchymal stem cells. Int J Mol Sci. 2014;15(3):4142-4157. [62] LI M, LI S, DU C, et al. Exosomes from different cells: Characteristics, modifications, and therapeutic applications. Eur J Med Chem. 2020;207: 112784. [63] DE ALMEIDA PE, RANSOHOFF JD, NAHID A, et al. Immunogenicity of pluripotent stem cells and their derivatives. Circ Res. 2013;112(3):549-561. [64] 李华.经血管内皮生长因子基因修饰的脂肪干细胞移植促进皮瓣预构的实验研究[D].广州:南方医科大学,2010. [65] 尹朝奇,周建大,罗成群,等.转染TGF-β1的骨髓间充质干细胞移植对预构皮瓣存活影响的实验研究[J].中国普通外科杂志,2016,25(6):875-881. [66] LENG X, FAN Y, WANG Y, et al. Treatment of Ischemia-Reperfusion Injury of the Skin Flap Using Human Umbilical Cord Mesenchymal Stem Cells (hUC-MSCs) Transfected with “F-5” Gene. Med Sci Monit. 2017;23:2751-2764. [67] 刘家明,孙健,马小睦,等.携带“F-5”基因片段hUC-MSCs对大鼠皮瓣缺血再灌注损伤的效果[J].青岛大学学报(医学版),2018,54(5):536-539+543. [68] 董政,常谨,樊勇乐,等.携带“F-5”基因片段人脐带间充质干细胞治疗大鼠皮瓣缺血再灌注损伤的研究[J].中国美容整形外科杂志,2019, 30(4):197-201. [69] 刘林奇.低氧预处理的人脂肪来源干细胞促进血管生成的体外实验研究[D].广州:南方医科大学,2013. [70] 宋慧芳,郭蕊,张亮.低氧预处理通过激活AKT通路提高老年hBM-MSCs对氧化应激损伤的耐受能力[J].中国病理生理杂志,2016,32(5): 912-916. [71] 宋慧芳,谈佳音,康毅,等.低氧预处理增强老年人骨髓间充质干细胞条件培养基对H9C2细胞氧化应激损伤的保护作用[J].中国组织工程研究,2022,26(1):1-6. [72] 胡玄. 低氧预处理脂肪干细胞—胞外囊泡促进皮瓣移植后血管新生的实验研究[D].南昌:南昌大学,2020. [73] BAI Y, HAN YD, YAN XL, et al. Adipose mesenchymal stem cell-derived exosomes stimulated by hydrogen peroxide enhanced skin flap recovery in ischemia-reperfusion injury. Biochem Biophys Res Commun. 2018;500(2): 310-317. [74] 刘流,刘琳,梁力川,等.IL-1β预处理脂肪间充质干细胞促进VEGF蛋白分泌和巨噬细胞M_2型极化的研究[J].四川大学学报(医学版), 2019,50(2):171-176. |
| [1] | Yang Yufang, Yang Zhishan, Duan Mianmian, Liu Yiheng, Tang Zhenglong, Wang Yu. Application and prospects of erythropoietin in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1443-1449. |
| [2] | Chen Kaijia, Liu Jingyun, Cao Ning, Sun Jianbo, Zhou Yan, Mei Jianguo, Ren Qiang. Application and prospect of tissue engineering in treatment of osteonecrosis of the femoral head [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1450-1456. |
| [3] | Yang Yifeng, Ye Nan, Wang Lin, Guo Shuaicheng, Huang Jian. Signaling pathway of dexmedetomidine against ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1464-1469. |
| [4] | Lou Guo, Zhang Yan, Fu Changxi. Role of endothelial nitric oxide synthase in exercise preconditioning-induced improvement of myocardial ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1283-1288. |
| [5] | Feng Ruiqin, Han Na, Zhang Meng, Gu Xinyi, Zhang Fengshi. Combination of 1% platelet-rich plasma and bone marrow mesenchymal stem cells improves the recovery of peripheral nerve injury [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 985-992. |
| [6] | Qiu Xiaoyan, Li Bixin, Li Jingdi, Fan Chuiqin, Ma Lian, Wang Hongwu. Differentiation of insulin-producing cells from human umbilical cord mesenchymal stem cells infected by MAFA-PDX1 overexpressed lentivirus [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1000-1006. |
| [7] | Liu Qiwei, Zhang Junhui, Yang Yuan, Wang Jinjuan. Role and mechanism of umbilical cord mesenchymal stem cells on polycystic ovary syndrome [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1015-1020. |
| [8] | Pan Xiaolong, Fan Feiyan, Ying Chunmiao, Liu Feixiang, Zhang Yunke. Effect and mechanism of traditional Chinese medicine on inhibiting the aging of mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1091-1098. |
| [9] | Liu Hanfeng, Wang Jingjing, Yu Yunsheng. Artificial exosomes in treatment of myocardial infarction: current status and prospects [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1118-1123. |
| [10] | Ma Shuwei, He Sheng, Han Bing, Zhang Liaoyun. Exosomes derived from mesenchymal stem cells in treatment of animals with acute liver failure: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1137-1142. |
| [11] | Zhang Kefan, Shi Hui. Research status and application prospect of cytokine therapy for osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(6): 961-967. |
| [12] | Wang Yeyuan, Du Yilang, Yu Dehao, Ning Fengting, Bai Bing. Effect of micro-arc oxidation treatment on biological activity of medical metals [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 771-776. |
| [13] | Wang Jiani, Chen Junyu. Angiogenesis mechanism of metal ions and their application in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 804-812. |
| [14] | Zhang Ya, Mu Qiuju, Wang Zilin, Liu Hongjie, Zhu Lili. Hydrogel loaded with platelet-rich plasma promotes wound healing in diabetic rats [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 690-696. |
| [15] | Shen Ziqing, Xia Tian, Shan Yibo, Zhu Ruijun, Wan Haoxin, Ding Hao, Pan Shu, Zhao Jun. Vascularized tracheal substitutes constructed by exosome-load hydrogel-modified 3D printed scaffolds [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 697-705. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||