Chinese Journal of Tissue Engineering Research ›› 2023, Vol. 27 ›› Issue (15): 2453-2460.doi: 10.12307/2023.614
Role of exosomes and miRNAs in the mechanism, diagnosis and treatment of premature ovarian insufficiency
Li Ran1, Jia Hongling2, Zhang Chunxiao2, Zhao Ruoxi3, Dong Jingwen1, Cheng Yixin1, Cui Wenzhe1, Zhang Jing4
- 1College of Acupuncture and Massage, 3College of Traditional Chinese Medicine, Shandong University of Traditional Chinese Medicine, Jinan 250014, Shandong Province, China; 2Department of Acupuncture and Moxibustion, Second Affiliated Hospital of Shandong University of Traditional Chinese Medicine, Jinan 250001, Shandong Province, China; 4Shandong University of Traditional Chinese Medicine, Jinan 250355, Shandong Province, China
-
Received:2022-07-04Accepted:2022-08-09Online:2023-05-28Published:2022-10-18 -
Contact:Zhang Jing, MD, Shandong University of Traditional Chinese Medicine, Jinan 250355, Shandong Province, China -
About author:Li Ran, Master candidate, College of Acupuncture and Massage, Shandong University of Traditional Chinese Medicine, Jinan 250014, Shandong Province, China -
Supported by:Key Project of Natural Science Foundation of Shandong Province, No. ZR2020KH027 (to ZJ); Shandong Provincial Key Research & Development Program, No. 2018GSF119025 (to ZJ); 2017 Shandong Provincial Postgraduate Education Quality Course Construction Project, No. SDYKC17067 (to ZJ)
CLC Number:
Cite this article
Li Ran, Jia Hongling, Zhang Chunxiao, Zhao Ruoxi, Dong Jingwen, Cheng Yixin, Cui Wenzhe, Zhang Jing. Role of exosomes and miRNAs in the mechanism, diagnosis and treatment of premature ovarian insufficiency[J]. Chinese Journal of Tissue Engineering Research, 2023, 27(15): 2453-2460.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
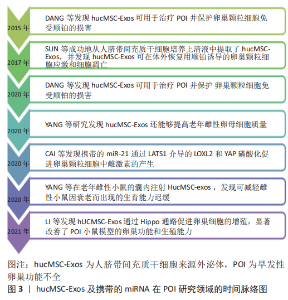
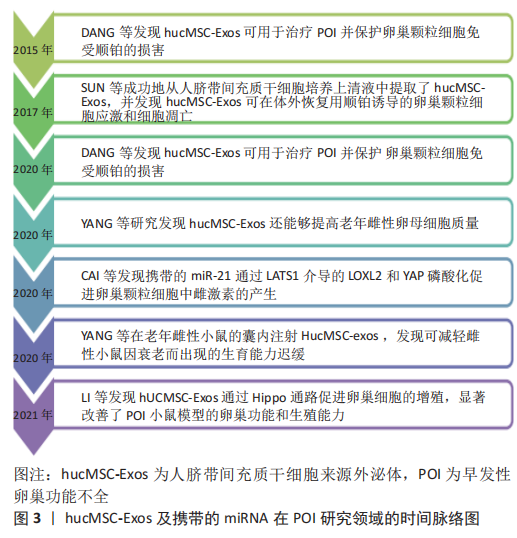
2.1 外泌体及miRNA的概述 外泌体作为信号分子的载体,是细胞间通讯和信息传递的重要方式,而且外泌体含有多种蛋白质和核酸,在周围的微环境中发挥重要作用[8]。外泌体内所含的遗传物质包括DNA和RNA,其中在靶细胞内起作用的主要是RNA。外泌体中的RNA主要包括mRNA、microRNA(miRNA)以及长链非编码RNA(long noncoding RNA,lncRNA),其中miRNA属于功能性RNA,通过在3’非翻译区mRNA和miRNAs之间形成半互补结构来调节基因表达[9],从而干预疾病的发生发展。从hucMSC-Exos及携带的miRNA研究领域的发展中,可以看出越来越多的研究人员发现了外泌体及miRNA在卵巢相关疾病中发挥的重要功能,见图3。"

2.1.1 外泌体及miRNA的形成 近年来,因间充质干细胞具有来源广泛、应用性强的特点,成为许多学者的研究热点。其中,外泌体作为细胞旁分泌的重要成分,是细胞间通讯和信息传递的重要方式。外泌体作为胞外囊泡的主要形式,广泛存在于血液、乳液、胎盘、羊水和胸腔积液等体液中[10]。外泌体的产生是一个连续的过程,包括2次胞膜内陷和胞内多囊泡体的形成,并通过与胞膜的融合和胞吐过程,进而以外泌体的形式进入细胞的外环境中[11]。外泌体通过胞吐作用将miRNA等物质分泌到细胞外环境并作用于细胞,从而调控靶细胞内的蛋白表达、细胞增殖、分化和凋亡等生理和病理。有研究发现血清和唾液的外泌体部分高度富含miRNA,并且这类RNA中的大多数不能在人体生物体液中自由循环,而是主要包裹在外泌体中[12]。由此可知,循环中的miRNA主要来源于外泌体。 2.1.2 外泌体及miRNA的潜在生物学功能 外泌体作为一种新的细胞间通讯的媒介,可以通过与配受体结合或者直接接触,发生吞噬或者融合作用,将mRNA、miRNA等物质释放出去,从而调节细胞的生物活性。有研究显示,外泌体主要通过3种机制参与细胞间通讯:①外泌体与靶细胞之间受体/配体相互作用,将信息传递给靶细胞;②外泌体膜上磷脂酰丝氨酸与活化的T淋巴细胞及巨噬细胞膜上的TIM1、TIM4等受体结合形成复合体,再与靶细胞膜上的整合素αvβ3、αvβ5结合;③靶细胞直接将外泌体内吞吸收[13]。一般来说,外泌体的功能取决于它们的母本细胞[14]。不同间充质干细胞来源外泌体表现出多种功能,如抑制受损颗粒细胞凋亡、降低卵巢活性氧水平、促进细胞增殖和抗炎作用。 在外泌体所含的生物分子中,miRNA是一类长度为22-25个碱基的单链非编码RNA,广泛存在于真核生物体内,有研究表明,miRNA可以参与卵巢颗粒细胞的增殖、分化和凋亡以及激素的代谢,并且在卵母细胞的存活和发育中发挥了重要的作用[15]。 2.2 外泌体及miRNA 在POI作用机制的研究 外泌体及miRNA能够修复组织损伤、促进器官恢复,具有良好的应用前景,深入探究其作用机制,能够为临床应用提供强有力的理论依据。 2.2.1 影响增殖 增殖是生命体最重要的特征,只有卵巢颗粒细胞和各级卵泡数目增加,卵巢功能才能够逐渐恢复。卵巢颗粒细胞的增殖在滋养卵母细胞的生长和发育方面起着至关重要的作用,并具有分泌类固醇激素以保证生殖功能的作用,这是维持卵泡正常发育的关键。因此,促进卵巢内各种细胞,特别是卵巢颗粒细胞和卵母细胞的增殖,是治疗卵巢早衰的重要途经。有研究人员发现人经血间充质干细胞来源外泌体(embryonic stem cell-derived exosomes,MenSC-Exos)通过提高卵巢生殖标记物Ki67的表达来促进体外原始和初级卵泡中卵巢颗粒细胞的增殖,并且恢复了动情周期和血清性激素水平,同时抑制卵泡凋亡,因此MenSC-Exos可以有效促进POI疾病的卵泡发育,并恢复POI大鼠的生育能力[16]。在此研究中,研究人员使用荧光标记MenSC-Exos,在双侧卵巢皮质和子宫下段检测到相应的荧光标记物,从而证实了MenSC-Exos对于卵巢皮质和子宫下段的趋向性,为外泌体的靶向治疗提供了有力的证据。 此前有研究表明,hucMSC-Exos可用于治疗POI并保护卵巢颗粒细胞免受顺铂的损害,但其中的具体机制不清[17]。另一项动物实验证明了在体内和体外动物实验中,人脐带间充质干细胞通过Hippo通路恢复卵巢颗粒细胞促卵泡激素受体表达并促进体内卵巢颗粒细胞增殖,改善POI卵巢功能和生殖能力;并且当关键的Hippo分子被阻断时,治疗结果被抑制,从而说明Hippo通路在外泌体治疗POI过程中的必要性[18]。众所周知,卵母细胞的成熟与卵泡的生长发育密切相关[19]。YANG 等[20]将新生儿卵巢与不同剂量的人脐带间充质干细胞一起培养24 h后,蛋白质印迹结果显示磷酸化Akt水平显著增加,表明原始卵泡募集的增加与外泌体对卵母细胞磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)和mTOR信号通路的刺激作用有关,并且这些通路通过外泌体的miRNA,如 miR-146a-5p或miR-21-5p发挥作用,这说明了hucMSC-Exos不是从Hippo通路这一个通路来影响卵巢功能,而是通过多种通路协同作用的结果。而后向老年小鼠囊内注射人脐带间充质干细胞,进一步证明了它们对与年龄相关的生育力下降的恢复作用,这不仅体现在卵母细胞产量的增加,而且还改善了卵母细胞的质量。这项实验验证了人脐带间充质干细胞通过卵母细胞中外泌体的特异性富集来调节休眠原始卵泡的激活。另一项动物实验选用了出生3 d的小鼠卵巢进行体外培养,加入hucMSC-Exos进行处理,经过观察发现外泌体处理后大量卵细胞中Foxo3a出核,伴有mTOR信号通路相关蛋白磷酸化程度升高,并且原始卵泡被大量激活[21];而在进一步实验中加入通路抑制剂及肝素以后,原始卵泡的激活作用可被抑制。这两项研究有力证明了hucMSC-Exos可通过影响卵母细胞的mTOR通路激活休眠的原始卵泡,增加原始卵泡的募集,从而促进卵母细胞发育,恢复小鼠的生育能力。 国内外多项研究证实,有些miRNA 的上调会使得卵巢颗粒细胞的增殖抑制,从而影响卵巢的正常生长发育。DANG等[22]发现人卵巢颗粒细胞中miR-379-5p的强制表达显著降低了多聚ADP-核糖聚合酶 1(poly ADP-ribose polymerase1,PARP1)和X射线修复补充中国仓鼠细胞6 (X-ray repair complementing defective repair in Chinese hamster cells 6,XRCC6)的 mRNA和蛋白质水平,导致卵巢颗粒细胞增殖抑制,并且检测到DNA损伤生物标志物γH2AX升高,这项研究说明miR-379-5p对DNA的修复产生了不利影响,为POI提供了新的病因学解释。张群[23]通过荧光定量PCR与细胞增殖活力检测结果证实,随着外源性miR-181a表达量的增加,小鼠卵巢颗粒细胞的增殖活力明显降低,并进一步通过miR-181a的功能缺失实验表明卵巢颗粒细胞转染50 nmol/L miR-181a inhibitor时,可显著增加卵巢颗粒细胞的增殖活力以及卵巢颗粒细胞中cyclin D2的表达。另外有两项动物实验在芯片结果中发现miR-127-5p在生化卵巢早衰患者卵巢颗粒细胞中显著上调、靶基因高迁移率组框 2 (high mobility group box 2,HMGB2)中显著下调[24-25]。体外实验表明,miR-127-5p降调HMGB2基因导致卵巢颗粒细胞增殖抑制、DNA损伤加重、修复延迟。由此可见,有些miRNA的上调能够延缓DNA的修复,加重DNA损伤,证实了DNA修复在POI 病因学中的贡献,其中涉及的深层分子机制仍需要进一步的研究。 2.2.2 抑制卵巢颗粒细胞凋亡 卵巢颗粒细胞是包裹在卵母细胞表面的壁细胞,在创造一个适合卵母细胞生长的微环境方面起着主要的作用,并且卵巢颗粒细胞具有分泌激素以维持生殖功能的能力。有研究表明卵巢颗粒细胞衰老和凋亡是卵巢储备功能下降的主要原因[26]。相应的,卵巢颗粒细胞的状态对卵泡发育很重要,从本质上减少卵巢颗粒细胞的凋亡和原始卵泡储备池的修复,是修复卵巢功能的主要机制[27]。 国内外多项研究证实外泌体及miRNA可以有效调控卵巢颗粒细胞凋亡达到治疗POI的目的。有一项动物实验发现,外泌体可以直接靶向受损的卵巢颗粒细胞,来达到治疗目的[28]。研究人员用绿色荧光标记hucMSC-Exos,发现hucMSC-Exos可以整合到受损的卵巢颗粒细胞中,从而加速卵巢从顺铂诱导的卵巢颗粒细胞应激和细胞凋亡中恢复。此外,miRNA直接靶向受损细胞时也会显著提高治疗效果。XIAO等[29]发现当miR-10a在体外直接递送至受损的卵巢颗粒细胞或化疗诱导的POI小鼠卵巢时发挥了有效的抗凋亡作用。但这项研究未深入探寻miR-10a发挥作用的潜在机制。为进一步探讨其内在机制,有研究人员在顺铂诱导的卵巢早衰小鼠模型中发现骨髓间充质干细胞来源外泌体(bone marrow mesenchymal stem cells-derived exosomes,BMSC-Exos)上调Bcl-2蛋白水平并下调c-caspase-3蛋白水平以保护卵巢颗粒细胞损伤,并且在miR-664-5p敲除后再从骨髓间充质干细胞中分离出外泌体,观察其对卵巢颗粒细胞凋亡的影响,发现顺铂诱导的早期凋亡卵巢颗粒细胞比例增加,证实BMSC-Exos中的miR-664-5p对卵巢颗粒细胞具有保护作用[30]。此研究有力地说明了调控细胞凋亡相关基因的表达是抑制卵巢颗粒细胞和卵母细胞凋亡的重要机制。另一项研究也证实了这一结论:BMSC-Exos可通过抑制卵巢颗粒细胞的凋亡起到改善卵巢早衰大鼠生殖功能的作用[31]。 统计可知,间充质干细胞来源外泌体及miRNA发挥抑制卵巢颗粒细胞凋亡的作用,主要通过3种不同的信号通路,包括PI3K/AKT信号通路、TGF-β通路和核因子κB通路。ZHANG等[32]发现在移植早期,人羊膜间充质干细胞来源外泌体显著抑制卵巢颗粒细胞凋亡,保护卵巢血管免受损伤,并参与维持受损卵巢中原始卵泡的数量。并且人羊膜间充质干细胞来源外泌体中存在富集的 miRNAs,靶基因富集在磷脂酰肌醇信号通路和凋亡通路中,这就提示人羊膜间充质干细胞来源外泌体发挥作用主要是通过这两个通路完成的。一项动物实验发现在去氧乙烯基环己烯诱导的大鼠卵巢颗粒细胞损伤模型中,脂肪间充质干细胞来源外泌体使卵巢颗粒细胞中促进凋亡基因Bax和凋亡蛋白酶Caspase3的表达水平均明显降低,而抑制凋亡基因Bcl-2的表达水平明显增加,进一步探寻其中机制发现,脂肪间充质干细胞来源外泌体可以影响凋亡与抗凋亡相关途径蛋白的表达,进而激活KIT-KITL-PI3K-AKT信号传导通路得以实现对卵巢颗粒细胞的保护作用[33]。因此,无论是人羊膜间充质干细胞来源还是脂肪间充质干细胞来源外泌体均可通过PI3K-AKT信号传导通路抑制卵巢内细胞凋亡。此外,不仅是间充质干细胞来源外泌体,还有些miRNA(如miR-21)也是通过PI3K/AKT通路调控卵巢颗粒细胞凋亡。一项移植了过表达 miR-21的间充质干细胞治疗化疗诱导的卵巢早衰的动物实验表明,过表达miR-21的间充质干细胞凋亡减少,移植细胞的活力增加[34]。miR-21组磷酸酶和张力蛋白同源物(phosphatase and tensin homolog,PTEN)和PDCD4的mRNA和蛋白表达下调,PTEN调控下游PI3K通路对卵巢颗粒细胞的增殖和凋亡有影响,体外结果也表明移植过表达miR-21的间充质干细胞对卵巢颗粒细胞的凋亡有更强的抑制作用。由此推测miR-21可能通过下调PTEN和PDCD4来抑制卵巢颗粒细胞的凋亡。并且另一项研究也证实了miR-21能部分改善化疗药物损伤的卵巢结构,这一作用与其调控靶基因PTEN、PDCD4紧密相关[35]。另一种BMSC-Exos携带的miR-144-5p对环磷酰胺损伤的卵巢颗粒细胞的治疗作用,也是通过PTEN激活PI3K/AKT途径靶向抑制环磷酰胺损伤的卵巢颗粒细胞凋亡[36]。 此外,外泌体及miRNA还能够通过其他通路调控凋亡因子的表达,从而影响卵巢功能。一项动物实验将脂肪间充质干细胞来源外泌体与POI卵巢颗粒细胞共培养,发现脂肪间充质干细胞来源外泌体可以促进卵巢颗粒细胞的增殖率并抑制细胞凋亡率;此外,脂肪间充质干细胞来源外泌体可以在体内和体外增加SMAD2、SMAD3和SMAD5的 mRNA和蛋白质表达,这表明脂肪间充质干细胞来源外泌体通过激活SMAD通路抑制Fas/FasL、caspase-3和caspase-8的表达来改善卵巢功能[37]。研究人员发现卵巢早衰患者血浆和卵巢颗粒细胞中miR-146a的上调;此外,miR-146a通过同时靶向白细胞介素1受体相关激酶(interleukin 1 receptor associated kinase,IRAK1)和肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor associated factor 6,TRAF6)来调节 toll 样受体(toll-like receptor,TLR) 信号传导,这会影响 NF-κB和IKBα的活性以及半胱天冬酶联级反应[38]。因此,miR-146a通过caspase级联途径靶向IRAK1和TRAF6对卵巢颗粒细胞的凋亡具有重要的促进作用,也表明抑制 miR-146a可能有利于卵巢早衰的治疗。由此可知,外泌体及miRNA能够通过SMAD通路和NF-κB通路改善卵巢功能。 有些miRNA在POI卵巢中高表达,会促进细胞凋亡,造成POI损伤。据一项动物研究报道,对照组和POI组卵巢外泌体中miRNA的表达谱存在显著差异,其中与凋亡相关的miR-122-5p在化疗组卵巢的外泌体中上调超过32倍,实验结果表明外泌体miR-122-5p通过靶向BCL9促进卵巢颗粒细胞的凋亡[39]。通过对比正常卵巢和化疗组卵巢的miRNA差异,可以认识到在化疗组卵巢中显著增多的miR-122-5p也许是造成POI的原因之一。 ZHAO等[40]利用细胞转染及双荧光素酶实验验证了miR-483-5p是FKBP4的上游调节因子,并且在化疗药物诱导的POI小鼠模型及POI患者血清中均高表达。另一项体内和体外实验也证实了顺铂诱导的卵巢损伤过程可能与上调的miR-483-5p靶向作用于FKBP4,进而导致的FKBP4表达下降有关[41]。这两项实验均发现了POI卵巢中另一上调的miRNA——miR-483-5p。一项研究在用pre-mir-23a转染的人卵巢颗粒细胞中观察到X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)表达和caspase-3蛋白水平降低以及切割的 caspase-3蛋白增加,同时细胞凋亡的发生率增加,miR-23a 可能通过降低人卵巢颗粒细胞中XIAP的表达在调节细胞凋亡中发挥重要作用[42]。董小敏等[43]下调miR-204-5p表达可增强人骨髓间充质干细胞对卵巢早衰大鼠卵巢结构和功能的恢复作用,抑制卵巢颗粒细胞凋亡,这可能通过下调MAPK、Bcl-2、Bax、Caspase-3基因和蛋白表达起到作用。张群[44]发现在卵巢早衰患者血清中异常高表达的miR-181a通过靶向抑制SIRT1的表达,介导FoxO1乙酰化修饰及细胞核转运,最终导致卵巢颗粒细胞凋亡。综上所述,抑制凋亡是外泌体及miRNA治疗POI的一项重要内在机制,也是外泌体及miRNA能够恢复卵巢功能的核心机制,其调控的差异,可能因为外泌体的来源不同和携带的miRNA不同,而产生不同的调控作用。 2.2.3 影响激素分泌 在哺乳动物中,卵巢卵泡的生长、排卵和黄体化受到促卵泡激素 (follicle stimulating hormone,FSH)和促黄体激素(luteinizing hormone,LH)的严格调节。促卵泡激素促进卵泡发育到排卵前阶段。促黄体激素激增迅速启动颗粒/卵丘细胞的终末分化,导致卵母细胞减数分裂成熟和卵丘扩大。为了确定miRNA对于激素分泌的影响,早在2009年,已有研究人员通过酶免疫测定法评估用80种不同的人类pre-miRNA 构建体培养的原代卵巢颗粒细胞对黄体酮、睾酮和雌二醇释放的影响,并发现36种miRNA抑制卵巢颗粒细胞中黄体酮释放,10种miRNA 促进黄体酮的释放,51种miRNA抑制雌二醇的释放[45]。越来越多的文献表明外泌体及miRNA在调控卵巢内激素分泌过程中也发挥着重要的作用。 YANG等[36]通过给POI大鼠腹腔注射BMSC-Exos进行体内治疗,发现外泌体移植可以显著恢复发情周期,增加卵巢早衰大鼠基底和窦卵泡的数量,提高雌二醇和抗苗勒管激素 (AMH)水平,并降低血清中促卵泡激素和促黄体激素的水平,可缓解环磷酰胺诱导的卵巢组织损伤。DAI等[46]发现miR-133b通过与3’UTR中的叉头盒 L2(forkhead box L2,Foxl2) mRNA种子序列结合并削弱Foxl2介导的促类固醇急性调节蛋白和CYP19A1的负转录调节来抑制人和小鼠卵巢颗粒细胞中的Foxl2表达,从而刺激雌激素的产生。有研究人员证实hucMSC-Exos携带的miR-21可以下调大肿瘤抑制因子1(large tumor suppressor 1,LATS1),从而减少磷酸化的赖氨酰氧化酶样2(lysyl oxidase like 2,LOXL2)和Yes相关蛋白(Yes-associated protein,YAP),最终促进卵巢颗粒细胞雌激素分泌[47]。因此,miR-21不仅能够通过下调PTEN和PDCD4来抑制卵巢颗粒细胞的凋亡,还能够调控赖氨酰氧化酶样2和Yes相关蛋白来刺激雌激素的分泌,可以合理地推测外泌体miRNA对于POI的治疗往往不是调控一个方面的结果,而是通过调节多个方面来达到良好的治疗效果。 另外,有学者发现有些miRNA不是单独发挥作用,相反是通过lncRNA协同调控卵巢卵泡发育[48]。该学者通过比较卵巢早衰患者与正常女性的卵巢组织发现,卵巢早衰患者卵巢组织存在多个差异表达RNA,包括20个lncRNAs、56个mRNAs和95个miRNAs;并在雌二醇中验证发现miR-204-5p可以与GCslnc-GULP1-2:1和COL3A1协同作用减少细胞增殖以及雌激素生成。 2.2.4 影响氧化应激反应 氧化应激是细胞衰老的重要原因之一。氧化应激在POI发病机制中的作用虽未得到深入研究,但已有研究显示卵巢氧化应激是原始卵泡加速衰竭的原因[49]。有研究人员通过荧光激活细胞分选(fluorescence-activated cell sorting, FACS)和免疫荧光实验发现,人羊膜间充质干细胞来源外泌体靶向SIRT4,降低了POI小鼠的卵巢颗粒细胞和卵母细胞中的氧化应激水平,并改善了卵巢重量和产仔数,而且miRNA-320a在这一过程中起关键作用[50]。DING等[7]将hucMSC-Exos添加到环磷酰胺损伤卵巢颗粒细胞的培养基中,并将混合物注射到环磷酰胺诱导的POI模型小鼠的卵巢中,然后通过小RNA测序检测hucMSC-Exos的microRNA表达谱,其研究结果阐明了miR-17-5P通过抑制SIRT7来下调 PARP1、γH2AX和XRCC6的表达和活性氧的积累。LIU等[51]发现环磷酰胺通过上调 microRNA-15b的表达从而使内源性K1 mRNA表达沉默并激活下游的TGFβ1/SMAD通路,诱导卵巢颗粒细胞凋亡和导致活性氧清除的能力降低,进而导致卵巢早衰,并发现miR-15b 通过抑制卵巢颗粒细胞中的α-Klotho表达诱导小鼠卵巢早衰。总之,通过上述研究发现化疗会引起卵巢颗粒细胞中外泌体及miRNA的变化,反之,调控外泌体及miRNA可以减轻化疗所带来的氧化还原损伤。另外,一项以纳米粒子作为miRNA载体的研究发现高脂肪和高糖饮食可以激活Dab2ip/Ask1/p38信号通路,并通过抑制内源性miR-146的表达和促进卵巢颗粒细胞衰老来诱导γH2A.X磷酸化,从而导致卵巢早衰的发展;相反以纳米粒子PLGA为载体过表达miR-146可减轻p38诱导的γH2A.X 磷酸化,延缓卵巢颗粒细胞氧化应激损伤并缓解卵巢早衰症状[52]。 2.2.5 影响炎症反应 有研究表明,POI与炎症反应密切相关[53]。在POI患者中miRNA-146 的表达下调,而白细胞介素6和肿瘤坏死因子α的表达上调,提示 miRNA-146 可以调节 TLR4和NF-κB信号通路将靶基因与炎症因子(如肿瘤坏死因子α)结合,以负反馈方式进行外来炎症反应。研究人员首次证明了miRNA-146的过表达可以刺激肿瘤坏死因子α和白细胞介素1β等炎症因子的表达,并通过触发TLR4/NF-κB信号通路从而降低NF-κB的表达。NF-κB作为一种转录因子,是慢性炎症性疾病的主要特征。因此,miRNA-146的上调可以通过TLR4和NF-κB信号通路抑制抗炎作用来改善POI患者的卵巢功能。miRNA-146家族成员被称为炎症诱导型miRNA,可以参与Toll样受体信号的负反馈调节,来调节炎症反应。从上述研究中,miRNA-146作为免疫调节因子已经成为POI疾病的新靶点。 总之,通过上述临床前研究,可知外泌体通过转运卵巢疾病相关的miRNA等活性物质,达到治疗POI的目的,这为临床治疗卵巢相关疾病提供了新的方向。表1总结了外泌体及miRNA治疗早发性卵巢功能不全的多种机制及主要治疗结果。 2.3 外泌体及miRNA在POI诊疗方面的研究 外泌体作为细胞通讯的新机制,能够靶向识别病变组织或者细胞。最近有研究发现,能够通过检测卵泡液中外泌体及miRNA的含量来进行疾病的诊断,这也使外泌体及miRNA作为疾病诊断和治疗的新型标志物发挥其重要的靶向作用[54]。当卵巢衰老时,卵巢内细胞所分泌的外泌体或miRNA会发生显著变化,例如:DA SILVEIRA等[55]收集了青年(3-12岁)母马在不同发育阶段的卵泡液,经对比发现了卵泡液中有26个miRNAs的差异表达,又在老年马(20-26岁)的卵泡液中发现了55个miRNAs的差异表达,它们参与调控卵泡中类固醇激素的合成和TGF-β信号通路等过程,与卵巢的发育和衰老密切相关。并且与正常卵巢相比,在POI卵巢的外泌体中miRNA的表达谱存在显著差异,其中与凋亡相关的miR-122-5p在化疗组卵巢的外泌体中上调超过32倍[39],印证了能够通过外泌体及miRNA的含量来进行疾病诊断的假设。反之,外泌体或miRNA可以恢复受损的卵巢组织,例如:SUN等[30]提出,BMSC-Exos携带的miR-644-5p通过靶向细胞的p53抑制卵巢颗粒细胞的凋亡,提示miR-644-5p具有治疗恢复卵巢功能的潜力。又有研究员发现,BMSC-Exos携带的miR-144-5p通过靶向PTEN改善化疗诱导的卵巢衰竭后的大鼠卵巢功能。通过上文可知,调控外泌体及miRNA的含量能够恢复卵巢功能,达到治疗疾病的目的[36]。 此外,外泌体及miRNA的发现在POI诊疗中有重要的作用,同时研究病变组织外泌体及miRNA为发现POI诊断标记物、探索新的发病机制以及开发新的诊疗措施提供可靠的技术手段和依据。ZHOU等[56]发现电针可降低POI女性的血清促卵泡激素和促黄体激素水平,提高血清雌二醇水平,并提出一个合理的假设:针灸是通过调节下丘脑-垂体-卵巢轴治疗POI疾病的。并有研究结果支持其假设,用电针刺激去卵巢的大鼠,结果显示电针治疗下调了下丘脑视前区雌激素受体的表达[57]。 同时也有类似的研究表明,低频电针改善了大鼠的发情周期并降低了下丘脑促性腺激素释放激素和雄激素受体的表达[58]。针灸作为一种良性刺激,是通过启动内源性自稳调控系统“神经-分泌-免疫”网络对机体进行多水平、多系统、多靶点的调节[59]。而外泌体作为细胞间通讯的重要媒介,为针刺信号传导中发挥着重要作用;而且外泌体的靶向调节也为针刺的“气至病所”、靶向趋病提供重要的生物学基础。此前已有研究结果显示,针刺可以调控血清中外泌体及miRNA的含量[60-61]。因此未来可以通过调控外泌体的含量来靶向控制针灸治病的效应,从而提高针灸应用水平。"

| [1] 黄燕靖,张明敏,周凡茹,等.早发性卵巢功能不全致病因素及机制研究进展[J].中西医结合研究,2022,14(1):48-51+55. [2] SULLIVAN SD, SARREL PM, NELSON LM. Hormone replacement therapy in young women with primary ovarian insufficiency and early menopause. Fertil Steril. 2016;106(7):1588-1599. [3] BOMPOULA MS, VALSAMAKIS G, NEOFYTOU S, et al. Demographic, clinical and hormonal characteristics of patients with premature ovarian insufficiency and those of early menopause: data from two tertiary premature ovarian insufficiency centers in Greece. Gynecol Endocrinol. 2020;36(8):693-697. [4] US Preventive Services Task Force, GROSSMAN DC, CURRY SJ, et al. Hormone Therapy for the Primary Prevention of Chronic Conditions in Postmenopausal Women: US Preventive Services Task Force Recommendation Statement. JAMA. 2017;318(22):2224-2233. [5] GUPTA S, LODHA P, KARTHICK MS, et al. Role of Autologous Bone Marrow-Derived Stem Cell Therapy for Follicular Recruitment in Premature Ovarian Insufficiency: Review of Literature and a Case Report of World’s First Baby with Ovarian Autologous Stem Cell Therapy in a Perimenopausal Woman of Age 45 Year. J Hum Reprod Sci. 2018;11(2):125-130. [6] TESFAYE D, GEBREMEDHN S, SALILEW-WONDIM D, et al. MicroRNAs: tiny molecules with a significant role in mammalian follicular and oocyte development. Reproduction. 2018;155(3):R121-R135. [7] DING C, ZHU L, SHEN H, et al. Exosomal miRNA-17-5p derived from human umbilical cord mesenchymal stem cells improves ovarian function in premature ovarian insufficiency by regulating SIRT7. Stem Cells. 2020;38(9):1137-1148. [8] KOWAL J, TKACH M, THÉRY C. Biogenesis and secretion of exosomes. Curr Opin Cell Biol. 2014;29:116-125. [9] SALAS-HUETOS A, JAMES ER, ASTON KI, et al.The Expression of miRNAs in Human Ovaries, Oocytes, Extracellular Vesicles, and Early Embryos: A Systematic Review. Cells. 2019;8(12):1564. [10] VLASSOV AV, MAGDALENO S, SETTERQUIST R, et al. Exosomes: current knowledge of their composition, biological functions, and diagnostic and therapeutic potentials. Biochim Biophys Acta. 2012;1820(7):940-948. [11] KALLURI R, LEBLEU VS. The biology, function, and biomedical applications of exosomes. Science. 2020;367(6478):eaau6977. [12] GALLO A, TANDON M, ALEVIZOS I, et al. The majority of microRNAs detectable in serum and saliva is concentrated in exosomes. PLoS One. 2012;7(3):e30679. [13] SUN D, ZHUANG X, ZHANG S, et al. Exosomes are endogenous nanoparticles that can deliver biological information between cells. Adv Drug Deliv Rev. 2013;65(3):342-347. [14] ZHAO AG, SHAH K, CROMER B, et al. Mesenchymal Stem Cell-Derived Extracellular Vesicles and Their Therapeutic Potential. Stem Cells Int. 2020;2020:8825771. [15] FITZGERALD JB, GEORGE J, CHRISTENSON LK. Non-coding RNA in Ovarian Development and Disease. Adv Exp Med Biol. 2016;886:79-93. [16] ZHANG S, HUANG B, SU P, et al. Concentrated exosomes from menstrual blood-derived stromal cells improves ovarian activity in a rat model of premature ovarian insufficiency. Stem Cell Res Ther. 2021;12(1):178. [17] DANG J, JIN Z, LIU X, et al. Human cord blood mononuclear cell transplantation for the treatment of premature ovarian failure in nude mice. Int J Clin Exp Med. 2015;8(3):4122-4127. [18] LI Z, ZHANG M, ZHENG J, et al. Human Umbilical Cord Mesenchymal Stem Cell-Derived Exosomes Improve Ovarian Function and Proliferation of Premature Ovarian Insufficiency by Regulating the Hippo Signaling Pathway. Front Endocrinol (Lausanne). 2021;12:711902. [19] MEHRI S, LEVI SETTI PE, GRECO K, et al. Correlation between follicular diameters and flushing versus no flushing on oocyte maturity, fertilization rate and embryo quality. J Assist Reprod Genet. 2014;31(1):73-77. [20] YANG W, ZHANG J, XU B, et al. HucMSC-Derived Exosomes Mitigate the Age-Related Retardation of Fertility in Female Mice. Mol Ther. 2020;28(4):1200-1213. [21] 杨玮杰. 人脐带间充质干细胞来源外泌体激活原始卵泡的研究[D].南京:南京医科大学,2018. [22] DANG Y, WANG X, HAO Y, et al. MicroRNA-379-5p is associate with biochemical premature ovarian insufficiency through PARP1 and XRCC6. Cell Death Dis. 2018; 9(2):106. [23] 张群. microRNA181a直接靶向acvr2a抑制小鼠卵巢颗粒细胞的增殖[D].南京:南京医科大学,2012. [24] ZHANG X, DANG Y, LIU R, et al. MicroRNA-127-5p impairs function of granulosa cells via HMGB2 gene in premature ovarian insufficiency. J Cell Physiol. 2020; 235(11):8826-8838. [25] 张新玥. MicroRNA-127-5p及环状RNA在早发性卵巢功能不全中的作用及机制研究[D].济南:山东大学,2021. [26] SANTORO N. Mechanisms of premature ovarian failure. Ann Endocrinol (Paris). 2003;64(2):87-92. [27] LIU M, QIU Y, XUE Z, et al. Small extracellular vesicles derived from embryonic stem cells restore ovarian function of premature ovarian failure through PI3K/AKT signaling pathway. Stem Cell Res Ther. 2020;11(1):3. [28] SUN L, LI D, SONG K, et al. Exosomes derived from human umbilical cord mesenchymal stem cells protect against cisplatin-induced ovarian granulosa cell stress and apoptosis in vitro. Sci Rep. 2017;7(1):2552. [29] XIAO GY, CHENG CC, CHIANG YS, et al. Exosomal miR-10a derived from amniotic fluid stem cells preserves ovarian follicles after chemotherapy. Sci Rep. 2016;6:23120. [30] SUN B, MA Y, WANG F, et al. miR-644-5p carried by bone mesenchymal stem cell-derived exosomes targets regulation of p53 to inhibit ovarian granulosa cell apoptosis. Stem Cell Res Ther. 2019;10(1):360. [31] 周政. 骨髓间充质干细胞外泌体对SD大鼠早衰卵巢影响机制研究[D].锦州:锦州医科大学,2018. [32] ZHANG Q, SUN J, HUANG Y, et al. Human Amniotic Epithelial Cell-Derived Exosomes Restore Ovarian Function by Transferring MicroRNAs against Apoptosis. Mol Ther Nucleic Acids. 2019;16:407-418. [33] 赵玮. 脂肪干细胞来源的外泌体对大鼠卵巢早衰的作用及机制研究[D].上海:中国人民解放军海军军医大学,2020. [34] FU X, HE Y, WANG X, et al. Overexpression of miR-21 in stem cells improves ovarian structure and function in rats with chemotherapy-induced ovarian damage by targeting PDCD4 and PTEN to inhibit granulosa cell apoptosis. Stem Cell Res Ther. 2017;8(1):187. [35] 李欣然,何援利,王雪峰,等.miR-21调控PTEN及PDCD4基因治疗化疗性卵巢早衰[J].现代妇产科进展,2017,26(9):661-665. [36] YANG M, LIN L, SHA C, et al. Bone marrow mesenchymal stem cell-derived exosomal miR-144-5p improves rat ovarian function after chemotherapy-induced ovarian failure by targeting PTEN. Lab Invest. 2020;100(3):342-352. [37] HUANG B, LU J, DING C, et al. Exosomes derived from human adipose mesenchymal stem cells improve ovary function of premature ovarian insufficiency by targeting SMAD. Stem Cell Res Ther. 2018;9(1):216. [38] CHEN X, XIE M, LIU D, et al. Downregulation of microRNA 146a inhibits ovarian granulosa cell apoptosis by simultaneously targeting interleukin 1 receptor associated kinase and tumor necrosis factor receptor associated factor 6. Mol Med Rep. 2015;12(4):5155-5162. [39] ZHANG X, ZHANG R, HAO J, et al. miRNA-122-5p in POI ovarian-derived exosomes promotes granulosa cell apoptosis by regulating BCL9. Cancer Med. 2022;11(12):2414-2426. [40] ZHAO H, GU W, PAN W, et al. miR-483-5p aggravates cisplatin-induced premature ovarian insufficiency in rats by targeting FKBP4. Nan Fang Yi Ke Da Xue Xue Bao. 2021;41(6):801-810. [41] 赵茴茴,古文清,潘文斌,等.miR-483-5p通过靶向FKBP4加重顺铂诱导的小鼠卵巢损伤[J].南方医科大学学报,2021,41(6):801-810. [42] YANG X, ZHOU Y, PENG S, et al. Differentially expressed plasma microRNAs in premature ovarian failure patients and the potential regulatory function of mir-23a in granulosa cell apoptosis. Reproduction. 2012;144(2):235-244. [43] 董小敏,李睿,杨进,等.miR-204-5p对卵巢早衰大鼠卵巢GCs凋亡的调控机制[J].西部医学,2021,33(5):636-643+649. [44] 张群. microRNA-181a调控卵巢颗粒细胞凋亡的机制研究[D].南京:南京大学,2015. [45] SIROTKIN AV, OVCHARENKO D, GROSSMANN R, et al. Identification of microRNAs controlling human ovarian cell steroidogenesis via a genome-scale screen. J Cell Physiol. 2009;219(2):415-420. [46] DAI A, SUN H, FANG T, et al. MicroRNA-133b stimulates ovarian estradiol synthesis by targeting Foxl2. FEBS Lett. 2013;587(15):2474-2482. [47] CAI JH, SUN YT, BAO S. HucMSCs-exosomes containing miR-21 promoted estrogen production in ovarian granulosa cells via LATS1-mediated phosphorylation of LOXL2 and YAP. Gen Comp Endocrinol. 2022;321-322:114015. [48] 徐一江. MiR-204-5p/lnc-GULP1-2:1/COL3A1协同调控卵巢早衰发生的机制研究[D].郑州:郑州大学,2017. [49] LIM J, ALI S, LIAO LS, et al. Antioxidant supplementation partially rescues accelerated ovarian follicle loss, but not oocyte quality, of glutathione-deficient mice†. Biol Reprod. 2020;102(5):1065-1079. [50] DING C, QIAN C, HOU S, et al. Exosomal miRNA-320a Is Released from hAMSCs and Regulates SIRT4 to Prevent Reactive Oxygen Species Generation in POI. Mol Ther Nucleic Acids. 2020;21:37-50. [51] LIU T, LIU Y, HUANG Y, et al. miR-15b induces premature ovarian failure in mice via inhibition of α-Klotho expression in ovarian granulosa cells. Free Radic Biol Med. 2019;141:383-392. [52] LIU T, LIN J, CHEN C, et al. MicroRNA-146b-5p overexpression attenuates premature ovarian failure in mice by inhibiting the Dab2ip/Ask1/p38-Mapk pathway and γH2A.X phosphorylation. Cell Prolif. 2021;54(1):e12954. [53] HE F, LIU Y, LI T, et al. MicroRNA-146 attenuates lipopolysaccharide induced ovarian dysfunction by inhibiting the TLR4/NF-κB signaling pathway. Bioengineered. 2022;13(5):11611-11623. [54] KOUREMBANAS S. Exosomes: vehicles of intercellular signaling, biomarkers, and vectors of cell therapy. Annu Rev Physiol. 2015;77:13-27. [55] DA SILVEIRA JC, WINGER QA, BOUMA GJ, et al. Effects of age on follicular fluid exosomal microRNAs and granulosa cell transforming growth factor-β signalling during follicle development in the mare. Reprod Fertil Dev. 2015;27(6):897-905. [56] ZHOU K, JIANG J, WU J, et al. Electroacupuncture modulates reproductive hormone levels in patients with primary ovarian insufficiency: results from a prospective observational study. Evid Based Complement Alternat Med. 2013; 2013:657234. [57] MA S, WU J, FENG Y, et al. Elevated estrogen receptor expression in hypothalamic preoptic area decreased by electroacupuncture in ovariectomized rats. Neurosci Lett. 2011;494(2):109-113. [58] FENG Y, JOHANSSON J, SHAO R, et al. Hypothalamic neuroendocrine functions in rats with dihydrotestosterone-induced polycystic ovary syndrome: effects of low-frequency electro-acupuncture. PLoS One. 2009;4(8):e6638. [59] 李柠岑,李明月,李牧洋,等.外泌体在针刺靶向趋病中的作用探讨[J].中华中医药杂志,2021,36(10):6222-6224. [60] 李牧洋,王婷婷,陈波,等.电针足三里-环跳穴对不同状态大鼠血清外泌体表达的影响[J].陕西中医,2019,40(2):139-142. [61] 班维固,滕秀英,齐辉.针灸疗法调控microRNA在基础实验中应用的研究进展[J].中医药导报,2021,27(7):138-142+147. [62] 李璐,孙博,孙莹璞.间充质干细胞来源外泌体治疗原发性卵巢功能不全机制研究进展[J].中华生殖与避孕杂志,2021,41(12):1091-1095. [63] 张秀娟,张瑞红,郝晶, 等.外泌体及其miRNA治疗化疗所致早发性卵巢功能不全的研究进展[J].现代妇产科进展,2021,30(5):389-391. |
| [1] | Nong Fuxiang, Jiang Zhixiong, Li Yinghao, Xu Wencong, Shi Zhilan, Luo Hui, Zhang Qinglang, Zhong Shuang, Tang Meiwen. Bone cement augmented proximal femoral nail antirotation for type A3.3 intertrochanteric femoral fracturalysis [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(在线): 1-10. |
| [2] | Pan Zhongjie, Qin Zhihong, Zheng Tiejun, Ding Xiaofei, Liao Shijie. Targeting of non-coding RNAs in the pathogenesis of the osteonecrosis of the femoral head [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(9): 1441-1447. |
| [3] | Liu Wentao, Feng Xingchao, Yang Yi, Bai Shengbin. Effect of M2 macrophage-derived exosomes on osteogenic differentiation of bone marrow mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(6): 840-845. |
| [4] | Li Qicheng, Deng Jin, Fu Xiaoyang, Han Na. Effects of bone marrow mesenchymal stem cells-derived exosomes on hypoxia-treated myoblasts [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(6): 853-859. |
| [5] | Wang Min, Yin Xiushan, Wang Yingxi, Zhang Yan, Zhao Long, Xia Shuyue. Inhalation of bone marrow mesenchymal stem cells-derived exosomes alleviates inflammatory injury in chronic obstructive pulmonary disease [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(6): 827-834. |
| [6] | Zhang Houjun, Deng Bowen, Jiang Shengyuan, Zhao Yi, Ren Jingpei, Xu Lin, Mu Xiaohong. Proteomic analysis of cerebrospinal fluid exosomes derived from cerebral palsy children [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(6): 903-908. |
| [7] | Gao Ting, Ma Xiaohong, Li Xiaorong. Extraction and identification of exosomes from three different sources of ovarian granulosa cells [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(6): 860-865. |
| [8] | Yuan Bo, Xie Lide, Fu Xiumei. Schwann cell-derived exosomes promote the repair and regeneration of injured peripheral nerves [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(6): 935-940. |
| [9] | Xu Qijing, Yang Yichun, Lei Wei, Yang Ying, Yu Jiang, Xia Tingting, Zhang Meng, Zhang Tao, Zhang Qian. Advances and problems in cell-free treatment of diabetic skin chronic wounds [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(6): 962-969. |
| [10] | Chen Guanting, Zhang Linqi, Li Qingru. Meta-analysis of the value of exosomal miRNA for the diagnosis of chronic kidney disease [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(6): 970-976. |
| [11] | Li Zhichao, Tan Guoqing, Su Hui, Xu Zhanwang, Xue Haipeng. Regulatory role of non-coding RNAs as potential therapeutic targets in spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(5): 758-764. |
| [12] | Shao Zichen, Li Huanan, Gu Bing, Zhang Xiaoyun, Sun Weikang, Liu Yongqian, Gan Bin. MicroRNA, long non-coding RNA and circular RNA mediate the mechanism of decreasing uric acid, anti-inflammation and regulating bone metabolism in gout [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(5): 765-771. |
| [13] | Liu Hongwen, Li Jiao, Xu Wenhao, Nie Hua, Liu Shaojiang, Xu Jie, Yin Li. Differential expression profiles of microRNAs in muscle tissue of denervated skeletal muscle atrophy rats [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(5): 732-737. |
| [14] | Zhang Weiye, Zhan Jiawen, Zhu Liguo, Wang Shangquan, Chen Ming, Wei Xu, Feng Minshan, Yu Jie, Han Tao, Cai Chuhao, Zhou Shuaiqi, Shao Chenchen. Effect of nucleus pulposus cells-derived exosomes under cyclic mechanical tension on endplate chondrocytes [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(2): 223-229. |
| [15] | Yang Jun, Li Peng. Differentiation of bone marrow mesenchymal stem cells into meniscus fibrochondrocytes induced by transforming growth factor beta [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(15): 2412-2419. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||