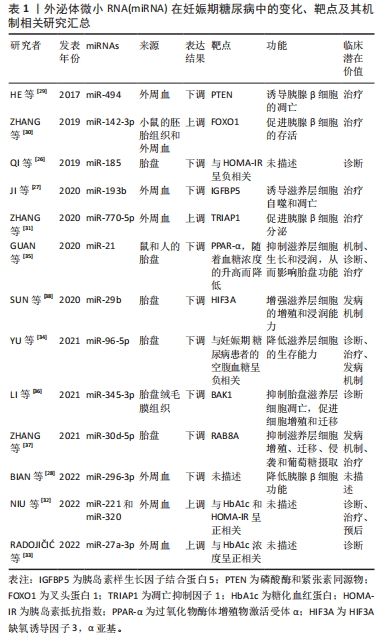
Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (31): 5070-5077.doi: 10.12307/2024.714
Previous Articles Next Articles
Role of non-coding RNA and exosomes in pathogenesis of gestational diabetes mellitus and their early diagnostic value
Hu Lingli1, Li Na2, Li Jingyang1, Zhang Eryun3, Chen Yu4, Gu Ying4
- 1Nanjing Medical University, Nanjing 211166, Jiangsu Province, China; 2Research Institute for Reproductive Health and Genetic Diseases, Wuxi Maternity and Child Health Care Hospital, Wuxi 214000, Jiangsu Province, China; 3Jiangnan University, Wuxi 214000, Jiangsu Province, China; 4Wuxi Maternity and Child Health Care Hospital Affiliated to Nanjing Medical University, Wuxi Maternity and Child Health Care Hospital, Wuxi 214000, Jiangsu Province, China
-
Received:2023-09-11Accepted:2023-10-14Online:2024-11-08Published:2024-01-23 -
Contact:Gu Ying, Master, Chief physician, Wuxi Maternity and Child Health Care Hospital Affiliated to Nanjing Medical University, Wuxi Maternity and Child Health Care Hospital, Wuxi 214000, Jiangsu Province, China -
About author:Hu Lingli, Master candidate, Nanjing Medical University, Nanjing 211166, Jiangsu Province, China -
Supported by:2021 Maternal and Child Health Research Project of Jiangsu Province, No. F202107 (to GY); Research Project of Wuxi Municipal Health Commission, No. M202217 (to GY); Youth Project of Wuxi Municipal Health Commission, No. Q202104 (to LN)
CLC Number:
Cite this article
Hu Lingli, Li Na, Li Jingyang, Zhang Eryun, Chen Yu, Gu Ying. Role of non-coding RNA and exosomes in pathogenesis of gestational diabetes mellitus and their early diagnostic value[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(31): 5070-5077.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
2.1 妊娠期糖尿病的临床诊断及不良影响 妊娠期糖尿病定义为妊娠期间首次发生或者确诊的糖耐量异常状态,其主要临床表现是糖代谢紊乱的一种内分泌代谢性疾病,妊娠期糖尿病的发生与肥胖、2型糖尿病、高龄产妇以及糖尿病家族史等因素相关。目前妊娠期糖尿病的筛查和诊断方法是在孕24-28周时进行75 g葡萄糖耐量试验:空腹血糖水平,口服葡萄糖后1 h和2 h血糖水平分别为5.1,10.0 和8.5 mmol/L,如果这3个值中的任何一个达到或超过边界水平,患者应被诊断为妊娠期糖尿病[8]。 妊娠期糖尿病影响全球5%-25%的妊娠[9],根据国际糖尿病与妊娠研究组标准,中国妊娠期糖尿病的患病率为14.8%[10]。妊娠期糖尿病会给母儿造成各种近期和远期不良影响,可能会导致新生儿发生低血糖、呼吸窘迫综合征,并且孩子在以后的生活中患有肥胖、2型糖尿病等疾病的风险增加。此外,与正常女性相比,患有妊娠期糖尿病的女性孕后患有2型糖尿病以及心血管疾病的风险增加[9]。 近年来,越来越多的研究表明妊娠期糖尿病的发生发展与外泌体功能密切相关。 2.2 外泌体的生成与功能 外泌体是一种小型的细胞外囊泡,由细胞分泌并释放到体液中[11]。外泌体的生物发生包括3个过程:内吞囊泡的形成、多囊泡体的生成和外泌体的释放[12],其中多囊泡体的去向与外泌体的产生过程相关,与多囊泡体溶酶体融合后被降解或与细胞膜融合则被释放到细胞外环境中作为外泌体[12-14]。外泌体的膜结构是具有特征性和细胞特异性膜蛋白的脂质双分子层[15],它们的内容物包括蛋白质 (如膜蛋白、胞浆和核蛋白、细胞外基质蛋白)、核酸 (如DNA,mRNA)、脂质和代谢物[10-13]。此外,外泌体膜表面可表达不同的受体。 外泌体作为细胞外环境的一部分可对细胞外环境进行重塑。此外,外泌体作为细胞间信号转导和分子传递的媒介,可以向邻近或远处的细胞输送货物 (包括蛋白质、脂质、核酸或其他细胞成分),运输的货物会因不同的生理或病理条件而变化[16-18]。外泌体表面受体对受体细胞的影响可能不同,表现为诱导细胞存活、诱导细胞凋亡以及诱导免疫调节等[14],外泌体通过运输关键蛋白和遗传物质在细胞通信和表观遗传调控中发挥重要作用[19]。 2.3 外泌体与妊娠 妊娠是一个复杂的生物学过程,涉及到胚胎着床、胚胎发育和胎盘形成等多个阶段。外泌体通过运输和传递包括蛋白质、核酸和代谢产物在内的生物分子,参与了妊娠的调控和维持。在胚胎着床过程中,外泌体被认为在胚胎与子宫内膜之间进行信息传递。研究发现,外泌体中的微小RNA可以通过转运到子宫内膜细胞中,调控基因表达,影响子宫内膜的状态,从而促进胚胎的着床。此外,外泌体中的蛋白质和细胞因子也参与了胚胎着床过程中的信号传导和细胞相互作用[20]。在妊娠过程中,外泌体还发挥着胎盘发育和功能的重要作用。研究表明,外泌体通过调控胎盘细胞的增殖、分化和凋亡等过程,参与了胎盘的形成和发育。此外,外泌体中的微小RNA和蛋白质也可以被转运到母体循环中,影响母体免疫系统的调节和母胎交流[21] 。 胎盘外泌体由各种胎盘细胞分泌,富含生长因子、DNA片段、非编码RNA和mRNA。胎盘外泌体可调节母体生理功能和胎儿发育,在胎盘与邻近或远端母体器官之间的细胞间通讯中发挥着重要作用[22],并且参与了妊娠的病理过程,如高血压疾病、妊娠期糖尿病、早产和胎膜早破。胎盘外泌体运输各种微小RNA和mRNAs,在怀孕期间胎盘外泌体运输的物质及其浓度发生变化[23]。正常孕妇的胎盘外泌体总量在母体血浆中的浓度随着妊娠进程增加了6倍,在足月时达到了最高浓度。胎盘外泌体的释放动力学和生物活性受微环境 (例如氧气压力、葡萄糖浓度和炎症)的调节。研究表明增加葡萄糖浓度会影响原代滋养层外泌体的释放速率,也会影响其含量及其对靶细胞的生物活性[23]。 然而,外泌体在妊娠中的作用还有待进一步的研究和探索。例如,外泌体在妊娠相关疾病如妊娠期糖尿病、子痫前期和胎盘功能障碍等疾病中的作用尚不清楚。文章整理了近期关于非编码RNA和外泌体在妊娠期糖尿病中的差异表达,并归纳了其靶点与功能,见图3,4。"
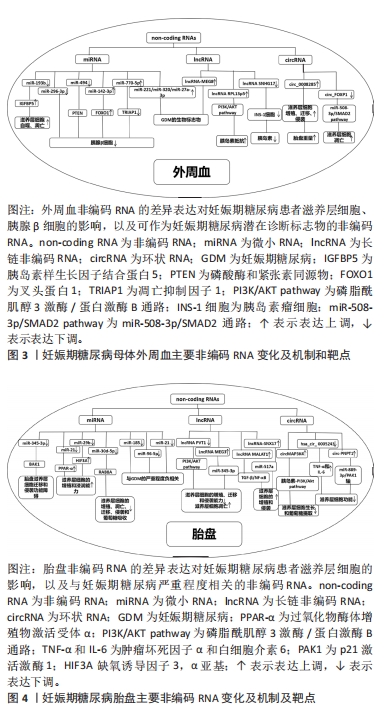
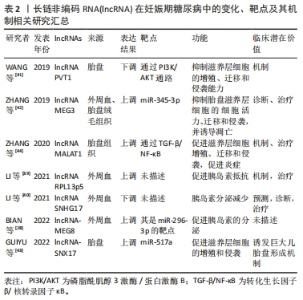
(1)外周血微小RNA与妊娠期糖尿病 外周血微小RNA与滋养层细胞障碍:妊娠期的滋养层细胞可以保证胎儿营养充足,外周血微小RNA可通过调节滋养层细胞功能影响胎儿发育,滋养层细胞可为胎儿提供营养物质和氧气维持胎儿的正常发育。研究表明miR-193b可以靶向胰岛素样生长因子结合蛋白5基因并使胰岛素样生长因子结合蛋白5上调,胰岛素样生长因子结合蛋白5参与胎儿的生长发育的调控。妊娠期糖尿病患者外周血中的miR-193b表达下调可诱导滋养层细胞自噬和凋亡[27]。滋养层细胞的自噬和凋亡是一种自我保护机制,滋养层细胞在不良环境下可通过自噬和凋亡来保护胎儿。但过度的自噬和凋亡会影响胎儿营养物质的供应,影响胎儿的生长发育。 外周血微小RNA与胰腺β细胞功能障碍:妊娠期糖尿病特点是胰岛素分泌减少或胰岛素抵抗增加,导致血糖水平的升高。妊娠中晚期,为维持正常糖代谢水平,胰岛素需求量必须相应增加。胰岛素是由胰腺β细胞分泌,但在妊娠期糖尿病患者中,外周血微小RNA的变化使胰腺β细胞的总胰岛素含量和分泌降低,从而导致胰岛素的分泌减少。研究发现妊娠期糖尿病患者外周血中miR-296-3p和miR-494表达下调。MiR-296-3p表达下调可降低胰腺β细胞的活力诱导胰岛素分泌减少,而上调miR-296-3p可逆转上述现象[28];miR-494在妊娠期糖尿病患者外周血中的表达显著下调,靶向磷酸酶和紧张素同源物,抑制胰腺β细胞的增殖并诱导细胞凋亡[29],从而抑制胰岛素分泌和总胰岛素含量。此外,部分微小RNA在妊娠期糖尿病患者外周血中呈显著上调,如miR-142-3p和miR-770-5p。ZHANG等[30]研究表明外周血叉头蛋白1在妊娠期糖尿病中表达均上调,可能减弱miR-142-3p对β细胞的促进存活作用,miR-142-3p在妊娠期糖尿病患者外周血中呈代偿性升高,其与叉头蛋白1的共调控失衡致胰腺β细胞数量减少;有研究发现[31]外周血miR-770-5p在妊娠期糖尿病患者中表达上调,miR-770-5p通过靶向凋亡抑制因子1诱导胰腺β细胞凋亡,减少胰岛素分泌。 外周血微小RNA与糖尿病妊娠期血糖的关系:部分微小RNA可以直接或间接反映妊娠期糖尿病患者妊娠期间的血糖水平。糖化血红蛋白是一种血红蛋白的衍生物,可反映过去两三个月内平均血糖的水平,NIU等[32]研究表明血浆miR-221和miR-320在妊娠期糖尿病中显著升高,且与糖化血红蛋白和胰岛素抵抗指数呈正相关,这表明miR-221和miR-320的高表达可能与妊娠期糖尿病的血糖控制和胰岛素抵抗有关。RADOJI?I?等[33]研究发现,与健康对照组相比,诊断为妊娠期糖尿病的患者中外周血miR-27a-3p的表达明显更高,且与糖化血红蛋白水平呈直接相关性,故而提示可通过检测miR-27a-3p的表达水平筛查妊娠期糖尿病,其具备妊娠期糖尿病筛查的生物标志物潜质。 (2)胎盘微小RNA与妊娠期糖尿病 胎盘微小RNA与妊娠期糖尿病严重程度的关系:微小RNA水平高低被报道与妊娠期糖尿病的严重程度相关。例如,QI等[26]研究表明重度妊娠期糖尿病组的胎盘miR-185水平显著低于对照组和轻度妊娠期糖尿病组,这表明miR-185的下调与妊娠期糖尿病的严重程度有关,并可能参与妊娠期糖尿病的发生和发展;有研究表明胎盘miR-96-5p表达水平与妊娠期糖尿病患者的空腹血糖水平呈负相关,并用ROC曲线分析表明miR-96-5p可以作为妊娠期糖尿病的诊断生物标志物,具有高灵敏度和特异性[34]。还有研究通过检测大鼠胎盘中miR-21的水平表明miR-21的变化与血糖浓度显著相关[35]。 胎盘微小RNA与滋养层细胞功能损伤:滋养层细胞作为胎盘中一种重要的细胞类型,对胎盘功能的维持起着重要作用。滋养层细胞具有迁移和侵袭功能,这种迁移和侵袭可受到胎盘微小RNA的影响,从而诱导胎盘功能障碍。具体来说,一些微小RNA可以抑制滋养层细胞的迁移和侵袭功能,无法维持胎盘的正常功能。另一些微小RNA可以促进滋养层细胞的迁移和侵袭功能,但过度的迁移和侵袭功能可导致胎盘的异常增生,进而引发胎盘相关疾病。有研究结果表明,妊娠期糖尿病患者胎盘组织中miR-345-3p,miR-29b,miR-96-5p和miR-30d-5p的表达水平都发生了变化。妊娠期糖尿病患者胎盘组织miR-345-3p表达下调,然而在妊娠期间胎盘miR-345-3p的高表达通过抑制胎盘滋养层细胞凋亡和通过靶向BAK1促进细胞增殖和迁移发挥保护作用,因此,胎盘组织miR-345-3p表达下调可能介导了妊娠期糖尿病胎盘滋养层细胞迁移和侵袭功能障碍[36];研究发现miR-96-5p水平显著降低导致滋养层细胞的生存能力下降[34];miR-30d-5p表达下调,并通过靶向RAB8A影响滋养层细胞的增殖、凋亡、迁移、侵袭和葡萄糖吸收能力[37]。此外,动物实验研究也证实了此结果[34]。在妊娠期糖尿病大鼠模型中,miR-21表达的降低导致胎盘滋养层细胞过氧化物酶体增殖物激活受体α表达的增加,从而抑制滋养层细胞的生长和浸润,影响滋养层细胞的功能。以上胎盘微小RNA的变化均导致滋养层细胞迁移和侵袭能力降低。然而miR-29b的表达下调通过介导缺氧诱导因子3,α亚基上调,增强滋养层细胞的增殖和浸润能力,导致胎盘异常增生影响正常的功能[38]。这些研究发现表明微小RNA在妊娠期糖尿病胎盘功能中的重要作用。 2.4.2 长链非编码RNA与妊娠期糖尿病 长链非编码RNA是指长度超过200个核苷酸的 RNA,其特征是低水平的序列保守和表达,具有有限的蛋白质编码潜力[28],其表达稳定、特异性强,不易被破坏,在血、尿中表达稳定。大量的研究表明,长链非编码RNA能以RNA的形式通过表观遗传、转录以及转录后水平调控基因的表达,参与调控心血管疾病、肿瘤、泌尿系统疾病和代谢性疾病等多种生命体疾病的发生发展过程。迄今为止,已有部分研究涉及长链非编码RNA在妊娠期糖尿病和胰岛素抵抗中的作用[39]。 (1)外周血长链非编码RNA与妊娠期糖尿病 外周血长链非编码RNA通过磷脂酰肌醇3激酶/蛋白激酶B通路诱导胰岛素抵抗:胰岛素抵抗是妊娠期糖尿病可能的机制之一,胰岛素抵抗是指机体对胰岛素的敏感性降低,胰岛素无法有效将葡萄糖转运至细胞内,从而导致机体血糖水平升高。近年来的研究表明,长链非编码RNA在胰岛素抵抗和妊娠期糖尿病中起着重要的作用。LI等[39]研究表明与妊娠期糖尿病胰岛素信号通路相关的长链非编码RNA转录本主要富集于磷脂酰肌醇3激酶/蛋白激酶B信号通路和胰岛素信号通路。长链非编码RNA RPL13P5通过磷脂酰肌醇3激酶/蛋白激酶B通路和胰岛素信号通路与TSC2基因形成共表达网络,参与妊娠期糖尿病胰岛素抵抗过程,长链非编码RNA RPL13P5在妊娠期糖尿病患者中显著过表达可能通过磷脂酰肌醇3激酶/蛋白激酶B信号通路促进胰岛素抵抗。 靶向长链非编码RNA可能为妊娠期糖尿病的诊断与治疗提供新的思路:有研究表明,外周血中长链非编码RNA SNHG17在妊娠期糖尿病中表达显著下调,下调的SNHG17可以抑制胰岛素瘤细胞的生长,降低胰岛素分泌,靶向SNHG17的分子治疗可能成为妊娠期糖尿病的一种新的替代治疗方法[40]。作为一种稳定且可测量的RNA,长链非编码RNA RPL13P5可能通过互补非编码RNA表达的下调和抑制非编码RNA的过表达来治疗疾病[39]。外周血中长链非编码RNA的浓度变化可以为妊娠期糖尿病的诊断提供新的诊断标志物,BIAN等[28]通过研究长链非编码RNA-MEG8在妊娠期糖尿病与正常孕妇外周血中的表达,发现长链非编码RNA-MEG8作为miR-296-3p的靶基因在妊娠期糖尿病组明显升高,这使得长链非编码RNA-MEG8可能作为妊娠期糖尿病潜在的早期筛查指标。 (2)胎盘长链非编码RNA调控妊娠期糖尿病胎盘滋养层细胞增殖迁移:胎盘长链非编码RNA可通过影响滋养层细胞的增殖和凋亡进而调控胎盘功能。一些长链非编码RNA的改变导致滋养层细胞的凋亡,滋养层细胞的减少可影响胎盘的发育和功能,进而影响胎儿营养物质的传输和代谢的调节。有研究表明在妊娠期糖尿病胎盘中低表达的长链非编码RNA PVT1可以通过抑制磷脂酰肌醇3激酶/蛋白激酶B通路而显著抑制滋养层细胞的增殖、迁移和侵袭能力,并显著促进滋养层细胞凋亡[41]。ZHANG等[42]研究的长链非编码RNA MEG3在妊娠期糖尿病胎盘中通过靶向miR-345-3p调控人类绒毛膜滋养层细胞的迁移和侵袭,并诱导滋养层细胞凋亡。此外,长链非编码RNA的改变也可促进滋养层细胞的增殖,滋养层细胞过度增殖可使胎盘体积与重量增加异常,如长链非编码RNA-SNX17被发现在妊娠期糖尿病诱导的巨大儿胎盘中上调,长链非编码RNA-SNX17通过与miR-517a结合,降低胰岛素生长因子1来促进滋养层的侵袭和增殖[43]。 长链非编码RNA MALAT1在妊娠期糖尿病胎盘组织中的上调也会促进滋养层细胞的增殖、侵袭和迁移,并且体外小干扰RNA实验表明长链非编码RNA MALAT1下调可能通过调控转化生长因子β/核转录因子κB信号通路抑制炎症,抑制妊娠期糖尿病胎盘滋养层细胞增殖、侵袭和迁移,从而维持胎盘的正常生长发育[44]。 文章总结了长链非编码RNA在妊娠期糖尿病中的变化、靶点及其机制,见表2。"


2.4.3 环状RNA与妊娠期糖尿病 环状RNA是一类在真核细胞中广泛表达的内源性非编码RNA,其来源于mRNA序列的“反向剪接”过程,3’和5’末端之间的共价结合。与其他RNA相比,环状RNA更丰富、更特异及组织性更高[45]。环状RNA具有多种分子功能,比如作为微小RNA海绵,转录和调节基因表达和编码蛋白质[46]。值得一提的是,环状RNA在细胞外环境中具有稳定性,不易受RNA酶活性、突然的温度变化和极端pH值的影响,因此它们不仅作为细胞外分子非常稳定,也能够作为诊断、预后和治疗生物标志物。近年研究发现,环状RNA参与了恶性肿瘤、代谢性疾病和心脑血管疾病等的发生发展,并有潜力作为早期诊断的分子标记物。环状RNA与妊娠期糖尿病关系密切,其在正常和妊娠期糖尿病孕妇血清、胎盘组织和脐血中具有明显表达差异[47-53],见表3。"


(1)外周血环状RNA与妊娠期糖尿病滋养层细胞损伤:妊娠期糖尿病患者外周血环状RNA的表达与正常孕妇的表达差异提示外周血环状RNA可能参与妊娠期糖尿病的发生发展。在高糖环境中,滋养层细胞的功能受损,从而影响胎盘的功能。CHEN等[47]报道在高血糖环境,滋养层细胞的增殖增加,妊娠期糖尿病患者胎盘质量更大,体外实验也证实胎盘质量的异常增加是因上调的circ_0008285可促进滋养层细胞的增殖、迁移和侵袭。并有研究表明circ_FOXP1通过靶向miR-508-3p/SMAD2途径保护滋养层细胞免受高糖损伤,高糖环境下circ_FOXP1的表达下调也可诱导滋养层细胞的损伤[48]。 (2)胎盘环状RNA与妊娠期糖尿病滋养层细胞增殖迁移与代谢:随着高通量测序应用的增加,妊娠期糖尿病患者胎盘中发现了大量失调的环状RNA。WANG等[49]在妊娠期糖尿病患者胎盘中检测到46种差异表达的环状RNA,而YAN等[50]在妊娠期糖尿病患者胎盘绒毛中检测到482种异常表达的环状RNA。有研究用实时荧光定量PCR技术证实胎盘组织中circ_5824,circ_3636和circ_0395的表达与RNA组测序技术与分析一致[49]:即妊娠期糖尿病组的表达水平显著低于正常组的结论。与胎盘微小RNA和长链非编码RNA一样,胎盘环状RNA也会影响滋养层细胞的作用:如有研究发现妊娠期糖尿病患者中hsa_cir_ 0005243的低表达可抑制滋养层细胞的增殖及迁移,并诱导滋养层细胞的凋亡[51];CHEN等[52]研究表明circ-PNPT1通过miR-889-3p/PAK1轴促进高糖诱导的滋养层细胞细胞增殖和迁移和侵袭能力减弱,细胞凋亡率增加。此外,滋养层细胞功能障碍不仅表现在增殖、迁移和凋亡的变化,滋养层细胞的代谢水平如葡萄糖代谢也会影响滋养层细胞的生长,进而影响滋养层细胞的功能,如DU等[53]研究表明circMAP3K4上调通过miR-6795-5p/PTPN1轴抑制胰岛素-磷脂酰肌醇3激酶/蛋白激酶B信号通路,进而抑制妊娠期糖尿病期间滋养层细胞的葡萄糖摄取和细胞生长,促进妊娠期糖尿病的发展。 2.4.4 外泌体非编码RNA与妊娠期糖尿病 近年来研究发现外泌体非编码RNA参与妊娠期糖尿病的发生发展。 (1)外泌体微小RNA与妊娠期糖尿病 外周血外泌体微小RNA影响妊娠期糖尿病血糖水平和葡萄糖糖稳态:如YE等[54]通过高通量小RNA测序表明,外周血外泌体中上调的miR-423-5p可以靶向胰岛素样生长因子1受体和人糖原合成酶1影响妊娠期糖尿病患者的水平,其中胰岛素样生长因子1受体与胰岛素受体高度同源,抑制胰岛素样生长因子1受体可能会损害胰岛素信号通路,人糖原合成酶1的下调导致糖原合成酶的低表达,从而影响葡萄糖稳态;下调的miR-122-5p可以靶向葡萄糖-6-磷酸酶3和法尼基二磷酸法尼基转移酶1,葡萄糖-6-磷酸酶3和法尼基二磷酸法尼基转移酶1与胰岛素和腺苷酸激活蛋白激酶信号通路相关,表明葡萄糖-6-磷酸酶3和法尼基二磷酸法尼基转移酶1可能参与妊娠期糖尿病的代谢调节。FILARDL等[55]研究表明外周血外泌体miR-222-3p的表达与妊娠期糖尿病患者的血糖水平呈正相关,miR-222-3p与妊娠期葡萄糖代谢之间存在潜在联系;miR-409-3p表达与空腹血糖、糖化血红蛋白和胰岛素抵抗稳态模型评估之间也有显著的正相关,miR-409-3p可能参与葡萄糖稳态。妊娠期糖尿病患者外周血外泌体中miR-122-5p,miR-132-3p,miR-29b-3p,miR-182-3p和miR-29a-3p上调可参与胰岛素抵抗,从而影响妊娠期糖尿病患者的血糖水平[7]。此外妊娠期糖尿病患者外周血外泌体中高表达的微小RNA-144通过靶向胰岛素受体底物1调节胰腺β细胞的发育和能量稳态参与能量代谢[56]。 胎盘来源的外泌体微小RNA可通过影响胎盘功能参与妊娠期糖尿病的发生发展:妊娠期糖尿病胎盘外泌体中过度表达的miR-135a-5p通过去乙酰化酶 1促进磷脂酰肌醇3激酶/蛋白激酶B通路活性,导致滋养层细胞的增殖、侵袭和迁移功能异常,从而使胎盘功能发生障碍[57]。ZHANG等[56]研究表明胎盘外泌体miR-125b在妊娠期糖尿病中低表达可通过增加β细胞“不允许基因”c-Maf转录的表达,抑制SIRT7 的表达,从而促进高血糖。此外,miR-140-3p和miR-574-3p的表达水平与趋化素呈负相关,妊娠期糖尿病胎盘外泌体中miR-140-3p和miR-574-3p下调,致使趋化素通过巨噬细胞的募集和白细胞介素18和白细胞介素1β的释放诱导胎盘炎症,从而促进妊娠期糖尿病中脐静脉内皮细胞的增殖、迁移和管状形成[58]。HERRERA-VAN OOSTDAM等[59]通过妊娠期糖尿病患者尿液中提取胎盘外泌体非编码RNA发现妊娠中期妊娠期糖尿病患者miR-16-5p的上调会导致胰岛素受体底物1和胰岛素受体底物2的负调控,从而导致Wnt/β-catenin信号传导异常,妊娠中期miR-16-5p的表达可能是妊娠期糖尿病妇女胰岛素抵抗的重要分子机制。 (2)外泌体长链非编码RNA和环状RNA与妊娠期糖尿病:目前,针对外周血外泌体长链非编码RNA和环状RNA与妊娠期糖尿病相关性及机制的研究较少。TANG等[60]报道妊娠期糖尿病的外周血外泌体长链非编码RNA GAS5下调,提高了其与HERC5的对接亲和力,TAC1与HERC5具有结构相互作用,研究推测GAS5/HERC5/TAC1相互作用可能在妊娠期糖尿病的发生发展中发挥重要作用。除上述外泌体长链非编码RNA,外泌体环状RNA同样被报道参与妊娠期糖尿病的发生发展。如 JIANG等[61]研究发现妊娠期糖尿病孕妇在分娩前不同妊娠阶段外周血外泌体hsa_环状RNA_0039480表达水平均高于正常孕妇,表明hsa_环状RNA_0039480可作为可作为妊娠期糖尿病的早期检测生物标志物。胎盘来源的外泌体环状RNA可影响胎盘的功能和炎症,有研究表明胎盘来源的外泌体circ_0001578的下调可能通过转化生长因子β/核转录因子κB和氨基末端激酶途径诱导胎盘慢性炎症[62]。另有研究表明胎盘外泌体circ-PNPT1在妊娠期糖尿病和高糖诱导的滋养细胞胎盘组织中高表达通过miR-889-3p/p21蛋白激活激酶1轴抑制高糖诱导的滋养细胞增殖、迁移和侵袭,因为高糖处理可诱导滋养层细胞凋亡,抑制滋养层细胞的活力、侵袭和迁移,降低circ-PNPT1的表达显著逆转了高糖介导的滋养细胞功能障碍[63];以上研究均提示外泌体长链非编码RNA和环状RNA与妊娠期糖尿病的病理生理学相关。 2.4.5 非编码RNA在妊娠期糖尿病诊断中的临床价值 目前研究人员正探索早期诊断妊娠期糖尿病的方法,其中非编码RNA有巨大的潜力。许多研究将微小RNA作为妊娠期糖尿病的早期诊断生物标志物。细胞外微小RNA存在于血液中,可以在临床中快速量化。这一特性使得微小RNA作为临床诊断妊娠期糖尿病的生物标志物成为可能。例如,ZHU等[64]研究发现miR-16-5p,miR-17-5p,miR-19a-3p,miR-19b-3p和miR-20a-5p在16-19周的妊娠期糖尿病外周血中即呈现上升,这比通常在24-28周采用葡萄糖耐量试验确诊妊娠期糖尿病的时间有了显著提前,因此这些微小RNA被认为可以预测妊娠早期的妊娠期糖尿病。另一项研究进一步表明miR-16-5p,miR-17-5p和miR-20a-5p的ROC曲线下面积分别为0.92 (95%CI:0.871-0.984)、0.88 (95%CI:0.798-0.962)和0.74 (95%CI:0.618-0.870)[65],进一步支持了这些微小RNA作为妊娠期糖尿病早期诊断的临床价值。YOFFE等[66]评估了妊娠早期母体血清微小RNA作为妊娠期糖尿病患者新的早期诊断生物标志物的潜力,发现miR-223和miR-23a在妊娠期糖尿病组显著增加,且相对于miR-23a,miR-223的分类效果略好于miR223+miR-23a或单独使用miR-23a。其中miR-223的ROC曲线下面积值为0.94;miR-23a的ROC曲线下面积值为0.89;miR-223+miR-23a的ROC曲线下面积值为 0.91。这些微小RNA可能成为新的外周血早期诊断生物标志物,并有潜力发展成为妊娠期糖尿病患者新的介入靶点。 除微小RNA外,还有少数研究探索了长链非编码RNA、环状RNA和外泌体作为妊娠期糖尿病早期诊断生物标志物的价值。例如,长链非编码RNA MEG8可能是早期诊断妊娠期糖尿病的生物标志物。ZHANG等[67]进行的一项研究表明,孕前血浆中长链非编码RNA MEG8水平较高的患者在妊娠期间患妊娠期糖尿病的发病率较高,而在妊娠期糖尿病诊断前1个月的长链非编码RNA MEG8血浆水平足以区分妊娠期糖尿病患者和健康对照组。此外,环状RNA也有潜力成为妊娠期糖尿病的诊断生物标志物。例如,YANG等[68]报道hsa_环状RNA_102893在外周血中表达下调,有助于早期发现妊娠期糖尿病,其在训练集和测试集的ROC曲线下面积分别为0.806和0.741。此外,hsa_环状RNA_0054633在妊娠中期的ROC曲线下面积为0.793,其最佳敏感性和特异性分别为57.6%和90.9%[69]。外泌体也可能成为妊娠期糖尿病新的早期诊断生物标志物。提取自孕中期尿液胎盘来源的外泌体显示,miR-16-5p,miR-517-3p和miR-518-5p的ROC曲线下面积为1,表明这些外泌体微小RNA在区分正常和妊娠期糖尿病中具有很高的诊断准确性[60]。 文章最后总结了外泌体非编码RNA在妊娠期糖尿病中的变化、靶点及其机制,见表4。"

| [1] MOON JH, JANG HC. Gestational diabetes mellitus: diagnostic approaches and maternal-offspring complications. Diabetes Metab J. 2022;46(1):3-14. [2] MCINTYRE HD, CATALANO P, ZHANG C, et al. Gestational diabetes mellitus. Nat Rev Dis Primers. 2019;5(1):47. [3] ZHAO C, DONG J, JIANG T, et al. Early second-trimester serum miRNA profiling predicts gestational diabetes mellitus. PLoS One. 2011;6(8):e23925. [4] CHEN LL. The biogenesis and emerging roles of circular RNAs. Nat Rev Mol Cell Biol. 2016;17(4):205-211. [5] XU YX, PU SD, LI X, et al. Exosomal ncRNAs: novel therapeutic target and biomarker for diabetic complications. Pharmacol Res. 2022;178:106135. [6] ILJAS JD, GUANZON D, ELFEKY O, et al. Review: Bio-compartmentalization of microRNAs in exosomes during gestational diabetes mellitus. Placenta. 2017;54:76-82. [7] GILLET V, OUELLET A, STEPANOV Y, et al. miRNA profiles in extracellular vesicles from serum early in pregnancies complicated by gestational diabetes mellitus. J Clin Endocrinol Metab. 2019;104(11):5157-5169. [8] GAO C, SUN X, LU L, et al. Prevalence of gestational diabetes mellitus in mainland China: a systematic review and meta-analysis. J Diabetes Investig. 2019;10(1):154-162. [9] VINCE K, PERKOVIC P, MATIJEVIC R. What is known and what remains unresolved regarding gestational diabetes mellitus (GDM). J Perinat Med. 2020;48(8):757-763. [10] JUAN J, YANG H. Prevalence, prevention, and lifestyle intervention of gestational diabetes mellitus in China. Int J Environ Res Public Health. 2020;17(24):9517. [11] DOYLE LM, WANG MZ. Overview of extracellular vesicles, their origin, composition, purpose, and methods for exosome isolation and analysis. Cells. 2019;8(7):727. [12] WEI H, CHEN Q, LIN L, et al. Regulation of exosome production and cargo sorting. Int J Biol Sci. 2021;17(1):163-177. [13] JADLI AS, BALLASY N, EDALAT P, et al. Inside(sight) of tiny communicator: exosome biogenesis, secretion, and uptake. Mol Cell Biochem. 2020;467(1-2):77-94. [14] KALLURI R, LEBLEU VS. The biology, function, and biomedical applications of exosomes. Science . 2020;367(6478):eaau6977. [15] GURUNG S, PEROCHEAU D, TOURAMAINDOU L, et al. The exosome journey: from biogenesis to uptake and intracellular signalling. Cell Commun Signal. 2021;19(1):47. [16] PEGTEL DM, GOULD SJ. Exosomes. Annu Rev Biochem. 2019;88:487-514. [17] SHAO J, ZARO J, SHEN Y. Advances in exosome-based drug delivery and tumor targeting: from tissue distribution to intracellular fate. Int J Nanomedicine. 2020;15:9355-9371. [18] LI SP, LIN ZX, JIANG XY, et al. Exosomal cargo-loading and synthetic exosome-mimics as potential therapeutic tools. Acta Pharmacol Sin. 2018;39(4):542-551. [19] YANG D, ZHANG W, ZHANG H, et al. Progress, opportunity, and perspective on exosome isolation - efforts for efficient exosome-based theranostics. Theranostics. 2020;10(8):3684-3707. [20] SIMON C, GREENING DW, BOLUMAR D, et al. Extracellular vesicles in human reproduction in health and disease. Endocr Rev. 2018;39(3):292-332. [21] GHAFOURIAN M, MAHDAVI R, AKBARI JONOUSH Z, et al. The implications of exosomes in pregnancy: emerging as new diagnostic markers and therapeutics targets. Cell Commun Signal. 2022;20(1):51. [22] HERRERA-VAN OOSTDAM AS, SALGADO-BUSTAMANTE M, LOPEZ JA, et al. Placental exosomes viewed from an ‘omics’ perspective: implications for gestational diabetes biomarkers identification. Biomark Med. 2019;13(8):675-684. [23] JIN J, MENON R. Placental exosomes: a proxy to understand pregnancy complications. Am J Reprod Immunol. 2018;79(5):e12788. [24] CORREIA DE SOUSA M, GJORGJIEVA M, DOLICKA D, et al. Deciphering miRNAs’ Action through miRNA Editing. Int J Mol Sci. 2019;20(24):6249. [25] LU TX, ROTHENBERG ME. MicroRNA. J Allergy Clin Immunol. 2018;141(4):1202-1207. [26] QI S, WANG X. Decreased expression of miR-185 in serum and placenta of patients with gestational diabetes mellitus. Clin Lab. 2019. doi:10.7754/Clin.Lab. 2019.190445. [27] JI Y, ZHANG W, YANG J, et al. MiR-193b inhibits autophagy and apoptosis by targeting IGFBP5 in high glucose-induced trophoblasts. Placenta. 2020;101:185-193. [28] BIAN G, XUE Y, LIU Y, et al. Role of lncRNA-MEG8/miR-296-3p axis in gestational diabetes mellitus. Nephrology (Carlton). 2022;27(12):994-1002. [29] HE Y, BAI J, LIU P, et al. miR-494 protects pancreatic β-cell function by targeting PTEN in gestational diabetes mellitus. EXCLI J. 2017;16:1297-307. [30] ZHANG T, JI C, SHI R. miR-142-3p promotes pancreatic β cell survival through targeting FOXO1 in gestational diabetes mellitus. Int J Clin Exp Pathol. 2019;12(5):1529-1538. [31] ZHANG YL, CHEN XQ. Dysregulation of microRNA-770-5p influences pancreatic-β-cell function by targeting TP53 regulated inhibitor of apoptosis 1 in gestational diabetes mellitus. Eur Rev Med Pharmacol Sci. 2020;24(2):793-801. [32] NIU S, YU K, WANG W, et al. The expression and clinical value of miR-221 and miR-320 in the plasma of women with gestational diabetes mellitus. Clin Lab. 2022. doi:10.7754/Clin.Lab. 2021.210927. [33] RADOJICIC O, DOBRIJEVIC Z, ROBAJAC D, et al. Gestational diabetes is associated with an increased expression of miR-27a in peripheral blood mononuclear cells. Mol Diagn Ther. 2022;26(4):421-435. [34] YU X, LIU Z, FANG J, et al. miR-96-5p: a potential diagnostic marker for gestational diabetes mellitus. Medicine (Baltimore). 2021;100(21):e25808. [35] GUAN CY, TIAN S, CAO JL, et al. Down-regulated miR-21 in gestational diabetes mellitus placenta induces PPAR-α to inhibit cell proliferation and infiltration. Diabetes Metab Syndr Obes. 2020;13:3009-3034. [36] LI Y, ZHUANG J. miR-345-3p serves a protective role during gestational diabetes mellitus by targeting BAK1. Exp Ther Med. 2021;21(1):2. [37] ZHANG L, LI K, TIAN S, et al. Down-regulation of microRNA-30d-5p is associated with gestational diabetes mellitus by targeting RAB8A. J Diabetes Complications. 2021;35(8):107959. [38] SUN DG, TIAN S, ZHANG L, et al. The miRNA-29b is downregulated in placenta during gestational diabetes mellitus and may alter placenta development by regulating trophoblast migration and invasion through a HIF3A-dependent mechanism. Front Endocrinol (Lausanne). 2020;11:169. [39] LI Y, CHENG X, LI D. LncRNA RPL13p5 gene expression promotes insulin resistance in patients with gestational diabetes. Ann Palliat Med. 2021;10(10):11024-11034. [40] LI J, DU B, GENG X, et al. lncRNA SNHG17 is downregulated in gestational diabetes mellitus (GDM) and has predictive values. Diabetes Metab Syndr Obes. 2021;14:831-838. [41] WANG Q, LU X, LI C, et al. Down-regulated long non-coding RNA PVT1 contributes to gestational diabetes mellitus and preeclampsia via regulation of human trophoblast cells. Biomed Pharmacother. 2019;120:109501. [42] ZHANG H. Mechanism associated with aberrant lncRNA MEG3 expression in gestational diabetes mellitus. Exp Ther Med. 2019;18(5):3699-3706. [43] GUIYU S, QUAN N, RUOCHEN W, et al. LncRNA-SNX17 promotes htr-8/svneo proliferation and invasion through miR-517a/IGF-1 in the placenta of diabetic macrosomia. Reprod Sci. 2022;29(2):596-605. [44] ZHANG Y, QU L, NI H, et al. Expression and function of lncRNA MALAT1 in gestational diabetes mellitus. Adv Clin Exp Med. 2020;29(8):903-910. [45] SHAFABAKHSH R, MIRHOSSEINI N, CHAICHIAN S, et al. Could circRNA be a new biomarker for pre-eclampsia? Mol Reprod Dev. 2019;86(12):1773-1780. [46] MAHMOUDI E, CAIRNS MJ. CircRNA and ageing. Subcell Biochem. 2023;102:249-270. [47] CHEN H, ZHANG S, WU Y, et al. The role of circular RNA circ_0008285 in gestational diabetes mellitus by regulating the biological functions of trophoblasts. Biol Res. 2021; 54(1):14. [48] LI M, HUANG Y, XI H, et al. Circ_FOXP1 promotes the growth and survival of high glucose-treated human trophoblast cells through the regulation of miR-508-3p/SMAD family member 2 pathway. Endocr J. 2022;69(9):1067-1078. [49] WANG H, SHE G, ZHOU W, et al. Expression profile of circular RNAs in placentas of women with gestational diabetes mellitus. Endocr J. 2019;66(5):431-441. [50] YAN L, FENG J, CHENG F, et al. Circular RNA expression profiles in placental villi from women with gestational diabetes mellitus. Biochem Biophys Res Commun. 2018; 498(4):743-750. [51] WANG H, ZHOU W, SHE G, et al. Downregulation of hsa_circ_0005243 induces trophoblast cell dysfunction and inflammation via the β-catenin and NF-κB pathways. Reprod Biol Endocrinol. 2020;18(1):51. [52] CHEN X, HUANG J, PENG Y, et al. The role of circRNA polyribonucleotide nucleoside transferase 1 on gestational diabetes mellitus. Cell Mol Biol (Noisy-le-grand). 2022; 68(6):148-154. [53] DU R, WU N, BAI Y, et al. circMAP3K4 regulates insulin resistance in trophoblast cells during gestational diabetes mellitus by modulating the miR-6795-5p/PTPN1 axis. J Transl Med. 2022;20(1):180. [54] YE Z, WANG S, HUANG X, et al. Plasma exosomal miRNAs associated with metabolism as early predictor of gestational diabetes mellitus. Diabetes. 2022;71(11):2272-2283. [55] FILARDI T, CATANZARO G, GRIECO GE, et al. Identification and validation of miR-222-3p and miR-409-3p as plasma biomarkers in gestational diabetes mellitus sharing validated target genes involved in metabolic homeostasis. Int J Mol Sci. 2022;23(8):4276. [56] ZHANG L, ZHANG T, SUN D, et al. Diagnostic value of dysregulated microribonucleic acids in the placenta and circulating exosomes in gestational diabetes mellitus. J Diabetes Investig. 2021;12(8):1490-1500. [57] ZHANG Q, YE X, XU X, et al. Placenta-derived exosomal miR-135a-5p promotes gestational diabetes mellitus pathogenesis by activating PI3K/AKT signalling pathway via SIRT1. J Cell Mol Med. 2023;27(23):3729-3743. [58] ZHANG L, WU Q, ZHU S, et al. Chemerin-induced down-regulation of placenta-derived exosomal miR-140-3p and miR-574-3p promotes umbilical vein endothelial cells proliferation, migration, and tube formation in gestational diabetes mellitus. Cells. 2022;11(21):3457. [59] HERRERA-VAN OOSTDAM AS, TORO-ORTIZ JC, LOPEZ JA, et al. Placental exosomes isolated from urine of patients with gestational diabetes exhibit a differential profile expression of microRNAs across gestation. Int J Mol Med. 2020;46(2):546-560. [60] TANG GY, YU P, ZHANG C, et al. The neuropeptide-related HERC5/TAC1 interactions may be associated with the dysregulation of lncRNA GAS5 expression in gestational diabetes mellitus exosomes. Dis Markers. 2022;2022:8075285. [61] JIANG B, ZHANG J, SUN X, et al. Circulating exosomal hsa_circRNA_0039480 is highly expressed in gestational diabetes mellitus and may be served as a biomarker for early diagnosis of GDM. J Transl Med. 2022;20(1):5. [62] ZHANG W, ZHAO X, LI L. Downregulationof circ_0001578 promotes gestational diabetes mellitus by inducing placental inflammation via the NF-κB and JNKs pathways. Front Endocrinol (Lausanne). 2022;13:657802. [63] ZHANG L, ZENG M, TANG F, et al. Circ-PNPT1 contributes to gestational diabetes mellitus (GDM) by regulating the function of trophoblast cells through miR-889-3p/PAK1 axis. Diabetol Metab Syndr. 2021;13(1):58. [64] ZHU Y, TIAN F, LI H, et al. Profiling maternal plasma microRNA expression in early pregnancy to predict gestational diabetes mellitus. Int J Gynaecol Obstet. 2015;130(1): 49-53. [65] CAO YL, JIA YJ, XING BH, et al. Plasma microRNA-16-5p, -17-5p and -20a-5p: novel diagnostic biomarkers for gestational diabetes mellitus. J Obstet Gynaecol Res. 2017; 43(6):974-981. [66] YOFFE L, POLSKY A, GILAM A, et al. Early diagnosis of gestational diabetes mellitus using circulating microRNAs. Eur J Endocrinol. 2019;181(5):565-577. [67] ZHANG W, CAO D, WANG Y, et al. LncRNA MEG8 is upregulated in gestational diabetes mellitus (GDM) and predicted kidney injury. J Diabetes Complications. 2021;35(1):107749. [68] YANG H, YE W, CHEN R, et al. Circulating expression of Hsa_circRNA_102893 contributes to early gestational diabetes mellitus detection. Sci Rep. 2020;10(1):19046. [69] WU H, WU S, ZHU Y, et al. Hsa_circRNA_0054633 is highly expressed in gestational diabetes mellitus and closely related to glycosylation index. Clin Epigenetics. 2019;11(1):22. [70] CHEN X, BA Y, MA L, et al. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases. Cell Res. 2008;18(10):997-1006. [71] SARKER S, SCHOLZ-ROMERO K, PERZE A, et al. Placenta-derived exosomes continuously increase in maternal circulation over the first trimester of pregnancy. J Transl Med. 2014;12:204. [72] LV Q, DENG J, CHEN Y, et al. Engineered human adipose stem-cell-derived exosomes loaded with miR-21-5p to promote diabetic cutaneous wound healing. Mol Pharm. 2020;17(5):1723-1733. [73] SHI R, ZHAO L, CAI W, et al. Maternal exosomes in diabetes contribute to the cardiac development deficiency. Biochem Biophys Res Commun. 2017;483(1):602-608. [74] SU T, ZHANG P, ZHAO F, et al. Exosomal microRNAs mediating crosstalk between cancer cells with cancer-associated fibroblasts and tumor-associated macrophages in the tumor microenvironment. Front Oncol. 2021;11:631703. |
| [1] | Sheng Siqi, Xie Lin, Zhao Xiangyu, Jiang Yideng, Wu Kai, Xiong Jiantuan, Yang Anning, Hao Yinju, Jiao Yun. Involvement of miR-144-3p in Cbs+/- mouse hepatocyte autophagy induced by high-methionine diet [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1289-1294. |
| [2] | Liu Hanfeng, Wang Jingjing, Yu Yunsheng. Artificial exosomes in treatment of myocardial infarction: current status and prospects [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1118-1123. |
| [3] | Ma Shuwei, He Sheng, Han Bing, Zhang Liaoyun. Exosomes derived from mesenchymal stem cells in treatment of animals with acute liver failure: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1137-1142. |
| [4] | Shen Ziqing, Xia Tian, Shan Yibo, Zhu Ruijun, Wan Haoxin, Ding Hao, Pan Shu, Zhao Jun. Vascularized tracheal substitutes constructed by exosome-load hydrogel-modified 3D printed scaffolds [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 697-705. |
| [5] | Lin Zhanying, Lin Ziyun, Huang Liuyan, Zhang Wenxi, Zuo Changqing. Overexpression of long non-coding RNA Gm16104 affects osteogenic differentiation of C3H10T1/2 mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(31): 4964-4969. |
| [6] | Cao Jiawei, Ding Shaorui, Tie Hua, Xue Jing, Jia Yuanyuan, Liang Xueyun, Li Feng. Human placental mesenchymal stem cells inhibit occurrence of pulmonary fibrosis by regulating transforming growth factor-beta 1/Smad3 signaling pathway [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(31): 4970-4974. |
| [7] | Li Yue, Qiao Hua. miRNA derived from mesenchymal stem cells and its derivatives in treatment of pathological scar [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(31): 5042-5047. |
| [8] | Yuan Ping, Wang Zhihua, Wang Weizhou, Wang Wentong, He Fei. Exosome-derived microRNA with bone and joint diseases: role and mechanism [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(31): 5063-5069. |
| [9] | Dai Jing, Liu Shasha, Shen Mingjing. Exosome-loaded injectable hydrogel for repairing bone defects around implants [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 347-354. |
| [10] | Liu Ying, Liu Yalei, Liu Yu. Screening and analysis of differentially expressed long non-coding RNAs in adriamycin-induced myocardial injury antagonized with daisy leaf gentianone [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(26): 4121-4128. |
| [11] | Han Xia, Zhao Ruidong, Yang Junli. Targeted induction of human umbilical cord mesenchymal stem cells cultured with human peripheral blood serum into neural stem cells [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(25): 4000-4004. |
| [12] | He Bo, He Zhijun, Liu Tao, Ma Suilu, Wei Xiaotao, Wang Weiwei. Action mechanism and advantages of mesenchymal stem cells for treating flap ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(25): 4065-4071. |
| [13] | Xiong Wanqi, Li Zhenhao, Cui Yan, Liu Jiahe, Li Chenzhi, Wu Mingjian, Li Yancheng, Yang Fan, Liu Baoyi. Effects of biomechanics on biological characteristics of osteoblasts [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(21): 3407-3412. |
| [14] | Wan Jun, Bai Yanjie, Wang Yan, Chen Shuying, Chen Limin, Xiao Yuqian, Sun Kexin. Mechanism of action and related signaling pathways of long non-coding RNAs in neuroimmuno-inflammatory response after ischemic stroke [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(20): 3265-3271. |
| [15] | Guo Xiangying, Peng Zifu, He Yimin, Fang Hongbo, Jiang Ning. MiRNA-122 contributes to the effect of exercise on non-alcoholic fatty liver [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(2): 272-279. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||