Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (29): 4703-4709.doi: 10.12307/2024.535
Previous Articles Next Articles
3D-printed biomimetic hydrogel for repairing tissue damage in motor systems
Wu Jicenyuan, Zhu Zhou, Pei Xibo
- National Clinical Medical Research Center for Oral Diseases, State Key Laboratory of Oral Diseases, Department of Prosthodontics, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, Sichuan Province, China
-
Received:2023-10-07Accepted:2023-11-14Online:2024-10-18Published:2024-03-23 -
Contact:Pei Xibo, PhD, Associate professor, Master’s supervisor, National Clinical Medical Research Center for Oral Diseases, State Key Laboratory of Oral Diseases, Department of Prosthodontics, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, Sichuan Province, China -
About author:Wu Jicenyuan, Master candidate, National Clinical Medical Research Center for Oral Diseases, State Key Laboratory of Oral Diseases, Department of Prosthodontics, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, Sichuan Province, China -
Supported by:National Natural Science Foundation of China, No. 82271016 (to PXB); Cross-Disciplinary Innovation Project of Sichuan University West China School of Stomatology, No. RD-03-202310 (to PXB)
CLC Number:
Cite this article
Wu Jicenyuan, Zhu Zhou, Pei Xibo. 3D-printed biomimetic hydrogel for repairing tissue damage in motor systems[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(29): 4703-4709.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
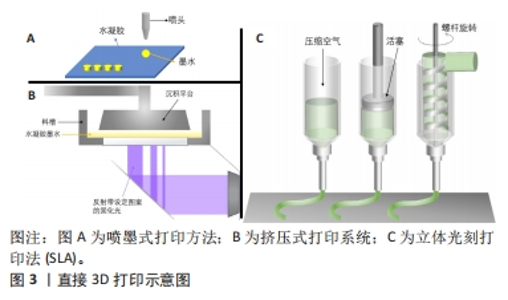
2.1 3D打印具有仿生结构的水凝胶支架的技术 3D打印水凝胶可以通过几种不同的方式实现,如直接3D打印,混合模式3D打印,或是通过打印中间模具来制造具有3D仿生结构的水凝胶。直接3D打印技术,包括喷墨打印、基于激光的系统和挤压式打印的方法。其他制造技术可以添加到直接打印中以创建混合模式制造平台,例如结合3D打印和静电纺丝来制造水凝胶[6]。此外,3D打印可用于快速制作铸造水凝胶的原型模具[7]。研究者应结合该仿生结构想要达到的性能,比较不同制造技术的优势来作出选择。 2.1.1 直接3D打印 目前主流的直接3D打印水凝胶技术有挤压式打印系统、喷墨打印系统和基于激光的打印系统[8],见图3,以下对这3种方法进行简述。"
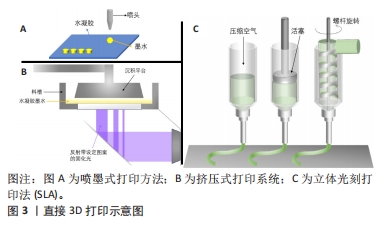
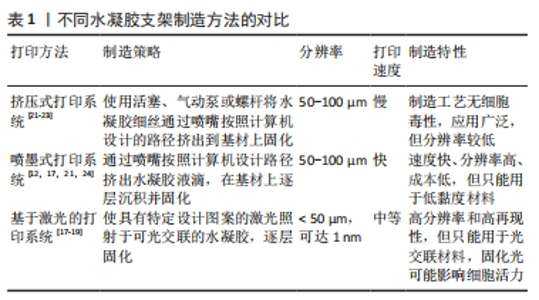
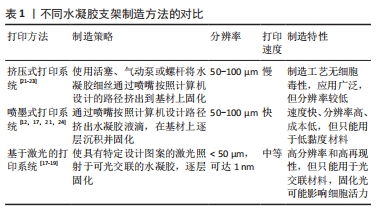
挤压式打印系统是构建水凝胶支架最流行的技术,其主要使用活塞、气动泵或螺杆将水凝胶细丝通过喷嘴挤出到基材上固化[9]。通过计算机建模预先设计打印路径,按照构建的模型逐层、有顺序地挤出材料,形成目标3D结构,使用这种方法成功制造出 3D 打印结构的关键是有良好的层间黏合。因此,对水凝胶的各种参数,如凝固温度、流变性能和凝胶凝固机制的控制就显得至关重要。在挤压式打印技术中,最初的聚合物必须是具有黏性或黏弹性的,在打印下一层之前,这些印刷层会固化并成为自支撑水凝胶[10]。基于挤出的3D打印是一种具有成本效益的水凝胶制造技术,与黏度范围为30-6×107 mPa?s的水凝胶墨水兼容[11]。 喷墨打印技术以可控的尺寸和小体积产生液体墨滴,并将其输送到基板上的特定位置[12],它由一个打印头和一个可沿Z轴移动的构建平台组成,并通过喷嘴打印到移动的XY平面上,喷头压力和打印速度分别取决于喷嘴直径和水凝胶的流变性[10]。基于喷墨的水凝胶 3D 打印使用计算机控制的液滴在基材上逐层沉积。喷墨打印已制造出各种响应外部刺激的形状变化的水凝胶致动器[13]。具有< 10 mPa?s 的低黏度的水凝胶通常用于喷墨打印,由此产生的水凝胶致动器具有低结构完整性[14]。 喷墨和挤压式打印机在简单、灵活和低成本方面具有独特的优势,然而,这两种方法也有局限性。喷嘴受到物理限制,这两种打印方法的分辨率较低,通常都在50 μm以上;此外,印刷结构的完整性也常受到限制,特别是在液滴(在喷墨印刷的情况下)和线条(在挤出印刷的情况中)的界面处 [15]。 大多数基于激光的3D打印系统适用于水凝胶复合材料制造,以特定设计图案的激光(通常为紫外光范围)照射于可光交联的水凝胶以构建3D结构[16]。将光固化液体的表面暴露在紫外激光下,会形成薄的单层凝胶,然后随着样品台顺序向上或向下移动,可在预制结构的顶部继续形成下一层[10]。基于激光的3D打印系统可根据激光源的类型、光束传输系统、扫描或曝光方法以及操作台移动系统的类型分为几类:激光诱导的正向转移,其使用激光将水凝胶液滴从供体层排放到基底上[17];双光子聚合(two photon polymerization,TPP),通过近红外激光脉冲照射引发水凝胶聚合[16];立体光刻(stereo lithography appearance,SLA)进行的光聚合(紫外光或可见光)[18];数字光投影(digital light processing,DLP),由SLA的掩模投影系统发展而来[19]。然而,这些技术大多都需要后期处理,例如去除支撑物和其他不需要的材料,因此,后固化程序是必要的,以完全固化构建的结构来获得完整的机械稳定性。 与喷墨或挤出打印机的串行打印过程(逐滴或逐行)相比,DLP打印机通过将光学图案的整个平面投影到光聚合物溶液上进行平行打印,这显著减少了制造所需的时间,可以打印平滑的3D对象,而不会在液滴(喷墨打印)或线条(挤出打印)之间出现人工界面。高精度的激光辅助打印系统的打印分辨率可以高达1 nm甚至更微细。但是,激光辅助打印系统对于打印材料的要求就比较局限,材料必须可光聚合,因此对于一些没有光聚合特性的材料,只能通过改性处理尝试打印或者采用其他的打印方法。而且基于激光的打印系统通常需要将原料充满到料槽内,打印结束后便不可避免的造成一部分材料的浪费和制造成本的增加[20]。 文中将不同水凝胶支架的3D制造方法进行对比[12,17-19,21-24],见表1。"
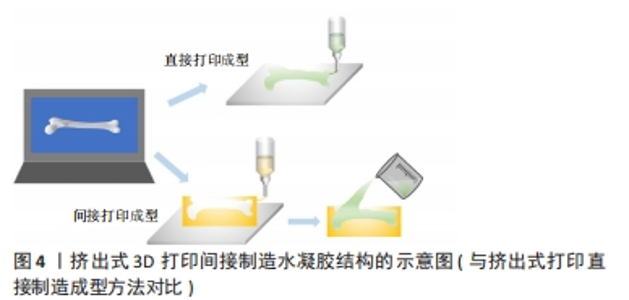
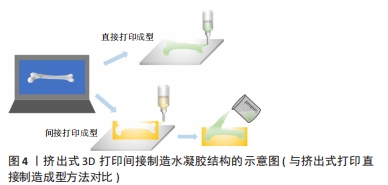
直接3D打印技术也存在一定的局限性。例如:基于激光系统的应用仅限于光聚合材料或高度可控的熔融材料;并且,SLA中使用的未反应单体和光引发剂具有细胞毒性[25]。对于挤压式打印系统,也存在某些设计限制。例如,其分辨率低于喷墨式打印系统和基于激光的打印技术。新材料的成功应用通常需要对工艺参数进行广泛且耗时的优化,因此,通常必须在分辨率或材料性能方面作出妥协,以生成合适的结构[26]。 2.1.2 间接3D打印 为了克服直接3D打印技术的局限性,间接3D打印技术应运而生,是应用直接打印技术生成的构造作为最终构造的中间模具或牺牲模板[27],中间模型与最终结构方向相对应,挤出式3D制造的示意图如图4所示。间接打印终模型的方法,可以实现更高分辨率的终模型的生产,且由于间接打印的牺牲模具多是采用成熟的3D打印原材料制作,就使得终模型的材料限制显著放宽,一些原来无法直接打印的材料也可以通过中间模具来形成终模型,同时也不会在应用新材料时因为优化工艺参数等各种调整而造成大量的材料浪费,而如SLA技术产生的中间模型在成型后就可把未交联的单体去除 ,也不会留在终模型内而造成细胞毒性[28]。直接打印水凝胶材料通常难以获得理想的机械强度,或是难以采用有利于细胞生存浓度的水凝胶材料直接打印[29]。然而,与直接打印相比,间接打印能够使用质量分数10%及以下的聚合物浓度构建自支撑支架[27]。"

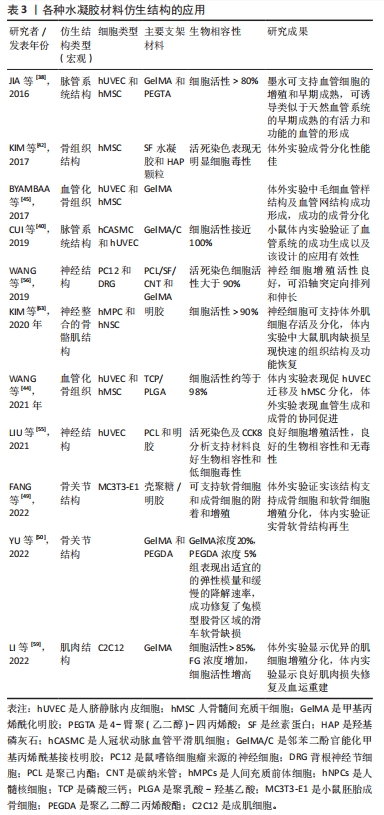
下面通过将3D打印的水凝胶仿生结构在组成运动系统的各个组织内得到的应用来分别阐述。组成运动系统的各部分组织中,血管为其他组织提供营养,而骨缺损的修复通常与脉管系统的滋养密切相关,关节结构的修复需要同时实现骨和软骨区域的恢复,而在修复肌肉组织的缺损时,如要恢复其功能便需要修复缺损区域的神经支配。因此,该节的阐述顺序为:脉管系统-骨-关节-神经-肌肉。 2.2.1 脉管系统仿生水凝胶 运动系统的每个部分都需要血管的滋养,在修复相应的组织缺损时,如果缺损部位伴有血管的损伤,也需要注意修复该组织相应的血供,否则不利于该缺损区域的恢复,如自体移植腓骨皮瓣修复大段颌骨缺损时,需要利用腓骨周围伴行的血管以建立颌骨缺损部位的血供,方可增加移植成功率和改善预后。因此,在研究生物相容性的材料用于大范围运动系统组织损伤时,需要考虑设计出可模仿脉管灌注系统功能的结构以恢复组织损伤区域破坏的血供。 微血管结构工程组织在体内发挥作用是需要宿主提供营养和氧气支持的,而通过其他方法制作的微血管结构工程组织,在植入宿主体内的初期常缺乏与周围组织的良好整合,其在宿主体内发挥的作用便受到了限制。因此,在工程组织构建体中创建可灌注的脉管系统有望解决这些问题,因为它在植入初期即允许血液运输。这种灌注可以提供充足的氧气和营养物质供应,同时去除废物,避免在组织内形成大块坏死区域[36-37]。 JIA等[38]设计了一种基于甲基丙烯酰化明胶(gelatin methacryloyl,GelMA)、海藻酸钠和4-臂聚(乙二醇)-四丙烯酸酯[4-arm poly (ethylene glycol)-tetra-acrylate,PEGTA]的共混生物墨水,利用三层同轴喷嘴实现中空血管微纤维的生物打印,并通过增强PEGTA的交联密度在提高机械强度的同时保持有益的多孔结构,结果显示在该可灌注纤维内包封的人脐静脉内皮细胞和骨髓间充质干细胞可以成熟为功能性细胞,并且该结构具有能让封装血管细胞存活和增殖。 制造可灌注的小直径脉管系统是生产用于临床应用的人体组织/器官的基础步骤[39]。生成与平滑肌和内皮结合的脉管系统,以复制自然血管的复杂性和功能性,是一项极具挑战性的工作。Cui等[40]合成了受贻贝启发的邻苯二酚官能化甲基丙烯酰基接枝明胶(catechol-functionalized gelatin methacrylate,GelMA/C),并用同轴挤压印刷制造了具有分层结构的自立式小直径脉管系统,协同使用无组织交联浆料来支持和固化GelMA/C生物墨水,从而确保血管系统的成功生成,通过生物功能化和动态刺激显著改善了平滑肌和内皮的血管重塑,通过体内生物相容性研究和对免疫缺陷小鼠3D生物打印脉管系统发育的研究验证了该设计的有效性,进一步验证了复杂组织/器官应用的效率和潜力。 上述制造出的复杂的、可灌注血管仿生结构,具有可诱导形成生物相关、高度组织化、完整的血管的潜能,并通过体外实验和动物实验验证了其应用于复杂组织和器官中的潜力。然而,用于临床修复的仿生血管将会需要大规模的组织生产,这迫切需要对打印尺寸和速度有进一步的改进,对于增加的组织尺寸也需要更大量的营养和氧气输送才能保持细胞的活力并促进组织的成熟,来保证组织的成功血管化。尽管在3D打印脉管系统方面已取得了重大进展,但将这类人工脉管系统网络成功整合到整个组织中仍然充满了挑战,使用生物反应器的动态培养可能是促进血管化组织成熟和延长生存能力的解决方案。 2.2.2 骨组织结构仿生水凝胶 在临床实践中,骨移植、金属装置和牵张成骨已被用于填充或修复下颌骨缺损。其中,腓骨游离皮瓣移植是下颌骨重建的金标准[41]。但自体皮瓣移植又会对取瓣部位造成损伤,因此,寻找具有良好生物相容性、机械强度与骨组织接近、可实现仿骨组织结构的人工合成材料是非常理想的。骨骼是高度分化的复杂结构,其含有矿物质基质、多种细胞和血管网络。由于缺乏仿生结构、生物活性因子和功能性脉管系统,临床上对于大规模骨缺损的重建仍然具有挑战性。随着3D生物打印的进步,可以利用生物打印技术,模仿天然骨的分级结构和功能,将水凝胶与不同类型的细胞和生长因子结合,制造出更接近天然骨组成与结构的组织工程支架,以更好地实现骨再生。 骨多孔结构仿生:仿生结构支架的研究从骨结构的特点入手,骨结构包含了骨皮质与骨松质,其中由骨小梁作为连接。在骨结构仿生支架的研究中,往常研究的有机支架常没有令人满意的压缩模量,而无机陶瓷支架虽然具有优异的刚度,但易碎且孔隙率低,临床应用可能会导致骨折植入物松动。KIM等[42]根据骨松质疏松多孔的结构,采用γ射线辐照处理制备了用于骨组织工程的含有羟基磷灰石(hydroxyapatite,HAP)纳米颗粒的丝素蛋白(silk fibroin,SF)复合水凝胶,并且在结果中显示,SF/HAP复合水凝胶具有高度多孔的结构,HAP/纳米颗粒均匀地分散在SF水凝胶中,与纯SF水凝胶相比,SF/HAP复合水凝胶还显示出细胞增殖和黏附增加。此外,这些水凝胶增强了体外人骨髓间充质干细胞的成骨分化。因此,这些结果表明3D多孔SF/HAP复合水凝胶有望成为骨组织工程的生物材料。 血管化工程骨结构仿生:在物理和化学特性及其多尺度脉管系统方面模拟生物组织的复杂结构时,组织工程面临着艰巨的挑战。用于临床的骨组织工程支架不仅应具有优异的成骨能力,还应具有营养转移、氧交换、废物清除、细胞和信号分子调节的互连血管[43]。在前文中以阐述过脉管系统仿生结构的运用,一些研究者们根据骨组织需要血管滋养的生理特性,开发了仿血管化骨组织结构的水凝胶。 WANG等[44]通过低温3D打印β-磷酸三钙和含水/聚乳酸-乙醇酸/二氯甲烷乳液墨水的成骨肽,制备了具有平衡骨传导性/骨诱导性的定制骨组织工程支架,其制备的支架具有分层多孔结构,在机械性能上可与人类松质骨相媲美,然后将含有Ⅰ型胶原水凝胶的血管生成肽涂覆在支架表面,以进一步提供具有血管生成能力的支架,支架获得了快速血管生成肽释放和缓慢但持续的连续成骨肽释放,在接种大鼠内皮细胞和大鼠骨髓间充质干细胞后,两种细胞均显示出高成活性,结果显示血管生成肽涂覆的支架改善了内皮细胞的体外迁移和血管生成,而在含有成骨肽的支架中观察到成骨分化功能的增强;体内结果表明,对于含有血管生成肽和成骨肽的支架,血管生成肽的快速释放在体内明显诱导了血管生成,同时成骨肽的持续释放显著改善了新骨形成。BYAMBAA等[45]设计了一种将含不同浓度梯度血管内皮生成因子并具有不同机械强度的甲基丙烯酸明胶(GelMA)水凝胶柱形结构组装起来的水凝胶支架,在不同位置的水凝胶柱内分别包封了不同比例的人脐静脉内皮细胞和人骨髓间充质干细胞,以仿生含有脉管系统的工程骨组织,该结构中心为仅含人脐静脉内皮细胞的低强度GelMA,这个部分的GelMA水凝胶柱快速地降解,使该结构中心很快能形成具有内皮衬里的可灌注管腔,体内培养21 d的结果显示该结构促进了包封的人骨髓间充质干细胞形成成熟的骨龛,这种方法为制造用于治疗大型骨缺损的工程骨结构提供了思路。 2.2.3 骨关节结构仿生水凝胶 关节软骨内无血管滋养,自我修复和自愈能力均较差,来自血液和骨髓的软骨细胞和祖细胞很难迁移到缺损部位,导致组织再生失败。大型骨软骨损伤不会自发恢复,如果治疗不当,小的软骨损伤会向下发展到软骨下骨,最终导致骨软骨组织退化[46]。 骨软骨组织的环境复杂,具有不同的组成和结构,从透明软骨到软骨下骨都具有不同的生物医学特性[47]。因此,具有模拟结构和生物化学性质的仿生水凝胶被认为是成功再生软骨细胞的有效方法[48]。FANG等[49]模拟骨软骨结构设计了一种机械增强生物相容性壳聚糖/明胶双网的双层水凝胶,该水凝胶具有与水凝胶层厚度相关的微观结构、机械性能和生物功能,以修复全厚度骨软骨缺损,这种双层水凝胶的上层掺入碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)以诱导软骨再生,而羟基磷灰石(HAp)纳米颗粒通过原位矿化均匀沉积于下层,提供了可直接与宿主骨结合的生物活性界面以实现支架和软骨下骨之间的直接结合;通过体外细胞分析证明,这种双层凝胶可以支持软骨细胞和成骨细胞的附着、增殖和分化,体内研究证实双层凝胶对骨软骨再生和整合的有效性。YU等[50]将聚乙二醇二丙烯酸酯(polyethylene glycol diacrylate,PEGDA)加入GelMA中,并探究了不同浓度PEGDA的实验组,并在水凝胶中引入生物活性和软骨保护分子(Kartogenin,KGN)以刺激软骨再生(该分子已被用于促进间充质基质细胞向软骨细胞的逐步分化)[51],最终20G+5P+KGN组(GelMA浓度20%,PEGDA浓度5%)具有较满意的弹性模量和缓慢降解速率,并且该水凝胶软骨植入物成功修复了兔模型股骨区域的滑车软骨缺损。 骨关节结构仿生修复的难点主要在骨和软骨之间的界面稳定结合以及人工材料与组织的成功整合,若界面结合不稳定可能导致支架在组织再生过程中发生断裂或变形。因此,需要在兼顾生物相容性的情况下,在骨软骨单元的不同深度制造具有所需生物医学功能的集成支架,以支持软骨和软骨下骨再生,实现成功的组织修复。 2.2.4 神经组织仿生水凝胶 运动系统由神经支配,无论是骨、骨骼肌、骨连结中任何部分的大范围组织缺损,均有可能伤及支配这一部分的运动或感觉的神经。因此,若运动系统的组织损伤伤及支配该区域的运动或感觉的神经时,需设计并利用可仿神经组织传导功能的结构恢复支配该区域神经的完整性。 随着再生医学的发展,临床相关的组织工程导管已被证明是一种有前途的神经修复治疗方法,旨在弥补神经移植短缺和移植需求之间的差距,然而,理想的神经导管应具有足够的机械性能、高孔隙率和优异的生物相容性,这是细胞生长和随后组织形成成功的关键因素[52-54]。LIU等[55]将电流体动力学喷墨印刷、浸涂和静电纺丝技术结合,制造出一种机械可调谐的三层明胶基神经导管结构,三层结构分别是:具有可调方向性的高分辨率电流体动力学喷射印刷的聚ε-己内酯[Poly(ε-caprolactone,PCL]细丝作为最内层;随后浸涂明胶水凝胶以形成中间层,最后用电纺PCL纳米纤维包裹作为导管的外层,并对制作导管的机械性能、孔隙率和生物相容性进行了评估,证实这种组合方法在制造具有良好神经元前体和血管细胞相容性的机械可调谐三层导管方面具有更大的潜力。WANG等[56]提出了一种基于水凝胶内排列的导电纳米纤维纱线的核壳支架,以模拟天然神经组织的3D分层排列结构,当PC12细胞和背根神经节细胞在其3D外周表面上培养时,该方法能够诱导轴突排列和伸长,还诱导排列的轴突延伸和细胞沿着纳米纤维的方向从背根神经节外植体迁移,这些排列的纳米纤维纱线具有足够的生物相容性,还可诱导细胞排列和轴突伸长,证明这种3D分层排列的核-壳支架在周围神经组织工程领域具有巨大的潜在应用。 2.2.5 肌肉组织仿生水凝胶 目前,3D生物打印技术已成为构建生物工程肌肉组织结构的有力工具。体积性肌肉损失(Volumetric muscle loss,VML)可能由严重创伤、肿瘤切除或肌肉消耗性疾病引起,会降低机体内源性自我修复能力,并导致肌肉功能丧失[57]。组织工程策略最近被视为体积性肌肉损失修复的潜在治疗选择,具有高度定向结构的天然骨骼肌是通过对齐的肌肉纤维束融合形成的,这在力的产生和各向异性运动中起着关键作用[58]。因此,生物制造仿生各向异性支架以模拟天然骨骼肌的排列结构,可以在三维环境中诱导细胞伸长,对于体外工程骨骼肌模型和体内体积肌肉损失修复至关重要。LI等[59]探究出一种具有快速应力松弛的互穿网络(interpenetrating network,IPN)水凝胶,由GelMA和纤维蛋白原在光交联和酶交联后组合而成,将其作为生物墨水打印对齐的骨骼肌仿生支架,这个支架内部通过调节GelMA与纤维蛋白原的浓度比,表现出可调的黏弹性,C2C12成肌细胞被包裹在这些IPN水凝胶中,具有快速应力松弛的IPN水凝胶显示出更高的3D细胞增殖和更好的分化,使用该水凝胶定制出体外3D工程化骨骼肌组织,发现其能够在体内增强体积性肌肉损失模型修复,因为它们能够募集天然肌肉细胞并促进原位血运重建。 已有文献表明,神经营养因子(或神经营养素)和神经成分释放的神经递质以及预先形成的神经肌肉接头(neuromuscular junctions,NMJ)可增加骨骼肌细胞的存活和分化[60-61] 。肌肉纤维通过NMJ与运动神经元连接,将肌肉收缩信号从大脑传递到肌肉纤维,这些肌肉纤维被结缔组织层分组并包围,为骨骼肌提供结构稳定性[62]。为了解决与神经支配延迟相关的问题,KIM等[63]通过生物印刷人类肌肉祖细胞和人类神经干细胞来开发具有神经细胞整合能力的人类骨骼肌构建体,并且评估将神经细胞整合到生物打印骨骼肌构建体中加速体内功能性肌肉再生的效果,作者通过体外实验证明了神经细胞成分可以支持长期细胞存活,增强肌源性分化,并在体外诱导生物打印骨骼肌结构中的肌纤维上形成NMJ,并且以此依据在大鼠胫骨前肌肌肉缺损模型中也显示出快速恢复肌肉功能的能力,证明了使用这种生物打印方法修复临界尺寸肌肉缺损损伤的可行性。这些结果表明,3D生物打印的人类神经骨骼肌结构可以与宿主神经网络快速集成,从而加速肌肉功能恢复,这种NMJ预制的生物工程骨骼肌结构可能是一种治疗广泛骨骼肌缺损的有效治疗方法。由此可见,3D制造水凝胶仿生结构修复骨骼肌损伤多从模拟天然骨骼肌的肌束排列切入,并且考虑合并实现缺损部位血运重建或神经传导是更好恢复缺损部位功能的思路。 在此总结各种水凝胶材料仿生结构的设计思路及制造策略以及在运动系统中各个组成部分中的应用,见表2,3。"

从上述表2,3整理看出,目前用于组织工程研究的水凝胶材料大多都具有较好的生物相容性,大部分研究者们都会考虑以明确较好生物相容性的GelMA材料作为3D生物打印的墨水,挤出式打印是3D打印水凝胶仿生结构的应用最广泛的制造手段。水凝胶的仿生结构设计和3D打印技术在体外和体内实验中已显示出一定的潜力,但尚未广泛应用于临床治疗,说明此类材料距离临床应用尚有一段距离。材料创新度较大,制造难度更高的研究中通常欠缺一些完整的体外和体内实验数据,文章内更着重于描述材料制造以及材料创新、体外及体内实验数据更加完善的文章,在材料制造工艺上又会缺乏一些更精细或者更符合其仿生灵感的设计,这启发研究者要更积极地采取跨学科、跨专业的合作模式来完善研究,使研究成果有更大的临床转化可能和临床应用空间。"

| [1] 胡莹莹,李雷,张维,等.基于运动系统知识框架的解剖学教学认知体系构建[J].基础医学教育,2021,23(7):448-451. [2] 张亮,韩泽奎,臧旖欣,等.仿生蛛网孔隙结构3D打印个性化钛网设计及三维有限元分析[J].中国组织工程研究,2023,27(30):4796-4801. [3] NAIK RR, SINGAMANENI S. Introduction: bioinspired and biomimetic materials. Chem Rev. 2017;117(20):12581-12583. [4] ZHANG Y, CHEN H, LI J. Recent advances on gelatin methacrylate hydrogels with controlled microstructures for tissue engineering. Int J Biol Macromol. 2022; 221:91-107. [5] 王曙东,马倩,王可,等. 3D生物打印制备组织工程支架的研究进展[J].纺织学报,2023,44(3):210-220. [6] WU Y. Electrohydrodynamic jet 3D printing in biomedical applications. Acta Biomater. 2021;128:21-41. [7] SUN W, SCHAFFER S, DAI K, et al. 3D printing hydrogel-based soft and biohybrid actuators: a mini-review on fabrication techniques, applications, and challenges. Front Robot AI. 2021;8:673533. [8] OSTROVIDOV S, SALEHI S, COSTANTINI M, et al. 3D bioprinting in skeletal muscle tissue engineering. Small. 2019;15(24):e1805530. [9] LI J, WU C, CHU PK, et al. 3D printing of hydrogels: Rational design strategies and emerging biomedical applications. Mat Sci Eng R. 2020;140:100543. [10] JANG TS, Jung HD, Pan HM, et al. 3D printing of hydrogel composite systems: recent advances in technology for tissue engineering. Int J Bioprint. 2018;4(1):126. [11] KYLE S, JESSOP ZM, AL-SABAH A, et al. ‘Printability’ of candidate biomaterials for extrusion based 3D printing: state-of-the-art. Adv Healthc Mater. 2017;6(16): 1700264. [12] LI X, LIU B, PEI B, et al. Inkjet bioprinting of biomaterials. Chem Rev. 2020;120(19): 10793-10833. [13] AXPE E, OYEN ML. Applications of alginate-based bioinks in 3D bioprinting. Int J Mol Sci. 2016;17(12):1976. [14] MANI MP, SADIA M, JAGANATHAN SK, et al. A review on 3D printing in tissue engineering applications. J Polym Eng, De Gruyter. 2022;42(3):243-265. [15] ZHU W, MA X, GOU M, et al. 3D printing of functional biomaterials for tissue engineering. Curr Opin Biotechnol, 2016;40:103-112. [16] BILLIET T, VANDENHAUTE M, SCHELFHOUT J, et al. A review of trends and limitations in hydrogel-rapid prototyping for tissue engineering. Biomaterials. 2012;33(26):6020-6041. [17] MIRI AK, MIRZAEE I, HASSAN S, et al. Effective bioprinting resolution in tissue model fabrication. Lab Chip. 2019;19(11):2019-2037. [18] LIN Q, TANG M, KE C. Thermo-responsive 3D-printed polyrotaxane monolith. Polymer Chemistry, The RSC. 2020;11(2):304-308. [19] RASTOGI P, KANDASUBRAMANIAN B. Review of alginate-based hydrogel bioprinting for application in tissue engineering. Biofabrication. 2019;11(4):042001. [20] SHINKAR K, RHODE K. Could 3D extrusion bioprinting serve to be a real alternative to organ transplantation in the future? Annals of 3D Printed Medicine. 2022;7:100066. [21] BUDHARAJU H, SUBRAMANIAN A, SETHURAMAN S. Recent advancements in cardiovascular bioprinting and bioprinted cardiac constructs. Biomater Sci. 2021; 9(6):1974-1994. [22] BUDHARAJU H, SUBRAMANIAN A, SETHURAMAN S. Efficient dual crosslinking of protein-in-polysaccharide bioink for biofabrication of cardiac tissue constructs. Biomater Adv. 2023;152:213486. [23] RAMESH S, HARRYSSON OLA, RAO PK, et al. Extrusion bioprinting: recent progress, challenges, and future opportunities. Bioprinting. 2021;21:e00116. [24] GOMES GAMA JF, DIAS EA, AGUIAR COELHO RMG, et al. Development and implementation of a significantly low-cost 3D bioprinter using recycled scrap material. Front Bioeng Biotechnol. 2023;11:1108396. [25] CHIA HN, WU BM. Recent advances in 3D printing of biomaterials. J Biol Eng. 2015;9(1):4. [26] HOUBEN A, VAN HOORICK J, VAN ERPS J, et al. Indirect rapid prototyping: opening up unprecedented opportunities in scaffold design and applications. Ann Biomed Eng. 2017;45(1):58-83. [27] VAN HOORICK J, DECLERCQ H, DE MUYNCK A, et al. Indirect additive manufacturing as an elegant tool for the production of self-supporting low density gelatin scaffolds. J Mater Sci Mater Med. 2015;26(10):247. [28] TABOAS JM, MADDOX RD, KREBSBACH PH, et al. Indirect solid free form fabrication of local and global porous, biomimetic and composite 3D polymer-ceramic scaffolds. Biomaterials. 2003;24(1):181-194. [29] BILLIET T, GEVAERT E, DE SCHRYVER T, et al. The 3D printing of gelatin methacrylamide cell-laden tissue-engineered constructs with high cell viability. Biomaterials. 2014;35(1):49-62. [30] LEE JM, YEONG WY. Design and printing strategies in 3D bioprinting of cell-hydrogels: a review. Adv Healthc Mater. 2016;5(22):2856-2865. [31] KOLESKY DB, TRUBY RL, GLADMAN AS, et al. 3D bioprinting of vascularized, heterogeneous cell-laden tissue constructs. Adv Mater. 2014;26(19):3124-3130. [32] HA DH, Ko DH, Kim JO, et al. Indirect fabrication of versatile 3D microfluidic device by a rotating plate combined 3D printing system. RSC Adv. 2018;8(66): 37693-37699. [33] NAGHIEH S, SARKER MD, ABELSETH E, et al. Indirect 3D bioprinting and characterization of alginate scaffolds for potential nerve tissue engineering applications. J Mech Behav Biomed Mater. 2019;93:183-193. [34] CIULLA MG, MASSIRONI A, SUGNU M, et al. Recent advances in the development of biomimetic materials. Gels. 2023;9(10):833. [35] VINCENT JF. Biomimetics--a review. Proc Inst Mech Eng H. 2009;223(8):919-939. [36] RADISIC M, YANG L, BOUBLIK J, et al. Medium perfusion enables engineering of compact and contractile cardiac tissue. Am J Physiol Heart Circ Physiol. 2004; 286(2):H507-H516. [37] LIU Y, LIU X, ZHANG Y, et al. Interpenetrating polymer network HA/Alg-RGD hydrogel: an equilibrium of macroscopic stability and microscopic adaptability for 3D cell growth and vascularization. Biomacromolecules. 2023. doi: 10.1021/acs.biomac.3c01022. [38] JIA W, GUNGOR-OZKERIM PS, Zhang YS, et al. Direct 3D bioprinting of perfusable vascular constructs using a blend bioink. Biomaterials. 2016;106:58-68. [39] BARRS RW, JIA J, SILVER SE, et al. Biomaterials for bioprinting microvasculature. Chem Rev. 2020;120(19):10887-10949. [40] CUI H, ZHU W, HUANG Y, et al. In vitro and in vivo evaluation of 3D bioprinted small-diameter vasculature with smooth muscle and endothelium. Biofabrication. 2019;12(1):015004. [41] GUO J, YAO H, LI X, et al. Advanced hydrogel systems for mandibular reconstruction. Bioact Mater. 2023;21:175-193. [42] KIM MH, KIM BS, LEE J, et al. Silk fibroin/hydroxyapatite composite hydrogel induced by gamma-ray irradiation for bone tissue engineering. Biomater Res. 2017;21:12. [43] YAN Y, CHEN H, ZHANG H, et al. Vascularized 3D printed scaffolds for promoting bone regeneration. Biomaterials. 2019;190-191:97-110. [44] WANG C, LAI J, LI K, et al. Cryogenic 3D printing of dual-delivery scaffolds for improved bone regeneration with enhanced vascularization. Bioact Mater. 2021; 6(1):137-145. [45] BYAMBAA B, ANNABI N, YYE K, et al. Bioprinted osteogenic and vasculogenic patterns for engineering 3D bone tissue. Adv Healthc Mater. 2017;6(16):1700015. [46] RIM YA, NAM Y, JU JH. Application of cord blood and cord blood-derived induced pluripotent stem cells for cartilage regeneration. Cell Transplant. 2019;28(5):529-537. [47] GAO F , XU Z , LIANG Q, et al. Direct 3D printing of high strength biohybrid gradient hydrogel scaffolds for efficient repair of osteochondral defect. Adv Funct Mater. 2018;28(13):1706644. [48] GAO Y, ZHANG X, ZHOU H. Biomimetic hydrogel applications and challenges in bone, cartilage, and nerve repair. Pharmaceutics. 2023;15(10):2405. [49] FANG J, LIAO J, ZHONG C, et al. High-strength, biomimetic functional chitosan-based hydrogels for full-thickness osteochondral defect repair. ACS Biomater Sci Eng. 2022;8(10):4449-4461. [50] YU H, FENG M, MAO G, et al. Implementation of photosensitive, injectable, interpenetrating, and kartogenin-modified GELMA/PEDGA biomimetic scaffolds to restore cartilage integrity in a full-thickness osteochondral defect model. ACS Biomater Sci Eng. 2022;8(10):4474-4485. [51] JOHNSON K, ZHU S, TREMBLAY MS, et al. A stem cell-based approach to cartilage repair. Science. 2012;336(6082):717-721. [52] ZHANG L, ZHANG H, WANG H, et al. Fabrication of multi-channel nerve guidance conduits containing schwann cells based on multi-material 3D bioprinting. 3D Print Addit Manuf. 2023;10(5):1046-1054. [53] VIJAYAVENKATARAMAN S, ZHANG S, THAHARAH S, et al. Electrohydrodynamic jet 3D printed nerve guide conduits (NGCs) for peripheral nerve injury repair. Polymers. 2018;10(7):753. [54] VIJAYAVENKATARAMAN S, THAHARAH S, ZHANG S, et al. Electrohydrodynamic jet 3D-printed PCL/PAA conductive scaffolds with tunable biodegradability as nerve guide conduits (NGCs) for peripheral nerve injury repair. Mater Design. 2019;162:171-184. [55] LIU S, SUN L, ZHANG H, et al. High-resolution combinatorial 3D printing of gelatin-based biomimetic triple-layered conduits for nerve tissue engineering. Int J Biol Macromol. 2021;166:1280-1291. [56] WANG L, WU Y, HU T, et al. Aligned conductive core-shell biomimetic scaffolds based on nanofiber yarns/hydrogel for enhanced 3D neurite outgrowth alignment and elongation. Acta Biomater. 2019;96:175-187. [57] AGRAWAL G, AUNG A, VARGHESE S. Skeletal muscle-on-a-chip: an in vitro model to evaluate tissue formation and injury. Lab Chip. 2017;17(20):3447-3461. [58] ZHANG Y, ZHANG Z, WANG Y, et al. 3D myotube guidance on hierarchically organized anisotropic and conductive fibers for skeletal muscle tissue engineering. Sci Eng C Mater Biol Appl. 2020;116:111070. [59] LI T, HOU J, WANG L, et al. Bioprinted anisotropic scaffolds with fast stress relaxation bioink for engineering 3D skeletal muscle and repairing volumetric muscle loss. Acta Biomater. 2022;156:21-36. [60] KO IK, LEE BK, LEE SJ, et al. The effect of in vitro formation of acetylcholine receptor (AChR) clusters in engineered muscle fibers on subsequent innervation of constructs in vivo. Biomaterials. 2013;34(13):3246-3255. [61] VILMONT V, CADOT B, OUANOUNOU G, et al. A system for studying mechanisms of neuromuscular junction development and maintenance. Development. 2016; 143(13):2464-2477. [62] ZHANG W, LIU Y, ZHANG H. Extracellular matrix: an important regulator of cell functions and skeletal muscle development. Cell Biosci. 2021;11:65. [63] KIM JH, KIM I, SEOL YJ, et al. Neural cell integration into 3D bioprinted skeletal muscle constructs accelerates restoration of muscle function. Nat Commun. 2020;11:1025. |
| [1] | Yang Yufang, Yang Zhishan, Duan Mianmian, Liu Yiheng, Tang Zhenglong, Wang Yu. Application and prospects of erythropoietin in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1443-1449. |
| [2] | Chen Kaijia, Liu Jingyun, Cao Ning, Sun Jianbo, Zhou Yan, Mei Jianguo, Ren Qiang. Application and prospect of tissue engineering in treatment of osteonecrosis of the femoral head [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1450-1456. |
| [3] | Wang Menghan, Qi Han, Zhang Yuan, Chen Yanzhi. Three kinds of 3D printed models assisted in treatment of Robinson type II B2 clavicle fracture [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1403-1408. |
| [4] | Wang Shanshan, Shu Qing, Tian Jun. Physical factors promote osteogenic differentiation of stem cells [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1083-1090. |
| [5] | Mei Jingyi, Liu Jiang, Xiao Cong, Liu Peng, Zhou Haohao, Lin Zhanyi. Proliferation and metabolic patterns of smooth muscle cells during construction of tissue-engineered blood vessels [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1043-1049. |
| [6] | Ning Tianliang, Wang Kun, Wang Lingbiao, Han Pengfei. Finite element analysis on correction effect of varus foot orthosis based on the three-point force principle [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(6): 891-899. |
| [7] | Chen Xiaofang, Zheng Guoshuang, Li Maoyuan, Yu Weiting. Preparation and application of injectable sodium alginate hydrogels [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 789-794. |
| [8] | Wang Jiani, Chen Junyu. Angiogenesis mechanism of metal ions and their application in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 804-812. |
| [9] | Wang Wu, Fan Xiaolei, Xie Jie, Hu Yihe, Zeng Min. Hydroxyapatite-polyvinyl alcohol/collagen-chitosan-gelatin composite hydrogel for repairing rabbit osteochondral defect [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 682-689. |
| [10] | Zhang Ya, Mu Qiuju, Wang Zilin, Liu Hongjie, Zhu Lili. Hydrogel loaded with platelet-rich plasma promotes wound healing in diabetic rats [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 690-696. |
| [11] | Shen Ziqing, Xia Tian, Shan Yibo, Zhu Ruijun, Wan Haoxin, Ding Hao, Pan Shu, Zhao Jun. Vascularized tracheal substitutes constructed by exosome-load hydrogel-modified 3D printed scaffolds [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 697-705. |
| [12] | Zhu Liwei, Wang Jiangyue, Bai Ding. Application value of nanocomposite gelatin methacryloyl hydrogels in different bone defect environments [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 753-758. |
| [13] | Yang Yuqing, Chen Zhiyu. Role and application of early transient presence of M1 macrophages in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 594-601. |
| [14] | Yu Pengxin, Han Yuqiu, Guo Lina, Wang Xiuli. The construction of rat intestinal smooth muscle collagen band and evaluation of periodic stretching culture in vitro [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(35): 5630-5635. |
| [15] | Liu Penghui, Wu Fan, Wang Zejie, Wu Gaoyi, Zhou Libo. Constructing an animal model of temporomandibular joint osteoarthritis in Sprague-Dawley rats by digital technology [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(35): 5642-5648. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||