Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (29): 4710-4716.doi: 10.12307/2024.539
Previous Articles Next Articles
Advance in preparation methods of bone tissue engineering scaffolds
Huang Lei1, Wang Xiaoli1, Wang Siming2, Bao Xin1, Zhou Xin1, Wang Bendi2
- 1College of Mechanical Engineering, Jiangsu Ocean University, Lianyungang 222005, Jiangsu Province, China; 2Second People’s Hospital of Lianyungang, Lianyungang 222023, Jiangsu Province, China
-
Received:2023-10-11Accepted:2023-11-22Online:2024-10-18Published:2024-03-23 -
Contact:Wang Xiaoli, Doctor of Engineering, Associate professor, College of Mechanical Engineering, Jiangsu Ocean University, Lianyungang 222005, Jiangsu Province, China -
About author:Huang Lei, Master candidate, College of Mechanical Engineering, Jiangsu Ocean University, Lianyungang 222005, Jiangsu Province, China -
Supported by:Graduate Research and Practice Innovation Program of Jiangsu Ocean University, No. KYCX2023-77 (to HL)
CLC Number:
Cite this article
Huang Lei, Wang Xiaoli, Wang Siming, Bao Xin, Zhou Xin, Wang Bendi. Advance in preparation methods of bone tissue engineering scaffolds[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(29): 4710-4716.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
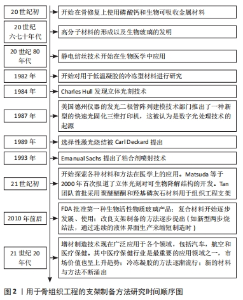
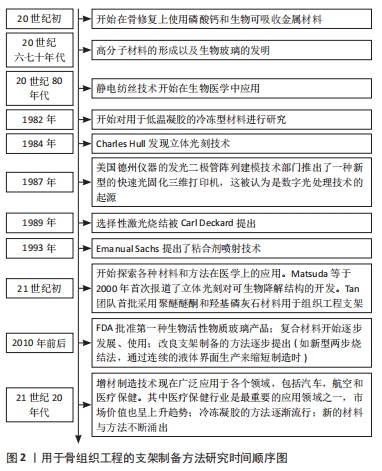
骨修复的最初研究涉及磷酸钙和生物可吸收金属的使用,随后在聚合物材料中观察到骨形成,同时发明了生物玻璃,这是第一种能够与活组织结合的人造材料。随后,各种制造技术开始不断涌现,也逐步开始应用在医学领域。随后,学者开始探索各种材料和方法在组织工程上的使用。更进一步,FDA批准第一种生物活性物质玻璃产品,提出改良支架制备的方法。到如今,增材制造技术现在广泛应用、冷冻凝胶的方法逐渐流行和新的材料与方法不断涌出,大多数制造方法(特别是增材制造法)在进行材料加工成骨支架时,非常依赖将目标组织用数字化表示。目前主流的获取和处理这些数据的方法是通过CT检测,生成的几何体通常以STL文件格式存储,STL文件格式会以三角形小平面来近似实体的包络面去表示3D模型,不过在近似曲面时会略微损失精度。下面介绍目前常用的用于制备骨组织工程支架的方法。有关骨组织工程的制备方法研究历史如图2所示。"
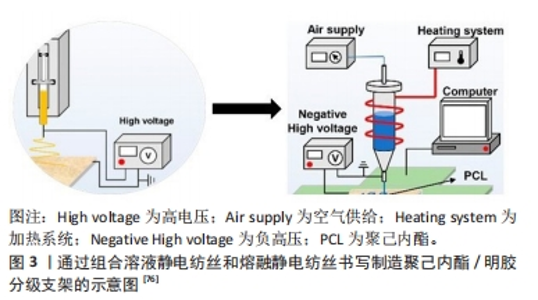
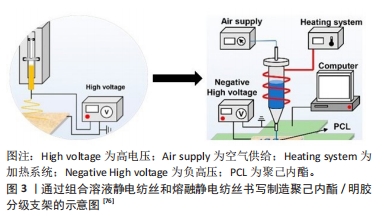
2.1 气体发泡 是一种在材料内部产生气体或使气体通过材料从而产生多孔结构的制备方法。目前常用的发泡技术有物理发泡法和化学发泡法。物理发泡是从外部将惰性气体(如N2和CO2)通过基质以产生所需的内部多孔结构。化学发泡首先将基质、发泡剂与粘合剂混合,然后将混合物制成所需求的形状并固化,之后将材料浸入含有发泡剂的溶液中,由于化学反应会产生气体作为副产物,因此支架内部逸出的气泡会形成所需的多孔状。POURSAMAR等[9]提出以碳酸氢钠为发泡剂,通过气体发泡的方法,成功制备了多孔明胶支架,经实验发现交联支架的微观结构具有理想的互连孔隙率。 与增材制造技术相比,气体发泡的主要优点是成本更低,加工时间更快。不过气体发泡的方法不适合制造复杂形状的支架,并且在单独使用气体发泡技术制备多孔支架时,孔间的连通率通常较低。目前可以通过与其他制备方法联合使用或添加其他材料来进行改善。MANAVITEHRANI等[10]对聚碳酸亚丙酯、淀粉和生物玻璃颗粒共混物使用气体发泡的方法,开发出一种具有良性降解副产物的多孔支架,经过观察,气体发泡技术有效地产生了具有高孔隙互连性的多孔结构。PETRIE ARONIN等[11]提出了一种新型支架制造方法,使用聚合物共混挤出和气体发泡技术来控制孔径分布。在对聚合物单独挤出和共挤出后分别进行发泡处理,发现单独使用挤出方法的支架产生的孔面积较大,但是孔隙率较低,孔间的连通性也较差;而在气体压力和退火时间保持恒定的条件下,在两种聚合物的共挤出之后进行气体发泡促进了更大范围的孔径分布,且对总孔隙率几乎没有影响。 气体发泡技术常通过控制材料与发泡剂的混合比来调控孔径,一般在该过程产生的气体越多,孔隙度水平就越高。聚乳酸、聚己内酯等具有适合于气体发泡的流变特性,已广泛用于该技术[12]。不过只是通过聚合物材料制备很难满足人工骨支架的需求,可以通过添加陶瓷填料以形成聚合物-陶瓷复合支架来改善聚合物支架的骨传导性能。另外由于常用的发泡剂一般都不利于细胞繁殖和生长,且在制备过程中不能很好地控制孔的尺寸和分布,用化学发泡制备组织工程多孔支架需要优化过程。MOON等[13]在制备了醋酸纤维素膜后,通过气体发泡与相关的化学反应同时进行,使银纳米粒子覆盖到三维纤维素上,制备了三维纤维素-银纳米粒子支架。对其研究后发现,这样的支架易于制造,具有良好的生物活性、抗菌效果和生物相容性。此外,也有学者通过应力-应变曲线的线性区域研究了气体发泡结构的力学性能[10]。 2.2 低温凝胶 其制备方法也被称为冷冻凝胶法,该方法先通过搅拌或超声等方法将凝胶剂(如高分子聚合物)均匀分散到溶剂中;然后将聚合物溶液冷冻至低于冰点的温度,使凝胶剂在溶剂中发生相分离产生微孔结构[14];接着将凝胶样品保持在低温条件下,直至凝胶完全形成和固化。凝胶形成后,通过洗涤、干燥后获得所需样品。 低温凝胶的制备由于在较低温度下进行,制备凝胶的过程可以更好地控制,避免材料的热降解,可以用于制备高度互连的多孔结构和高机械稳定性支架。另外预制的大孔冷冻凝胶支架可以种植细胞,细胞/支架结构可以通过小口径针输送,在细胞输送后几乎完全恢复几何形状,这可以保持高的细胞活力[15],但凝胶及其衍生物形成的支架通常力学性能较差。此外当低温凝胶法用作于制造组织再生的支架时,缺乏能够充分支持细胞黏附和增殖的特定细胞信号传导基序[16]。为了解决这一限制,一种策略是将凝胶或其衍生物与其他材料整合,以形成杂化或复合水凝胶,从而具有结合多种组分的优点。KAI等[17]研究发现纳米纤维(聚己内酯/明胶)增强的水凝胶与纯明胶水凝胶相比,复合水凝胶的杨氏模量显著增加,进行体外培养时细胞在支架上的增殖数量也有明显的提升。 低温凝胶技术适用一系列的生物相容性材料且几乎不改变材料原有的性能,这使得该工艺成为流行的选择。SALGADO等[18]将胶原蛋白溶液与纳米羟基磷灰石聚集体溶液以特定比例混合,在低温条件下加上交联剂制备了胶原及胶原-羟基磷灰石凝胶,结果发现羟基磷灰石纳米颗粒的添加可以改善材料的力学性能和生物降解能力,通过体外实验证实了冷冻凝胶提高了细胞活力,并且细胞能够进行增殖和成骨分化。KIM等[19]采用低温凝胶法来表征成骨蛋白、生物玻璃添加剂和药物的联合作用,通过体外细胞培养,发现了细胞能够进行持续的增殖分化。 已经有研究发现,低温凝胶在交联阶段所允许的时间用量对支架的形态有着直接的影响。一般情况下,允许交联时间越长,支架孔隙率水平越高,相邻孔间距越小[20]。 此外,在材料的选择上,相较从聚合物中获得的冷冻凝胶,明胶基冷冻凝胶展现出明显的优越性[21]。 2.3 增材制造 也被称为3D打印技术,是一种通过逐层添加材料来加工组织结构的先进制造方法,通过计算机控制设备逐层制造,将一层层的材料堆积成实体来创建复杂的三维结构。目前可以通过对打印参数的优化设计实现对支架外形、孔隙率等的精确调控[22]。由于增材制造技术在生物医用材料上精密、智能以及快捷的特性,目前在制造医用材料上已成为主流的方法[23]。同时增材制造技术在与患者相关的护理方面显示出惊人的潜力,可以依据需求为临床提供个性化设计,并匹配专门的定制部件。目前从解剖模型到定制骨支架,再到临床的挑战性转变,均体现出了增材制造技术的灵活性和多功能性[24]。增材制造技术的方法种类很多,其中粘合剂喷射、选择性激光烧结、熔融沉积成型、立体光刻和数字光处理是广泛用于组织支架的制造方法。 2.3.1 粘合剂喷射 也称为基于粉末的3D打印。通过使用粘合剂,发生化学或其他相互作用,将粉末状材料结合,在该过程中,打印头将有机粘合剂溶液逐滴施加到粉末床表面的选定区域上,以这种方式构建第一层,然后将构建平台降低限定的高度,重新散布新的粉末层,以相同的方式重复这些步骤,直到完成整个部件。再通过后处理(如固化、脱脂和烧结等)进行进一步的固结,以达到最终产品的最大可能密度[25]。 作为一种3D打印方式,粘合剂喷射可以制备出具有复杂结构的、与患者高度匹配的植入体。与其他使用液体材料的制造技术相比,粘合剂喷射的方式不受工作材料分散、稳定性不高等相关问题的影响,在构建过程中也不需要支撑结构[26];另外,在材料的选择上只要是粉末态基本上均可以使用,也可以进行彩色打印。不过粘合剂喷射技术制备的支架在强度和精度上较其他的增材制造技术会差一些[27]。此外,为了提升治疗效果,有时会添加一些药物和生物因子。粘合剂喷射技术是会将药物和生物因子直接掺入基质,由于高温条件下药物和生物因子会热解,使用粘合剂喷射的方法可能达不到预期的效果。 粘合剂喷射技术主要使用金属和陶瓷材料,陶瓷材料的种类又以生物陶瓷和结构陶瓷为主。其中,多孔陶瓷由于优异的热绝缘性和物理性能而应用广泛,然而在常规的制造环境中,需要额外的工艺用于人工孔隙控制。此外,由于成形工艺的限制,这些方法在制造产品的几何设计方面较差[28],但可以通过添加不同类型的氧化物流动剂以及对温度等参数控制,来克服传统制造工艺的局限性。有学者通过使用氧化铝粉末作为氧化物流动剂,较好地实现了多孔陶瓷的制备[25]。 在使用粘合剂喷射技术时,打印支架的精度和强度与粉末、粘结剂、印刷参数、热处理、设备及后处理等密切相关,其中以粉末和粘结剂的选择最为重要。就陶瓷粉末而言,其流动性和堆积密度会受到几何性能(如形状和粒度分布等)的影响。球形颗粒的流动性更加优异,而不规则形状的颗粒会具有更高的堆积密度。有研究者使用羟基磷灰石进行了实验,在烧结后发现尽管使用不规则粉末打印的零件相较球形打印的零件孔隙率略低,但零件的机械性能高出近一倍[29]。粘合剂性能是影响支架质量的另一项关键因素,但生物相容性、生物降解性、毒性和机械强度等要求限制了可用于骨支架制造的粘合剂数量。WEI等[30]对此采用分子动力学模拟和实验的方法,研究了3种聚合物粘结剂(聚乙烯吡咯烷酮,聚丙烯酰胺,聚乙烯醇)在羟基磷灰石骨三维制作中的内聚能密度、力学性能、粘结行为和表面形态,通过揭示3种聚合物粘合剂的粘合机制,为粘合剂的选择提供了理论依据。此外,有学者针对羟基磷灰石粉末与标准水基油墨之间难以混合的问题,通过将羟基磷灰石粉末与聚乙烯醇作为粘合喷射制剂,来改善羟基磷灰石粉末基支架的结构、机械和生物性能[31]。其他因素如热处理也会影响打印陶瓷的高功能性。CHAVEZ等[32]分析了烧结条件对介电和压电能力的影响,发现垂直于印刷层测试的压电响应比平行测试的压电响应高35%以上。 2.3.2 选择性激光烧结 此工艺出现在20世纪80年代,是通过使用高功率激光器(如二氧化碳激光器)熔融或烧结粉末材料的连续层来生产聚合物部件的制造技术。在该过程中,高功率激光束由控制系统按CAD数据进行轨迹的精确控制,利用激光束扫描,对可熔粉末进行烧结,被照射的粉末材料在激光束的瞬间高温下熔融,并与相邻的材料颗粒结合,形成固态的物体层。在完成当前层的烧结之后,工作台会降低相应的层厚度,再次加装一层粉末材料,重复上述过程,直到整个物体构建完成。在冷却后用高压空气砂磨或用加压空气清洁[33]。 选择性激光烧结技术具有多个优点,如无须支撑结构制造复杂几何形状的能力,允许使用多种材料混合以及产品表面粗糙等[34]。由于加工过程涉及的温度相对较低,因此适合加工低熔点聚合物,但是设备的成本较高[35]。在加工陶瓷材料时,选择性激光烧结技术可用于制备无裂纹的致密陶瓷部件,研究发现制备的陶瓷部件具有极高的熔点、低塑性和较低的抗热震性[36]。虽然选择性激光烧结方法制备的陶瓷部件分辨率低,表面光洁度差,但在构建多孔骨支架方面的应用仍然广泛[37]。 近年来,已有许多通过选择性激光烧结工艺制备出生物相容性能良好的骨支架。LIN等[38]通过选择性激光烧结的方法,使用纳米羟基磷灰石和聚丙交酯复合微球制备了骨支架,该支架具有较好的细胞黏附性。此外,在利用选择性激光烧结技术时,可以向粉末混合物中添加陶瓷改性剂,来增强支架的骨诱导和骨传导性能;也可以通过添加生长因子使支架能进一步增强骨的生成。为了减弱热降解的风险,生长因子通常稍晚些通过浸泡加入。SASKA等[39]通过在聚羟基丁酸酯支架上加入成骨生长肽,使支架具有了一定的促进成骨和造血功能。另外也有学者通过添加纳米氧化钛等材料,使打印的支架具有良好的抑菌性能[40]。 此外,不同的研究人员探索使用选择性激光烧结技术来调控支架的表面质量和孔隙率。PAXTON等[41]通过比较新型激光烧结多孔高密度聚乙烯支架、传统模制的高密度聚乙烯支架和临床金标准植入物支架的孔隙率变化,来研究表面化学性质和孔隙率对组织向内生长的影响,与其他方法制备的支架相比,激光烧结支架显示出更高的“组织向内生长”和血管形成的能力。同样,对于骨科应用,MUMITH等[42]通过激光烧结制备了具有不同孔径的复合材料支架,这表明择性激光烧结技术具有制造不同孔径支架的潜力。 另外,也有学者研究材料以及工艺参数的选择对支架性能的影响。HAN等[43]采用选择性激光烧结法,制备了多个生物活性玻璃/聚己内酯复合支架,支架的硼酸盐生物活性玻璃含量各不相同,经检测发现这些支架结构的机械强度足以支撑在修复期间的稳定性。IMANIAN等[44]采用聚乙烯醇和炭黑复合材料,通过选择性激光烧结技术,制备了支架样件,分析了主要工艺参数及其交互作用对表面粗糙度和尺寸精度的影响,发现激光速度、扫描间距、激光功率、和层间厚度均显著影响表面粗糙度和尺寸精度。因此在具体的材料和设备条件下,需要对工艺参数进行优化,以获得良好的性能。 2.3.3 熔融沉积成型 该方法是将热塑性材料在螺杆挤出机的工作下挤出成丝,然后在机械作用下,将热塑丝条送进液化器流道,通过喷嘴将材料按预定的路径挤出,在打印平台上冷却凝固。一层结束后,平台高度下降一个层厚,重复过程一直到样件成型。此外,在制造一些结构复杂的样件(如空腔、悬突等)结构时,需要添加支撑材料,在后续处理时再去除支撑。 相较于其他的增材制造技术,熔融沉积成型方法涉及到的设备较为简单,成本较低,只需要液化器加热及运动机构就可以实现;打印过程清洁无污染,也不涉及高温高压,安全性高;对于需要有支撑结构的部件进行机械剥离或化学溶解即可[45],后处理简单。CALì等[46]通过聚乳酸以及农业废弃物的有机副产物作为原料,以评估熔融沉积成型打印的适用性,结果发现在轻量化、强度和粗糙度方面的性能均适合于生物医学的应用。此外,这种创新的生物复合材料允许降低环境影响的成本以及生产管理成本。不过熔融沉积成型制备的支架往往表面粗糙、精度较差,同时对材料要求熔点不能过高[47]。 熔融沉积成型技术可用于制备特定孔径和孔隙率的骨支架,并具有互连的孔结构[48-49]。DHANDAPANI等[50]采用熔融沉积技术制造了互连多孔、可生物降解的皮质骨螺钉,而传统螺钉成型技术无法制造这种螺钉。另外,由于大多数熔融沉积成型技术使用的长丝材料是石油基,在印刷过程中可能会释放有毒物质,因此熔融沉积成型技术可使用的材料较为有限。目前开发用于熔融沉积成型的生物基长丝越来越受欢迎,已有许多研究在熔融沉积成型技术中使用来自可再生资源(如玉米、玉米糖蜜和甜菜糖含量)的合成聚合物来作为支架材料[46,51-52]。 在用熔融沉积成型方法制造骨支架时,需要重点考虑设计结构、材料和工艺参数3个因素。微结构设计是骨支架制备的重要环节。骨支架结构分为两种,第一种是基于单位单元设计,第二种是基于整个设计。诸如八隅结构晶格和螺旋晶格的结构设计可以具有与骨支架一样优异的压缩性能。工艺参数的设置(层厚度、光栅角度、构建方向、填充密度、打印速度、填充图案、挤出温度、光栅宽度、喷嘴直径、轮廓宽度、轮廓到轮廓气隙、轮廓数和气隙)对结构部件的特征及其生产效率同样具有重大影响[51]。有学者对连续纤维增强复合材料进行实验,总结了打印温度、层厚、纤维体积分数及打印速度等熔融沉积成型常见的参数对复合材料产品的力学性能影响[53]。 2.3.4 立体光刻 该方法使用光学能量源来扫描光聚合物液体的容器,从而固化液体表面上的特定区域。通常定位支撑板(打印床)在液面正下方,打印一层后,将该板从表面移开一个距离,其尺寸等于下一层的厚度。重复这个过程,逐渐堆叠每一层的固态材料,形成完整的打印物体。打印完成后,需要进行后处理以去除未固化的树脂和支撑结构[54]。 除了易于操作、有光滑的表面光洁度以及制造复杂结构的能力外,立体光刻技术的一个突出特点是具有良好的分辨率,因此在组织工程中实用性较好。不过立体光刻技术制备成型件主要面临树脂的黏度大、收缩率高、生物相容性光聚合物的可用性限制等问题。对此有学者通过使用硅烷偶联剂制备了超支化聚硅氧烷,研究了不同含量聚硅氧烷对试件的体积收缩率和线收缩率的影响,并得出了最优值[55]。此外由于用于立体光刻的大多数聚合物未被FDA批准,在使用时可能会引起未知的反应问题,导致产生毒性,立体光刻打印物的安全性问题值得关注[56]。 作为被首个发现的增材制造方法[57],立体光刻技术已广泛用于制造各种骨科应用的支架。ALEXANDER等[58]使用立体光刻技术,利用氧化铝陶瓷浆料制备了4种不同的大孔陶瓷骨植入物。THAVORNYUTIKARN等[59]证明立体光刻技术可以制备各种相互连接的多孔有序支架,通过改变支架的孔径可以调控支架的机械强度。CHEN等[60]通过立体光刻技术制备了聚乙二醇二丙烯酸酯/纳米羟基磷灰石生物材料,实验发现印刷样品的压缩强度满足骨组织的抗压强度要求。 在工艺参数的选择上,有学者通过建立高精度的仿真模型研究了激光功率和扫描速度对双应力植入式三维打印机形成过程的影响,揭示了其机制[61],结果表明立体光刻技术打印的残余应力随扫描速度的增加而减小,随激光功率的增加而增大。另外,立体光刻方法中的打印分辨率主要取决于工艺中使用的激光直径和层厚度参数[62]。此外,也有学者研究了孔几何形状对立体光刻制造的钙硅酸盐生物陶瓷支架结构强度的影响[63]。 2.3.5 数字光处理 该技术与立体光刻技术的基本原理相同,即通过紫外光的选择性照射来控制陶瓷浆料的局部固化,不同的是,数字光处理技术通过使用对象横截面图像的紫外线光或蓝光投影代替激光,固化液体光聚合物。另外,连续数字光处理技术通过利用连续层图像的连续数字投影来创建从一个层到下一个层的平滑过渡,从而使数字光处理技术有着高分辨率和更光滑表面光洁度的结构[64]。 相较立体光刻技术,数字光处理技术具有更好的分辨率和更快的处理速度[65]。同样,由于光聚合在光和光引发剂的存在下发生,有毒的光聚合物、光引发剂、染料引发剂和溶剂造成严重的细胞毒性风险,缩小了可行材料的部署范围。 数字光处理技术在结构陶瓷领域应用广泛,但受限于光源和投影设备,数字光处理技术通常用于制造尺寸不大的陶瓷零件。 PREOBRAZHENSKIY等[66]使用数字光处理方法制备基于填充磷酸钙的水凝胶生物复合材料,有望作为用于骨组织恢复的弹性生物植入物。WU等[67]通过数字光处理技术为打印磷酸钙陶瓷提供一种高精度和低缺陷的闭环解决方案,获得了高性能磷酸钙陶瓷。也有学者使用含氮化硅的陶瓷聚合物与光敏树脂浆料,通过数字光处理制备了复杂结构的陶瓷基复合材料[68]。研究发现,陶瓷填料的引入不仅防止了材料在热解过程中的坍塌,而且有效地降低了材料的线收缩率和质量损失。此外,作为增强相,显著提高了最终复合材料的机械性能。 不过,通过数字光处理打印制备高精度羟基磷灰石增强复合材料以有效促进骨再生仍然是一个挑战。为此,SONG等[69]以明胶甲基丙烯酰胺和羟基磷灰石复合油墨,通过数字光处理技术制备了高精度的骨修复支架,经测量,多孔复合支架的实际打印分辨率达到了100 μm。在体外实验中,多孔复合支架显著促进了成骨细胞的黏附和增殖,并促进了成骨分化。 在数字光处理制造工艺参数的选择上,增加暴露于UV光的时间在改善材料的弹性性质和强度方面起相关作用。在暴露时间较长时,设定小的层厚度有助于改善拉伸性能;由于其有限的透明度而在材料中发生有限的聚合,使用太大的层厚度会降低机械拉伸性能;此外,承重聚合物部件的工艺设置和印刷布局需要特别注意,因为它们对最终的机械特性影响很大[70]。 2.4 静电纺丝 是一种制备纳米纤维的技术,利用静电力将聚合物溶液或熔融聚合物从尖端喷出,形成纤维纳米级别的结构。液体聚合物在所施加压力的作用下,液体材料以液滴的形式被挤出针尖,并且暴露于喷丝头和收集器之间的静电场中,静电场作用在该液滴外层上的带电材料颗粒上,将它们拉向更靠近集电板的单个点(通常称为泰勒锥),随着朝向收集器尖端方向积累增长,材料进一步伸长最终导致材料从喷丝头侧加速转移到收集器而不破坏链节。同时在材料朝向收集器加速转移过程中,观察到直径进一步减小,使得该过程能够制造具有纳米/微米尺度直径的纤维[71]。 相较其他的制备技术,静电纺丝技术的突出特点是可以生产具有大表面积的微米至纳米级纤维[72]。有学者制备了聚己内酯/羧甲基壳聚糖/海藻酸钠复合微米纤维,研究发现复合微米纤维具有优良的拉伸强度,同时复合支架无明显的细胞毒性,可促进成骨细胞的黏附[73]。静电纺丝纤维膜通过动态压缩应变和分层影响成骨细胞的增殖和分化,这往往有利于细胞的附着和生长[74]。不过由于静电纺丝支架固有的弱机械性能,限制了其在骨再生和骨修复方面的临床应用。 目前根据溶液状态分为传统的溶液静电纺丝和熔体静电纺丝。相较传统静电纺丝,熔体静电纺丝的纳米纤维有着高比表面积、高孔隙率等特点,纤维射流的路径更稳定,也没有有机溶剂残留[75]。不过,也有学者提出了将熔融静电纺丝书写(熔融静电纺丝书写技术是熔体静电纺丝与3D打印相结合的一种新兴技术,与传统3D打印技术相比,该方法可以实现亚微米纤维的精确定位,比3D打印技术小约2个数量级)和溶液静电纺丝相结合来制备微纳米分级骨组织工程支架。有学者使用聚己内酯和明胶材料,通过交替堆叠熔融静电纺丝书写层和溶液静电纺丝层来制备多层复合支架[76],结果表明,两种技术相结合的复合支架比单熔融静电纺丝书写具有更高的细胞黏附效率、细胞增殖能力和成骨能力。该在研究中,通过交替堆叠溶液静电纺丝制备的纳米明胶纤维和熔融静电纺丝制备的聚己内酯微米纤维来制造复合支架。首先将明胶纳米纤维通过常规溶液静电纺丝制备,然后将覆盖有明胶纳米纤维的导电玻璃放置在移动平台上,进行熔融静电纺丝制备聚己内酯网格,此过程重复5次。图3为通过组合溶液静电纺丝和熔融静电纺丝书写制造聚己内酯/明胶分级支架的示意图。"

静电纺丝的加工可塑性有利于生产各种聚合物纤维。通过将合成聚合物(作为骨架材料)与天然聚合物(在表面上用于改善细胞黏附)组合,可以生产具有最佳机械和相容性的复合纤维支架用于生物医学应用。另外针对静电纺丝支架的弱机械性能,有学者提出一种通过增材制造来打印网状增强的电纺支架方法[77],以提高其机械刚度和强度。将明胶与聚己内酯按一定的比例制成静电纺丝支架,由聚乳酸组成的网状物打印在支架上,结果发现通过3D打印网状材料增强的电纺支架改善了力学性能,并在大鼠颅骨缺损中表现出可接受的生物相容性。此外,也有学者将明胶和聚左旋乳酸组合,使用静电纺丝和熔融沉积技术制备了具有多种功能的新型层状支架,可用于软骨下骨和鼻软骨修复[78]。多材料复合以及与其他制备技术的一同使用,也许有助于解决静电纺丝支架性能的一些局限性。 静电纺丝纳米纤维的直径和形态取决于几个参数,这些参数分为3个主要类别:溶液的固有性质、工艺参数和环境因素[79]。溶液的固有性质(如浓度、黏度、分子质量、电导率、弹性以及溶剂的极性和表面张力)对静电纺丝纳米纤维的形态和最终直径具有显著影响[80]。表1列举了一些静电纺丝工艺参数对纤维形态的具体影响。另外环境因素数如环境的湿度和温度也是非常重要,高的湿度会阻碍纺丝过程和带电喷射,而在低温下会形成珠粒,高温下形成凝聚和扁平纤维。"

| [1] SHI W, ZHANG X, BIAN L, et al. Alendronate crosslinked chitosan/polycaprolactone scaffold for bone defects repairing. Int J Biol Macromol. 2022;204:441-456. [2] CHEN Z, KLEIN T, MURRAY RZ, et al. Osteoimmunomodulation for the development of advanced bone biomaterials. Mater Today. 2016;19(6):304-321. [3] WANG P, LI X, LUO S, et al. Additively manufactured heterogeneously porous metallic bone with biostructural functions and bone-like mechanical properties. J Mater Sci Technol. 2021;62:173-179. [4] DOROZHKIN SV. A detailed history of calcium orthophosphates from 1770s till 1950. Mater Sci Eng C Mater Biol Appl. 2013;33(6):3085-3110. [5] KOONS GL, DIBA M, MIKOS AG. Materials design for bone-tissue engineering. Nat Rev Mater. 2020;5(8):584-603. [6] 罗卓荆, 毕龙. 我国骨缺损修复的成就与展望[J].空军军医大学学报,2022, 43(4):263-267. [7] WANG Z, WANG Y, YAN J, et al. Pharmaceutical electrospinning and 3D printing scaffold design for bone regeneration. Adv Drug Deliv Rev. 2021;174:504-534. [8] 王阮彬,程丽乾,陈凯.高分子材料在3D打印生物骨骼及支架中的应用与价值[J].中国组织工程研究,2022,26(4):610-616. [9] POURSAMAR SA, HATAMI J, LEHNER AN, et al. Gelatin porous scaffolds fabricated using a modified gas foaming technique: characterisation and cytotoxicity assessment. Mater Sci Eng C Mater Biol Appl. 2015;48:63-70. [10] MANAVITEHRANI I, LE TYL, DALY S, et al. Formation of porous biodegradable scaffolds based on poly (propylene carbonate) using gas foaming technology. Mater Sci Eng C Mater Biol Appl. 2019;96:824-830. [11] PETRIE ARONIN CE, COOPER JA JR, SEFCIK LS, et al. Osteogenic differentiation of dura mater stem cells cultured in vitro on three-dimensional porous scaffolds of poly (epsilon-caprolactone) fabricated via co-extrusion and gas foaming. Acta Biomater. 2008;4(5):1187-1197. [12] COSTANTINI M, COLOSI C, MOZETIC P, et al. Correlation between porous texture and cell seeding efficiency of gas foaming and microfluidic foaming scaffolds. Mater Sci Eng C Mater Biol Appl. 2016;62:668-677. [13] MOON JY, LEE J, HWANG TI, et al. A multifunctional, one-step gas foaming strategy for antimicrobial silver nanoparticle-decorated 3D cellulose nanofiber scaffolds. Carbohydr Polym. 2021;273:118603. [14] CARVALHO BMA, DA SILVA SL, DA SILVA LHM, et al. Cryogel poly (acrylamide): synthesis, structure and applications. Sep Purif Rev. 2013;43(3):241-262. [15] HUANG YH, CHEN HA, CHEN CH, et al. Injectable gelatin/glucosamine cryogel microbeads as scaffolds for chondrocyte delivery in cartilage tissue engineering. Int J Biol Macromol. 2023;253(Pt 1):126528. [16] DI MUZIO L, SERGI C, CARRIERO VC, et al. Gelatin-based spongy and compressive resistant cryogels with shape recovery ability as ideal scaffolds to support cell adhesion for tissue regeneration. React Funct Polym. 2023;189:105607. [17] KAI D, PRABHAKARAN MP, STAHL B, et al. Mechanical properties and in vitro behavior of nanofiber-hydrogel composites for tissue engineering applications. Nanotechnology. 2012;23(9):095705. [18] SALGADO CL, GRENHO L, FERNANDES MH, et al. Biodegradation, biocompatibility, and osteoconduction evaluation of collagen-nanohydroxyapatite cryogels for bone tissue regeneration. J Biomed Mater Res A. 2016;104(1):57-70. [19] KIM HD, AMIRTHALINGAM S, KIM SL, et al. Biomimetic materials and fabrication approaches for bone tissue engineering. Adv Healthc Mater. 2017. doi:10.1002/adhm.201700612. [20] KUMAR A, MISHRA R, REINWALD Y, et al. Cryogels: freezing unveiled by thawing. Mater Today. 2010;13(11):42-44. [21] HE Y, WANG C, WANG C, et al. An overview on collagen and gelatin-based cryogels: fabrication, classification, properties and biomedical applications. Polymers (Basel). 2021;13(14):2299. [22] 史耕田.PLGA/PCL复合材料人工骨支架高温挤出3D打印制造方法和性能研究[D]. 宁波:宁波大学,2020. [23] 张光曦,刘世锋,杨鑫,等.增材制造技术制备生物植入材料的研究进展[J].粉末冶金技术,2019,37(4):312-318. [24] CHARBONNIER B, HADIDA M, MARCHAT D. Additive manufacturing pertaining to bone:Hopes, reality and future challenges for clinical applications. Acta Biomater. 2021;121:1-28. [25] KWON M, CHOI JH, KIM JH, et al. Optimization of inorganic powder properties for manufacturing ceramic filter using binder jetting process. Addit Manuf. 2023; 70:103564. [26] LV X, YE F, CHENG L, et al. Binder jetting of ceramics: powders, binders, printing parameters, equipment, and post-treatment. Ceram Int. 2019;45(10):12609-12624. [27] 陈现伦,杨建明,黄大志,等.3DP法三维打印技术制备骨科植入物的发展现状[J].热加工工艺,2018,47(4):35-39. [28] HAMMEL EC, IGHODARO OLR, OKOLI OI. Processing and properties of advanced porous ceramics: an application based review. Ceram Int. 2014;40(10):15351-15370. [29] SUWANPRATEEB J, SANNGAM R, PANYATHANMAPORN T. Influence of raw powder preparation routes on properties of hydroxyapatite fabricated by 3D printing technique. Mater Sci Eng C. 2010;30(4):610-617. [30] WEI Q, WANG Y, CHAI W, et al. Molecular dynamics simulation and experimental study of the bonding properties of polymer binders in 3D powder printed hydroxyapatite bioceramic bone scaffolds. Ceram Int. 2017;43(16):13702-13709. [31] ZHOU Z, LENNON A, BUCHANAN F, et al. Binder jetting additive manufacturing of hydroxyapatite powders: effects of adhesives on geometrical accuracy and green compressive strength. Addit Manuf. 2020;36:101645. [32] CHAVEZ LA, IBAVE P, WILBURN B, et al. The influence of printing parameters, post-processing, and testing conditions on the properties of binder jetting additive manufactured functional ceramics. Ceramics. 2020;3(1):65-77. [33] DADKHAH M, TULLIANI JM, SABOORI A, et al. Additive manufacturing of ceramics: advances, challenges, and outlook. J Eur Ceram Soc. 2023;43(15):6635-6664. [34] ZHOU M, ZHU W, YU S, et al. Selective laser sintering of carbon nanotube–coated thermoplastic polyurethane:Mechanical, electrical, and piezoresistive properties. Compos Part C: Open Access. 2022;7:100212. [35] SOLEYMANI S, NAGHIB SM. 3D and 4D printing hydroxyapatite-based scaffolds for bone tissue engineering and regeneration. Heliyon. 2023;9(9):e19363. [36] CHEN AN, WU JM, LIU K, et al. High-performance ceramic parts with complex shape prepared by selective laser sintering: a review. Adv Appl Ceram. 2017; 117(2):100-117. [37] CHEN Z, LI Z, LI J, et al. 3D printing of ceramics: a review. J Eur Ceram Soc. 2019; 39(4):661-687. [38] LIN K, LIU J, WU JM, et al. Selective laser sintered nano-HA/PDLLA composite microspheres for bone scaffolds applications. Rapid Prototyp J. 2020;26(6):1131-1143. [39] SASKA S, PIRES LC, COMINOTTE MA, et al. Three-dimensional printing and in vitro evaluation of poly(3-hydroxybutyrate) scaffolds functionalized with osteogenic growth peptide for tissue engineering. Mater Sci Eng C Mater Biol Appl. 2018;89: 265-273. [40] SHUAI C, SHUAI C, FENG P, et al. Antibacterial capability, physicochemical properties, and biocompatibility of nTiO(2) incorporated polymeric scaffolds. Polymers (Basel). 2018;10(3):328. [41] PAXTON NC, DINORO J, REN J, et al. Additive manufacturing enables personalised porous high-density polyethylene surgical implant manufacturing with improved tissue and vascular ingrowth. Appl Mater Today. 2021;22:100965. [42] MUMITH A, CHEONG VS, FROMME P, et al. The effect of strontium and silicon substituted hydroxyapatite electrochemical coatings on bone ingrowth and osseointegration of selective laser sintered porous metal implants. PLoS One. 2020;15(1):e0227232. [43] HAN J, WU J, XIANG X, et al. Biodegradable BBG/PCL composite scaffolds fabricated by selective laser sintering for directed regeneration of critical-sized bone defects. Mater Des. 2023;225:111543. [44] IMANIAN ME, BIGLARI FR. Modeling and prediction of surface roughness and dimensional accuracy in SLS 3D printing of PVA/CB composite using the central composite design. J Manuf Process. 2022;75:154-169. [45] 冯东,王博,刘琦,等.高分子基功能复合材料的熔融沉积成型研究进展[J].复合材料学报,2021,38(5):1371-1386. [46] CALÌ M, PASCOLETTI G, GAETA M, et al. New filaments with natural fillers for FDM 3D printing and their applications in biomedical field. Procedia Manuf. 2020;51: 698-703. [47] LIGON SC, LISKA R, STAMPFL J, et al. Polymers for 3D printing and customized additive manufacturing. Chem Rev. 2017;117(15):10212. [48] KIM CG, HAN KS, LEE S, et al. Fabrication of biocompatible polycaprolactone–hydroxyapatite composite filaments for the FDM 3D printing of bone scaffolds. Appl Sci. 2021;11(14):6351. [49] COCKERILL I, SU Y, SINHA S, et al. Porous zinc scaffolds for bone tissue engineering applications: a novel additive manufacturing and casting approach. Mater Sci Eng C Mater Biol Appl. 2020;110:110738. [50] DHANDAPANI R, KRISHNAN PD, ZENNIFER A, et al. Additive manufacturing of biodegradable porous orthopaedic screw. Bioact Mater. 2020;5(3):458-467. [51] WINARSO R, ANGGORO PW, ISMAIL R, et al. Application of fused deposition modeling (FDM) on bone scaffold manufacturing process: a review. Heliyon. 2022;8(11):e11701. [52] WASTI S, ADHIKARI S. Use of biomaterials for 3D printing by fused deposition modeling technique: a review. Front Chem. 2020;8:315. [53] 牟宇松,姜沅政,李红宾,等.基于FDM技术的连续纤维增强复合材料研究进展[J].工程塑料应用,2021,49(12):153-156, 161. [54] MALIK HH, DARWOOD AR, SHAUNAK S, et al. Three-dimensional printing in surgery:a review of current surgical applications. J Surg Res. 2015;199(2):512-522. [55] 曹嘉欣. SLA-3D打印光敏树脂的改性及其性能研究[D].西安:西安科技大学,2020. [56] LAKKALA P, MUNNANGI SR, BANDARI S, et al. Additive manufacturing technologies with emphasis on stereolithography 3D printing in pharmaceutical and medical applications: a review. Int J Pharm X. 2023;5:100159. [57] JACOBS P. Rapid prototyping manufacturing-Fundamentals of stereolithography. J Manuf Syst. 1993;12(5):430-433. [58] ALEXANDER AE, WAKE N, CHEPELEV L, et al. A guideline for 3D printing terminology in biomedical research utilizing ISO/ASTM standards. 3D Print Med. 2021;7(1):8. [59] THAVORNYUTIKARN B, TESAVIBUL P, SITTHISERIPRATIP K, et al. Porous 45S5 Bioglass(R)-based scaffolds using stereolithography: effect of partial pre-sintering on structural and mechanical properties of scaffolds. Mater Sci Eng C Mater Biol Appl. 2017;75:1281-1288. [60] CHEN Q, ZOU B, LAI Q, et al. SLA-3d printing and compressive strength of PEGDA/nHAP biomaterials. Ceram Int. 2022;48(20):30917-30926. [61] 赵丽.面向医用植入体的氧化锆基陶瓷材料3D打印残余应力产生机理研究[D].济南:山东大学,2021. [62] CARTER SD, COSTA PF, VAQUETTE C, et al. Additive Biomanufacturing: an advanced approach for periodontal tissue regeneration. Ann Biomed Eng. 2017;45(1):12-22. [63] LU F, WU R, SHEN M, et al. Rational design of bioceramic scaffolds with tuning pore geometry by stereolithography:Microstructure evaluation and mechanical evolution. J Eur Ceram Soc. 2021;41(2):1672-1682. [64] WALLACE J, WANG MO, THOMPSON P, et al. Validating continuous digital light processing (cDLP) additive manufacturing accuracy and tissue engineering utility of a dye-initiator package. Biofabrication. 2014;6(1):015003. [65] GARDAN J. Additive manufacturing technologies:state of the art and trends. Int. J Prod Res. 2015;54(9-10):3118-3132. [66] PREOBRAZHENSKIY II, TIKHONOV AA, EVDOKIMOV PV, et al. DLP printing of hydrogel/calcium phosphate composites for the treatment of bone defects. Open Ceramics. 2021;6:100115. [67] WU Y, CAO Q, WANG Y, et al. Optimized fabrication of DLP-based 3D printing calcium phosphate ceramics with high-precision and low-defect to induce calvarial defect regeneration. Mater Des. 2023;233:112230. [68] 欧俊,黄民忠,黄瑶,等.基于DLP技术打印制备聚合物转化陶瓷基复合材料的研究[J].陶瓷学报,2023,44(1):154-162. [69] SONG P, LI M, ZHANG B, et al. DLP fabricating of precision GelMA/HAp porous composite scaffold for bone tissue engineering application. Composites Part B. 2022;244:110163. [70] BRIGHENTI R, MARSAVINA L, MARGHITAS MP, et al. The effect of process parameters on mechanical characteristics of specimens obtained via DLP additive manufacturing technology. Mater Today Proc. 2023;78:331-336. [71] FAZAL F, DIAZ SANCHEZ FJ, WAQAS M, et al. A modified 3D printer as a hybrid bioprinting-electrospinning system for use in vascular tissue engineering applications. Med Eng Phys. 2021;94:52-60. [72] MOVAHEDI M, ASEFNEJAD A, RAFIENIA M, et al. Potential of novel electrospun core-shell structured polyurethane/starch (hyaluronic acid) nanofibers for skin tissue engineering:In vitro and in vivo evaluation. Int J Biol Macromol. 2020;146:627-637. [73] TAO F, CHENG Y, TAO H, et al. Carboxymethyl chitosan/sodium alginate-based micron-fibers fabricated by emulsion electrospinning for periosteal tissue engineering. Mater Des. 2020;194:108849. [74] GUPTA D, VENUGOPAL J, MITRA S, et al. Nanostructured biocomposite substrates by electrospinning and electrospraying for the mineralization of osteoblasts. Biomaterials. 2009;30(11):2085-2094. [75] 姚子琪,马东明,雷文龙,等.熔体静电纺丝直写技术在组织工程中的应用进展[J].化工进展,2019,38(8):7. [76] WANG Z, WANG H, XIONG J, et al. Fabrication and in vitro evaluation of PCL/gelatin hierarchical scaffolds based on melt electrospinning writing and solution electrospinning for bone regeneration. Mater Sci Eng C. 2021;128(4):112287. [77] PENSA NW, CURRY AS, BONVALLET PP, et al. 3D printed mesh reinforcements enhance the mechanical properties of electrospun scaffolds. Biomater Res. 2019;23(1):22. [78] RAJZER I, KUROWSKA A, JABŁOŃSKI A, et al. Layered gelatin/PLLA scaffolds fabricated by electrospinning and 3D printing- for nasal cartilages and subchondral bone reconstruction. Mater Des. 2018;155(OCT.):297-306. [79] SUN B, LONG YZ, ZHANG HD, et al. Advances in three-dimensional nanofibrous macrostructures via electrospinning. Prog Polym Sci. 2014;39(5):862-890. [80] SILL TJ, VON RECUM HA. Electrospinning:applications in drug delivery and tissue engineering. Biomaterials. 2008;29(13):1989-2006. |
| [1] | Yang Yufang, Yang Zhishan, Duan Mianmian, Liu Yiheng, Tang Zhenglong, Wang Yu. Application and prospects of erythropoietin in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1443-1449. |
| [2] | Chen Kaijia, Liu Jingyun, Cao Ning, Sun Jianbo, Zhou Yan, Mei Jianguo, Ren Qiang. Application and prospect of tissue engineering in treatment of osteonecrosis of the femoral head [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1450-1456. |
| [3] | Mei Jingyi, Liu Jiang, Xiao Cong, Liu Peng, Zhou Haohao, Lin Zhanyi. Proliferation and metabolic patterns of smooth muscle cells during construction of tissue-engineered blood vessels [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1043-1049. |
| [4] | Wang Shanshan, Shu Qing, Tian Jun. Physical factors promote osteogenic differentiation of stem cells [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1083-1090. |
| [5] | Shen Ziqing, Xia Tian, Shan Yibo, Zhu Ruijun, Wan Haoxin, Ding Hao, Pan Shu, Zhao Jun. Vascularized tracheal substitutes constructed by exosome-load hydrogel-modified 3D printed scaffolds [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 697-705. |
| [6] | Zhu Liwei, Wang Jiangyue, Bai Ding. Application value of nanocomposite gelatin methacryloyl hydrogels in different bone defect environments [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 753-758. |
| [7] | Xu Rong, Wang Haojie, Geng Mengxiang, Meng Kai, Wang Hui, Zhang Keqin, Zhao Huijing. Research advance in preparation and functional modification of porous polytetrafluoroethylene artificial blood vessels [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 759-765. |
| [8] | Yin Tong, Yang Jilei, Li Yourui, Liu Zhuoran, Jiang Ming. Application of core-shell structured nanofibers in oral tissue regeneration [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 766-770. |
| [9] | Chen Xiaofang, Zheng Guoshuang, Li Maoyuan, Yu Weiting. Preparation and application of injectable sodium alginate hydrogels [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 789-794. |
| [10] | Wang Jiani, Chen Junyu. Angiogenesis mechanism of metal ions and their application in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 804-812. |
| [11] | Yang Yuqing, Chen Zhiyu. Role and application of early transient presence of M1 macrophages in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 594-601. |
| [12] | Li Yulin, Yu Haipeng, Tang Huajing, Zhang Zitong, Lin Xingnan. The mechanism, safety and application of berberine in promoting bone regeneration [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(35): 5702-5708. |
| [13] | Yu Pengxin, Han Yuqiu, Guo Lina, Wang Xiuli. The construction of rat intestinal smooth muscle collagen band and evaluation of periodic stretching culture in vitro [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(35): 5630-5635. |
| [14] | Shang Yonghui, Li Shuai, Liu Yicong, Zhao Qihang, Liu Wen. Three-dimensional finite element study on the effect of posterior tooth forward movement on temporomandibular joint stress in orthodontic reduction patients [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(34): 5516-5520. |
| [15] | Huang Keqi, Li Jiagen, Chen Shangtong, Rong Xiangbin. Mechanisms of long non-coding RNA in osteoarthritis and traditional Chinese medicine intervention [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(34): 5571-5576. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||

