Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (29): 4671-4676.doi: 10.12307/2024.589
Previous Articles Next Articles
Applications of 3D printing in periodontal tissue engineering
Nie Wen1, Huang Hongli1, Mo Wenwen1, Long Guiyue1, Liao Hongbing2
- 1Guangxi Key Laboratory of Oral and Maxillofacial Restoration and Reconstruction, Guangxi Cranio-Maxillofacial Malformation Clinical Research Center, Guangxi Health Commission Key Laboratory of Prevention and Treatment for Oral Infectious Diseases, 2Department of Prosthetics, School of Stomatology, Guangxi Medical University, Nanning 530021, Guangxi Zhuang Autonomous Region, China
-
Received:2023-10-23Accepted:2023-12-28Online:2024-10-18Published:2024-03-22 -
Contact:Liao Hongbing, Chief physician, Professor, Department of Prosthetics, School of Stomatology, Guangxi Medical University, Nanning 530021, Guangxi Zhuang Autonomous Region, China -
About author:Nie Wen, Master candidate, Guangxi Key Laboratory of Oral and Maxillofacial Restoration and Reconstruction, Guangxi Cranio-Maxillofacial Malformation Clinical Research Center, Guangxi Health Commission Key Laboratory of Prevention and Treatment for Oral Infectious Diseases, School of Stomatology, Guangxi Medical University, Nanning 530021, Guangxi Zhuang Autonomous Region, China -
Supported by:National Natural Science Foundation of China, No. 82160192 (to LHB)
CLC Number:
Cite this article
Nie Wen, Huang Hongli, Mo Wenwen, Long Guiyue, Liao Hongbing. Applications of 3D printing in periodontal tissue engineering[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(29): 4671-4676.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
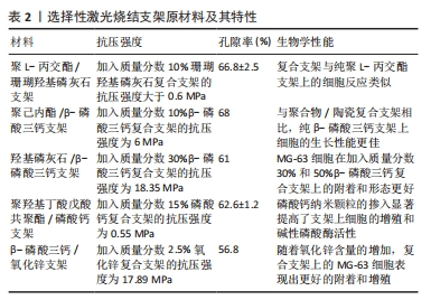
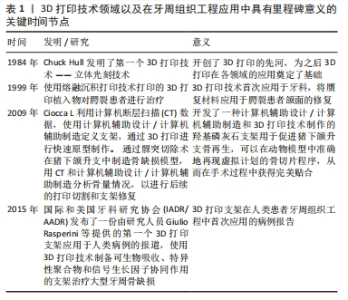
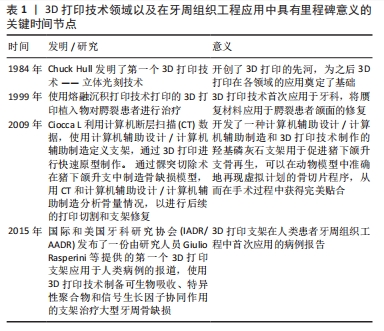
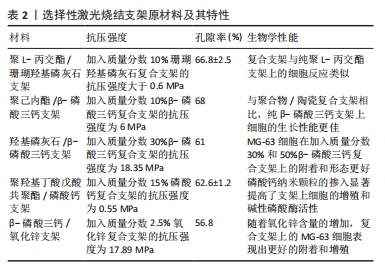
2.2 激光辅助3D打印 激光辅助3D打印采用激光辅助、光固化或立体光刻技术技术以生成印刷和生物印刷产品。 2.2.1 选择性激光烧结技术 1986年,Carl Deckard和Joe Beaman发明了选择性激光烧结技术[16]。选择性激光烧结技术利用高功率二氧化碳激光器将聚合物粉末的微小颗粒融合在一起,这一过程由计算机控制,激光会将粉末加热至略低于其熔点(烧结),从而将粉末颗粒融合成固体;随后,选择性激光烧结机器的平台下降,揭示出一层新的粉末,以供激光烧结和融合,这个过程持续进行,直到整个对象被完全打印出来。由于物体被粉末包裹,因此这种技术无需额外的支撑结构。RASPERINI等[17]使用选择性激光烧结技术对含4%羟基磷灰石的聚己内酯粉末进行3D打印,用于治疗牙周骨缺损的病例,是个性化3D打印生物可吸收支架治疗牙周缺损的首次应用,尽管该支架的长期应用并不成功,但提示基于3D打印的支架在牙周重建过程中仍具有一定的潜力。与其他增材制造技术相比,选择性激光烧结技术存在一些缺点:尺寸精度相对较低,通常只能达到150-180 μm[18];此外,选择性激光烧结技术还面临一些其他挑战,包括无法在打印过程中合并生长因子和细胞[18],以及由于热扭曲引起的支架收缩和翘曲问题[19]。不同选择性激光烧结支架原材料及其特性总结,见表2。"
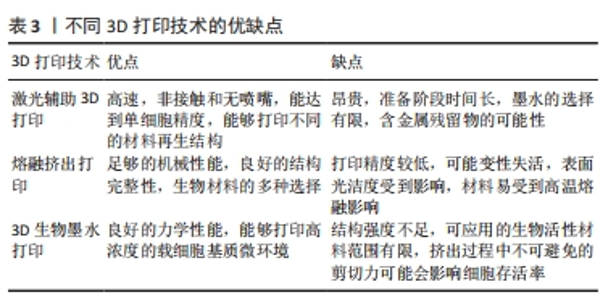
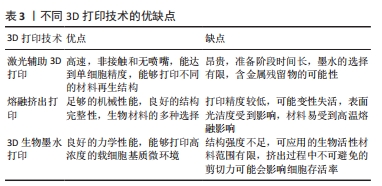
2.2.2 激光诱导前沿技术 激光诱导前沿技术辅助打印机基本上由3个主要组成部分构成:脉冲激光源,用作印刷材料支持的目标(通常是透明的载玻片或色带),以及用于收集这些材料的接收基材。在打印过程中,一个聚焦的激光脉冲照射到目标的一个小区域,这个区域包括表面上的能量吸收层和下方的生物墨水溶液;接着,部分能量吸收层被蒸发并形成液滴,这些液滴被收集到接收基材上并在其中交联[20-21]。MIYAJI等[22]报道了两种用于牙齿表面修饰的激光技术,其中在打印过程中首先制备一层掺入细胞黏附蛋白的磷灰石薄膜作为原料,在单个激光脉冲照射后将其转移至牙齿表面,因加工时间短对薄膜热影响较小,因此该薄膜仍表现出良好的细胞黏附活性。激光辅助技术允许用高细胞密度和高黏度的生物材料进行生物打印,并且使用无喷嘴的仪器,避免了由其他技术产生的堵塞或高剪切应力问题,但成本高、印刷技术复杂是其主要缺点。 2.3 熔融挤出打印 2.3.1 熔融沉积模型 熔融沉积模型是一项由Scott Crump于20世纪80年代末发明并申请专利的技术[23],是目前最常见的3D打印技术之一,为基于热塑性聚合物的逐层打印原理。在熔融沉积模型过程中,热塑性聚合物在其熔点加热经过由固态到半固态的相变后,通过喷嘴挤压成直径介于160-700 μm之间的细丝。 熔融沉积模型技术具有许多优点,包括高打印速度、通过使用多个喷头能同时打印多种不同的材料[24];此外,熔融沉积模型技术具有高度可重复性,能够相对较快地控制最终支架的关键物理特性,如力学性能、孔隙度和孔隙形状[25]。VAHDATINIA等[26]将采用熔融沉积模型技术打印的明胶/弹性蛋白/透明质酸钠膜与两种市场上应用于牙周组织再生的传统胶原膜(Botiss Jason?和Smartbrane-Regedent membranes)进行比较,组织学评估发现3D打印膜组的新骨形成水平更高,提示3D打印明胶/弹性蛋白/透明质酸钠膜可安全有效地用于牙周组织再生治疗,其效果优于或与商业胶原膜相当,是一种具有潜力的替代品。然而,熔融沉积模型技术也伴随一些限制:首先,它受到材料的限制,只能使用热塑性材料作为原料;其次,最终支架的精度和形状取决于挤压出后的冷却和硬化速度[27]。尽管存在这些限制,熔融沉积模型仍然是一种经济实惠的技术,具有高速打印的能力,特别是在使用多喷头打印机时可以同时打印多种材料[28]。 2.3.2 熔融静电直写技术 熔融静电直写技术是制备具有微尺度三维多孔结构材料或支架的一种方法[29-31]。熔融静电直写设备包括一个装有加热系统的打印头,用于将材料融化,然后通过金属喷嘴注射。熔融静电直写头部配备了计算机辅助翻译系统,以实现直接模型写入到收集器中。输送系统(通常是通过空气压力)将聚合物熔体挤出喷嘴,同时在喷嘴之间施加电场,以产生电场效应,当电场克服喷嘴尖端液滴的表面张力时会在短时间内形成一个泰勒锥;一旦电场达到临界值,电荷斥力超过表面张力,液体喷流会从泰勒锥表面喷射出来[32]。喷流经历一系列稳定和不稳定的拉伸过程,导致纤维变得更长、更细,最终在接收装置上形成纤维。通过反复堆积和固化聚合物纤维,根据增材制造原理可以制造具有明确孔隙率和高表面结构的支架[33-34]。 相对于其他支架制造方法(如溶液静电纺丝),熔融静电直写技术的一个显著特点是无溶剂特性[35],这使其在组织工程和再生医学领域具有广泛应用[36-39]。BLAUDEZ等[40]将熔融静电直写技术打印的支架与人成骨细胞共培养以沉积骨特异性细胞外基质,同时使用牙周膜细胞制备细胞膜片,随后与骨细胞外基质支架复合形成双相牙周膜结构,将得到的双相结构进行脱细胞处理以保留沉积的基质,在牙周缺损模型中比较新鲜脱细胞支架与保存3个月冻干支架的再生性能,组织学显示两组支架中新形成的牙骨质和牙周附着量相似。 熔融静电直写技术在设计支架宏观几何结构和微观结构方面具有多功能性。支架的微结构(包括纤维直径、孔径和孔形等)对细胞行为产生深远影响,包括细胞附着[41]、对齐[42]、增殖、迁移以及天然生物学功能[43],这些都是推动熔融静电直写技术发展的关键因素。需要注意的是,由于黏度较高及电场拉伸有限等原因,熔融静电直写技术制造的纤维直径通常比溶液静电纺丝大,一般在微米级别,这也限制了该技术在需要高表面积比支架中的使用[44]。 2.4 生物墨水打印 3D生物墨水打印过程包括6个主要阶段:①数据采集:这一阶段涉及使用X射线扫描、计算机断层扫描、MRI或直接使用计算机辅助设计软件等方法来获取有关要打印的结构数据,这些数据经过处理后将被转换为打印机可读的文件[45]。②生物墨水的选择:根据印刷技术和印刷结构的需求选择适当的生物墨水。生物墨水通常是由水凝胶或其前体形式构成,其中嵌入所需类型的细胞,这些生物墨水以逐层方式用于构建组织状结构。生物墨水必须具备适当的力学性能、生物相容性和可打印性,以满足印刷的要求。生物墨水可以包含分离的细胞、生长因子和其他生物打印材料,并且根据需要进行制备,以适应生理条件、pH值和印刷结构[46-47]。③设置打印参数:根据所选的生物墨水和打印产品的期望结构,配置适当的打印参数。④生物打印:执行生物打印过程,并且在过程中仔细观察打印产品,必要时进行打印参数的调整。打印分辨率通常是根据具体的打印机和生物墨水类型来确定的,提高分辨率可能会增加打印时间[48]。⑤印刷后阶段:这一阶段可能包括对印刷对象进行旋转和显微镜评估。生物打印后的对象通常需要在特定条件下保存,例如在培养箱或生物反应器中。⑥生物打印产品的放置:最终的生物打印产品可以被放置在体内或体外的条件下,从而实现预期的治疗效果。 YANG等[49]利用甲基丙烯酸酯明胶/脱细胞细胞外基质载细胞生物墨水设计了一种具有高度结构完整性的3D生物打印仿生牙周模块,该模块具有良好的力学性能和取向引导功能;在比格犬牙周缺损模型中,生物打印模块显著增强了牙周组织的再生,证明了3D生物打印结合特异性脱细胞细胞外基质生物墨水用于牙周组织再生的有效性和可行性。 在牙周组织工程中,3D生物墨水打印技术具有控制孔隙大小、形状、分布和互联性的能力。此外,通过将生物打印技术与成像测试(如锥形束计算机断层扫描)相结合可以制定专门的结构,以满足不同病例和特定情况的需求[50]。不同3D打印技术的优缺点见表3。"

2.5 用于3D打印的材料 2.5.1 有机聚合物 有机聚合物在再生医学领域尤其是骨再生领域受到广泛研究,这些有机聚合物主要是生物可降解的,具有适当的生物相容性,因此成为组织工程支架的理想材料[51]。有机聚合物包括各种不同类型的材料,从软到硬、从合成到天然。在组织工程中,常见的有机聚合物包括聚己内酯、聚醚醚酮、聚乳酸、聚乳酸共乙醇酸和壳聚糖[52-53]。聚合物的选择取决于研究者的具体研究目标,例如:聚乳酸或聚己内酯通常被用于药物传递,而海藻酸盐和明胶常用于细胞封装[54-55]。 天然有机聚合物(如壳聚糖、海藻酸盐、多肽、胶原蛋白和水凝胶)由于能够被酶降解的特性,也在再生医学中备受关注。水凝胶具有较高的可塑性,是出色的生物活性分子载体,同时还具备良好的生物相容性和细胞亲和性,因此已成为3D生物墨水打印中重要的支架材料,特别在牙周再生领域具有重要的应用潜力[56-57]。 合成聚合物在再生医学领域中扮演着重要角色,其中最常用的材料之一是脂肪族聚醚,包括聚己内酯、聚乳酸、聚乙醇酸以及它们的共聚物(乳酸共乙醇酸)[58],这些材料各自具有特定的特点:①聚乳酸具有高热稳定性、良好的细胞相容性和无毒的降解产物。聚乳酸的聚合单体乳酸存在2种光学异构体——L-乳酸和D-乳酸,因此有左旋聚L-乳酸、右旋聚D-乳酸和消旋聚DL-乳酸3种异构体。通过调整2种光学异构体的比例可以优化聚乳酸的降解速率。②乳酸共乙醇酸是聚乙醇酸和聚乳酸的组合,具有出色的生物相容性、生物降解性和可调的机械性能[59],被FDA批准用于医疗应用。③聚己内酯已获得FDA批准用于骨修复。聚己内酯具有良好的溶解性、低熔点及出色的混合相容性等优点[60]。相对于聚乳酸和聚乙醇酸,聚己内酯易于加工。由于聚己内酯的降解速度较慢,对于需要长期植入医疗设备的开发非常有用。聚己内酯的降解主要通过酯键的非酶水解切割,因此需要较长时间(三四年)才能完全降解。 这些高分子材料的多样性赋予它们高度的多功能性,当与3D打印提供的卓越空间分辨率结合时在牙周组织再生领域具有广泛的应用前景。 2.5.2 无机材料 (1)金属:金属生物材料(如钛及其合金)具有一些独特的特点,包括高强度、低弹性模量和低密度。在牙周组织工程中,钛网和钛合金通常被用作不可吸收的金属屏障膜,以及用于增强可吸收胶原蛋白膜和聚四氟乙烯等材料。 研究人员发现钛网的厚度和孔径会影响下方新骨的生长,适当的孔径和厚度在促进骨组织生长过程中发挥着至关重要的作用。研究表明0.4 mm厚度的钛网不仅具有足够的强度,而且对黏膜的刺激较小,因此更适合临床应用[61]。钛网具有良好的生物力学性能[62-63],可以有效维持成骨空间,防止上皮细胞和结缔组织细胞的迁移,因此,它在重建明显的颌骨缺损和牙槽骨缺损方面已被广泛应用[64]。 (2)生物陶瓷:在再生医学领域,生物活性陶瓷包括生物玻璃和磷酸钙,尤其是羟基磷灰石和β-磷酸三钙,这些生物活性陶瓷是固体化学物质,可以与周围的骨组织进行固定结合,从而促进周围骨组织的再生。 羟基磷灰石与自然骨组织具有化学和结构上的相似性,因此具有一定的骨诱导性质,然而其体内外降解速度相对较慢。 β-磷酸三钙的结构也与骨组织相似,但其在体内的降解速度较快。纯β-磷酸三钙支架通常太脆,难以处理,通过添加人工合成有机材料可以提高支架的强度。研究表明3D打印的磷酸三钙/聚乳酸混合支架具有更好的稳定性,并且能够促进成骨细胞的迁移[65-66]。 生物陶瓷因卓越的生物兼容性、亲水性和生物活性被视为骨重建的理想材料,它们与骨组织中的无机成分非常相似,具有骨传导性和潜在的骨诱导性。具有内在骨诱导特性的生物陶瓷具有触发非分化细胞向成骨谱系分化的能力。不同3D打印原材料及其优缺点见表4。"


2.6 3D打印在牙周组织工程中的应用 2.6.1 单相支架 单相支架是一种具有特定隔间结构的支架,具备以下特点和功能[67]:维持和稳定可再生的骨缺损;确保骨增殖,不受上皮细胞的干扰,促进骨缺损的愈合;在时间和空间上控制愈合过程。 (1)纯单相支架:CARREL等[68]研究人员使用一种由分层磷酸三钙和羟基磷灰石组成的3D打印多孔支架(OsteoFlux?,OF)进行实验,将其植入成年绵羊颅骨上评估了多孔支架引导的垂直骨生长高度,并将其与颗粒状牛骨和颗粒状磷酸三钙进行比较,在前8周观察到3D打印多孔支架组骨生长显著增加,至16周时3组间没有差异。 MANGANO等[69]通过挤压打印制备了一种由30%羟基磷灰石、60%β-磷酸三钙和10%α-磷酸三钙组成的孔隙率为60%的单相支架,将其植入羊鼻窦后表现出很好的耐受性,植入后第45天观察到缺损周围发生骨重塑,植入后第90天观察到外周层骨的形成,然而植入90 d后支架继续吸收,留下了不完全填充的骨缺损并形成了纤维组织区域。 ZHAO等[70]使用3D打印选择性激光熔融方法制备了钛-纳米合金的多孔合金网络,并且在该网格上形成壳聚糖/明胶/强力霉素的多孔涂层,支架表面的涂层能够有效阻止成纤维细胞的生长,同时允许营养物质的浸润,此外还具有抗菌作用。 (2)载细胞单相支架:这种策略通过在3D打印支架结构中接种不同类型的细胞来增加愈合的潜力,可以实现具有单一或异质细胞群体、定义明确且几何复杂的结构[71],以产生在生理和形态上类似于相关活性组织的结构[72-73]。到目前为止,根据细胞类型和生物墨水组成,基于挤压的生物打印技术在生物打印结构中的细胞活力在80%-90%之间。水凝胶前体通常被用作生物墨水,因为它们可以提供高度水合和渗透的3D聚合结构,改善营养和氧气扩散,从而提高细胞活性和功能[74]。实质上,水凝胶提供了一个类似于细胞外基质的微环境,可以调节使细胞优先在水凝胶结构中迁移。 DAN等[75]通过静电纺丝技术制备了含磷酸钙涂层的聚己内酯支架,将该支架与从牙周不同部位(牙龈结缔组织、牙周膜和牙槽骨)来源的细胞膜片相关联,植入大鼠牙周缺损模型中发现其促进了牙周缺损处骨、牙骨质和新附着的形成。 (3)释放生长因子单相支架:生物活性分子和生长因子在牙周组织再生中起着关键作用,包括釉原蛋白、成纤维细胞生长因子(包括碱性成纤维细胞生长因子和成纤维细胞生长因子)、血小板衍生生长因子、富血小板血浆、骨形态发生蛋白等,这些生物活性分子调节着牙周和间充质干细胞的迁移、分化、增殖,以及细胞的趋化性和特异性细胞外基质的产生[76]。 对于生长因子的传递,合成聚合物支架具有延迟降解的特性和改进的力学性能,然而将这些生物元素直接混合到支架结构中常常因高温制造过程和使用强有机溶剂而导致这些生物元素的变性。为了克服这些限制,微球作为载体被广泛应用于组织工程,尤其是牙周组织再生。 CHO等[77]的研究设计了一种聚己内酯支架,通过挤压打印方式制备了负载骨形态发生蛋白2、骨形态发生蛋白7和结缔组织生长因子的聚乳酸共乙醇酸微球,这一支架的特点是改变了包裹生长因子分子的释放曲线,使生长因子能够以延迟的方式释放。在体外植入人牙根表面后,支架中的微球能够实现生长因子的缓慢释放,其中骨形态发生蛋白7的释放诱导了骨水泥样组织的形成。延迟释放的特性还有助于促进后期的骨水泥形成。这种方法为促进牙周组织再生提供了一种有效策略。 2.6.2 双相支架 在牙周组织复杂的结构中,骨再生与牙骨质和牙周膜的新形成有关。因此,为了实现多组织牙周再生,双相支架与多相支架应运而生,它们特殊的支架结构以及独特化学特征能够用来模拟牙周组织的带状结构。 (1)单纯双相支架:VAQUETTE等[78]开发了由聚己内酯和20%β-磷酸三钙制成的双相3D打印支架,支架孔隙率为70%,孔隙互连率为100%。在这种支架结构中,一部分用于骨区,而另一部分则通过聚己内酯溶液的静电纺丝创建用于支持和递送成熟牙周膜细胞的薄片,该双相支架与牙本质切片结合后植入无胸腺皮下的大鼠模型中,观察到具有牙周膜细胞片测试组大约67%的牙本质表面显示了新的牙骨质样组织,而没有牙周膜细胞片测试组仅17%的牙本质表面显示了新的牙骨质样组织,这表明双相支架的设计有助于骨和牙周膜区的再生,为牙周组织再生提供了新的视野。 (2)载细胞双相支架:WANG等[79]的研究团队应用引导组织再生概念和3D制造方法开发了一种载牙龈成纤维细胞的胶原蛋白/锶掺杂硅酸钙双相支架,以引导牙周组织再生。研究结果显示,锶掺杂硅酸钙表面在浸泡14 d后形成了羟基磷灰石,并且在浸泡6个月后仍能释放锶和硅离子;体外研究表明,双层支架增强了人牙龈成纤维细胞释放成纤维细胞生长因子2、骨形态发生蛋白2和血管内皮生长因子等生长因子,同时增加了Wharton’s Jelly间充质干细胞释放成骨相关蛋白碱性磷酸酶、骨涎蛋白和骨钙素。将该支架植入动物骨质疏松模型中,发现该支架能够增加骨密度、骨结构参数骨小梁厚度和骨体积分数的比率,增强骨质疏松性骨再生,表明这种方法对于促进牙周组织再生和骨再生具有潜力。 (3)释放生长因子双相支架:HUANG等[80]设计了一种由明胶和β-磷酸三钙/羟基磷灰石组成的双相冷冻凝胶支架,通过负载促牙骨质形成的釉基质衍生物和促进成骨形成的骨形态发生蛋白2,成功实现了牙周组织的再生。 2.6.3 三相支架 牙骨质的形成具有挑战性,因为它依赖于内源性细胞来促进牙骨质在根牙本质表面的沉积。因此,为了更好地促进牙骨质的再生,可以考虑和实施第三个组织特异性区域——即三相支架。这种支架在牙周组织再生中起关键作用,因为它可以同时促进牙骨质的再生并支持牙周膜纤维的有序排列,为整个再生过程提供更多的控制和支持。 (1)纯三相支架:LIANG等[81]开发了一种新型支架,结合细胞特异性细胞外基质来增强牙周组织再生,该支架的表层和底层分别涂覆了牙周膜细胞和牙骨质细胞特异性的去细胞化细胞外基质,以模拟牙周组织的结构和功能。研究结果表明该支架具有良好的纤维形成、水分保持、生物降解、力学强度和细胞增殖和分化特性,能够有效诱导牙周膜细胞和牙骨质细胞的定向分化,促进牙周组织的再生。 (2)载细胞三相支架:CHEN等[82]开发了牙骨质蛋白1、聚己内酯和Ⅰ型胶原三相支架并接种了牙周膜干细胞,将支架植入缺陷大鼠模型中,经过8周的观察发现牙骨质样组织形成。 (3)释放生长因子三相支架:LEE等[83]制备了具有组织特定带状排列的三相聚己内酯/羟基磷灰石支架,其中微通道的直径分别适用于牙骨质、牙周膜和牙槽骨,分别为100,600,300 μm,这种支架结构允许创建逐层的组织特定带状支架。他们还将具有再生信号的聚乳酸共乙醇酸微球引入特定区域,这些信号包括釉原蛋白(用于牙骨质区域)、结缔组织生长因子(牙周膜区域)和骨形态发生蛋白2(用于骨区域),以促进组织特异性细胞分化。体外在支架上植入牙槽骨、牙周膜干细胞和牙髓干细胞以及区域特异性的GFS偶联,发现了新骨和牙骨质样组织的形成,种植牙髓干细胞的支架产生了排列整齐的牙周膜样胶原,位于新骨和牙骨质附近,表明通过时空输送不同的蛋白质可以在体内将单个细胞分化为多组织牙周复合体。 尽管三相支架在牙周组织再生中表现出巨大的潜力,但由于其临床应用仍具有挑战性,还需要进一步的研究和探索。三相支架可以帮助模拟和促进多组织的牙周复合体再生,为口腔医学和牙周组织工程领域提供新的前景。"

| [1] FU Z, OUYANG L, XU R, et al. Responsive biomaterials for 3D bioprinting: A review. Materi Today. 2022;52:112-132. [2] STEPANOVSKA J, SUPOVA M, HANZALEK K, et al. Collagen Bioinks for Bioprinting: A Systematic Review of Hydrogel Properties, Bioprinting Parameters, Protocols, and Bioprinted Structure Characteristics. Biomedicines. 2021;9(9):1137. [3] DALY AC, PRENDERGAST ME, HUGHES AJ, et al. Bioprinting for the Biologist. Cell. 2021;184(1):18-32. [4] KANG X, ZHANG XB. Bioprinting for bone tissue engineering. Front Bioeng Biotechnol. 2022;10:2296-4185. [5] CHAE S, CHO DW. Biomaterial-based 3D bioprinting strategy for orthopedic tissue engineering. Acta Biomater. 2023;156:4-20. [6] ZHANG J, XU W, LI C, et al. Tissue Engineering Microtissue: Construction, Optimization, and Application. Tissue Eng Part B Rev. 2022;28(2):393-404. [7] WANG J, CUI Z, MANIRUZZAMAN M. Bioprinting: A focus on improving bioink printability and cell performance based on different process parameters. Int J Pharm. 2023;640:123020. [8] ROATO I, MASANTE B, PUTAME G, et al. Challenges of Periodontal Tissue Engineering: Increasing Biomimicry through 3D Printing and Controlled Dynamic Environment. Nanomaterials (Basel). 2022;12(21):3878. [9] MIAO G, LIANG L, LI W, et al. 3D Bioprinting of a Bioactive Composite Scaffold for Cell Delivery in Periodontal Tissue Regeneration. Biomolecules. 2023;13(7):1062. [10] ROATO I, MASANTE B, PUTAME G, et al. Challenges of Periodontal Tissue Engineering: Increasing Biomimicry through 3D Printing and Controlled Dynamic Environment. Nanomaterials (Basel). 2022;12(21):3878. [11] YANG X, MA Y, WANG X, et al. A 3D-Bioprinted Functional Module Based on Decellularized Extracellular Matrix Bioink for Periodontal Regeneration. Adv Sci (Weinh). 2023;10(5):e2205041. [12] YAO Y, RAYMOND JE, KAUFFMANN F, et al. Multicompartmental Scaffolds for Coordinated Periodontal Tissue Engineering. J Dent Res. 2022;101(12):1457-1466. [13] MATAI I, KAUR G, SEYEDSALEHI A, et al. Progress in 3D bioprinting technology for tissue/organ regenerative engineering. Biomaterials. 2020;226:119536. [14] KWAN JC, DONDANI J, IYER J, et al. Biomimicry and 3D-Printing of Mussel Adhesive Proteins for Regeneration of the Periodontium-A Review. Biomimetics (Basel). 2023;8(1):78. [15] LIU P, LI Q, YANG Q, et al. Evaluation of the effect of 3D-bioprinted gingival fibroblast-encapsulated ADM scaffolds on keratinized gingival augmentation. J Periodontal Res. 2023;58(3):564-574. [16] DECKARD CR. Method and apparatus for producing parts by selective sintering. US Patent 4863538, 1989. [17] RASPERINI G, PILIPCHUK SP, FLANAGAN CL, et al. 3D-printed Bioresorbable Scaffold for Periodontal Repair. J Dent Res. 2015;94(9 Suppl):153S-157S. [18] HAN W, KONG LB, XU M. Advances in selective laser sintering of polymers. Int J Extrem Manuf. 2022;4(4): 42002. [19] LUPONE F, PADOVANO E, CASAMENTO F, et al. Process Phenomena and Material Properties in Selective Laser Sintering of Polymers: A Review. Materials (Basel). 2021;15(1):183. [20] LEE CKW, PAN Y, YANG R, et al. Laser-Induced Transfer of Functional Materials. Top Curr Chem (Cham). 2023;381(4):18. [21] REHMAN ZU, YANG F, WANG MM, et al. Fundamentals and Advances in Laser-Induced Transfer. Opt Laser Technol. 2023;160:109065. [22] MIYAJI H, OYANE A, NARAZAKI A. Biological modification of tooth surface by laser-based apatite coating techniques. J Oral Biosci. 2022;64(2):217-221. [23] CRUMP SS. Apparatus and method for creating three dimensional objects. US Patent 5121329, 1992. [24] MISHRA V, NEGI S, KAR S, et al. Recent advances in fused deposition modeling based additive manufacturing of thermoplastic composite structures: A review. J Thermoplast Compos Mater. 2023;36(7):3094-3132. [25] MARTINI M, SCACCIA M, MARCHELLO G, et al. An Outline of Fused Deposition Modeling: System Models and Control Strategies. Appl Sci. 2022;12:5400. [26] VAHDATINIA F, HOOSHYARFARD A, JAMSHIDI S, et al. 3D-Printed Soft Membrane for Periodontal Guided Tissue Regeneration. Materials (Basel). 2023;16(4):1364. [27] MOGAN J, HARUN WSW, KADIRGAMA K, et al. Fused Deposition Modelling of Polymer Composite: A Progress. Polymers (Basel). 2022;15(1):28. [28] SELVARAJ SK, PRASAD SK, YASIN SY, et al. Additive manufacturing of dental material parts via laser melting deposition: A review, technical issues, and future research directions. J Manuf Process. 2022;76:67-78. [29] CHEN Z, LIU Y, HUANG J, et al. Enhanced In Vitro Biocompatible Polycaprolactone/Nano-Hydroxyapatite Scaffolds with Near-Field Direct-Writing Melt Electrospinning Technology. J Funct Biomater. 2022;13(4):161. [30] CAO K, ZHANG F, ZAERI A, et al.Advances in design and quality of melt electrowritten scaffolds. Mater Design. 2023;226:111618. [31] XU T, GU J, MENG J, et al. Melt electrowriting reinforced composite membrane for controlled drug release. J Mech Behav Biomed Mater. 2022;132:105277. [32] TAYLOR GI. Electrically driven jets. Proc R Soc. London, Ser A. 1969;313:453. [33] O’NEILL KL, DALTON PD. A Decade of Melt Electrowriting. Small Methods. 2023; 7(7):e2201589. [34] MUELLER KMA, UNTERRAINER A, ROJAS-GONZÁLEZ DM, et al. Introducing Controlled Microporosity in Melt Electrowriting. Adv Mater Technol. 2023;8: 2201158. [35] MIESZCZANEK P, ROBINSON TM, DALTON PD, et al. Convergence of Machine Vision and Melt Electrowriting. Adv Mater. 2021;33(29):e2100519. [36] REIZABAL A, KANGUR T, SAIZ PG, et al. MEWron: An open-source melt electrowriting platform. Addit Manuf. 2023;71:103604. [37] MIRANI B, MATHEW SO, LATIFI N, et al. Programmable Melt Electrowriting to Engineer Soft Connective Tissues with Prescribed, Biomimetic, Biaxial Mechanical Properties. Adv Funct Mater. 2023:2302786. doi:10.1002/adfm.202302786 [38] DUFOUR A, GALLOSTRA XB, O’KEEFFE C, et al. Integrating melt electrowriting and inkjet bioprinting for engineering structurally organized articular cartilage. Biomaterials. 2022;283:121405. [39] DAGHRERY A, DE SOUZA ARAÚJO IJ, CASTILHO M, et al. Unveiling the potential of melt electrowriting in regenerative dental medicine. Acta Biomater. 2023;156: 88-109. [40] BLAUDEZ F, IVANOVSKI S, VAQUETTE C. Harnessing the Native Extracellular Matrix for Periodontal Regeneration Using a Melt Electrowritten Biphasic Scaffold. J Funct Biomater. 2023;14(9):479. [41] WANG Z, WANG H, XIONG J, et al. Fabrication and in vitro evaluation of PCL/gelatin hierarchical scaffolds based on melt electrospinning writing and solution electrospinning for bone regeneration. Mater Sci Eng C Mater Biol Appl. 2021; 128:112287. [42] CONSTANTE G, APSITE I, ALKHAMIS H, et al. 4D Biofabrication Using a Combination of 3D Printing and Melt-Electrowriting of Shape-Morphing Polymers. ACS Appl Mater Interfaces. 2021;13(11):12767-12776. [43] CASTILHO M, VAN MIL A, MAHER M, et al. Melt electrowriting allows tailored microstructural and mechanical design of scaffolds to advance functional human myocardial tissue formation. Adv Funct Mater. 2018;28(40):1803151. [44] GROßHAUS C, BAKIRCI E, BERTHEL M, et al. Melt Electrospinning of Nanofibers from Medical-Grade Poly(ε-Caprolactone) with a Modified Nozzle. Small. 2020; 16(44):e2003471. [45] CHEN XB, FAZEL ANVARI-YAZDI A, DUAN X, et al. Biomaterials / bioinks and extrusion bioprinting. Bioact Mater. 2023;28:511-536. [46] YANG J, HE H, LI D, et al. Advanced strategies in the application of gelatin-based bioink for extrusion bioprinting. Bio-des Manuf. 2023;6:586-608. [47] FATIMI A, OKORO OV, PODSTAWCZYK D, et al. Natural Hydrogel-Based Bio-Inks for 3D Bioprinting in Tissue Engineering: A Review. Gels. 2022;8(3):179. [48] TUFTEE C, ALSBERG E, OZBOLAT IT, et al. Emerging granular hydrogel bioinks to improve biological function in bioprinted constructs. Trends Biotechnol. 2023:S0167-7799(23)00281-0. doi: 10.1016/j.tibtech.2023.09.007 [49] YANG X, MA Y, WANG X, et al. A 3D-Bioprinted Functional Module Based on Decellularized Extracellular Matrix Bioink for Periodontal Regeneration. Adv Sci (Weinh). 2023;10(5):e2205041. [50] DECANTE G, COSTA JB, SILVA-CORREIA J, et al. Engineering bioinks for 3D bioprinting. Biofabrication. 2021;13(3). doi: 10.1088/1758-5090/abec2c. [51] MATICHESCU A, ARDELEAN LC, RUSU LC, et al. Advanced Biomaterials and Techniques for Oral Tissue Engineering and Regeneration-A Review. Materials (Basel). 2020;13(22):5303. [52] TAPPA K, JAMMALAMADAKA U. Novel Biomaterials Used in Medical 3D Printing Techniques. J Funct Biomater. 2018;9(1):17. [53] BATTISTELLA E, VARONI E, COCHIS A, et al. Degradable polymers may improve dental practice. J Appl Biomater Biomech. 2011;9(3):223-231. [54] OBREGON F, VAQUETTE C, IVANOVSKI S, et al. Three-Dimensional Bioprinting for Regenerative Dentistry and Craniofacial Tissue Engineering. J Dent Res. 2015; 94(9 Suppl):143S-152S. [55] STANSBURY JW, IDACAVAGE MJ. 3D printing with polymers: Challenges among expanding options and opportunities. Dent Mater. 2016;32(1):54-64. [56] ARPORNMAEKLONG P, SAREETHAMMANUWAT M, APINYAUPPATHAM K, et al. Characteristics and biologic effects of thermosensitive quercetin-chitosan/collagen hydrogel on human periodontal ligament stem cells. J Biomed Mater Res B Appl Biomater. 2021;109(10):1656-1670. [57] LIU S, WANG YN, MA B, et al. Gingipain-Responsive Thermosensitive Hydrogel Loaded with SDF-1 Facilitates In Situ Periodontal Tissue Regeneration. ACS Appl Mater Interfaces. 2021;13(31):36880-36893. [58] HOLTEN CH. Lactic Acid. Properties and Chemistry of Lactic Acid and Derivatives. Verlag Chemie, Weinheim, 1971. DOI: 10.1042/bst0010312a [59] COHN D, YOUNES H, MAROM G. Amorphous and crystalline morphologies in glycolic acid and lactic acid polymers. Polymer. 1987;28:2018-2022. [60] ENGELBERG I, KOHN J. Physico-mechanical properties of degradable polymers used in medical applications: a comparative study. Biomaterials. 1991;12(3):292-304. [61] BAI L, JI P, LI X, et al. Mechanical Characterization of 3D-Printed Individualized Ti-Mesh (Membrane) for Alveolar Bone Defects. J Healthc Eng. 2019;2019:4231872. [62] KHOR HL, NG KW, HTAY AS, et al. Preliminary study of a polycaprolactone membrane utilized as epidermal substrate. J Mater Sci Mater Med. 2003;14(2): 113-120. [63] ALAGL AS, MADI M. Localized ridge augmentation in the anterior maxilla using titanium mesh, an alloplast, and a nano-bone graft: a case report. J Int Med Res. 2018;46(5):2001-2007. [64] ABDEL-HADY GEPREEL M, NIINOMI M. Biocompatibility of Ti-alloys for long-term implantation. J Mech Behav Biomed Mater. 2013;20:407-415. [65] MATICHESCU A, ARDELEAN LC, RUSU LC, et al. Advanced Biomaterials and Techniques for Oral Tissue Engineering and Regeneration-A Review. Materials (Basel). 2020;13(22):5303. [66] FERRAGE L, BERTRAND G, LENORMAND P, et al. A review of the additive manufacturing (3DP) of bioceramics: Alumina, zirconia (PSZ) and hydroxyapatite. J Aust Ceram Soc. 2016;53:11-20. [67] WANG Z, HUANG X. Elements of 3D bioprinting in periodontal regeneration: Frontiers and prospects. Processes. 2021;9(10):1724. [68] CARREL JP, WISKOTT A, MOUSSA M, et al. A 3D printed TCP/HA structure as a new osteoconductive scaffold for vertical bone augmentation. Clin Oral Implants Res. 2016;27(1):55-62. [69] MANGANO C, BARBONI B, VALBONETTI L, et al. In Vivo Behavior of a Custom-Made 3D Synthetic Bone Substitute in Sinus Augmentation Procedures in Sheep. J Oral Implantol. 2015;41(3):240-250. [70] ZHAO D, DONG H, NIU Y, et al. Electrophoretic deposition of novel semi-permeable coatings on 3D-printed Ti-Nb alloy meshes for guided alveolar bone regeneration. Dent Mater. 2022;38(2):431-443. [71] MURPHY SV, ATALA A. 3D bioprinting of tissues and organs. Nat Biotechnol. 2014;32(8):773-785. [72] DUBEY N, FERREIRA JA, MALDA J, et al. Extracellular matrix/amorphous magnesium phosphate bioink for 3D bioprinting of craniomaxillofacial bone tissue. ACS Appl Mater Interfaces. 2020;12(21):23752-23763. [73] MÖLLER T, AMOROSO M, HÄGG D, et al. In Vivo Chondrogenesis in 3D Bioprinted Human Cell-laden Hydrogel Constructs. Plast Reconstr Surg Glob Open. 2017; 5(2):e1227. [74] GROLL J, BURDICK JA, CHO DW, et al. A definition of bioinks and their distinction from biomaterial inks. Biofabrication. 2018;11(1):013001. [75] DAN H, VAQUETTE C, FISHER AG, et al. The influence of cellular source on periodontal regeneration using calcium phosphate coated polycaprolactone scaffold supported cell sheets. Biomaterials. 2014;35(1):113-122. [76] DARBY IB, MORRIS KH. A systematic review of the use of growth factors in human periodontal regeneration. J Periodontol. 2013;84(4):465-476. [77] CHO H, TARAFDER S, FOGGE M, et al. Periodontal ligament stem/progenitor cells with protein-releasing scaffolds for cementum formation and integration on dentin surface. Connect Tissue Res. 2016;57(6):488-495. [78] VAQUETTE C, FAN W, XIAO Y, et al. A biphasic scaffold design combined with cell sheet technology for simultaneous regeneration of alveolar bone/periodontal ligament complex. Biomaterials. 2012;33(22):5560-5573. [79] WANG CY, CHIU YC, LEE AK, et al. Biofabrication of Gingival Fibroblast Cell-Laden Collagen/Strontium-Doped Calcium Silicate 3D-Printed Bi-Layered Scaffold for Osteoporotic Periodontal Regeneration. Biomedicines. 2021;9(4):431. [80] HUANG RY, TAI WC, HO MH, et al. Combination of a biomolecule-aided biphasic cryogel scaffold with a barrier membrane adhering PDGF-encapsulated nanofibers to promote periodontal regeneration. J Periodontal Res. 2020;55(4):529-538. [81] LIANG C, WANG G, LIANG C, et al. Hierarchically patterned triple-layered gelatin-based electrospun membrane functionalized by cell-specific extracellular matrix for periodontal regeneration. Dent Mater. 2024;40(1):90-101. [82] CHEN X, LIU Y, MIAO L, et al. Controlled release of recombinant human cementum protein 1 from electrospun multiphasic scaffold for cementum regeneration. Int J Nanomedicine. 2016;11:3145-3158 [83] LEE CH, HAJIBANDEH J, SUZUKI T, et al. Three-dimensional printed multiphase scaffffolds for regeneration of periodontium complex. Tissue Eng Part A. 2014; 20(7-8):1342-1351. |
| [1] | Wang Menghan, Qi Han, Zhang Yuan, Chen Yanzhi. Three kinds of 3D printed models assisted in treatment of Robinson type II B2 clavicle fracture [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1403-1408. |
| [2] | Liu Hanfeng, Wang Jingjing, Yu Yunsheng. Artificial exosomes in treatment of myocardial infarction: current status and prospects [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1118-1123. |
| [3] | Ning Tianliang, Wang Kun, Wang Lingbiao, Han Pengfei. Finite element analysis on correction effect of varus foot orthosis based on the three-point force principle [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(6): 891-899. |
| [4] | Shen Ziqing, Xia Tian, Shan Yibo, Zhu Ruijun, Wan Haoxin, Ding Hao, Pan Shu, Zhao Jun. Vascularized tracheal substitutes constructed by exosome-load hydrogel-modified 3D printed scaffolds [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 697-705. |
| [5] | Zhu Liwei, Wang Jiangyue, Bai Ding. Application value of nanocomposite gelatin methacryloyl hydrogels in different bone defect environments [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 753-758. |
| [6] | Li Yulin, Yu Haipeng, Tang Huajing, Zhang Zitong, Lin Xingnan. The mechanism, safety and application of berberine in promoting bone regeneration [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(35): 5702-5708. |
| [7] | Liu Penghui, Wu Fan, Wang Zejie, Wu Gaoyi, Zhou Libo. Constructing an animal model of temporomandibular joint osteoarthritis in Sprague-Dawley rats by digital technology [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(35): 5642-5648. |
| [8] | Zhang Aili, Huang Jiazheng, Fan Wen, Li Yihuan, Li Shuang, Gan Xuewen, Xiong Ying. Establishing equivalent model to verify the precision of personalized bone model rapidly [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(30): 4795-4799. |
| [9] | Wang Xiao, Zhang Fan, Lin Lupan, Qi Tianxu, Lin Fuqing. Reverse design of a new type of low-profile lateral malleolus steel plate assisted by computer bioengineering technology [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(30): 4800-4805. |
| [10] | Kong Xiangyu, Wang Xing, Pei Zhiwei, Chang Jiale, Li Siqin, Hao Ting, He Wanxiong, Zhang Baoxin, Jia Yanfei. Biological scaffold materials and printing technology for repairing bone defects [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 479-485. |
| [11] | Xu Jing, Lyu Huixin, Bao Xin, Zhang Yi, Wang Yihan, Zhou Yanmin. Application of near infrared responsive hydrogels in tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 486-492. |
| [12] | Xu Xiaodong, Zhou Jiping, Zhang Qi, Feng Chen, Zhu Mianshun, Shi Hongcan. 3D printing process of gelatin/oxidized nanocellulose skin scaffold with high elastic modulus and high porosity [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 398-403. |
| [13] | Yang Jie, Hu Haolei, Li Shuo, Yue Wei, Xu Tao, Li Yi. Application of bio-inks for 3D printing in tissue repair and regenerative medicine [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 445-451. |
| [14] | Dong Bo, Li Xiaoyu, Li Birong, Li Zhen, Wang Zixuan, Yin Zhaoyi, Meng Weiyan. 3D-printed scaffolds repair infected bone defects [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(29): 4685-4690. |
| [15] | Wu Jicenyuan, Zhu Zhou, Pei Xibo. 3D-printed biomimetic hydrogel for repairing tissue damage in motor systems [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(29): 4703-4709. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||