Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (23): 3751-3758.doi: 10.12307/2024.381
Previous Articles Next Articles
Active ingredients of Panax notoginseng regulate signaling pathways related to steroid-induced necrosis of the femoral head
Han Jie1, Peng Qinglin2, Xu Zhiwei1, Wu Yukun1, Ren Guowu2, Xie Xiaozhong2, Jin Wanqing2, Yang Ling2
- 1Department of Joint and Sports Medicine, Ruikang Hospital Affiliated to Guangxi University of Chinese Medicine, Nanning 530000, Guangxi Zhuang Autonomous Region, China; 2Guangxi University of Chinese Medicine, Nanning 530000, Guangxi Zhuang Autonomous Region, China
-
Received:2023-05-25Accepted:2023-06-20Online:2024-08-18Published:2023-09-14 -
Contact:Han Jie, Department of Joint and Sports Medicine, Ruikang Hospital Affiliated to Guangxi University of Chinese Medicine, Nanning 530000, Guangxi Zhuang Autonomous Region, China -
About author:Han Jie, Master, Professor, Chief physician, Department of Joint and Sports Medicine, Ruikang Hospital Affiliated to Guangxi University of Chinese Medicine, Nanning 530000, Guangxi Zhuang Autonomous Region, China -
Supported by:National Natural Science Foundation of China, No. 82260858 (to HJ); Guangxi Education Department Young Teachers’ Scientific Research Ability Improvement Project, No. 2021KY0290 (to XZW); Three-year Action Plan Project for Construction of High-level Talent Team of Guangxi University of Chinese Medicine, No. 2022V001; Guangxi Young Qihuang Scholar Training Project in 2022, No. GTYKEF[2022]13 (to HJ)
CLC Number:
Cite this article
Han Jie, Peng Qinglin, Xu Zhiwei, Wu Yukun, Ren Guowu, Xie Xiaozhong, Jin Wanqing, Yang Ling. Active ingredients of Panax notoginseng regulate signaling pathways related to steroid-induced necrosis of the femoral head[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(23): 3751-3758.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
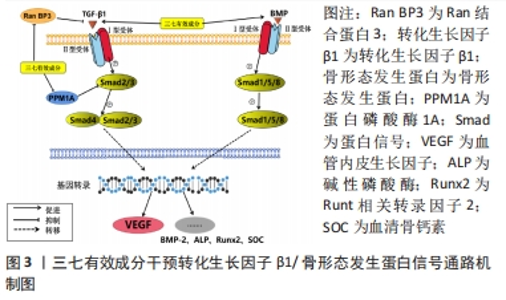
2.1 三七有效成分调控激素性股骨头坏死相关信号通路 三七各种成分能够通过干预转化生长因子β/骨形态发生蛋白、Wnt/β-catenin、丝裂原活化蛋白激酶(mitogen-activited protein kinases,MAPK)、骨保护蛋白,核因子κB受体激活剂(receptor activator of nuclear factor-κB,RANK),核因子κB受体激活剂配体 (receptor activator of nuclear factor-κB ligand,RANKL)及缺氧诱导因子1α等多条信号通路,主要起到促进成骨细胞分化、抑制破骨细胞生成和骨吸收、促进血管内皮细胞生成及血管形成等作用,进而干预激素性股骨头坏死进程。下文将从上述5个激素性股骨头坏死相关信号通路作用机制以及三七活性成分的干预作用展开综述。 2.1.1 转化生长因子β1/骨形态发生蛋白信号通路 转化生长因子β/骨形态发生蛋白信号通路涉及多种生物学过程,包括细胞增殖、凋亡和分化等[14]。转化生长因子β超家族系含有多种细胞因子,如转化生长因子β、骨形态发生蛋白及生长分化因子(growth differentiation factor,GDF)等。转化生长因子β信号通路的传导过程可概括为:转化生长因子β1与细胞表面上的受体结合,并激活信号传导;转化生长因子β配体与转化生长因子β受体Ⅱ结合,激活并磷酸化转化生长因子β受体Ⅰ,被激活的转化生长因子β受体Ⅰ进一步磷酸化Smad蛋白质,形成复合物,随后进入细胞核并与DNA结合,从而影响基因表达。这个复合物可以与其他转录因子相互作用,从而协同调节基因的表达[15]。转化生长因子β可通过调节DNA转录,使成骨细胞前体细胞加速向骨细胞分化,调节细胞周期和基因表达。转化生长因子β还能诱导成骨细胞向骨母细胞和软骨样细胞分化,从而对骨骼生长和再生等方面产生重要影响。骨形态发生蛋白能够促进成骨细胞的增殖、分化和成熟,从而诱导成骨分化。骨形态发生蛋白信号通路可以诱导多种成骨细胞转录因子的表达,如Runt相关转录因子2(runt-relatedtranscription factor 2,Runx2)及成骨细胞特异基因Osterix等,可启动骨特异性基因的表达,并促进骨细胞成熟。此外,骨形态发生蛋白还能够抑制脂肪细胞分化,并在骨再生和修复过程中扮演重要角色[16-18]。激素性股骨头坏死的病理生理机制之一是成骨细胞功能被破坏,转化生长因子β信号通路可以通过调节成骨细胞的增殖、分化和功能,维持骨代谢的平衡,进而促进骨骼的生长和修复激素性股骨头坏死[19]。 蛋白磷酸酶1A(Protein Phosphatase Mg/Mn Dependent 1A,PPM1A)可以通过下调磷酸化的Smad2/3来抑制转化生长因子β1信号的传递和下游效应;Ran结合蛋白3(Ran Binding Protein 3,Ran BP3)可以与转化生长因子β1结合,从而抑制转化生长因子β1的受体结合和下游信号转导通路的激活,阻止转化生长因子β1信号氧化磷酸化Smad2/3。三七总皂苷是三七主要活性成分,研究表明三七总皂苷可上调骨髓间充质干细胞中TβR-Ⅱ的表达,激活转化生长因子β1/Smad信号通道,上调Smad2、Smad3的表达促进该通路信号传导,抑制PPM1A和Ran BP3的表达,抑制PPM1A和Ran BP3对该信号传导的终止作用,从而促进骨髓间充质干细胞的成骨分化,提升骨髓间充质干细胞的成骨功能[20]。 血管内皮生长因子和骨形态发生蛋白2的表达在骨形成和骨修复过程中起到关键作用,二者共同促进成骨和成血管,该课题组前期研究表明,三七总皂苷可提高激素性股骨头坏死模型兔的血管内皮生长因子 mRNA和骨形态发生蛋白2 mRNA表达,激活骨形态发生蛋白信号从而加快成骨细胞和血管内皮细胞增殖分化[21]。细胞基质矿化是指组织细胞生成和沉积适量钙和磷酸盐等矿物质成分,形成高度有序、化学稳定的骨样物质的过程。在骨组织中,碱性磷酸酶是成骨细胞活性的标志物。成骨细胞在活跃状态时,碱性磷酸酶的分泌会显著增加,这些酶会促进骨基质的沉积和矿化,从而帮助形成新的骨组织。卞伟等[22]研究证实,槲皮素能够增加碱性磷酸酶活性及矿化结节数目,并可上调骨髓间充质干细胞骨向分化过程中骨形态发生蛋白2 mRNA的表达,这可能是其促进大鼠骨髓间充质干细胞向成骨细胞分化的机制之一。羟基磷灰石具有骨传导特性,其颗粒形式可作为骨再生的有效药物载体。有研究者将含有骨形态发生蛋白2/槲皮素的羟基磷灰石移植到到大鼠骨缺损中并评估其成骨能力,发现羟基磷灰石/骨形态发生蛋白2/槲皮素组的成骨标记基因(如碱性磷酸酶和Runx2)的mRNA水平上调,新形成的骨量和缺损内的骨表面积显著提高[23]。 在激素性股骨头坏死大鼠中,人参皂苷Rb1可防止类固醇诱导的缺血性坏死并抑制血清骨钙素(serum osteocalcin,SOC)、显著逆转碱性磷酸酶和骨钙素活性、上调血管内皮生长因子受体、血管内皮生长因子、Runx2和骨形态发生蛋白2的表达[24]。据上述研究结果,可见三七总皂苷、槲皮素及人参皂苷Rb1在治疗激素性股骨头坏死的机制方面涉及到激活转化生长因子β/骨形态发生蛋白信号通路,并且通过这一信号通路有效地提高了Runx2、血管内皮生长因子和骨形态发生蛋白2的表达,从而促进了激素性股骨头坏死坏死骨组织的修复和新骨形成以及血管新生。根据目前文献资料显示,有关三七有效成分干预激素性股骨头坏死的转化生长因子β/骨形态发生蛋白通路相关机制的研究已经取得阶段性的进展,主要集中在干预骨髓间充质干细胞成骨分化和血管内皮细胞成血管分化方面,众多研究者进行了动物实验和细胞实验,但是研究的数量和质量尚未达到较高的水平,关于其他机制如抗氧化应激、抗炎、调节脂质代谢的研究较少,未来可加深对三七干预激素性股骨头坏死转化生长因子β/骨形态发生蛋白其他相关机制的研究。目前已有研究证实骨形态发生蛋白2联合槲皮素/羟基磷灰石可提高骨损伤部位成骨能力,未来可研究将该生物材料应用于激素性股骨头坏死损伤部位以提高骨修复能力,这将拥有极大的研究价值,见图3。"

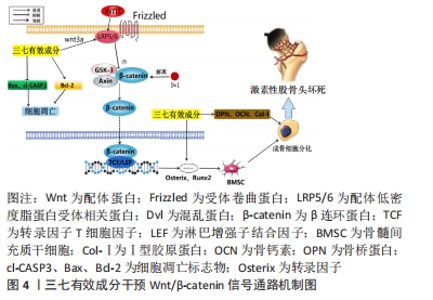
2.1.2 Wnt/β-catenin信号通路 该通路对骨组织动态平衡具有调控作用,该通路通过多种机制调节骨髓间充质干细胞分化、骨细胞增殖和多种细胞因子的表达[25]。Wnt/β-catenin信号通路的激活可概括为:Wnt与卷曲蛋白Frizzled以及受体相关蛋白(low-density lipoprotein receptor-related protein 5/6,LRP5/6)结合,蛋白激酶磷酸化混乱蛋白(dishevelled,Dvl);Dvl与其他相关蛋白质将β-catenin从降解复合物上解离下来,从而提高β-catenin在细胞质中的稳定性,然后,β-catenin进入细胞核后结合转录因子T细胞因子(T-cell factor,TCF)/淋巴增强子结合因子(lymphoid enhancer-binding factor,LEF),形成复合物,促进下游基因的转录和表达,下游基因的表达是调控骨髓间充质干细胞成骨分化、成骨细胞与破骨细胞骨代谢平衡,以及血管生成的关键因素[26-27]。糖皮质激素能够抑制Wnt/β-catenin信号,骨细胞中Wnt/β-catenin信号调控失去平衡时,成骨细胞生成会减少,破骨细胞的活性增加,进而导致骨髓间充质干细胞向脂质细胞异常分化。这些变化破坏了骨结构,使其无法有效地修复干骺端,最终导致股骨头坏死[28]。 cl-CASP3在细胞凋亡中具有凋亡执行的作用,Bax是BCL-2基因家族中细胞凋亡促进基因,而Bcl-2具有明显抑制细胞凋亡的作用,三者水平的变化可反映细胞凋亡的情况。陈杰等[29]研究表明,经三七总皂苷干预后,激素性股骨头坏死兔股骨头组织cl-CASP3、Bax蛋白表达明显下调,而Bcl-2,Wnt3a,LRP5,β-catenin和Runx2蛋白表达显著上调,表明三七总皂苷通过激活Wnt/β-catenin通路起到了对骨组织的保护作用;过量使用激素易导致血脂升高,股骨头周围血管微循环栓塞形成,股骨头血供障碍,而三七总皂苷干预后,激素性股骨头坏死家兔的血清三酰甘油、血清总胆固醇及低密度脂蛋白胆固醇水平均降低,高密度脂蛋白胆固醇升高,表明三七总皂苷具有较好的降脂作用,可促进股骨头脂质代谢,进而达到治疗激素性股骨头坏死的作用。MC3T3-E1细胞是小鼠前胚胎成纤维细胞的一种细胞系,在经过诱导分化后能够分化成多种骨细胞,包括成骨细胞、成软骨细胞和成膜骨细胞。Ⅰ型胶原蛋白 (collagen typeⅠ,Col-Ⅰ)、骨钙素、骨桥蛋白(osteopontin,OPN)可以反映成骨细胞的生长和功能状态。罗劲涛[30]研究发现三七总皂苷可以增强成骨细胞增殖的能力,减轻激素对MC3T3-E1细胞增殖的抑制效应,提高碱性磷酸酶活性,促进Col-Ⅰ、骨钙素及骨桥蛋白的表达。另有研究表明,人参皂苷CK可上调Runx2和β-catenin表达,可激活Wnt/β-catenin信号,此外,人参皂苷CK可提高骨损伤组织区域骨保护蛋白、骨钙素和碱性磷酸酶的表达[31]。 SaOS-2细胞是一种源自人骨肉瘤的细胞系,其具有高分化的骨细胞形态特征,表现出哺乳动物骨细胞的基本功能,包括骨髓基质中的细胞增殖、骨再生和细胞骨化。Osterix是骨细胞分化和骨形成过程的关键转录因子。骨唾液酸蛋白(bone sialoprotein,BSP)是骨基质蛋白的其中一种,其主要作用是参与骨钙磷化的过程,可在骨形成和骨再生中发挥重要作用。研究发现,经山柰酚处理后的SaOS-2成骨细胞碱性磷酸酶活性、胶原合成以及Runx2、Osterix、骨桥蛋白和BSP的mRNA表达水平均显著升高。Axin2(Axis inhibition protein 2)是Wnt信号通路中的重要调节因子,山柰酚对SaOS-2细胞的刺激导致Axin2活性的增加,Wnt信号介导的转录因子β-catenin的稳定,可能导致Wnt靶向成骨基因的激活。同时,研究结果表明,山柰酚诱导的碱性磷酸酶活性被Wnt信号通路抑制剂FH 535完全消除,说明山柰酚可通过增加β-catenin的稳定性和上调Wnt信号分子来促进成骨细胞分化和骨形成[32]。有研究表明,槲皮素激活Wnt/β-catenin通路,并通过H19/miR-625-5p轴促进骨髓间充质干细胞成骨分化[33]。通过上述研究可以得出,三七总皂苷、人参皂苷CK、山柰酚及槲皮素均可促进Wnt/β-catenin信号、提高下游靶点基因表达,具有促进成骨分化、坏死骨组织重建的作用,其中三七总皂苷还可以抑制细胞凋亡基因cl-CASP3及Bax的表达,对骨组织起到保护作用,并且具有较好的降脂作用,可促进股骨头脂质代谢。以上结果表明Wnt/β-catenin信号通路是三七干预激素性股骨头坏死的关键性通路。然而目前并未发现三七结合骨组织工程材料通过Wnt/β-catenin通路干预激素性股骨头坏死的相关研究,未来可将此作为研究重点,填补此分支的空白,见图4。"
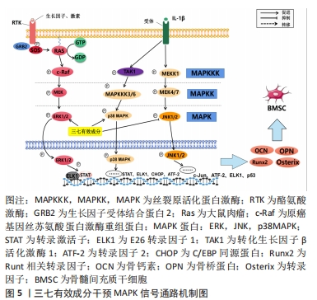
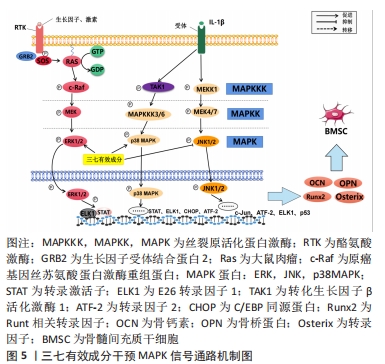
2.1.3 MAPK信号通路 该通路在骨细胞增殖、分化及凋亡等生命过程起到关键作用,其主要作用是通过激活一系列多个成员的蛋白激酶级联反应,将外刺激信号转化为细胞内的细胞生理或损伤信号,使细胞出现相应的生物学反应。MAPK信号转导可简述为丝分裂原刺激磷酸化激活MAPKKK,MAPKKK转而磷酸化激活MAPKK,最后由MAPKK磷酸化MAPK,使MAPK活化而转入核内。MAPK蛋白包括细胞外信号调节激酶(extracellular signal-Regulatory Kinase)、JNK(C-Jun N-terminal Kinases,ERK)和p38MAPK,分别对应于不同的细胞生理过程,不同种类的MAPKs受到磷酸化,从而激活它们的酶活性;MAPK蛋白进入细胞核,诱导转录因子的活化或抑制,从而改变基因表达,最终导致细胞生理功能的改变[34-36]。ERK是调节MAPK通路的主要激酶,ERK1/2通路通常被生长因子、激素等因子激活。c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)通路可以被炎症因子或生长因子激活,活化的JNK1/2会直接进入细胞核与c-Jun、激活转录因子2、ELK1及p53等靶基因结合从而达到调节转录的目的。 p38 MAPK通路可以被氧化应激及炎症因子等激活。当受体和配体结合后,活化的凋亡信号调节激酶1(apoptosis signal regulating kinase-1,ASK1)和转化生长因子β活化激酶1(Transforming growth factor beta activated kinase 1,TAK1)会通过激活下游的MAPKKK3/6进一步激活 p38 MAPK。活化的p38 MAPK会直接进入细胞核使信号传导及转录激活蛋白(signal transducer and activator of transcription,STAT)、C/EBP同源蛋白及ATF-2等靶点磷酸化,从而达到调节转录的目的。生长因子和炎症因子等细胞外源性因子与细胞膜上相应受体结合促进ERK磷酸化,能够促进成骨转录因子Runx2和osterix表达,进而促进成骨细胞的分化和增殖。p38 MAPK通路在发育中的骨骼和控制成人骨量中具有关键作用。研究发现糖皮质激素可通过上调成骨细胞中的p-JNK蛋白表达来激活JNK通路,促进Bax表达,然后移动到线粒体并与Bcl-2结合形成促进细胞凋亡的二聚体,激活了线粒体凋亡途径,进而诱导成骨细胞凋亡和自噬,加速股骨头坏死进程[37-39]。 miR-23a是一种微小RNA,经证实miR-23a可加速成骨细胞的分化[40]。WANG等[41]研究表明,三七皂苷R1可通过上调miR-2a的表达来促进Runx-23和Osterix的表达以及碱性磷酸酶活性;其中,三七皂苷R1通过激活MAPK信号通路来促进Runx-3和Osterix表达以及碱性磷酸酶活性,而三七皂苷R2通过改善MAPK的磷酸化来增强Runx-3、Osterix和碱性磷酸酶活性,而下调的miR-23a阻断了由三七皂苷R1触发的MAPK途径。LIU等 [42]制备了一种可注射的三七皂苷R1-透明质酸/羟基磷灰石纳米颗粒复合水凝胶支架并探究其对骨再生和炎症的影响,研究结果表明,阻断ERK信号通路可以抑制三七皂苷R1对骨髓间充质干细胞的碱性磷酸酶活性的促进作用。因此,ERK信号通路对于三七皂苷R1诱导的骨髓间充质干细胞成骨分化是必需的核因子,并且三七皂苷R1能够抑制肿瘤坏死因子α的表达,上调骨桥蛋白,骨钙素和Runx2的表达。RANKL由成骨细胞表达,与骨吸收细胞表面上的RANK受体结合,对骨重塑的调节和骨质维持起着关键作用。 ZHAO等[43]的实验中观察到三七皂苷R1抑制RANKL介导的MAPK,包括JNK1/2,P38,ERK1/2信号通路的磷酸化水平,并抑制RANKL介导的破骨细胞发生和破骨细胞骨吸收。过氧化物酶体增殖物激活受体γ2是一种广泛存在于脂肪组织的受体,其激活可以抑制成骨,即抑制骨细胞的分化和功能,阻碍骨组织形成和重建。LI 等[44]研究提示,三七总皂苷可以通过调节MAPK信号通路来促进骨髓间充质干细胞的成骨,其研究发现三七总皂苷降低了过氧化物酶体增殖物激活受体γ2 mRNA水平。在成骨诱导下,骨髓间充质干细胞的ERK和p38被激活,三七总皂苷进一步增强了这一活性,ERK和p38磷酸化水平的增加证明了此观点。通过上述研究可以得出,三七总皂苷及三七皂苷R1可通过调节MAPK信号通路磷酸化水平,上调Runx-3、Osterix、骨桥蛋白、骨钙素及Runx2等骨形成相关因子,同时下调肿瘤坏死因子α、RANKL、过氧化物酶体增殖物激活受体γ2等骨细胞凋亡相关因子,来促进骨髓间充质干细胞分化、抑制破骨、促进骨组织重建修复,从而达到治疗激素性股骨头坏死的目的。但由于激素性股骨头坏死发病机制复杂,上述研究并未清楚地阐明三七有效成分通过MAPK通路干预激素性股骨头坏死的具体机制过程,只说明了相关因子的变化情况,未来有待继续探究其具体机制过程。已有研究证实,三七皂苷R1-透明质酸联合羟基磷灰石纳米颗粒复合水凝胶支架可促进成骨并降低炎症反应,并说明其与ERK通路的相关性,未来可以此作为研究重点,继续加快三七皂苷R1联合生物材料治疗激素性股骨头坏死研究进展,见图5。"
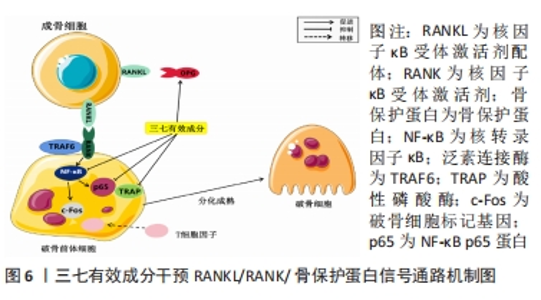
2.1.4 RANKL/RANK/骨保护蛋白信号通路 RANKL/RANK/骨保护蛋白信号通路是破骨和成骨的重要通路之一,主要成分包括RANKL,RANK,骨保护蛋白。该通路的激活过程可简述为:成骨细胞表达的RANKL与骨吸收细胞表面上的RANK结合后,启动RANKL/RANK信号通路,刺激骨吸收细胞分化、活化和存活。由于骨质吸收的负面影响,成骨细胞会通过表达可溶性膜蛋白骨保护蛋白来拮抗RANKL与RANK的结合。泛素连接酶TRAF6是胞膜上的关键开关,能够决定在细胞内开启何种信号。RANK与TRAF-6结合,核转录因子κB活化并转位至细胞核内,增加原癌基因Fos(proto-oncogene Fos,c-Fos)的表达。c-Fos与活化的T细胞核因子结合并产生相互作用,而后开启破骨细胞相关生成基因的转录,诱导形成成熟的破骨细胞。在激素性股骨头坏死病理生理过程中,应用糖皮质激素会导致RANKL表达增加和骨保护蛋白表达下降,导致骨吸收的增加,进而造成骨形成和骨吸收失衡,骨质结构逐渐被破坏,形成微骨折,循环障碍抑制骨细胞代谢发生骨坏死后形成死骨,在长期外部应力作用的刺激下,骨小梁坏死断裂,股骨头血供受损,最终造成骨坏死和骨塌陷[45-47]。 在激素性股骨头坏死过程中,破骨细胞可能被异常激活,引起骨吸收和破坏[48]。TRAP mRNA是编码破骨细胞表面标志物酸性磷酸酶(tartrate-Resistant Acid Phosphatase,TRAP)的RNA分子。TRAP为破骨细胞胞膜的一种酶,也是破骨细胞的标志物之一,可以用于筛查和确定破骨细胞的存在和活性。CONG等[49]研究表明,人参皂苷Rb2处理使TRAP mRNA的表达量显著降低,同时,钙调磷酸酶依赖1 (nuclear factor of activated T-cells,cytoplasmic,calcineurindependent 1,NFATc1)、c-Fos、组织蛋白酶cathepsin K等破骨细胞标记基因表达也显著降低,表明人参皂苷Rb2对破骨细胞分化有抑制作用。进一步实验表明,RANKL诱导的细胞核中核转录因子κB p65蛋白的表达在经过人参皂苷Rb2处理后显著下降,而经过人参皂苷Rb2处理的细胞质中核转录因子κB p65蛋白的表达则显著上升;经过人参皂苷Rb2处理后,核转录因子κB信号的转录活性也显著下降,表明人参皂苷Rb2能够抑制破骨细胞分化过程中的核转录因子κB信号激活。 方姝晨等[50]研究发现三七总皂苷可明显降低激素性股骨头坏死股骨头塌陷、骨组织缺失、骨髓组织脂肪增生及纤维增生等病理改变,进而改善股骨头形态,降低空骨陷窝率,RANKL及TRAP-5b表达,上调骨保护蛋白表达。自噬是真核细胞的一种分解代谢过程,其具有高度保守性,影响着细胞稳态和增殖分化。因此,自噬同样影响着破骨细胞的增殖分化和骨吸收功能。刘昭明等[51]的研究结果表明,槲皮素可抑制破骨细胞增殖,明显减少其自噬小体数量,TRAP、半胱氨酸蛋白酶K(cysteine protease K,CTSK)及核因子AT(Nuclear factor of activated T-cells)1的mRNA表达下降,调控自噬的泛素结合蛋白62(ubiquitin-binding protein 62,p62) 、自噬相关基因5(autophagy-related gene 5,ATG5)、雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)和酵母ATG6同源物(Beclin)的mRNA表达也均下降。王大伟等[52]采用三七总皂苷干预股骨头坏死兔模型,发现三七总皂苷可明显提高碱性磷酸酶含量和钙化结节数量;可以显著促进兔成骨细胞的增殖和分化,并有效提高成骨细胞的骨保护蛋白 mRNA的表达量,且会抑制其RANKL mRNA的表达,进而降低破骨细胞活性,减轻股骨头坏死程度。 综上,可知人参皂苷Rb2可通过干预核转录因子κB通路抑制TRAP mRNA、NFATc1、c-Fos及组织蛋白酶cathepsin K进而抑制破骨细胞分化,对骨组织具有保护作用。同时已有实验通过观察病理变化证实三七总皂苷干预激素性股骨头坏死的有效性,可证实RANKL/RANK/骨保护蛋白通路是三七有效成分抑制破骨、促进成骨、维持骨吸收和骨形成平衡进而治疗激素性股骨头坏死的重要途径之一,但此类研究深度仍然不足,未来应深化三七有效成分通过RANKL/RANK/骨保护蛋白通路干预激素性股骨头坏死炎症反应、氧化应激及脂质代谢等方面的研究,以促进三七治疗激素性股骨头坏死的研究进展,见图6。"
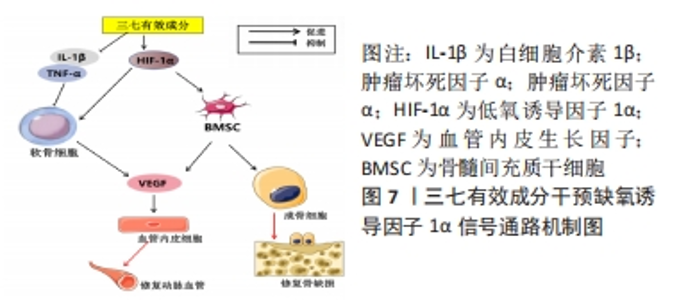
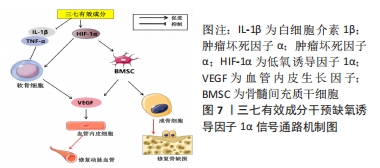
2.1.5 缺氧诱导因子1α信号通路 该通路主要功能是在低氧条件下调节细胞代谢和适应能力。缺氧诱导因子1α是缺氧诱导因子1亚单位的重要成员,能够调节骨细胞代谢、股骨头内微血管形成等[53-54]。缺氧诱导因子1α信号传导通常涉及多个细胞信号通路的激活,包括磷酸化、蛋白酶体和乙酰化,其信号传导过程如下:外界氧气浓度下降时,可抑制缺氧诱导因子1α的氧化反应、胶原蛋白原氧化酶的活性和氧化独立的酵素等多个机制诱导缺氧诱导因子1α的表达;而后磷酸化增加缺氧诱导因子1α的稳定性以及与其他蛋白质的相互作用,从而影响缺氧诱导因子1α在核内的寿命,调节与其相互作用的协同蛋白;磷酸化的缺氧诱导因子1α可以被去磷酸酶进一步调节,去磷酸化可以降低缺氧诱导因子1α的导致性和稳定性;随后缺氧诱导因子1α被泛素化,并被26S蛋白酶体分解。细胞缺氧时,泛素化过程被抑制,从而维护缺氧诱导因子1α的稳定性;最后是乙酰化,缺氧诱导因子1α与组蛋白乙酰转移酶相互作用。 在骨代谢过程中,缺氧诱导因子1α信号通路在破骨细胞分化、骨髓间充质干细胞的生长和分化以及骨细胞的代谢调节等方面发挥着关键作用[55]。缺氧诱导因子1α在激素性股骨头坏死的发生和发展中起着重要作用,与多种因素的互动有关,包括肿瘤坏死因子α,白细胞介素1β、血管内皮生长因子、纤溶酶原激活物抑制剂1等均通过缺氧诱导因子1α信号通路的调节参与股骨头坏死的病理生理过程,并影响血管生成和骨代谢平衡的调节。在激素性股骨头坏死早期的低氧或缺氧环境下缺氧诱导因子1α代偿性表达上调,并通过激活下游靶向基因血管内皮生长因子促进内皮细胞增殖、分化;但随着疾病的进展,加重坏死骨组织能量代谢失衡,扰乱了缺氧诱导因子1α,血管内皮生长因子信号传导,缺氧诱导因子1α和血管内皮生长因子 mRNA表达下降,导致血管循环生成障碍。在激素诱导下的骨细胞中缺氧诱导因子1α,表达明显下降,导致骨细胞凋亡[56-57]。 血管内皮生长因子可以通过结合其在血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR-2)上的结合来促进血管生成和血管内皮细胞增殖,改善坏死区域的缺血缺氧情况。有研究表明三七总皂苷在上调VEGF-A,VEGFR-1和VEGFR-2信号系统以及促进骨髓间充质干细胞血管生成方面具有显著功效[58]。伍海军等[59]研究表明三七中的槲皮素及山柰酚可作用于多个靶标,上调血管内皮生长因子、缺氧诱导因子1α,下调肿瘤坏死因子α,干预缺氧诱导因子1α通路起到保护缺血损伤、抗炎及促进血管修复等作用。另有研究表明,三七总皂苷可以抑制促炎细胞因子白细胞介素1β和肿瘤坏死因子α的表达[60]。同样有研究证实槲皮素、山柰酚可与肿瘤坏死因子、白细胞介素6等网络靶点有效结合,能够降低肿瘤坏死因子α及白细胞介素1β的表达来保护关节软骨[61-62]。 聚乙烯-L-乳酸(polyethylene L-lactic acid,PLLA)是一种生物材料,常用于骨组织工程领域,基于三七总皂苷和整骨总黄酮(total flavonoids of bone,OTF)分别促进血管生成和成骨的作用,FENG等[63]研究发现将三七总皂苷和OTF分别嵌入PLLA外层和内层的复合PLLA材料植入激素性股骨头坏死兔中,可显著促进骨坏死部位的成骨和血管生成,植入部位的血管内皮生长因子、骨钙素、骨桥蛋白和碱性磷酸酶的分布和数量均显著增加,表明这种复合材料对激素性股骨头坏死具有显著的治疗作用,具有很好的研究前景。通过上述研究可以得出,三七总皂苷在影响血管内皮生长因子、缺氧诱导因子1α、肿瘤坏死因子α及白细胞介素1β等因子的表达方面具有积极作用,这些作用可对缺氧诱导因子1α信号通路产生影响,从而保护激素性股骨头坏死缺血性损伤,降低炎症、促进损伤血管修复及血管新生。网络药理学结果表明槲皮素、山柰酚可降低炎症因子,但其是否通过缺氧诱导因子1α信号通路抑制激素性股骨头坏死炎症反应有待进一步实验验证。三七总皂苷结合PLLA材料治疗骨损伤具有良好应用前景,未来应广泛研究三七总皂苷结合PLLA在激素性股骨头坏死治疗方面的实用性及其对缺氧诱导因子1α通路的作用,见图7。"
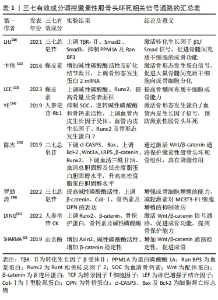
2.2 三七有效成分干预激素性股骨头坏死相关信号通路间关联点的研究 在生物信息学中,不同信号通路之间关系复杂,相互连接紧密。三七有效成分是通过多条信号通路干预激素性股骨头坏死进程的,通路之间存在着相互关联和相互作用。上文提到的RANKL与RANK结合后,下游信号通路被激活,导致破骨异常。在这些下游信号通路中,MAPK和核转录因子κB在破骨细胞形成和骨吸收过程中起关键作用。NFATc1和c-Fos在破骨细胞生成中发挥重要作用,是核转录因子κB和MAPK信号通路的两个关键转录因子。有研究证明,三七皂苷R1能够抑制NFATc1和c-Fos的表达,能够抑制RANKL介导的MAPK和核转录因子κB信号通路的磷酸化水平,并抑制RANKL介导的破骨细胞发生和破骨细胞骨吸收[43]。 人参皂苷Rb2能够抑制RANKL诱导的细胞核中核转录因子κB p65蛋白的表达,抑制NFATc1及c-Fos表达,抑制核转录因子κB信号的转录活性,表明人参皂苷Rb2同样能够抑制破骨细胞分化过程中的核转录因子κB信号激活[49]。因此,NFATc1和c-Fos是三七有效成分治疗激素性股骨头坏死过程中MAPK和核转录因子κB信号通路的关键因子,然而目前并未有相关研究文献验证三七有效成分具体是如何干预NFATc1和c-Fos而对激素性股骨头坏死进行调控的,同时也缺乏三七有效成分干预MAPK和核转录因子κB信号通路是否存在其他偶联机制的研究。肿瘤坏死因子α是MAPK和核转录因子κB信号通路上游的启动因子,三七皂苷R1能够抑制肿瘤坏死因子α的表达[42]。而目前并未有相关文献证实三七皂苷在干预激素性股骨头坏死过程中是通过抑制肿瘤坏死因子α表达进而同时调控MAPK和核转录因子κB信号通路来影响股骨头成骨分化和破骨吸收的。因此,未来可深入探究三七干预激素性股骨头坏死 MAPK和核转录因子κB信号通路而影响成骨分化或破骨吸收的具体机制以及两条通路之间的具体相互作用,以期为后期研究三七治疗激素性股骨头坏死提供参考。 随着对激素性股骨头坏死发病机制和治疗方法的纵向研究和横向研究不断深入和发展,中药三七治疗激素性股骨头坏死已经成为越来越多学者研究的重点,文章通过总结相关文献得出三七有效成分调控激素性股骨头坏死相关信号通路主要涉及转化生长因子β、Wnt/β-catenin、MAPK、RANKL/RANK/骨保护蛋白及缺氧诱导因子1α等,主要包括PPM1A、Ran BP3、骨形态发生蛋白2、碱性磷酸酶、Runx2及血管内皮生长因子等相关因子,进而干预激素性股骨头坏死成骨分化、破骨吸收、脂质代谢及血管修复及新生,对改善激素性股骨头坏死起到积极作用,见表1。"

| [1] MOTTA F, TIMILSINA S, GERSHWIN ME, et al. Steroid-induced osteonecrosis. J Transl Autoimmun. 2022;5:100168. [2] TAN B, LI W, ZENG P, et al. Epidemiological study based on china osteonecrosis of the femoral head database. Orthop Surg. 2021;13(1):153-160. [3] LU C, QI H, XU H, et al. Global research trends of steroid-induced osteonecrosis of the femoral head: a 30-year bibliometric analysis. Front Endocrinol (Lausanne). 2022;13:1027603. [4] EXPERT PANEL ON MUSCULOSKELETAL IMAGING; HA AS, CHANG EY, et al. ACR Appropriateness Criteria® Osteonecrosis: 2022 Update. J Am Coll Radiol. 2022;19(11S):S409-S416. [5] WANG A, REN M, WANG J. The pathogenesis of steroid-induced osteonecrosis of the femoral head: a systematic review of the literature. Gene. 2018;671:103-109. [6] HE P, CHEN J, YUE C,et al. Effectiveness and safety of traditional Chinese medicine in the treatment of steroid-osteonecrosis of femoral head: a protocol for systematic review and meta-analysis. Medicine (Baltimore). 2021;100(30):e26811. [7] 蔡飞,王鹤,秦崇涛,等.血府逐瘀胶囊与血管内皮生长因子促血管新生差异研究[J].中国中西医结合杂志,2018,38(4):441-446. [8] 张子龙,王文全.三七本草研究概述[J].世界科学技术(中医药现代化), 2010,12(2):271-276. [9] WANG T, GUO R, ZHOU G, et al. Traditional uses, botany, phytochemistry, pharmacology and toxicology of Panax notoginseng (Burk.) F.H. Chen: a review. J Ethnopharmacol. 2016;188:234-258. [10] 杨娟,袁一怔,尉广飞,等.三七植物化学成分及药理作用研究进展[J].世界科学技术(中医药现代化),2017,19(10):1641-1647. [11] QIANG H, LIU H, LING M, et al. Early steroid-induced osteonecrosis of rabbit femoral head and panax notoginseng saponins: mechanism and protective effects. Evid Based Complement Alternat Med. 2015;2015:719370. [12] QIN L, YAO D, ZHENG L, et al. Phytomolecule icaritin incorporated PLGA/TCP scaffold for steroid-associated osteonecrosis: proof-of-concept for prevention of hip joint collapse in bipedal emus and mechanistic study in quadrupedal rabbits. Biomaterials. 2015;59:125-143. [13] LOU P, ZHOU G, WEI B, et al. Bone grafting for femoral head necrosis in the past decade: a systematic review and network meta-analysis. Int J Surg. 2023;109(3):412-418. [14] MORIKAWA M, DERYNCK R, MIYAZONO K. TGF-β and the TGF-β family: context-dependent roles in cell and tissue physiology. Cold Spring Harb Perspect Biol. 2016;8(5):a021873. [15] LARSON C, ORONSKY B, CARTER CA, et al. TGF-beta: a master immune regulator. Expert Opin Ther Targets. 2020;24(5):427-438. [16] CHEN G, DENG C, LI YP. TGF-β and BMP signaling in osteoblast differentiation and bone formation. Int J Biol Sci. 2012;8(2):272-288. [17] GARCIA J, DELANY AM. MicroRNAs regulating TGFβ and BMP signaling in the osteoblast lineage. Bone. 2021;143:115791. [18] YANG X, CHEN Z, CHEN C, et al. Bleomycin induces fibrotic transformation of bone marrow stromal cells to treat height loss of intervertebral disc through the TGFβR1/Smad2/3 pathway. Stem Cell Res Ther. 2021;12(1):34. [19] 陈镇秋,何伟,魏秋实,等.激素性股骨头坏死患者骨组织中骨代谢相关因子的表达[J].中华关节外科杂志(电子版),2015,9(2):183-188. [20] LIU D, ZHAO Z, JIANG W, et al. Panax notoginseng saponin promotes bone regeneration in distraction osteogenesis via the TGF-β1 signaling pathway. Evid Based Complement Alternat Med. 2021;2021:2895659. [21] 韩杰,王世鑫,莫坚,等.三七总皂苷对激素性股骨头缺血性坏死模型兔骨组织血管内皮生长因子和骨形态形成蛋白2 mRNA表达的影响[J].广西医学,2016,38(5):611-614. [22] 卞伟,杨丽,孙宏,等.槲皮素对骨髓间充质干细胞增殖和骨向分化的影响[J].中药药理与临床,2016,32(5):27-30. [23] LEE S, PARK H, OH JS, et al. Hydroxyapatite microbeads containing BMP2 and quercetin fabricated via electrostatic spraying to encourage bone regeneration. Biomed Eng Online. 2023;22(1):15. [24] YE J, WEI D, PENG L, et al. Ginsenoside Rb1 prevents steroid induced avascular necrosis of the femoral head through the bone morphogenetic protein 2 and vascular endothelial growth factor pathway. Mol Med Rep. 2019;20(4):3175-3181. [25] SHEN G, REN H, SHANG Q, et al. Foxf1 knockdown promotes BMSC osteogenesis in part by activating the Wnt/β-catenin signalling pathway and prevents ovariectomy-induced bone loss. EBioMedicine. 2020;52:102626. [26] LIU J, XIAO Q, XIAO J, et al. Wnt/β-catenin signalling: function, biological mechanisms, and therapeutic opportunities. Signal Transduct Target Ther. 2022;7(1):3. [27] GAO J, XIANG S, WEI X, et al. Icariin promotes the osteogenesis of bone marrow mesenchymal stem cells through regulating sclerostin and activating the wnt/β-catenin signaling pathway. Biomed Res Int. 2021;2021:6666836. [28] ZHANG P, TAO F, LI Q, et al. 5-azacytidine and trichostatin a enhance the osteogenic differentiation of bone marrow mesenchymal stem cells isolated from steroid-induced avascular necrosis of the femoral head in rabbit. J Biosci. 2019;44(4):87. [29] 陈杰,张堃,孔令俊,等.三七总皂苷通过调控Wnt/β-catenin通路减轻家兔股骨头坏死[J].中药药理与临床,2019,35(4):95-99. [30] 罗劲涛. 三七总皂苷对激素诱导的MC3T3-E1成骨前体细胞成骨分化影响的研究[D]. 广州:广州中医药大学,2022. [31] DING L, GU S, ZHOU B, et al. Ginsenoside compound K enhances fracture healing via promoting osteogenesis and angiogenesis. Front Pharmacol. 2022;13:855393. [32] SHARMA AR, NAM JS. Kaempferol stimulates WNT/β-catenin signaling pathway to induce differentiation of osteoblasts. J Nutr Biochem. 2019;74: 108228. [33] BIAN W, XIAO S, YANG L, et al. Quercetin promotes bone marrow mesenchymal stem cell proliferation and osteogenic differentiation through the H19/miR-625-5p axis to activate the Wnt/β-catenin pathway. BMC Complement Med Ther. 2021;21(1):243. [34] GUO YJ, PAN WW, LIU SB, et al. ERK/MAPK signalling pathway and tumorigenesis. Exp Ther Med. 2020;19(3):1997-2007. [35] ROBERTS PJ, DER CJ. Targeting the Raf-MEK-ERK mitogen-activated protein kinase cascade for the treatment of cancer. Oncogene. 2007;26(22):3291-3310. [36] DROSTEN M, BARBACID M. Targeting the MAPK pathway in KRAS-driven tumors. Cancer Cell. 2020;37(4):543-550. [37] LEE CH, HUANG YL, LIAO JF, et al. Ugonin K promotes osteoblastic differentiation and mineralization by activation of p38 MAPK- and ERK-mediated expression of Runx2 and osterix. Eur J Pharmacol. 2011;668(3): 383-399. [38] PENG P, NIE Z, SUN F, et al. Glucocorticoids induce femoral head necrosis in rats through the ROS/JNK/c-Jun pathway. FEBS Open Bio. 2021;11(1):312-321. [39] GREENBLATT MB, SHIM JH, ZOU W, et al. The p38 MAPK pathway is essential for skeletogenesis and bone homeostasis in mice. J Clin Invest. 2010;120(7):2457-2473. [40] ZENG HC, BAE Y, DAWSON BC, et al. MicroRNA miR-23a cluster promotes osteocyte differentiation by regulating TGF-beta signalling in osteoblasts. Nat Comms. 2017;8:15000. [41] WANG C, SUN H, ZHONG Y. Notoginsenoside R1 promotes MC3T3-E1 differentiation by up-regulating miR-23a via MAPK and JAK1/STAT3 pathways. Artif Cells Nanomed Biotechnol. 2019;47(1):603-609. [42] LIU Y, ZHANG Y, ZHENG Z, et al. Incorporation of NGR1 promotes bone regeneration of injectable HA/nHAp hydrogels by anti-inflammation regulation via a MAPK/ERK signaling pathway. Front Bioeng Biotechnol. 2022;10:992961. [43] ZHAO S, YAN L, LI X, et al. Notoginsenoside R1 suppresses wear particle-induced osteolysis and RANKL mediated osteoclastogenesis in vivo and in vitro. Int Immunopharmacol. 2017;47:118-125. [44] LI XD, LIU ZY, CHANG B, et al. Panax notoginseng saponins promote osteogenic differentiation of bone marrow stromal cells through the ERK and P38 MAPK signaling pathways. Cell Physiol Biochem. 2011;28(2):367-76. [45] YASUDA H. Discovery of the RANKL/RANK/OPG system. J Bone Miner Metab. 2021;39(1):2-11. [46] TOBEIHA M, MOGHADASIAN MH, AMIN N, et al. RANKL/RANK/OPG pathway: a mechanism involved in exercise-induced bone remodeling. Biomed Res Int. 2020;2020:6910312. [47] 陈锋,任国武,章晓云,等.核因子κB受体活化因子信号转导机制与破骨细胞的活化[J].中国组织工程研究,2023,27(2):293-299. [48] CHEN K, LIU Y, HE J, et al. Steroid-induced osteonecrosis of the femoral head reveals enhanced reactive oxygen species and hyperactive osteoclasts. Int J Biol Sci. 2020;16(11):1888-1900. [49] CONG F, LIU J, WANG C, et al. Ginsenoside Rb2 inhibits osteoclast differentiation through nuclear factor-kappaB and signal transducer and activator of transcription protein 3 signaling pathway. Biomed Pharmacother. 2017;92:927-934. [50] 方姝晨,邹季,史政康,等.三七总皂苷对股骨头坏死大鼠股骨头成骨作用影响的实验研究[J].中国中医骨伤科杂志,2020,28(6):6-9, 15. [51] 刘昭明,关智宇,蒋太平,等.由“从瘀论治”理论探讨三七中槲皮素对破骨细胞分化的自噬调控机制[J]. 中国骨质疏松杂志,2022,12:1740-1744,1749. [52] 王大伟,卢培根,贾永龙,等.三七总皂苷干预酒精性股骨头缺血坏死模型兔的超微结构[J].中国组织工程研究,2014,18(27):4277-4281. [53] XU WN, ZHENG HL, YANG RZ, et al. HIF-1α regulates glucocorticoid-induced osteoporosis through PDK1/AKT/mTOR signaling pathway. Front Endocrinol (Lausanne). 2020;10:922. [54] LI HS, ZHOU YN, LI L, et al. HIF-1α protects against oxidative stress by directly targeting mitochondria. Redox Biol. 2019;25:101109. [55] YING C, WANG R, WANG Z, et al. BMSC-exosomes carry mutant HIF-1α for improving angiogenesis and osteogenesis in critical-sized calvarial defects. Front Bioeng Biotechnol. 2020;8:565561. [56] WU J, YAO L, WANG B, et al. Tao-Hong-Si-Wu decoction ameliorates steroid-induced avascular necrosis of the femoral head by regulating the HIF-1α pathway and cell apoptosis. Biosci Trends. 2016;10(5):410-417. [57] HAN J, CHAI Y, ZHANG XY, et al. Gujiansan ameliorates avascular necrosis of the femoral head by regulating autophagy via the HIF-1α/BNIP3 pathway. Evid Based Complement Alternat Med. 2021;2021:6683007. [58] ZHENG H, LIU C, OU Y, et al. Total saponins of Panax notoginseng enhance VEGF and relative receptors signals and promote angiogenesis derived from rat bone marrow mesenchymal stem cells. J Ethnopharmacol. 2013; 147(3):595-602. [59] 伍海军,吴静澜,杨欣,等.基于网络药理学三七治疗缺血性脑卒中的作用机制研究[J].中国医科大学学报,2021,50(9):814-819. [60] GAO J, YAO M, ZHANG W, et al. Panax notoginseng saponins alleviates inflammation induced by microglial activation and protects against ischemic brain injury via inhibiting HIF-1α/PKM2/STAT3 signaling. Biomed Pharmacother. 2022;155:113479. [61] 孙诗艺,颜炎,吴子轩,等.基于网络药理学和分子对接技术分析健脾活骨方治疗股骨头坏死的作用机制[J].中药新药与临床药理,2022, 33(10):1357-1365. [62] REN GW, WEN SB, HAN J, et al. Network-based pharmacology and bioinformatics study on the mechanism of action of gujiansan in the treatment of steroid-induced avascular necrosis of the femoral head. Biomed Res Int. 2022;2022:8080679. [63] FENG G, ZHANG P, HUANG J, et al. Sequential release of panax notoginseng saponins and osteopractic total flavone from Poly (-Lactic Acid) scaffold for treating glucocorticoid-associated osteonecrosis of femoral head. J Funct Biomater. 2023;14(1):31. |
| [1] | Yang Yufang, Yang Zhishan, Duan Mianmian, Liu Yiheng, Tang Zhenglong, Wang Yu. Application and prospects of erythropoietin in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1443-1449. |
| [2] | Yang Yifeng, Ye Nan, Wang Lin, Guo Shuaicheng, Huang Jian. Signaling pathway of dexmedetomidine against ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1464-1469. |
| [3] | Yu Weijie, Liu Aifeng, Chen Jixin, Guo Tianci, Jia Yizhen, Feng Huichuan, Yang Jialin. Advantages and application strategies of machine learning in diagnosis and treatment of lumbar disc herniation [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1426-1435. |
| [4] | Wei Juan, Li Ting, Huan Mengting, Xie Ying, Xie Zhouyu, Wei Qingbo, Wu Yunchuan. Mechanism by which static exercise improves insulin resistance in skeletal muscle of type 2 diabetes [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1271-1276. |
| [5] | Lin Zeyu, Xu Lin. Research progress in gout-induced bone destruction mechanism [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1295-1300. |
| [6] | Huang Haoran, Fan Yinuo, Wei-Yang Wenxiang, Jiang Mengyu, Fang Hanjun, Wang Haibin, Chen Zhenqiu, Liu Yuhao, Zhou Chi. Urolithin A mediates p38/MAPK pathway to inhibit osteoclast activity [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1149-1154. |
| [7] | Yue Yun, Wang Peipei, Yuan Zhaohe, He Shengcun, Jia Xusheng, Liu Qian, Li Zhantao, Fu Huiling, Song Fei, Jia Menghui. Effects of croton cream on JNK/p38 MAPK signaling pathway and neuronal apoptosis in cerebral ischemia-reperfusion injury rats [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1186-1192. |
| [8] | Liu Xin, Hu Man, Zhao Wenjie, Zhang Yu, Meng Bo, Yang Sheng, Peng Qing, Zhang Liang, Wang Jingcheng. Cadmium promotes senescence of annulus fibrosus cells via activation of PI3K/Akt signaling pathway [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1217-1222. |
| [9] | Liu Jianhong, Liao Shijie, Li Boxiang, Tang Shengping, Wei Zhendi, Ding Xiaofei. Extracellular vesicles carrying non-coding RNA regulate the activation of osteoclasts [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1076-1082. |
| [10] | Ma Shuwei, He Sheng, Han Bing, Zhang Liaoyun. Exosomes derived from mesenchymal stem cells in treatment of animals with acute liver failure: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1137-1142. |
| [11] | Wang Wen, Zheng Pengpeng, Meng Haohao, Liu Hao, Yuan Changyong. Overexpression of Sema3A promotes osteogenic differentiation of dental pulp stem cells and MC3T3-E1 [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 993-999. |
| [12] | Zhang Kefan, Shi Hui. Research status and application prospect of cytokine therapy for osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(6): 961-967. |
| [13] | Li Jiaqi, Huang Yuanli, Li Yan, Wang Chunren, Han Qianqian. Mechanism and influencing factors in molecular weight degradation of non-cross-linked hyaluronic acid [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 747-752. |
| [14] | Xu Rong, Wang Haojie, Geng Mengxiang, Meng Kai, Wang Hui, Zhang Keqin, Zhao Huijing. Research advance in preparation and functional modification of porous polytetrafluoroethylene artificial blood vessels [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 759-765. |
| [15] | Chen Xiaofang, Zheng Guoshuang, Li Maoyuan, Yu Weiting. Preparation and application of injectable sodium alginate hydrogels [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 789-794. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||