Chinese Journal of Tissue Engineering Research ›› 2016, Vol. 20 ›› Issue (52): 7891-7898.doi: 10.3969/j.issn.2095-4344.2016.52.020
Previous Articles Next Articles
Tissue-engineered scaffolds for articular cartilage repair
- Department of Bone and Joint Surgery, Renmin Hospital of Wuhan University, Wuhan 430060, Hubei Province, China
-
Received:2016-11-02Online:2016-12-16Published:2016-12-16 -
About author:Fang Hong-song, Master, Associate chief physician, Department of Bone and Joint Surgery, Renmin Hospital of Wuhan University, Wuhan 430060, Hubei Province, China -
Supported by:the National Natural Science Foundation of China, No. 81301592
CLC Number:
Cite this article
Fang Hong-song, Zhou Jian-lin, Peng Hao, Deng Shuang, Weng Jin-qing, Liu Feng, Chen Sen, Zhou Guan-jin.
share this article
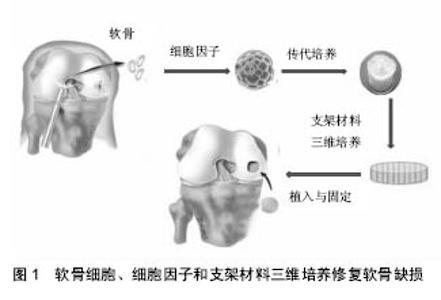
2.1 用于关节软骨缺损修复的软骨组织工程天然生物材料 关节软骨一旦受到损伤或者发生变性,便无法恢复为原来的玻璃软骨状态,随着时间的推移周围及相对面的软骨也会发生变性。用组织工程学技术修复关节软骨缺损具有广阔的临床应用前景。近年来,将细胞生物学技术与材料工程技术相结合,寻找合适的新型支架材料以及优化种子细胞复合体外培养已是软骨工程学的研究热点[16]。骨髓间充质干细胞的可获得性、可扩增性及可多向分化性展示了其良好的研究与应用前景,骨髓间充质干细胞有分化形成软骨的特性。现已知骨髓间充质干细胞在损伤部位具有归巢特性并且分化为特定的细胞或者是分泌一系列具有促进再生功能的活性因子,因此,骨髓间充质干细胞在治疗应用中成为广泛的供体。在软骨缺损修复中有重要的临床应用价值。黎婷等[17]观察兔骨髓间充质干细胞自体移植修复全层软骨缺损的实验效果,以及明胶海绵作为载体的可行性,认为骨髓间充质干细胞扩增并向成骨细胞定向诱导分化后,以明胶海绵支架为载体移植腭骨缺损中,能较好的修复骨组织缺损。同样陈克明等[18]研究结果说明自体骨髓间充质干细胞与纤维蛋白复合物可用于修复关节软骨缺损,但长远期疗效尚需做进一步研究。将软骨诱导的骨髓间充质干细胞移植于软骨细胞外基质衍生的支架后,细胞增殖率显著增高,所构建的组织工程软骨组织工程软骨的压缩模量更高,提高了组织组织工程软骨的生物力生物力学性能[19]。然而国外虽已研制出商品化人工软骨,但新生软骨组织后期仍有退变现象。如何使生长因子持续高效发挥作用以使种子细胞获得良好的生物学活性、如何从整体上阻断各种炎性递质对关节软骨的降解并抑制同种异体细胞移植的免疫排斥反应,提高修复质量的远期疗效,一直是关节软骨缺损修复组织工程学研究急待解决的关键问题。 研究开发软骨组织工程支架的材料和制备方法对今后软骨组织缺损修复具有重要的意义。组织工程支架按照性状可分为预成型支架材料及水凝胶材料两大类。胶原是一种天然生物医学材料,以胶原为基底制备的三维多孔支架,选取微创、仿生并且可以原位塑形的胶原材料复合种子细胞修复关节软骨损伤,在软骨组织工程化组织培养过程中发现不同类型的胶原材料影响软骨细胞的分化与表达,胶原材料的来源、结构及性质的稳定性决定软骨组织工程研究的可靠性。为损伤关节软骨的修复带来了希望[20]。有研究建立了以Ⅱ型胶原蛋白为材料的组织工程软骨支架制备技术[21],采用该技术制备的Ⅱ型胶原支架孔径为40-130 μm,孔隙率约90%以上并且孔通率较好,细胞材料共培养实验和兔背部皮下植入实验证实Ⅱ型胶原支架具有良好细胞相容性和组织相容性,Ⅰ型胶原支架与骨髓间充质干细胞相容性良好,使用兔自体骨髓基质细胞作为移植细胞在体外大量繁殖扩增,吸附于Ⅰ型胶原海绵上,骨髓间充质干细胞-胶原复合移植可达到透明软骨样修复软骨缺损。但是胶原三维多孔支架存在机械性能差、供源不足、排异反应等一系列问题,限制了其在软骨组织工程中的进一步应用。为改善这种状况,可以通过交联、共混等方式提高支架机械性能,结合细胞培养、负载生长因子等技术实现结构、功能高度仿生,此外为避免动物源胶原的安全隐患问题,使用重组胶原制备软骨替代物成为本领域的研究热点。以往研究发现通过制备肝素化胶原/壳聚糖支架来提高与转化生长因子β1的结合率,将脂肪干细胞种植于该支架材料上后直接种植于体内,可避免体外诱导过程,缩短组织工程构建的时间。软骨细胞从天然软骨分离和体外增殖后,将失去表达糖胺聚糖和Ⅱ型胶原蛋白的能力,导致去分化,减少细胞生存能力。将骨形态发生蛋白2与人缺端胶原支架复合,并附加胰岛素和T3激素可促进组织工程软骨形成[22],见图1。 将异体软骨微粒脱细胞基质、纤维蛋白胶和软骨细胞注射到关节软骨缺损区,结果构建的组织工程软骨修复效果良好,细胞在构建的组织工程软骨内生长良好并分泌细胞外基质,可用于修复关节软骨缺损[23]。通过组织工程构建动员软骨细胞形成并修复软骨,将新鲜的血纤维蛋白和富含血小板的血纤维蛋白与人骨髓源间充质干细胞结合,纤维蛋白复合人骨髓源间充质干细胞构建的组织工程软骨,软骨标志基因表达和累积更显著,纤维蛋白可作为构建组织工程软骨的材料[24]。 丝素蛋白是一种较佳的天然生物材料,安全无毒、无刺激性,且具有独特的机械性能和良好的生物学活性,不但可以单独用于组织工程支架的构建,还可与其他生物材料联用构建各种支架,广泛应用于软骨组织工程领域。陆史俊等[25]综合分析结果证实以上观点,丝素蛋白可被加工成水凝胶、薄膜、纳米纤维、三维多孔支架等多种不同形态,具有生物相容性好、生物降解慢、降解产物无毒、机械强度高等优点。同时,可以通过种植干细胞、适当的化学修饰以及负载生长因子、无机物等。范志海等[26]认为与纯丝素蛋白支架相比,丝素蛋白/透明质酸复合多孔支架具有更好的多孔三维结构。此外,支架制备过程中不含有毒溶剂,支持骨髓间充质干细胞的黏附铺展与增殖。说明实验制备的丝素蛋白/透明质酸复合支架的成孔性好,具有良好的细胞生物相容性。然而丝素蛋白作为一种常用的组织工程支架材料,其降解性能一直不甚清楚,从快速降解和酶降解的角度探究和分析了丝素蛋白的降解行为,以及根据降解性能分析结果设计和改良了丝素蛋白材,并用于软组织的修复[27]。发现经过脱胶及后期成型加工处理的丝素蛋白支架的降解速率偏慢,在60 d的高温降解以及42 d的酶溶液水解后仍有大部分丝素蛋白支架稳定存在。 壳聚糖是甲壳素脱乙酰基的产物,是第二大天然高分子,由于其良好的生物相容性、生物可降解性和成型性,作为软骨组织工程支架材料越来越受到重视。对壳聚糖为主的复合软骨骨组织工程支架的相关研究进行探讨。可以掌握其在不同的材料体系中的功能作用,并可预见壳聚糖基生物材料在软骨组织工程中的发展潜力。徐敬等[28]进一步研究表明,将壳聚糖 与种子细胞进行共同体外培养可以获得正常形态的软骨细胞并能合成特异性的细胞外基质成分,在动物体内,壳聚糖支架与种子细胞所构建的组织工程软骨能够修复 软骨损伤,形成与周围正常软骨相似的组织。史德海[29]发现壳聚糖与Ⅱ型胶原两种材料充分溶解、混和后可以用冷冻干燥法制作成复合三维多孔支架。复合支架交联后吸水性能及力学强度均增强。壳聚糖与Ⅱ型胶原复合解决了单纯壳聚糖降解过慢、单纯Ⅱ型胶原降解过快的问题。将壳聚糖水凝胶与肋软骨细胞构建组织工程软骨用于修复关节软骨缺损,将构建的组织工程软骨移植到关节软骨缺损处。12周后软骨缺损得到修复,再生组织与软骨下骨和正常组织紧密相连,再生组织中软骨陷窝与组织相似,结果说明将骨细胞与壳聚糖水凝胶支架材料结合,可以促进期限增殖和分泌细胞外基质,构建的组织工程软骨可以完全修复关节软骨缺损[30]。 2.2 高分子复合支架材料 天然生物材料生物相容性、细胞黏附性好,亲水性强,但力学强度差、吸收过快,而且难以大批量生产。人工合成高分子材料具有可控降解速度、力学强度好、易于塑形,但亲水性不够,对细胞的黏附性较弱以及有免疫反应、排斥反应等。因此,用于软骨组织工程的支架材料种类众多,结合不同材料特点制成合适的支架材料对软骨组织工程研究十分关键[31]。关节软骨不自我修复,自体软骨细胞移植已用于关节软骨损伤的修复,但自体软骨细胞移植时细胞扩增,导致软骨细胞去分化,诱导Ⅰ型胶原,导致纤维变性,存在产生纤维软骨的危险。为了提高软骨细胞的增殖效率,有研究将软骨细胞与聚醚酯嵌段共聚物支架材料共培养,培养后可形成大量软骨组织,提高软骨细胞扩增率[32]。将自体软骨细胞移植到可生物降解的聚L-乳酸或聚乳酸-DL-羟基乙酸共聚物支架材料上,移植1,2,6个月后聚L-乳酸支架材料构建的组织工程软骨有大量的软骨,但聚乳酸-DL-羟基乙酸共聚物支架材料不能生成软骨并修复软骨缺损,因为聚乳酸-DL-羟基乙酸共聚物降解速率较快,会在2月个月内完全降解,其降解物可以引起很严重的组织反应,所以聚L-乳酸有滞后降解性能,并可减少移植后组织炎性反应,适合用于软骨组织工程的构建[33]。也有研究分别制备了静电聚D-L丙交酯/聚L-乳酸和聚D-L丙交酯/聚己内酯以研究其作为组织工程软骨支材料材料的可行性,结果显示以聚D-L丙交酯/聚己内酯为支材料材料构建的组织工程软骨可使软骨细胞产生Ⅱ型胶原蛋白和蛋白聚糖(软骨细胞外基质的主要成分),可以修复软骨缺损,但静电聚D-L丙交酯/聚L-乳酸制备的组织工程软骨没有修复反应[34]。将人软骨细胞种植到聚乙醇酸支架并于生物反应器培养5周,可以促进细胞外基质分泌[35]。组织工程软骨目的在于构建具有与真实软骨类似的移植物,有研究将牛软骨细胞接种到聚氨酯支架并进行动态压缩,生物力学刺激可以促进细胞增殖并维护关节表面功能[36]。多孔生物可降解聚合物支架与缺端胶原凝胶复合材料,将软骨细胞/缺端胶原混合物与聚L-乳酸复合或高分子材料(聚D-L丙交酯、PLA/CL和聚乳酸-DL-羟基乙酸共聚物)复合移植到损伤区域,结果以聚D-L丙交酯、PLA/CL构建的组织工程软骨产生大量的巨噬细胞堆积,从而使再生软骨发生退变,聚乳酸-DL-羟基乙酸共聚物和聚L-乳酸构建的组织工程软骨有助于软骨再生,并改善软骨质量[37]。 复合支架无细胞毒性,在体外能够支持软骨细胞的生长、增殖,及维持软骨细胞的表型和功能。戴刚等[38]研制的聚磷酸钙纤维/L-聚乳酸支架复合材料具有高孔隙度的三维立体结构,良好的抗压缩性能和生物降解性能,经进一步优化设计后,可成为结构和性能符合各项要求的新型软骨组织工程支架材料。有研究发现聚磷酸钙纤维,明胶复合材料的物理力学性能和降解性能基本满足软骨组织工程支架材料的要求,该复合材料有希望成为软骨组织工程支架材料之一。有人将磷酸三钙、聚磷酸钙纤维与聚乳酸材料复合后,发现磷酸三钙/聚磷酸钙纤维/聚乳酸支架材料具有三维、连通、微孔网状结构,孔隙率在70%-95%;孔隙率相近时,该支架材料的压缩模量比纯聚乳酸支架的压缩模量有了明显提高;磷酸三钙的加入使降解液pH值保持在6.0-7.0之间,避免了酸性降解产物引起的无菌性炎症反应,说明磷酸三钙/聚磷酸钙纤维/聚乳酸支架材料的物理力学性能和降解性能基本满足软骨组织工程的要求。有研究用电纺技术构建了Ⅱ型胶原和透明质酸复合三维纳米支架组织工程软骨,组织学和免疫组化染色结果表明,软骨细胞可以在Ⅱ型胶原和透明质酸复合三维纳米支架上生长,并分泌细胞外基质,并在培养2周后产生类似软骨陷窝结构,提示透明软骨形成。Ⅱ型胶原和透明质酸复合三维纳米支架有良好的物理化学性质和优良的生物相容性,它可以用作组织工程软骨的支架材料[39]。自体骨软骨骨镶嵌修复后软骨间空隙通长用靠纤维修复,用聚乳酸-DL-羟基乙酸共聚物复合支架材料或骨髓单核细胞聚乳酸-DL-羟基乙酸共聚物复合支架材料均可以很好的修复软骨间空隙[40]。 对细胞增殖有调节作用的细胞因子是软骨组织工程中很重要的一环。抗炎性细胞因子可以上调软骨细胞外基质,各种生长因子在组织工程中必不可少,细胞因子的作用并非单一作用,而是存在于一个复杂的调节网络之中。转化生长因子、胰岛素样生长因子、骨形态发生蛋白等在软骨修复中发挥了重要的功能。而白细胞介素、肿瘤坏死因子α、白血病抑制因子、趋化因子等细胞因子对软骨细胞的作用多呈损伤性[41]。多细胞生长因子作用于改良纤维蛋白胶软骨膜块中可明显促进组织工程软骨膜块构建以及关节软骨缺损的修复。经转化生长因子β2修饰的人脂肪源干细胞可以向软骨细胞分化,并产生Ⅱ型胶原蛋白,与聚乳酸-DL-羟基乙酸共聚物支架材料共培养可以促进软骨细胞修复[42]。石宗义[43]研究证实,实验各剂量转化生长因子β1都可以促进关节软骨全层缺损的修复,100 ng较理想,最佳剂量和方法仍需探讨。有研究表明,转化生长因子β1、软骨源性形态发生蛋白1都具有较强的修复软骨能力,是修复关节软骨缺损的 良好的生长因子,而软骨源性形态发生蛋白1较转化生长因子β1价格较低,无骨软骨赘和正常关节软骨的退变,在临床应用及基础研究更为理想。有研究探讨胰岛素样生长因子1和透明质酸联合培养对人关节软骨细胞增殖及其生物学行为的影响[44],研究发现胰岛素样生长因子1能明显促进软骨细胞的增殖;单纯应用透明质酸对软骨细胞的增殖无影响;二者联合培养时其促增殖能力更强,并且能有效地保持软骨细胞表型的稳定,成纤维细胞生长因子β、转化生长因子β1和骨诱导形成蛋白6多种细胞生长因子联合构建改良纤维蛋白胶支架软骨膜块修复关节软骨缺损的作用。组织工程构建过程中机体对生物材料的免疫反应可能导致修复失败,将软骨细胞与巨噬细胞共培养可以促进巨噬细胞游走抑制因子和Fas配体的表达,所以生物材料与软骨细胞复合构建组织工程转骨可以调节宿主衍生的巨噬细胞表达,从而调节炎性反应[45]。 "
| [1]Christensen BB, Foldager CB, Olesen ML, et al. Experimental articular cartilage repair in the Göttingen minipig: the influence of multiple defects per knee.J Exp Orthop. 2015;2(1):13. [2]de Windt TS, Vonk LA, Brittberg M, et al. Treatment and Prevention of (Early) Osteoarthritis Using Articular Cartilage Repair-Fact or Fiction? A Systematic Review.Cartilage. 2013;4(3 Suppl): 5S-12S.[3]Zhao M, Chen Z, Liu K, et al. Repair of articular cartilage defects in rabbits through tissue-engineered cartilage constructed with chitosan hydrogel and chondrocytes. J Zhejiang Univ Sci B. 2015;16(11): 914-923.[4]Peretti GM, Pozzi A, Ballis R, et al.Current surgical options for articular cartilage repair.Acta Neurochir Suppl. 2011;108:213-219. [5]Chiang H, Liao CJ, Wang YH, et al.Comparison of articular cartilage repair by autologous chondrocytes with and without in vitro cultivation. Tissue Eng Part C Methods. 2010;16(2):291-300.[6]杨方军,张晓峰,吴兴杰,等.自体软骨细胞移植修复关节软骨缺损[J].世界最新医学信息文摘, 2013,(34): 91-94.[7]程聪,任士友,江小成,等.自体软骨细胞移植和微骨折术修复膝关节软骨缺损的Meta分析[J].中国组织工程研究, 2015,19(24):3916-3923.[8]崔春爱,杨镇洙,陈华勇.自体骨膜移植修复关节软骨缺损的实验观察[J].延边大学医学学报,2002,25(1):8-11.[9]王与荣,张文明.骨膜诱导再生关节软骨的组织学观察[J].中国修复重建外科杂志,1991,5(2):69-72.[10]马树强,姬海鹏,王坤正,等.骨-骨膜复合组织与软骨下钻孔治疗关节软骨缺损的实验研究[J].陕西医学杂志, 2004, 33(5):390-392.[11]Guo X, Zheng Q, Yang S, et al. Repair of full-thickness articular cartilage defects by cultured mesenchymal stem cells transfected with the transforming growth factor beta1 gene.Biomed Mater. 2006;1(4):206-215.[12]Quintavalla J, Uziel-Fusi S, Yin J, et al.Fluorescently labeled mesenchymal stem cells (MSCs) maintain multilineage potential and can be detected following implantation into articular cartilage defects. Biomaterials. 2002;23(1):109-119.[13]Lin L, Zhou C, Wei X, et al. Articular cartilage repair using dedifferentiated articular chondrocytes and bone morphogenetic protein 4 in a rabbit model of articular cartilage defects.Arthritis Rheum. 2008;58(4):1067-1075.[14]Yun A, Lee SH, Kim J. A phase-field model for articular cartilage regeneration in degradable scaffolds. Bull Math Biol. 2013;75(12):2389-2409.[15]Scholten PM, Ng KW, Joh K, et al. A semi-degradable composite scaffold for articular cartilage defects. J Biomed Mater Res A. 2011;97(1):8-15.[16]Song HX, Li FB, Shen HL, et al. Repairing articular cartilage defects with tissue-engineering cartilage in rabbits. Chin J Traumatol. 2006;9(5):266-271.[17]黎婷,孙晋虎,赵亮,等.骨髓间充质干细胞定向诱导分化成骨细胞移植修复腭裂骨缺损[J].口腔医学研究, 2011, 27(2): 113-115.[18]陈克明,葛宝丰,刘兴炎,等.骨髓间充质干细胞复合纤维蛋白凝胶修复大面积关节软骨缺损[J].中国矫形外科杂志, 2004,12(6):444-446.[19]Duan W, Da H, Wang W, et al. [Experimental study of tissue engineered cartilage construction using oriented scaffold combined with bone marrow mesenchymal stem cells in vivo]. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi. 2013;27(5):513-519.[20]Muhonen V, Salonius E, Haaparanta AM, et al. Articular cartilage repair with recombinant human type II collagen/polylactide scaffold in a preliminary porcine study.J Orthop Res. 2015. doi: 10.1002/jor.23099.[21]肖丹.Ⅰ型胶原海绵吸附自体骨髓基质细胞修复兔膝关节软骨缺损[D].中山医科大学,2001.[22]Ko EC, Fujihara Y, Ogasawara T, et al. BMP-2 embedded atelocollagen scaffold for tissue-engineered cartilage cultured in the medium containing insulin and triiodothyronine--a new protocol for three-dimensional in vitro culture of human chondrocytes. Tissue Eng Part C Methods. 2012;18(5):374-386.[23]Lin PB, Ning LJ, Lian QZ, et al. A study on repair of porcine articular cartilage defects with tissue-engineered cartilage constructed in vivo by composite scaffold materials. Ann Plast Surg. 2010; 65(4):430-436.[24]Ahmed TA, Giulivi A, Griffith M, et al. Fibrin glues in combination with mesenchymal stem cells to develop a tissue-engineered cartilage substitute. Tissue Eng Part A. 2011;17(3-4):323-335.[25]陆史俊,左保齐,刘洪臣.丝素蛋白生物支架材料在骨组织工程中的应用进展[J].中国修复重建外科杂志, 2014, 28(10):1307-1310.[26]范志海,陆福男,张锋,等.丝素蛋白/透明质酸复合多孔支架材料的表征及细胞相容性[J].中国组织工程研究, 2012,16(29):5428-5432.[27]熊思.丝素蛋白的降解性能及其三维打印生物活性支架在皮肤中的应用研究[D].浙江大学,2015.[28]徐敬,赵建宁,徐海栋,等.壳聚糖及其衍生物在软骨组织工程中的应用[J].中国组织工程研究, 2015,19(25): 4081-4085.[29]史德海.新型仿生软骨组织工程用壳聚糖/Ⅱ型胶原支架的构建及实验研究[D].中山大学,2005.[30]Zhao M, Chen Z, Liu K, et al. Repair of articular cartilage defects in rabbits through tissue-engineered cartilage constructed with chitosan hydrogel and chondrocytes. J Zhejiang Univ Sci B. 2015;16(11): 914-923.[31]Chen R, Curran SJ, Curran JM, et al. The use of poly(l-lactide) and RGD modified microspheres as cell carriers in a flow intermittency bioreactor for tissue engineering cartilage.Biomaterials. 2006;27(25): 4453-4460. [32]Schuurman W, Harimulyo EB, Gawlitta D, et al. Three-dimensional assembly of tissue-engineered cartilage constructs results in cartilaginous tissue formation without retainment of zonal characteristics. J Tissue Eng Regen Med. 2013. doi: 10.1002/term.1726. [Epub ahead of print][33]Asawa Y, Sakamoto T, Komura M, et al. Early stage foreign body reaction against biodegradable polymer scaffolds affects tissue regeneration during the autologous transplantation of tissue-engineered cartilage in the canine model. Cell Transplant. 2012; 21(7):1431-1442.[34]Wright LD, McKeon-Fischer KD, Cui Z, et al. PDLA/PLLA and PDLA/PCL nanofibers with a chitosan-based hydrogel in composite scaffolds for tissue engineered cartilage.J Tissue Eng Regen Med. 2014;8(12):946-954. [35]Shahin K, Doran PM. Strategies for enhancing the accumulation and retention of extracellular matrix in tissue-engineered cartilage cultured in bioreactors. PLoS One. 2011;6(8):e23119. [36]Grad S, Loparic M, Peter R, et al. Sliding motion modulates stiffness and friction coefficient at the surface of tissue engineered cartilage. Osteoarthritis Cartilage. 2012;20(4):288-295.[37]Tanaka Y, Yamaoka H, Nishizawa S, et al. The optimization of porous polymeric scaffolds for chondrocyte/atelocollagen based tissue-engineered cartilage. Biomaterials. 2010;31(16):4506-4516.[38]戴刚,石宗利,李起鸿,等.新型骨与软骨组织工程支架材料制备及其性能研究[J].第三军医大学学报, 2002,24(5): 502-505[39]Yang Z, Chen Z, Liu K, et al. [Experimental study on tissue engineered cartilage complex three-dimensional nano-scaffold with collagen type II and hyaluronic acid in vitro]. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi. 2013;27(10):1240-1245.[40]Zuo Q, Cui W, Liu F, et al. Utilizing tissue-engineered cartilage or BMNC-PLGA composites to fill empty spaces during autologous osteochondral mosaicplasty in porcine knees.J Tissue Eng Regen Med. 2016; 10(11): 916-926.[41]Madry H, Orth P, Kaul G, et al. Acceleration of articular cartilage repair by combined gene transfer of human insulin-like growth factor I and fibroblast growth factor-2 in vivo.Arch Orthop Trauma Surg. 2010; 130(10): 1311-1322.[42]Jin XB, Sun YS, Zhang K, et al. Tissue engineered cartilage from hTGF beta2 transduced human adipose derived stem cells seeded in PLGA/alginate compound in vitro and in vivo. J Biomed Mater Res A. 2008;86(4): 1077-1087.[43]石宗义.转化生长因子β1促进关节软骨缺损修复的量效关系比较[J].山东医学高等专科学校学报,2006,28(4): 241-243.[44]黄建荣.转IGF-I基因软骨细胞移植治疗关节软骨缺损的实验研究[D].中山大学,2003.[45]Fujihara Y, Takato T, Hoshi K. Immunological response to tissue-engineered cartilage derived from auricular chondrocytes and a PLLA scaffold in transgenic mice. Biomaterials. 2010;31(6):1227-1234.[46]Dai NT, Fan GY, Liou NH, et al. Histochemical and functional improvement of adipose-derived stem cell-based tissue-engineered cartilage by hyperbaric oxygen/air treatment in a rabbit articular defect model. Ann Plast Surg. 2015;74 Suppl 2:S139-145.[47]Li DW, Zhou Q, Guo P, et al. [Proliferation of tissue-engineered cartilage cells under compressive stress]. Nan Fang Yi Ke Da Xue Xue Bao. 2010;30 (11):2530-2532.[48]Hoenig E, Winkler T, Mielke G, et al. High amplitude direct compressive strain enhances mechanical properties of scaffold-free tissue-engineered cartilage. Tissue Eng Part A. 2011;17(9-10):1401-1411. |
| [1] | Zhang Tongtong, Wang Zhonghua, Wen Jie, Song Yuxin, Liu Lin. Application of three-dimensional printing model in surgical resection and reconstruction of cervical tumor [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(9): 1335-1339. |
| [2] | Wu Xun, Meng Juanhong, Zhang Jianyun, Wang Liang. Concentrated growth factors in the repair of a full-thickness condylar cartilage defect in a rabbit [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1166-1171. |
| [3] | Shen Jinbo, Zhang Lin. Micro-injury of the Achilles tendon caused by acute exhaustive exercise in rats: ultrastructural changes and mechanism [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1190-1195. |
| [4] | Li Jiacheng, Liang Xuezhen, Liu Jinbao, Xu Bo, Li Gang. Differential mRNA expression profile and competitive endogenous RNA regulatory network in osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1212-1217. |
| [5] | Geng Qiudong, Ge Haiya, Wang Heming, Li Nan. Role and mechanism of Guilu Erxianjiao in treatment of osteoarthritis based on network pharmacology [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1229-1236. |
| [6] | Liang Xueqi, Guo Lijiao, Chen Hejie, Wu Jie, Sun Yaqi, Xing Zhikun, Zou Hailiang, Chen Xueling, Wu Xiangwei. Alveolar echinococcosis protoscolices inhibits the differentiation of bone marrow mesenchymal stem cells into fibroblasts [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 996-1001. |
| [7] | Duan Liyun, Cao Xiaocang. Human placenta mesenchymal stem cells-derived extracellular vesicles regulate collagen deposition in intestinal mucosa of mice with colitis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1026-1031. |
| [8] | Zeng Yanhua, Hao Yanlei. In vitro culture and purification of Schwann cells: a systematic review [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1135-1141. |
| [9] | He Xiangzhong, Chen Haiyun, Liu Jun, Lü Yang, Pan Jianke, Yang Wenbin, He Jingwen, Huang Junhan. Platelet-rich plasma combined with microfracture versus microfracture in the treatment of knee cartilage lesions: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(6): 964-969. |
| [10] | Liu Xin, Yan Feihua, Hong Kunhao. Delaying cartilage degeneration by regulating the expression of aquaporins in rats with knee osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(5): 668-673. |
| [11] | Deng Zhenhan, Huang Yong, Xiao Lulu, Chen Yulin, Zhu Weimin, Lu Wei, Wang Daping. Role and application of bone morphogenetic proteins in articular cartilage regeneration [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(5): 798-806. |
| [12] | Xu Dongzi, Zhang Ting, Ouyang Zhaolian. The global competitive situation of cardiac tissue engineering based on patent analysis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(5): 807-812. |
| [13] | Wu Zijian, Hu Zhaoduan, Xie Youqiong, Wang Feng, Li Jia, Li Bocun, Cai Guowei, Peng Rui. Three-dimensional printing technology and bone tissue engineering research: literature metrology and visual analysis of research hotspots [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 564-569. |
| [14] | Li Li, Ma Li. Immobilization of lactase on magnetic chitosan microspheres and its effect on enzymatic properties [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 576-581. |
| [15] | Chang Wenliao, Zhao Jie, Sun Xiaoliang, Wang Kun, Wu Guofeng, Zhou Jian, Li Shuxiang, Sun Han. Material selection, theoretical design and biomimetic function of artificial periosteum [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 600-606. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||