Chinese Journal of Tissue Engineering Research ›› 2014, Vol. 18 ›› Issue (3): 452-457.doi: 10.3969/j.issn.2095-4344.2014.03.020
Previous Articles Next Articles
Small-caliber artificial blood vessels: problems and prospects
Xu Zhi-wei1, Tan Yan2, Wu Hao1, Li Wen-bin3
- 1 Department of Thoracic Surgery, 2 Department of ICU, Affiliated Hospital of Hangzhou Normal University, Hangzhou 310015, Zhejiang Province, China; 3 Department of Cardiac Surgery, Beijing Anzhen Hospital, Capital Medical University, Beijing 100000, China
-
Online:2014-01-15Published:2014-01-15 -
Contact:Tan Yan, Master, Attending physician, Department of ICU, Affiliated Hospital of Hangzhou Normal University, Hangzhou 310015, Zhejiang Province, China -
About author:Xu Zhi-wei, M.D., Attending physician, Department of Thoracic Surgery, Affiliated Hospital of Hangzhou normal University, Hangzhou 310015, Zhejiang Province, China
CLC Number:
Cite this article
Xu Zhi-wei, Tan Yan, Wu Hao, Li Wen-bin. Small-caliber artificial blood vessels: problems and prospects [J]. Chinese Journal of Tissue Engineering Research, 2014, 18(3): 452-457.
share this article

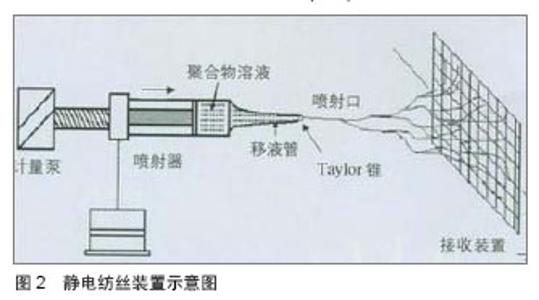
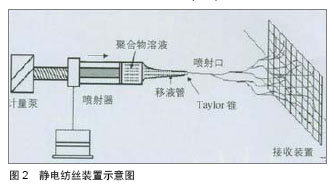
2.1 小口径血管支架材料 理想的小口径血管支架材料应具备良好的力学性能、物理稳定性、抗凝血性、生物相容性及抗感染性,但完全符合这些要求的材料还没有发现。目前已有的小口径血管支架材料包括天然生物材料、可降解高分子材料、复合材料及异种生物材料(表1)。 将人工合成高分子材料与天然生物材料复合制备复合材料,是近年来小口径血管支架材料研究的热点。陆树洋等[5]应用层层自组装的方法制备了肝素/胶原复合涂层聚四氟乙烯人工血管片,并进行了体外溶血实验、血小板黏附实验及血浆复钙时间实验,检测其抗凝血性能和血液相容性,结果复合小口径血管片表面仅有少量血小板贴覆,其溶血率为1.27%,复合小口径血管片观察至30 min未见纤维蛋白丝形成,证实肝素/胶原复合涂层聚四氟乙烯人工血管片有良好的抗凝血性能及血液相容性。 李少彬等[6]采用低温等离子体技术处理普通聚四氟乙烯人工血管内表面,涂覆丝素蛋白后再次使用低温等离子体技术对丝素膜进行磺酸化处理,成功制备了具有抗血液凝固性质的丝素蛋白膜聚四氟乙烯复合小口径人工血管。王聪[7]制备了内径为6 mm的新型纳米细菌纤维素涂层小口径人工血管,并通过电镜照片表征其涂层的光滑均匀性。有作者应用溶液蒸发技术制备了聚己酸内酯和多层碳纳米管的复合支架,通过观察此复合支架相组成和机械性能,证实了通过外加碳纳米管材料,复合支架的力学性能得到了很大的改善[8]。以上研究结果均说明复合材料能够兼具天然生物材料良好的生物相容性、亲水性和高分子人工合成材料可降解、机械强度高的优点,在血管组织工程领域有广阔的应用前景。 2.2 小口径血管支架的制备工艺 2.2.1 静电纺丝技术 静电纺工艺是利用聚合物溶液或熔体在高压静电场作用下,形成聚合物微小喷射流进行纺丝加工的工艺[9]。静电纺丝能够直接、连续制备聚合物纳米纤维,目前静电纺丝方法已经成为组织工程血管支架的主要制备方法之一。"

静电纺丝技术的优点:①能够得到微纳结构的纤维,纤维直径与天然的细胞外基质(如胶原纤维) 或细胞尺寸相近,所以可以最大程度模仿人体细胞外基质结构。②支架的孔隙率高,静电纺丝纤维这可能得到90%左右的孔隙率,能够满足细胞生长的要求。③具有很大的比表面积,有利于细胞的黏附生长。④能够负载生长因子诱导细胞黏附、增殖和分化。⑤静电纺丝得到的支架的力学性能、厚度及结构可控。 目前常用的静电纺丝制备方法有单一材料静电纺、共混静电纺及同轴共纺等[10-13],单一材料静电纺的生物相容性不佳,所以学者开始进行共混静电纺研究,所谓共混静电纺,即是将合成材料与天然材料纺丝溶液混合在一起,确定合适的比例后,通过静电纺丝法制备血管支架。同轴共纺技术制备的“壳•芯”结构纳米纤维,主要应用于有抗凝血功能的功能化支架中[14-15]。 总之,将天然材料和合成材料用静电纺方法共纺在一起,制备复合纳米纤维,既能克服天然材料力学性能的不足,又能避免合成材料生物相容性的缺陷,成为制备小口人工血管支架的必然趋势。但如何在天然材料与合成材料之间找到一个最佳比例,使复合材料的力学性能和血管相容性达到一个平衡,是需要解决的问题。 2.2.2 自组装技术 层层自组装是利用逐层交替沉积的方法,借助各层分子间的弱相互作用(如静电引力、配位键、氢键等),使层与层自发地缔合形成稳定且具有特定功能的分子聚集体或超分子结构的过程。 自组装技术的制备工艺比较简单,即通过材料表面吸附活性的表面活性剂分子,通过自发的界表面化学合成反应获得有序结构,其制备可在水溶液体系中进行,可在复杂表面结构的材料上形成组装分子在亚微米尺寸上的、排列致密有序的自组装膜。因自组装技术的简单性,其已经广泛应用于表面工程技术领域,在医用材料的表面修饰方面也显示出其独特的优势,如血管支架材料的表面涂层[16]、抗菌涂层的应用等。陈斌[17]采用层层自组装技术制备肝素壳聚糖表面修饰小口径涤纶人工血管,生物相容性测试证实肝素壳聚糖表面修饰后小口径涤纶人工血管的抗血小板黏附、抗凝血性能优异,生物相容性良好;力学性能测试证实符合人体使用标准;动物体内实验证实肝素壳聚糖层层自组装表面修饰的涤纶人工血管能够在体内完成内皮化进程,具有较高的近中期通畅率。 自组装可从材料的角度将自组装膜分为小分子和聚合物两类;也可按所用的键型分为离子键、配位键和共价键自组装;也可按自组装的层数分为单层膜和多层膜。而用于组织工程血管支架的自组装技术属于大分子自组装。自组装能够很好地解决合成支架容易引起的炎症、瘢痕等不利影响,其根源在于细胞自然增殖生长的能力。 2.2.3 快速成型技术 快速成型最早应用于航天工业,其特点是能在较短时间内制造出各种复杂零件的原型,很快被应用于汽车、模具等工业领域。快速成型技术在医学领域的应用主要得益于CT、MRI等高分辨率检测技术的发展,其基本步骤是通过计算机专用软件对CT、MRI扫描所获得的图像数据信息进行逐层转换,通过转换得到的数控加工命令可控制相应的机床依次逐层加工制作三维模型。该技术的特点是使用和维护简单、成本较低、速度快且无污染,已经在心血管外科、骨科、耳鼻外科以及组织工程等各个医学分支领域显示出良好的应用前景。如有作者采用MRI图像结合快速成型技术制造心腔模型[18-19],Kelly等[20]采用CT图像资料结合快速成型技术加工成鼻腔的模型,还有研究者利用快速成型技术制作心脏瓣膜[21-22]、脑血管以及心血管等系统的生物模型[23-25]。 目前,已有不少国内外学者利用快速成型技术制备组织工程管状支架[26-27],组织工程血管能够快速、精确、廉价的设计加工,使大规模用于临床的实现成为了可能。 2.2.4 凝胶纺丝技术 凝胶纺丝是通过似凝胶态中间物质得到高强度纤维的纺丝方法。凝胶纺丝法可使普通的柔性链成纤高聚物(如聚乙烯、聚丙烯腈和聚乙烯醇等)获得较理想结构、制得高强度高模量的纤维。凝胶纺丝的特点是所制备的初生丝条具有均匀疏松的网络结构,大分子链间缠结少,可进行高倍拉伸。目前,已经有人用凝胶纺丝技术制备了组织工程管状支架,其表现出了较高的力学性能,纤维结构也得到了更好的优化。 2.2.5 脱细胞技术 脱细胞制备的支架材料保持了血管的原有形态和物理性能,并保存了细胞识别的结合位点,可以为细胞的黏附、增殖、分化及功能发挥提供与体内组织发育的细胞外基质(ECM)相似的支架条件;且无或极低的免疫排斥反应,构建的血管支架材料也显示出良好的生物相容性和顺应性,通畅率高。 目前国内外常用的脱细胞方法主要有酶消化法、化学去垢法、机械法等,这几种方法各有利弊,物理法对支架结构的破坏较小但脱细胞效果较差;而化学方法脱细胞效果较好却容易破坏血管的胶原结构,且去垢剂残留会有一定的细胞毒性;酶消化法简单易行,但其浓度还没有统一标准,且脱细胞效果也不是很理想,而且长时间暴露于化学溶剂中脱细胞容易引起细菌的污染。另外,如何在保留脱细胞血管支架足够机械强度的前提下,提高材料的疏松性和孔隙率,也是目前组织工程脱细胞血管支架研究中一个亟待解决的难点。最后,脱细胞血管支架的消毒及长期保存也是需要进一步研究的问题。 2.3 小口径人工血管的内皮化 小口径人工血管的远期通畅率不高,容易堵塞,要解决这一问题的关键是促使人工血管的表面尽快内皮化,使构成的血管具有完整的内皮细胞层,有功能的内皮细胞层具有防止血小板黏附、抗血栓形成作用,能够有效抑制血管狭窄及堵塞的发生。 目前,促进人工血管内皮化的主要途径有是内皮细胞体外种植法及内皮细胞体内原位表面化,内皮细胞体外种植法又包括单期种植法、二期种植法以及自体静脉碎片快速种植法,所进行种植的细胞主要为内皮细胞/内皮祖细胞。种植培养方法有静态培养和动态培养。静态培养是细胞种植培养的最基础方法之一,其有助于细胞在人工血管内沉降、黏附,并促进细胞骨架的成熟和细胞间紧密连接形成融合单层,在细胞培养初期是有利的,但胴体效果不佳。后来,研究者发现,适宜的流体力学刺激有利于细胞增殖分化,所以近年来主要采用动态培养的方法,应用自制的生物反应器,在一定搏动流条件下完成种子细胞的种植。 促进小口径人工血管在体内皮化的方法有很多,包括接枝抗循环内皮细胞/内皮祖细胞膜受体的抗体、接枝内皮细胞/内皮祖细胞整合素特异性识别的功能性短肽、包被磁性分子、包被特异性结合内皮细胞/内皮祖细胞的适体及基因修饰等[34-38]。 研究表明,设计针对内皮细胞/内皮祖细胞表面分子标签CD34/CD133/VEGF-1、2的抗体,接枝到移植物的表面来捕捉循环中的内皮祖细胞及内皮细胞,较短时间内可实现内皮化。此外,接枝可以被整合素识别的RGD序列、REDV以及SVVYGLR功能性短肽序列,可介导细胞的黏附增殖以及迁移,促进小口径人工血管的内皮化[39]。李杰[40]构建了犬人工血管-腹主动脉置换模型,应用他汀类药物阿托伐他汀干预,观察其对人工血管移植后内皮化进程的作用,结果显示阿托伐他汀可以增加外周血内皮祖细胞的数目和活性,加速人工血管内皮化进程,改善小口径人工血管移植后的通畅率。耿纪群等[41]的研究证实,骨髓CD34+细胞较传统单核细胞更能满足人工血管体内种植的要求。 人工血管的基因修饰也是目前本研究热点,已有如血管内皮细胞生长因子基因、beta半乳糖基因、组织型纤溶蛋白原基因、血栓调节蛋白基因等多种基因用于内皮细胞基因修饰研究,体内及体外实验研究也获得了良好的效果。"
| [1]Huang Y, Gloviczki P, Noel AA,et al.Early complications and long-term outcome after open surgical treatment of popliteal artery aneurysms: is exclusion with saphenous vein bypass still the gold standard? J Vasc Surg. 2007;45(4):706-713.[2]Heyligers JM, Lisman T, Verhagen HJ,et al.A heparin-bonded vascular graft generates no systemic effect on markers of hemostasis activation or detectable heparin-induced thrombocytopenia-associated antibodies in humans.J Vasc Surg. 2008;47(2):324-329.[3]Martelli E, Ippoliti A, Ventoruzzo G,et al.Popliteal artery aneurysms. Factors associated with thromboembolism and graft failure.Int Angiol. 2004;23(1):54-65.[4]李辉,陈群清,李少彬,等.改良小口径人工血管的血液相容性研究[J].中国医学创新,2013,15:10-12.[5]陆树洋,孙晓宁, 张鹏,等.层层自组装肝素/胶原复合涂层聚四氟乙烯小口径人工血管的研究[J].中华实验外科杂志,2012,29(4): 589-591.[6]李少彬,闫玉生,李辉,等. 等离子体磺酸化丝素蛋白膜聚四氟乙烯复合小口径人工血管的制备[J].中国组织工程研究与临床康复,2010,14(8): 1357-1360.[7]王聪.细菌纤维素涂层的小口径人造血管研究[D].东华大学, 2012.[8]Pan L, Pei X, He R,et al.Multiwall carbon nanotubes/polycaprolactone composites for bone tissue engineering application.Colloids Surf B Biointerfaces. 2012;93:226-234.[9]Kawahira Y, Nishigaki K, Ueno T.Extracardiac Fontan procedure bridging the vertebra for apico-caval juxtaposition. Ann Thorac Surg. 2006;82(1):350-352.[10]Chen ZG, Wang PW, Wei B,et al.Electrospun collagen-chitosan nanofiber: a biomimetic extracellular matrix for endothelial cell and smooth muscle cell.Acta Biomater. 2010;6(2):372-382.[11]Chen R, Qiu L, Ke Q,et al.Electrospinning thermoplastic polyurethane-contained collagen nanofibers for tissue-engineering applications.J Biomater Sci Polym Ed. 2009;20(11):1513-1536. [12]Huang C, Chen R, Ke Q,et al.Electrospun collagen-chitosan-TPU nanofibrous scaffolds for tissue engineered tubular grafts.Colloids Surf B Biointerfaces. 2011;82(2):307-315.[13]Chen R, Huang C, Ke Q,et al.Preparation and characterization of coaxial electrospun thermoplastic polyurethane/collagen compound nanofibers for tissue engineering applications.Colloids Surf B Biointerfaces. 2010; 79(2):315-325. [14]Su Y, Li X, Liu Y,et al.Encapsulation and Controlled Release of Heparin from Electrospun Poly(L-Lactide-co-epsilon- Caprolactone) Nanofibers.J Biomater Sci Polym Ed. 2010. [Epub ahead of print][15]Yan S, Xiaoqiang L, Shuiping L,et al.Controlled release of dual drugs from emulsion electrospun nanofibrous mats.Colloids Surf B Biointerfaces. 2009;73(2):376-381.[16]隋景晗. 静电自组装糖胺聚糖抗体血管支架涂层的研究[D].大连理工大学.2008.[17]陈斌.肝素壳聚糖自组装表面修饰小口径涤纶人工血管的研究[D].复旦大学.2008.[18]Vloeberghs M, Hatfield F, Daemi F,et al.Soft tissue rapid prototyping in neurosurgery.Comput Aided Surg. 1998; 3(2):95-97.[19]Sun J, Xiong YY, Zhang FQ,et al.A preliminary study on maxillofacial prosthesis using structured light three-dimensional scanning and rapid prototyping technique.Zhonghua Kou Qiang Yi Xue Za Zhi. 2007; 42(7):403-405.[20]Kelly JT, Prasad AK, Wexler AS.Detailed flow patterns in the nasal cavity.J Appl Physiol (1985). 2000;89(1):323-337.[21]Anderson JR, Chiu DT, Jackman RJ,et al.Fabrication of topologically complex three-dimensional microfluidic systems in PDMS by rapid prototyping.Anal Chem. 2000;72(14): 3158-3164.[22]Luo Y, Zare RN.Perforated membrane method for fabricating three-dimensional polydimethylsiloxane microfluidic devices. Lab Chip. 2008;8(10):1688-1694. [23]D'Urso PS, Thompson RG, Atkinson RL,et al.Cerebrovascular biomodelling: a technical note.Surg Neurol. 1999;52(5): 490-500.[24]Wurm G, Tomancok B, Pogady P,et al.Cerebrovascular stereolithographic biomodeling for aneurysm surgery. Technical note.J Neurosurg. 2004;100(1):139-145.[25]Binder TM, Moertl D, Mundigler G,et al.Stereolithographic biomodeling to create tangible hard copies of cardiac structures from echocardiographic data: in vitro and in vivo validation.J Am Coll Cardiol. 2000;35(1):230-237.[26]Sodian R, Loebe M, Hein A,et al.Application of stereolithography for scaffold fabrication for tissue engineered heart valves.ASAIO J. 2002;48(1):12-16. [27]Hockaday LA, Kang KH, Colangelo NW,et al.Rapid 3D printing of anatomically accurate and mechanically heterogeneous aortic valve hydrogel scaffolds.Biofabrication. 2012;4(3):035005.[28]黄明清,李杰,李翠玲,等.小口径脱细胞基质人工血管移植的研究[J].中华实验外科杂志,2012,29(1):61-63.[29]陆军,肖学钧,陈欣欣.脱细胞牛颈静脉血管支架的内皮化研究[J].中华胸心血管外科杂志,2009,25(5):346-349.[30]周敏,刘长建,卫志庆,等. bFGF预载脱细胞支架构建小口径人工血管的研究[J].中国修复重建外科杂志, 2008,22(3):370-375.[31]周敏,刘长建,卫志庆,等.以肝素固化脱细胞支架构建的小口径抗凝人工血管[J].中国组织工程研究与临床康复,2008,12(36): 7118-7121.[32]黄明清,李翠玲,李杰,等.小口径脱细胞基质人工血管移植后4周内膜增生的初步研究[J].国际医药卫生导报,2013,19(15): 2257-2260.[33]刘硕. 脱细胞脐血管作为小口径组织工程血管支架的探索研究[D]. 首都医科大学.2009.[34]Rotmans JI, Heyligers JM, Verhagen HJ,et al.In vivo cell seeding with anti-CD34 antibodies successfully accelerates endothelialization but stimulates intimal hyperplasia in porcine arteriovenous expanded polytetrafluoroethylene grafts. Circulation. 2005;112(1):12-18.[35]Suuronen EJ, Wong S, Kapila V,et al.Generation of CD133+ cells from CD133- peripheral blood mononuclear cells and their properties.Cardiovasc Res. 2006;70(1):126-135.[36]Pislaru SV, Harbuzariu A, Gulati R,et al.Magnetically targeted endothelial cell localization in stented vessels.J Am Coll Cardiol. 2006;48(9):1839-1845.[37]Pislaru SV, Harbuzariu A, Agarwal G,et al.Magnetic forces enable rapid endothelialization of synthetic vascular grafts. Circulation. 2006;114(1 Suppl):1314-1318.[38]Hoffmann J, Paul A, Harwardt M,et al.Immobilized DNA aptamers used as potent attractors for porcine endothelial precursor cells.J Biomed Mater Res A. 2008;84(3):614-621.[39]Blindt R, Vogt F, Astafieva I,et al.A novel drug-eluting stent coated with an integrin-binding cyclic Arg-Gly-Asp peptide inhibits neointimal hyperplasia by recruiting endothelial progenitor cells.J Am Coll Cardiol. 2006;47(9):1786-1795.[40]李杰. 阿托伐他汀促进小口径人工血管移植后快速内皮化的初步研究[D] .中山大学.2010.[41]耿纪群,谢宗涛,蔡铭,等. 骨髓CD34+干细胞与单核细胞应用于组织工程小血管内皮化的比较[J].中华实验外科杂志,2012, 29(11): 2156-2158. |
| [1] | Zhang Tongtong, Wang Zhonghua, Wen Jie, Song Yuxin, Liu Lin. Application of three-dimensional printing model in surgical resection and reconstruction of cervical tumor [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(9): 1335-1339. |
| [2] | Zeng Yanhua, Hao Yanlei. In vitro culture and purification of Schwann cells: a systematic review [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1135-1141. |
| [3] | Xu Dongzi, Zhang Ting, Ouyang Zhaolian. The global competitive situation of cardiac tissue engineering based on patent analysis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(5): 807-812. |
| [4] | Wu Zijian, Hu Zhaoduan, Xie Youqiong, Wang Feng, Li Jia, Li Bocun, Cai Guowei, Peng Rui. Three-dimensional printing technology and bone tissue engineering research: literature metrology and visual analysis of research hotspots [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 564-569. |
| [5] | Chang Wenliao, Zhao Jie, Sun Xiaoliang, Wang Kun, Wu Guofeng, Zhou Jian, Li Shuxiang, Sun Han. Material selection, theoretical design and biomimetic function of artificial periosteum [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 600-606. |
| [6] | Liu Fei, Cui Yutao, Liu He. Advantages and problems of local antibiotic delivery system in the treatment of osteomyelitis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 614-620. |
| [7] | Li Xiaozhuang, Duan Hao, Wang Weizhou, Tang Zhihong, Wang Yanghao, He Fei. Application of bone tissue engineering materials in the treatment of bone defect diseases in vivo [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 626-631. |
| [8] | Zhang Zhenkun, Li Zhe, Li Ya, Wang Yingying, Wang Yaping, Zhou Xinkui, Ma Shanshan, Guan Fangxia. Application of alginate based hydrogels/dressings in wound healing: sustained, dynamic and sequential release [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 638-643. |
| [9] | Chen Jiana, Qiu Yanling, Nie Minhai, Liu Xuqian. Tissue engineering scaffolds in repairing oral and maxillofacial soft tissue defects [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 644-650. |
| [10] | Xing Hao, Zhang Yonghong, Wang Dong. Advantages and disadvantages of repairing large-segment bone defect [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(3): 426-430. |
| [11] | Chen Siqi, Xian Debin, Xu Rongsheng, Qin Zhongjie, Zhang Lei, Xia Delin. Effects of bone marrow mesenchymal stem cells and human umbilical vein endothelial cells combined with hydroxyapatite-tricalcium phosphate scaffolds on early angiogenesis in skull defect repair in rats [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(22): 3458-3465. |
| [12] | Wang Hao, Chen Mingxue, Li Junkang, Luo Xujiang, Peng Liqing, Li Huo, Huang Bo, Tian Guangzhao, Liu Shuyun, Sui Xiang, Huang Jingxiang, Guo Quanyi, Lu Xiaobo. Decellularized porcine skin matrix for tissue-engineered meniscus scaffold [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(22): 3473-3478. |
| [13] | Mo Jianling, He Shaoru, Feng Bowen, Jian Minqiao, Zhang Xiaohui, Liu Caisheng, Liang Yijing, Liu Yumei, Chen Liang, Zhou Haiyu, Liu Yanhui. Forming prevascularized cell sheets and the expression of angiogenesis-related factors [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(22): 3479-3486. |
| [14] | Liu Chang, Li Datong, Liu Yuan, Kong Lingbo, Guo Rui, Yang Lixue, Hao Dingjun, He Baorong. Poor efficacy after vertebral augmentation surgery of acute symptomatic thoracolumbar osteoporotic compression fracture: relationship with bone cement, bone mineral density, and adjacent fractures [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(22): 3510-3516. |
| [15] | Liu Liyong, Zhou Lei. Research and development status and development trend of hydrogel in tissue engineering based on patent information [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(22): 3527-3533. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||