Chinese Journal of Tissue Engineering Research ›› 2018, Vol. 22 ›› Issue (21): 3424-3430.doi: 10.3969/j.issn.2095-4344.0489
Previous Articles Next Articles
Adipose-derived stem cells in cartilage tissue engineering: cell markers, genetic modifications, and the ideal combination with scaffolds
Wei Yi-fan1, 2, Zeng Jing1, 2, Zhang Wei3, Wang Yao1, 2, Chen You-bai1, Han Yan1
- 1Department of Plastic Surgery, 3Department of Orthopedics, General Hospital of Chinese PLA, Beijing 100853, China; 2Medical School of Nankai University, Tianjin 300071, China
-
Revised:2018-02-07Online:2018-07-28Published:2018-07-28 -
Contact:Chen You-bai, M.D., Attending physician, Lecturer, Department of Plastic Surgery, General Hospital of Chinese PLA, Beijing 100853, China -
About author:Wei Yi-fan, Master candidate, Physician, Department of Plastic Surgery, General Hospital of Chinese PLA, Beijing 100853, China; Medical School of Nankai University, Tianjin 300071, China -
Supported by:the National Natural Science Foundation of China, No. 81272123
CLC Number:
Cite this article
Wei Yi-fan, Zeng Jing, Zhang Wei, Wang Yao, Chen You-bai, Han Yan. Adipose-derived stem cells in cartilage tissue engineering: cell markers, genetic modifications, and the ideal combination with scaffolds[J]. Chinese Journal of Tissue Engineering Research, 2018, 22(21): 3424-3430.
share this article

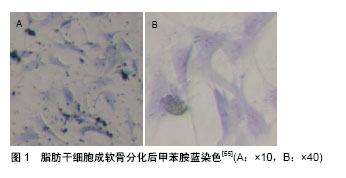
2.1 脂肪干细胞构建组织工程软骨的主要影响因素 2.1.1 生长因子 转化生长因子β:通过与表面受体结合,磷酸化激活素受体激酶5,激活Smad信号通路,诱导脂肪干细胞向软骨细胞分化,进而促进糖胺聚糖和Ⅱ型胶原等细胞外基质的合成。Pittenger等[9]的研究表明,转化生长因子β可改变糖胺聚糖的糖基模式,增加硫酸软骨素链长度,提高磷酸化程度,使其更加致密和富有弹性。Awad等[10]、Merceron等[11]和Hamid等[12]发现转化生长因子β1,β2和β3均可诱导脂肪干细胞分化为软骨细胞,但不同的亚型有不同的诱导效率。转化生长因子β1的作用具有浓度相关性,当其质量浓度为10 μg/L时,诱导脂肪干细胞向软骨细胞分化的效率最高[13]。Estes等[14]的研究显示转化生长因子β1和β3诱导脂肪干细胞成软骨分化的效果无显著差异。但对于骨髓干细胞而言,转化生长因子β3的软骨诱导效应强于转化生长因子β1。 骨形态发生蛋白:是转化生长因子β超家族的一员,能上调软骨相关基因的表达,促进软骨细胞成熟,并维持软骨细胞特性。研究显示,质量浓度50 μg/L的骨形态发生蛋白2可在透明质酸支架中诱导脂肪干细胞向软骨细胞分化[15]。Kim等[16]认为单独应用骨形态发生蛋白2,其诱导作用并不明显,且诱导的软骨很快发展为肥大软骨。Estes等[17]发现质量浓度500 μg/L的骨形态发生蛋白6可在藻酸盐微球中提高脂肪干细胞软骨相关基因的表达,并下调软骨肥大基因的表达。Knippenberg等[18]发现在三维培养时,骨形态发生蛋白7较骨形态发生蛋白2有更强的诱导成软骨分化能力。骨形态发生蛋白14又称软骨形态发生蛋白1或生长分化因子5,可促进软骨细胞合成糖胺聚糖和Ⅱ型胶原等特异性细胞外基质,维持软骨表型。在小鼠皮下及肌肉内注射骨形态发生蛋白14可见异位的软骨组织形成,提示其具有诱导间充质干细胞分化成软骨的能力。刘振宁等[19]利用外源性的骨形态发生蛋白14诱导脂肪干细胞向软骨分化,可见Ⅱ型胶原蛋白和糖胺聚糖的表达显著增加。马洪斌等[20]的研究显示,骨形态发生蛋白14转染后的脂肪干细胞,Ⅱ型胶原和软骨相关基因Sox-9的表达显著增加。Katayama等[21]用骨形态发生蛋白14基因转染兔骨髓干细胞,并修复兔关节软骨缺损,8周后可见成熟的透明软骨。李明辉等[22]的研究显示质量浓度100 μg/L的骨形态发生蛋白14诱导脂肪干细胞向软骨细胞分化的效果最好。杨亚军等[23]利用骨形态发生蛋白14诱导鼠脂肪干细胞,结合牛松质骨生物支架修复兔髌骨关节软骨缺损,24周时可见软骨组织形成。 胰岛素样生长因子1:可促进软骨细胞表达、合成和分泌蛋白聚糖和Ⅱ型胶原,抑制细胞外基质降解,是调节蛋白聚糖合成最重要的生长因子。Longobardi等[24]证实胰岛素样生长因子1能诱导脂肪干细胞向软骨细胞分化,增强Sox-9表达。Li等[25]用胰岛素样生长因子1转染脂肪干细胞,并施加动态压力,发现软骨特异性细胞外基质的分泌显著增加。 其他因子:成纤维细胞生长因子2能促进脂肪干细胞增殖和成软骨分化,其效果与浓度和作用阶段有关[26]。但成纤维细胞生长因子18是导致软骨肥大的主要生长因子之一[27]。此外,血小板衍生生长因子能促进间充质干细胞成软骨分化和细胞外基质的合成。 2.1.2 生长因子联合应用 转化生长因子+骨形态发生蛋白:Sukarto等[28]的研究显示质量浓度10 μg/L的转化生长因子β3与10 μg/L的骨形态发生蛋白6是诱导脂肪干细胞向软骨细胞分化的最佳组合,不仅可以增加Ⅱ型胶原和蛋白聚糖等软骨相关基因和蛋白的表达,还能有效控制软骨肥大基因的表达。有学者利用周期式的培养方法,前4 d向诱导液中添加转化生长因子β,后3 d向诱导液中添加骨形态发生蛋白6,循环3个周期,发现其诱导脂肪干细胞成软骨分化的效果更好。 脂肪干细胞转染骨形态发生蛋白基因后常导致成骨分化,与其他成基因联合转染则可使脂肪干细胞向软骨细胞分化。Mehlhorn等[29]单独利用骨形态发生蛋白2诱导脂肪干细胞,发现可同时发生成骨和成软骨分化,而加入转化生长因子β1后成骨分化被抑制,倾向于向软骨细胞分化。Kim等[30]发现转化生长因子β2和骨形态发生蛋白7联合应用能显著提高脂肪干细胞向软骨细胞分化的能力。 转化生长因子+胰岛素样生长因子:研究显示,转化生长因子β2或β3与胰岛素样生长因子1联合应用,诱导脂肪干细胞向软骨细胞分化的能力显著增强[31]。 转化生长因子+转铁蛋白:转铁蛋白具有促进细胞外基质分泌的作用,杨国庆等[32]发现转化生长因子β1和转铁蛋白联合诱导,可显著增强脂肪干细胞向软骨分化的能力。 转化生长因子+Sox9:常染色体性别反转基因(Sox9)是调控软骨发生的主要转录因子,可促进前体干细胞的聚集,维持软骨细胞增殖,抑制其向肥大软骨细胞分化。联合应用转化生长因子β1和Sox9可促进Ⅱ型胶原、糖胺聚糖的表达[33]。 骨形态发生蛋白+胰岛素样生长因子:An等[34]用胰岛素样生长因子1联合骨形态发生蛋白2转染脂肪干细胞,3周后检测到成熟软骨陷窝形成。 转化生长因子+骨形态发生蛋白+成纤维细胞成长因子:Mahmoudifar等[35]用含转化生长因子β1+骨形态发生蛋白6的培养基培养脂肪干细胞,接种于支架之前用成纤维细胞成长因子2处理,发现可增加蛋白多糖和Ⅱ型胶原纤维的分泌。 2.1.3 化学药物 本课题组利用含0.1 μmol/L地塞米松、6.25 mg/L胰岛素、50 nmol/L维生素C、质量浓度10 μg/L的转化生长因子β3和10 μg/L的骨形态发生蛋白6的诱导液,诱导脂肪干细胞向软骨细胞分化。其中,地塞米松是脂肪干细胞向软骨细胞分化的始动因素,与脂肪干细胞的糖皮质激素受体结合,抑制其向脂肪细胞分化,并促进其向软骨细胞分化。地塞米松的作用受浓度和时间的影响。胰岛素是体外培养细胞成活、有丝分裂、糖原合成必不可少的成分。维生素C可抑制细胞凋亡,促进细胞合成胶原时脯氨酸和赖氨酸羟基化,增加Ⅱ型胶原蛋白的表达。 2.1.4 细胞培养方式 细胞共培养:软骨细胞可通过细胞融合、缝隙连接及微管物质交换等直接与脂肪干细胞接触,还可通过分泌多种可溶性细胞因子和细胞外基质间接诱导,在不添加外源性生长因子和化学药物的情况下,促进脂肪干细胞向软骨细胞分化。Hildner等[36]将脂肪干细胞与人关节软骨细胞直接共培养,并加入转化生长因子β1,发现脂肪干细胞的增殖速度及细胞外基质分泌明显增加。张勇等[37]发现病理状态的软骨细胞与脂肪干细胞共培养21 d后,也可诱导其分化为软骨样细胞,为利用脂肪干细胞修复关节损伤打下了基础。许海委等[38]等利用Transwell间接共培养兔脂肪干细胞和软骨细胞,14 d后发现脂肪干细胞分化为软骨样细胞,表达软骨细胞特异性的基因和蛋白。间接共培养由于细胞未直接接触,不会导致不同类型的细胞融合或产生异核体,但是细胞缺乏直接交流。脂肪干细胞与软骨细胞按照1∶3-1∶5的共培养比例,均可有效的促进成软骨分化,增加软骨特异性细胞外基质的表达。将人骨髓间充质干细胞与人类髓核细胞直接共培养,两者比例为1∶3时,软骨特异性标志物表达最多,而进行间接共培养时比例不同则无差异。此外,共培养在促进向软骨细胞分化的同时,减少了软骨肥大标记物的表达,有助于改善新生软骨的纤维化及肥大。 微球三维培养:三维立体环境对构建组织工程软骨至关重要,微球培养可以使细胞紧密接触,增强细胞间信号交流,分泌和共享各种细胞因子。且早期细胞微球内的轻度缺氧激活了p38,AKT和缺氧诱导因子α等信号通路,从而增强了Sox9的表达,可有效促进脂肪干细胞向软骨细胞分化。本课题组将脂肪干细胞构成的细胞微球进行体外诱导向软骨细胞分化,1 d后可见细胞形态由梭形向多角形、多边形转变,3 d后出现软骨球,7 d后软骨球逐渐增多,开始分泌基质,约14 d形成细胞结节,细胞核周出现黑色颗粒;21 d时基质大量增加,软骨球直径可达1.5-2.0 mm。但是细胞聚集成团限制了生长空间,不利于营养物质的交换及外源性因子的渗入。此外,细胞的简单无序堆积,无法塑形,缺乏力学强度,限制了其临床应用[39]。 支架三维培养:支架是组织工程的3要素之一,理想的软骨组织工程支架材料需满足以下几个特点:①良好的力学强度,构建软骨的基本轮廓并提供支撑;②模拟软骨细胞外基质的微环境,利于种子细胞黏附、迁移和增殖。增强细胞间、细胞与支架的交流,释放信号定向诱导种子细胞的成软骨分化;③良好的生物相容性,相匹配的降解速度;④适当的空间结构和孔隙率,利于氧和营养物质的转运、废物排出[40]。软骨组织工程的支架材料主要有天然支架材料、人工合成支架材料及复合支架材料。天然支架具有良好的生物相容性,但力学性能和可塑性差强人意。人工合成支架来源广泛,可塑性好,具有一定的生物力学强度。因此将几种具有互补特性的材料按一定比例和方式合成的复合支架受到越来越多的青睐。近年来又逐渐发展了生长因子缓释支架、基因加载支架及纳米材料支架。此外,软骨脱细胞的细胞外基质支架也是目前的研究热点。软骨的细胞外基质主要由Ⅱ型胶原蛋白和糖胺聚糖(硫酸软骨素和硫酸角质素)组成。脱细胞软骨基质支架是利用曲拉通破坏细胞膜,核酸酶去除细胞的RNA和DNA,蛋白酶抑制剂保留Ⅱ型胶原和蛋白多糖等细胞外基质,仅残留空白软骨陷窝。这种脱细胞支架具有合适的微环境、孔隙率和孔径大小,可促进脂肪干细胞的黏附、迁移和向软骨细胞分化。缺点是脱细胞后的软骨机械性能较弱,如用于重建气管等,易导致术后狭窄。 动态三维培养:传统的三维培养,构建物中心的营养物质和代谢产物交流缓慢。利用生物反应器的动态三维培养可使氧及营养物质进入支架更充分,代谢产物排出更容易。此外,生物反应器的流体力学刺激能促进细胞增殖和分化,产生更多的细胞外基质,且细胞密度和分布更为合理。显著提高脂肪干细胞向软骨细胞分化的质量和效率,形成的组织工程软骨富含Ⅱ型胶原及蛋白多糖,具有较好的生物力学性能[41]。常用的生物反应器有旋转瓶式、灌注式、旋转壁式及流体静压系统等。 2.2 其他因素 2.2.1 细胞来源 不同物种的脂肪干细胞向软骨细胞分化的能力有所差异,相比兔和羊的脂肪干细胞,人脂肪干细胞向软骨细胞分化的能力较弱。供者年龄及解剖部位等对脂肪干细胞的成软骨能力无显著影响。脂肪干细胞的某些亚群可能有着较强的成软骨能力,例如孙恒赟等[42]发现相比CD61-的脂肪干细胞,CD61+的脂肪干细胞具有更强的体外软骨分化能力。其机制可能是CD61可协助激活转化生长因子β信号通路,而转化生长因子β在脂肪干细胞向软骨细胞分化中发挥着关键作用。 2.2.2 培养条件 氧浓度:软骨组织是一种缺氧组织,正常关节软骨无血管供应,其供氧只能依靠周围关节液的渗透作用,因此关节软骨表面的氧张力为5-10,而深层可能< 1。低氧分压可模拟关节软骨的生理条件,使低氧诱导因子稳定表达,促进软骨相关基因表达。软骨细胞培养常用的最佳氧含量介于1%-5%。Malladi等[43]的研究显示2%的低氧条件可促进脂肪干细胞向软骨分化。Kanichai等[44]的研究显示大鼠间充质干细胞在成软骨诱导液的作用下,低氧组Ⅱ型胶原蛋白和蛋白多糖的表达较常氧组有明显增加。戴兵等[45]在体积分数5%的低氧条件下,将脂肪干细胞和软骨细胞按3∶1的比例混合,接种于聚乳酸羟基乙酸共聚物的明胶支架上共培养,发现相比体积分数20%的常氧条件,低氧条件可促进脂肪干细胞向软骨细胞分化。 血清及糖浓度:高浓度血清可促进脂肪干细胞向软骨细胞分化,可能是其中的高浓度细胞因子发挥作用。高糖培养液可促进脂肪干细胞向软骨细胞分化,可能因为高糖培养液能减少细胞凋亡。 代数:传代对脂肪干细胞的成软骨能力影响不大,本课题组一般利用第3-5代的脂肪干细胞作为软骨组织工程的种子细胞,此时细胞表型较稳定,且增殖、分化能力较强[46]。 生物力学:力学刺激对关节软骨发育有着重要的作用,间歇性压力、适当的剪切力及微重力等可以通过PGE2通路传送至细胞内,增加细胞DNA的合成,直接或间接促进软骨细胞的增殖,增加Ⅱ型胶原合成及蛋白聚糖的合成和分泌[47]。 电磁场:Chen等[48]认为单脉冲的电磁场可促进脂肪干细胞向软骨细胞分化,但其分化效率尚未到达临床应用要求。 一氧化氮:外源性一氧化氮可以通过抑制转化生长因子及其下游信号通路,抑制脂肪干细胞的成软骨分化[49]。 疏密波:吴广文等[50]的研究显示疏密波可通过上调核心结合因子a和Sox9的mRNA表达,提高糖胺聚糖和Ⅱ型胶原的表达,促进骨髓间充质干细胞分化为软骨细胞。 2.2.3 miRNA 是在转录后水平调控基因表达的一类非编码单链小分子RNA,在维持软骨细胞内环境稳定中起重要作用。作为成软骨分化转录后重要的调节中介,miRNA通过结合靶基因,调节成软骨分化。在脂肪干细胞成软骨分化过程中7个miRNA表达上调,分别为hsa-miR-193b,hsa-miR-199a-3p/hsa-miR-199b-3p,hsa-miR-455-3p,hsa-miR-210,hsa-miR-381,hsa-miR-92a和hsa-miR-320c;4个miRNA表达下调,分别为hsa-miR-490-5p,hsa-miR-4287,evb-miR- BART8和hcmv-miR-US25-1。上调的miRNAs靶基因可能为CAAT/增强子结合蛋白β、B细胞κ轻链增强核因子的抑制物α,Sox4,丝裂原激活的蛋白激酶、Runx2和骨形成蛋白受体2等。下调的miRNAs靶基因可能为Sox4,Smad4/5,丝裂原激活的蛋白激酶和骨形成蛋白受体2。例如miR-199a在鼠骨髓间充质干细胞中可直接靶向结合Smad1,调节软骨形成;而miR-455-3p则通过调节转化生长因子β信号通路,抑制成软骨分化。miR-194 通过抑制Sox5的表达,影响脂肪干细胞向软骨细胞分化[51-54]。 2.2.4 富血小板血浆(PRP) 富含转化生长因子β等各种生长因子,并且具有天然的纤维蛋白支架,为脂肪干细胞提供了良好的黏附、增殖和分化环境,促进脂肪干细胞向软骨细胞分化。 2.2.5 甲状旁腺激素相关肽(PTHrP) 可促进软骨细胞增殖,并调节其肥大化。在成软骨诱导液中添加质量浓度10 μg/L的PTHrP能够显著抑制软骨肥大基因的表达,抑制诱导后干细胞的早期肥大,但同时也降低了软骨相关基因的表达。PTHrP对于脂肪干细胞向软骨细胞分化的影响还有待进一步研究。 2.3 验证脂肪干细胞向软骨细胞分化的方法 2.3.1 组织学染色 诱导脂肪干细胞向软骨细胞分化14 d后甲苯胺蓝染色阳性,21 d后阿尔新蓝染色阳性,胞浆呈蓝色,软骨细胞外的蛋白多糖可被Safranin O染成桔红色[55],见图1。 2.3.2 相关基因和蛋白的检测 一般通过对Sox9、Ⅱ型胶原蛋白、硫酸软骨素及硫酸角质素等软骨特异性基因和蛋白的检测,证实软骨细胞的形成[56]。"
| [1] 方洪松,周建林,彭昊.组织工程支架材料修复关节软骨缺损[J].中国组织工程研究与临床康复,2016,16(12):7891-7998.[2] 李广广,郭杨,戴国达.基于骨-软骨交互作用探析骨关节炎发病机制及治疗策略[J].中国组织工程研究,2017,21(24):3924-3930.[3] 周勇,朱伟民,彭亮权.构建组织工程软骨支架材料:现状及未来[J].中国组织工程研究,2017,21(10):1604-1610.[4] 张洪美,荆琳.自体软骨细胞移植治疗膝骨关节炎的临床研究与应用[J].中国组织工程研究,2007,11(8):1509-1511.[5] 谢鹏,张仲文.自体骨髓间充质干细胞和同种异体软骨细胞共培养优化软骨组织工程种子的细胞源[J].中国组织工程研究,2012,16(14): 2509-2514.[6] 刘耀升,刘蜀彬.软骨组织工程研究中的干细胞[J].中国组织工程研究,2009,13(7):1334-1337.[7] 李丽艳,黄金中,杜江.转化生长因子β1诱导骨髓间充质干细胞向软骨细胞分化[J].中国组织工程研究,2010,14(1):38-41.[8] 陈犹白,陈聪慧,韩岩.脂肪干细胞的分离、纯化和保存:研究进展和发展方向[J].中国组织工程研究,2016,20(10):1508-1520.[9] Pittenger MF, Mackay AM, Beck SC. Multilineage potential of adult human mesenchymal stem cells. Science. 1999;284(5411): 143-147. [10] Awad HA, Halvorsen YD, Gimble JM. Effects of transforming growth factor β1 and dexamethasone on the growth and chondrogenic differentiation of adipose-derived stromal cells. Tissue eng. 2003;9(6):1301-1312.[11] Merceron C, Portron S, Vignes-Colombeix C. Pharmacological modulation of human mesenchymal stem cell chondrogenesis by a chemically oversulfated polysaccharide of marine origin: potential application to cartilage regenerative medicine. Stem Cells. 2012;(3):471-480. [12] Hamid R, Brandt SJ. Transforming growth-interacting factor (TGIF) regulates proliferation and differentiation of human myeloid leukemia cells. Mol Oncol. 2009;(5-6):451-463.[13] 刘连江,李放,文天用.转化生长因子β1/胰岛素样生长因子1与髓核细胞诱导脂肪间充质干细胞向髓核样软骨细胞分化的比较[J].中国组织工程研究,2010,14(23):4217-4221.[14] Estes BT, Diekman BO, Gimble JM, et al. Isolation of adipose-derived stem cells and their induction to a chondrogenic phenotype. Nat Protoc. 2010;5(7):1294-1311.[15] Fu HL, Diao ZY, Shao L, et al. BMP-2 promotes chondrogenesis of rat adipose-derived stem cells by using a lentiviral system. Genet Mol Res. 2014;13(4):8620-8631.[16] Kim HY, Lee JH, Yun JW, et al. Development of Porous Beads to Provide Regulated BMP-2 Stimulation for Varying Durations: In Vitro and In Vivo Studies for Bone Regeneration. Biomacromolecules. 2016;17(5):1633-1642.[17] Estes BT, Wu AW, Storms RW. Extended passaging, but not aldehyde dehydrogenase activity, increases the chondrogenic potential of human adipose-derived adult stem cells. Cell Physiol. 2006;209(3):987-995.[18] Knippenberg M, Helder MN, Zandieh Doulabi B. Osteogenesis versus chondrogenesis by BMP-2 and BMP-7 in adipose stem cells. Biochem Biophys Res Commun. 2006;342(3):902-908.[19] 刘振宁,贾长青,韩长旭.生长分化因子5诱导兔脂肪干细胞成软骨细胞分化的实验研究[J].中国修复重建外科杂志,2009,23(4):483-489.[20] 马洪斌,李运祥,王铭伦.腺病毒携带骨形态发生蛋白14基因转染脂肪干细胞修复损伤关节软骨[J].中国组织工程研究,2015,19(1): 54-60.[21] Katayama Y, Matsuyama Y, Yoshihara H. Clinical and radiographic outcomes of posterolateral lumbar spine fusion in humans using recombinant human bone morphogenetic protein-2: an average five-year follow-up study. Int Orthop. 2009;33(4):1061-1067.[22] 李明辉,刘洋,孙凯.生长分化因子5诱导脂肪干细胞向软骨细胞的转化[J].中国组织工程研究,2016,20(51):7628-7633. [23] 杨亚军,高俊,马锋.软骨形态发生蛋白1诱导仔鼠脂肪干细胞裸鼠体内软骨的分化[J].中国组织工程研究与临床康复,2009, 13(15):2828-2832.[24] Longobardi L, Granero-Moltó F, O'Rear L., et al. Subcellular localization of IRS-1 in IGF-I-mediated chondrogenic proliferation, differentiation and hypertrophy of bone marrow mesenchymal stem cells. Growth Factors. 2009;27(5): 309-320.[25] Li J, Zhao Q, Wang E. Dynamic compression of rabbit adipose-derived stem cells transfected with insulin-like growth factor 1 in chitosan/gelatin scaffolds induces chondrogenesis and matrix biosynthesis. Cell Physiol. 2012;227(5): 2003-2012.[26] Hildner F, Wolbank S, Redl H.Howchondrogenic are human umbilical cord matrix cells? A comparison to adipose-derived stem cells. Tissue Eng Regen Med. 2010;4(3):242-245.[27] 宋林涛,姜潮,李校堃.成纤维细胞生长因子18(FGF18)的研究进展[J].中国生物工程杂志,2012,32(9):95-100.[28] Sukarto A, Yu C, Flynn LE.Co-delivery of adipose-derived stem cells and growth factor-loaded microspheres in RGD-grafted N-methacrylate glycol chitosan gels for focal chondral repair. Biomacromolecules. 2012;13(8):2490-2502.[29] Mehlhorn AT, Niemeyer P, Kaschte K. Differential effects of BMP-2 and TGF-beta1 on chondrogenic differentiation of adipose derived stem cells. Cell Prolif. 2007;40(6):809-823.[30] Kim BS, Kang KS, Kang SK. Soluble factors from ASCs effectively direct control of chondrogenic fate. Cell Prolif. 2010;43(3):249-261.[31] Madry H, Reyrico A, Venkatesan JK, et al. Transforming growth factor Beta-releasing scaffolds for cartilage tissue engineering. Tissue Eng Part B Rev. 2014;20(2):106. [32] 杨国庆,王兆杰,安荣泽.兔脂肪干细胞在含有转化因子和转铁蛋白培养基中向软骨细胞的分化[J].中国组织工程研究,2011, 15(45):8391-8394.[33] 贺明,陈洪亮,王大鹏.SOX-9和转化生长因子-β1共同诱导大鼠脂肪干细胞向软骨细胞分化[J].解剖科学进展,2009,15(2): 221-226.[34] An C, Cheng Y, Yuan Q, et al. IGF-1 and BMP-2 induces differentiation of adipose-derived mesenchymal stem cells into chondrocytes-like cells. Ann Biomed Eng. 2010;38(4): 1647-1654.[35] Mahmoudifar N, Doran PM. Chondrogenic differentiation of human adipose-derived stem cells in polyglycolic acid mesh scaffolds under dynamic culture conditions. Biomaterials. 2010;31(14):3858-3867.[36] Hildner F, Concaro S, Peterbauer A, et al. Human adipose-derived stem cells contribute to chondrogenesis in coculture with human articular chondrocytes. Tissue Eng Part A. 2009;15(12):3961-3969.[37] 张勇,赵建宁,韩宁波.不同培养条件下脂肪干细胞与软骨细胞共培养的研究[J].中国矫形外科杂志,2009,17(10):782-785.[38] 许海委,徐宝山,杨强.细胞共培养法诱导兔脂肪来源干细胞向软骨细胞分化的实验研究[J].中国修复重建外科杂志, 2013,27(2): 193-198.[39] 陈犹白,陈聪慧,韩岩.脂肪干细胞成骨分化的研究进展[J/CD].中华损伤与修复杂志:电子版,2016,11(2):126-134.[40] 陈犹白,陈聪慧,韩岩.脂肪干细胞成脂分化的研究进展[J].中国美容医学,2016,25(4):86-93.[41] 康红军,卢世璧,张莉.人脂肪干细胞复合脱细胞软骨基质支架在生物反应器中构建组织工程软骨[J].中国组织工程研究与临床康复,2007,11(10):1801-1804.[42] 孙恒赟,周广东,曹谊林.CD61阳性人脂肪来源细胞体外软骨分化潜能的初步研究[J].中华耳科学杂志,2013,11(4):540-542.[43] Malladi P, Xu Y, Chiou M, et al. Effect of reduced oxygen tension on chondrogenesis and osteogenesis in adipose-derived mesenchymal cells. Am J Physiol Cell Physiol. 2006;290(4):C1139-1146. [44] Kanichai M, Ferguson D, Prendergast PJ, et al.Hypoxia promotes chondrogenesis in rat mesenchymal stem cells: a role for AKT and hypoxia-inducible factor (HIF)-1alpha. Cell Physiol. 2008;216(3):708-715.[45] 戴兵,徐海艇,金海东.低氧对脂肪干细胞和关节软骨细胞三维共培养成软骨能力的影响[J].中国组织工程研究,2014,18(29): 4630-4635.[46] 陈犹白,柴密,乌兰哈斯.放射性损伤:类型、症状和机制[J/CD].中华损伤与修复杂志(电子版),2017,12(3):203-206.[47] Mellor LF, Steward AJ, Nordberg RC, et al. Comparison of Simulated Microgravity and Hydrostatic Pressure for Chondrogenesis of Hasc. Aerosp Med Hum Perform. 2017; 88(4):377-384.[48] Chen CH, Lin YS, Fu YC, et al. Electromagnetic fields enhance chondrogenesis of human adipose-derived stem cells in a chondrogenic microenvironment in vitro. Appl Physiol (1985). 2013;114(5):647-655.[49] Liu S, Huang HS, Yu M, et al. Influence of exogenous nitric oxide on chondrogenic differentiation of adipose derived stem cells. Sichuan Da Xue Xue Bao Yi Xue Ban. 2015;46(1):6-10, 21.[50] 吴广文,刘伯龄,刘献祥.疏密波最佳波段组合诱导大鼠骨髓间充质干细胞向软骨细胞的分化[J].中国组织工程研究与临床康复, 2009,13(6):1059-1063.[51] 闫继红,杨姝,孙海梅.共沉默miR-221-3p/222-3p表达抑制骨髓间充质干细胞增殖及促成软骨分化[J].中国组织工程研究,2015, 19(50):8056-8061.[52] 杞少华,武栋成,李东升.MicroRNA在干细胞增殖与分化过程中的调控作用[J].中国组织工程研究,2011,15(27):5096-5099.[53] 陈学斌,徐银胜,张芳.微小RNAs调控间充质干细胞的自我更新与分化[J].中国组织工程研究,2012,16(49):9294-9300.[54] 刘波,王希明,潘琦.miR-155有助于骨髓间充质干细胞成软骨分化[J].中国组织工程研究,2015,19(32):5113-5117.[55] 李宝军,邓展生,许宇霞. 特定培养基条件下大鼠脂肪间充质干细胞体外定向软骨细胞的分化[J].中国组织工程研究,2007, 11(3):435-438.[56] 赵娜.脂肪干细胞诱导分化的现状及前景[J].中国组织工程研究,2015,19(6):969-974.[57] 陈犹白,郝永红,王岚脂肪干细胞成脂分化的分子机制和信号通路[J].中国组织工程研究,2017,21(1):154-158.[58] 陈犹白,陈聪慧,张启旭. 脂肪干细胞表型和标记物的研究进展[J].中国美容医学,2016,25(3):91-100.[59] 陈犹白,张启旭,Butler CE. DOTAP脂质体介导VEGF基因转染人脂肪干细胞及目的基因的表达[J].临床耳鼻咽喉头颈外科, 2016,30(12):966-971.[60] 陈犹白,张启旭,Butle CE.血管内皮细胞生长因子基因转染的人脂肪干细胞具有较强的增殖和分化能力[J].细胞与分子免疫学, 2017,33(3):352-361. |
| [1] | Pu Rui, Chen Ziyang, Yuan Lingyan. Characteristics and effects of exosomes from different cell sources in cardioprotection [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(在线): 1-. |
| [2] | Lin Qingfan, Xie Yixin, Chen Wanqing, Ye Zhenzhong, Chen Youfang. Human placenta-derived mesenchymal stem cell conditioned medium can upregulate BeWo cell viability and zonula occludens expression under hypoxia [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(在线): 4970-4975. |
| [3] | Zhang Tongtong, Wang Zhonghua, Wen Jie, Song Yuxin, Liu Lin. Application of three-dimensional printing model in surgical resection and reconstruction of cervical tumor [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(9): 1335-1339. |
| [4] | Wu Xun, Meng Juanhong, Zhang Jianyun, Wang Liang. Concentrated growth factors in the repair of a full-thickness condylar cartilage defect in a rabbit [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1166-1171. |
| [5] | Li Jiacheng, Liang Xuezhen, Liu Jinbao, Xu Bo, Li Gang. Differential mRNA expression profile and competitive endogenous RNA regulatory network in osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1212-1217. |
| [6] | Geng Qiudong, Ge Haiya, Wang Heming, Li Nan. Role and mechanism of Guilu Erxianjiao in treatment of osteoarthritis based on network pharmacology [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1229-1236. |
| [7] | Zhang Xiumei, Zhai Yunkai, Zhao Jie, Zhao Meng. Research hotspots of organoid models in recent 10 years: a search in domestic and foreign databases [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1249-1255. |
| [8] | Hou Jingying, Yu Menglei, Guo Tianzhu, Long Huibao, Wu Hao. Hypoxia preconditioning promotes bone marrow mesenchymal stem cells survival and vascularization through the activation of HIF-1α/MALAT1/VEGFA pathway [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 985-990. |
| [9] | Shi Yangyang, Qin Yingfei, Wu Fuling, He Xiao, Zhang Xuejing. Pretreatment of placental mesenchymal stem cells to prevent bronchiolitis in mice [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 991-995. |
| [10] | Liang Xueqi, Guo Lijiao, Chen Hejie, Wu Jie, Sun Yaqi, Xing Zhikun, Zou Hailiang, Chen Xueling, Wu Xiangwei. Alveolar echinococcosis protoscolices inhibits the differentiation of bone marrow mesenchymal stem cells into fibroblasts [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 996-1001. |
| [11] | Fan Quanbao, Luo Huina, Wang Bingyun, Chen Shengfeng, Cui Lianxu, Jiang Wenkang, Zhao Mingming, Wang Jingjing, Luo Dongzhang, Chen Zhisheng, Bai Yinshan, Liu Canying, Zhang Hui. Biological characteristics of canine adipose-derived mesenchymal stem cells cultured in hypoxia [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1002-1007. |
| [12] | Geng Yao, Yin Zhiliang, Li Xingping, Xiao Dongqin, Hou Weiguang. Role of hsa-miRNA-223-3p in regulating osteogenic differentiation of human bone marrow mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1008-1013. |
| [13] | Lun Zhigang, Jin Jing, Wang Tianyan, Li Aimin. Effect of peroxiredoxin 6 on proliferation and differentiation of bone marrow mesenchymal stem cells into neural lineage in vitro [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1014-1018. |
| [14] | Zhu Xuefen, Huang Cheng, Ding Jian, Dai Yongping, Liu Yuanbing, Le Lixiang, Wang Liangliang, Yang Jiandong. Mechanism of bone marrow mesenchymal stem cells differentiation into functional neurons induced by glial cell line derived neurotrophic factor [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1019-1025. |
| [15] | Duan Liyun, Cao Xiaocang. Human placenta mesenchymal stem cells-derived extracellular vesicles regulate collagen deposition in intestinal mucosa of mice with colitis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1026-1031. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||