Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (15): 2430-2436.doi: 10.12307/2024.408
Previous Articles Next Articles
Preparation, characterization, and application of acylated collagen with anhydride
Li Weizhao, Zhou Hui, Peng Xinsheng, Li Baohong
- School of Pharmacy, Guangdong Medical University, Dongguan 523808, Guangdong Province, China
-
Received:2023-06-05Accepted:2023-07-17Online:2024-05-28Published:2023-09-23 -
Contact:Li Baohong, PhD, Professor, School of Pharmacy, Guangdong Medical University, Dongguan 523808, Guangdong Province, China Peng Xinsheng, PhD, Professor, School of Pharmacy, Guangdong Medical University, Dongguan 523808, Guangdong Province, China -
About author:Li Weizhao, Master candidate, School of Pharmacy, Guangdong Medical University, Dongguan 523808, Guangdong Province, China -
Supported by:Key Research Project for Ordinary Universities of Guangdong Provincial Department of Education, No. 2021ZDZX2039 (to PXS); Chongbu Qiang Key Project of Guangdong Medical University, No. 4SG21277P (to PXS)
CLC Number:
Cite this article
Li Weizhao, Zhou Hui, Peng Xinsheng, Li Baohong. Preparation, characterization, and application of acylated collagen with anhydride[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(15): 2430-2436.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
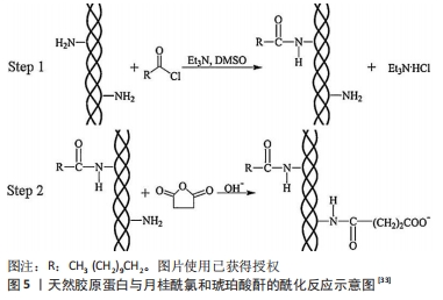
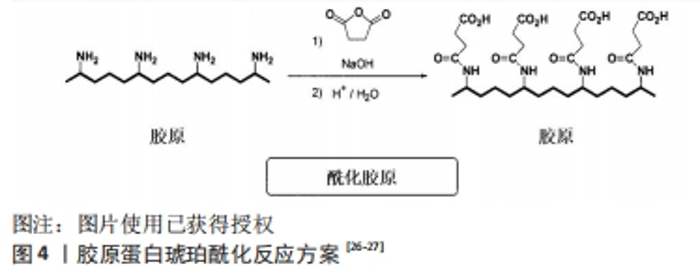
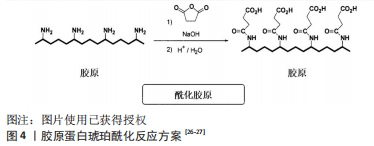
胶原蛋白侧链的ε-氨基会使得琥珀酸酐开环,与其生成酰胺键,另一端变成羧基,结果显示胶原蛋白不仅引入琥珀酸酐亲水基团,同时引入长碳链亲油基团,使胶原蛋白成为具有双极性基团的高分子表面活性剂,使得胶原蛋白的水溶性有明显提高。然而,这类反应存在两大技术难点:琥珀酸酐在过高或过低的pH环境下水溶性差,为了让胶原蛋白与琥珀酸酐顺利反应,一般反应体系中会使用有机溶剂如乙醇、二甲基亚砜等;反应过程产生的羧酸会导致反应体系的pH值下降,然而酰化反应最佳pH值在9-10,否则琥珀酸酐与胶原蛋白的反应速率降低,产率也相应地降低。为了解决该问题,改性反应进行的同时需要一直调节pH值,WANG等[28]将冻干胶原蛋白溶解在0.5 mol/L乙酸,得到2 mg/mL的胶原蛋白溶液,将该溶液于磷酸盐缓冲溶液(pH=9.0)在4 ℃透析3 d,琥珀酸酐以不同摩尔比加入胶原蛋白溶液并与胶原蛋白的氨基反应,反应体系在15 ℃下搅拌4 h,以完成胶原蛋白的琥珀酰化;酰化后溶液在4 ℃下与磷酸盐缓冲液(pH=7.4)或去离子水透析3 d,然后冷冻干燥保存。张军涛等[29-30]也利用酰化反应来实现天然胶原的N端精准接枝改性,将提取胶原后加入氨基保护试剂如丁二酸酐、2,3-二甲基马来酸酐等[31],得到侧链保护的酰化胶原蛋白,进一步对侧链保护的酰化胶原蛋白进行N端接枝,这一研究拓展了酰化胶原蛋白的应用领域。虽然琥珀酸酐的引入能使天然胶原蛋白的等电点降至3.5以下,但是该方法制备的琥珀酰化胶原蛋白热稳定性较差,琥珀酰化胶原蛋白变性温度是34 ℃,低于正常天然胶原蛋白的变性温度(38 ℃),不利于三螺旋结构的稳定。作者所在课题组利用新的缓冲体系制备酰化胶原蛋白,制备过程简洁稳定,pH值相对稳定;将酰化胶原蛋白冻干溶解在细胞培养基中,不仅可以促进成纤维细胞增殖,还可以使成纤维细胞迁移。由此可见,酰化胶原蛋白广泛参与细胞增殖与细胞迁移的过程,基于胶原蛋白的生物材料在组织修复和细胞增殖中扮演着重要角色。酰化胶原蛋白在保留胶原蛋白三螺旋结构的同时,还增加水溶性,让其使用浓度相比胶原蛋白增加了不少,扩大了胶原蛋白的应用范围。 此外,研究人员在天然胶原蛋白分子的自由氨基上引入了疏水性的月桂酰基和亲水性的琥珀酸基[32],反应机制如图5所示[33]:将天然胶原蛋白海绵溶于二甲基亚砜,然后在反应体系中加入适量月桂酰氯,在20 ℃下搅拌约24 h,中间产物用醋酸透析3 d;将含有琥珀酸酐的二甲基亚砜溶液加入中间产物溶液中搅拌约4 h,最后用去离子水对酰化胶原蛋白进行透析3 d。纯化的酰化胶原蛋白溶液在-50 ℃下冷冻干燥2 d,在4 ℃下保存直至使用。研究结果表明,通过双改性方法获得的酰化胶原蛋白不仅具有良好的水溶性和表面活性,而且具有更强的热稳定性,更加适合于促进疏水药物的分散和缓释。"
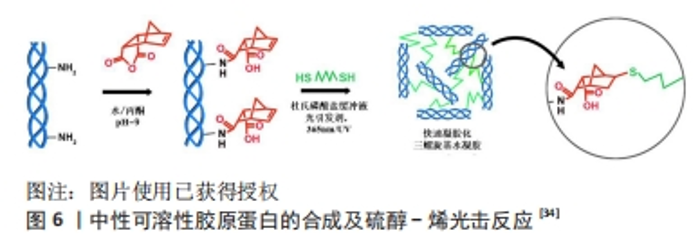
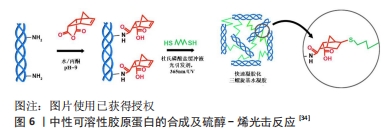
2.1.2 利用降冰片烯二酸酐制备酰化胶原蛋白 降冰片烯二酸酐,降莰烯的桥环烃,是一种白色固体,有刺激性酸味,化学式为C7H10,该分子由环己烯环和亚甲基桥(C-3和C-6之间)组成。降冰片烯进行酸催化水合反应,与水形成降冰片。降冰片烯二酸酐常用于过渡金属催化去影响亲电子过渡金属的迁移。相较于琥珀酸酐,降冰片烯二酸酐的优势在于:它与胶原蛋白反应后不仅可以提供在中性溶液中的良好溶解性,并且可以通过硫醇-烯化学快速光聚合成共价交联的水凝胶。GUO等[34]利用降冰片烯二酸酐与胶原蛋白反应产生额外羧基,从而显著改善胶原蛋白在中性缓冲液中的溶解度以及与其他聚合物的混溶性。利用降冰片烯二酸酐制备酰化胶原蛋白的反应机制如图6,胶原蛋白的赖氨酸ε-氨基与降冰片烯二酸酐反应,它使混合生物墨水能够对多种刺激作出反应,从而在混合水凝胶中形成连续交联的中性可溶性胶原蛋白网络。具体改性过程为:在搅拌下,将溶于丙酮(胶原蛋白溶液的1/20体积)的降冰片烯二酸酐(1,3和6 mg/mg的胶原蛋白)逐滴加入胶原蛋白溶液中,在加入降冰片烯二酸酐期间让反应体系的pH值保持在9.0;在4 ℃和无菌环境下搅拌2 h,在4 ℃下将混合物置于水中使用8 000-14 000 Da的透析管透析14 d,溶液被冻干成白色多孔泡沫,并储存在4 ℃。根据对中性可溶性胶原蛋白的一系列表征结果分析,中性可溶性胶原蛋白在pH值为7.0时的电荷变负值,而胶原蛋白的电荷则为0,结果显示酰化增加了胶原蛋白在中性溶液的溶解度。同时中性可溶性胶原蛋白仅在pH=5时表现出低溶解度,而胶原蛋白在3-5的酸性pH值范围内溶解度大,结果表明,可溶性胶原蛋白可溶于中性粒子溶液。"
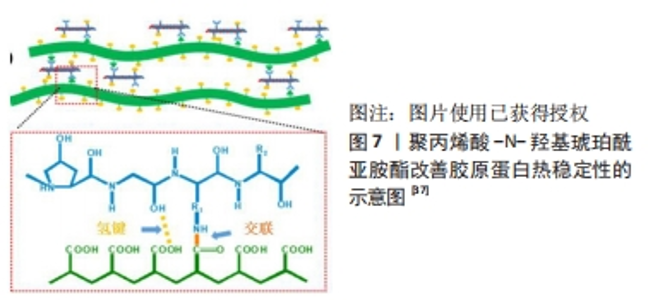
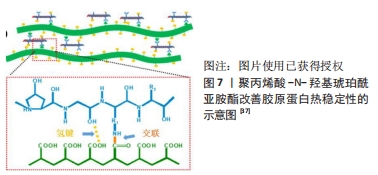
2.1.3 利用马来酸酐及柠檬酸酐制备酰化胶原蛋白 马来酸酐,简称顺酐,含有共轭马来酰基,一个乙烯基相连2个羰基,化学性质非常活泼,常用于接枝改性。柠檬酸酐是由柠檬酸2个羧基脱水形成,具有吸水性和酰化能力。混合酸酐的使用可以使反应更加快速和稳定。PAMFIL等[31]利用2,3-二甲基马来酸酐或柠檬酸酐反应合成带有乙烯基的多孔酰化胶原蛋白,其反应机制:胶原蛋白的侧链ε-氨基与2-甲基马来酸酐或N,N-二甲基乙酰胺发生开环反应,从而使开环的2-甲基马来酸酐或N,N-二甲基乙酰胺连接上胶原蛋白。胶原蛋白溶液是以质量分数1%的氢氧化钠溶液制备的,反应混合物pH值保持在9.0时,几乎所有存在于胶原蛋白分子上的赖氨酸ε-氨基都从质子化的形式中解放出来,且能够于改性剂反应。溶解在二甲基亚砜中的酸酐在室温下连续搅拌24 h后,滴加到反应瓶中的胶原蛋白溶液上(胶原蛋白∶酸酐质量比为1∶3或1∶5),加入氢氧化钠溶液保持pH值不变;用去离子水透析3 d以去除未反应的化合物,净化所得产品。经过2-甲基马来酸酐或N,N-二甲基乙酰胺修饰的胶原蛋白特性黏度和固有黏度显著增加,与未修饰的胶原蛋白相比,修饰的胶原蛋白在溶液中的黏度和分子质量增加,表明胶原蛋白大分子的形状和尺寸在修饰后发生了变化。酸酐化学改性后的胶原蛋白在固态下具有良好的热稳定性,且在酸性介质中具有增强的溶解度和高反应性。 2.1.4 利用双官能团改性剂制备酰化胶原蛋白 研究表明,酰化胶原蛋白一般是由天然胶原蛋白与酸酐反应制得,最常用的酸酐是琥珀酸酐,但这种改性是有缺陷的,琥珀酰化胶原蛋白变性温度是34 ℃,低于正常的天然胶原的变形温度(38 ℃)。天然胶原蛋白本身热稳定性较差,在37-40 ℃以上会变性,由于酰化修饰导致胶原蛋白的三螺旋构象不稳定性加剧,导致热稳定性下降,所以需要通过不同途径去加强酰化胶原蛋白的热稳定性。 ZHANG等[35]设计了一种新型的双官能团改性剂γ-聚乙醇酸-N-羟基琥珀酰亚胺酯,将胶原蛋白溶解于稀盐酸酸化的水中,用氢氧化钠溶液调节pH值至9.0,加入γ-聚乙醇酸-N-羟基琥珀酰亚胺酯,在添加过程中,加入氢氧化钠溶液使pH值保持在9.0,反应混合物在室温搅拌30 min,最后用去离子水透析3 d,将生成的溶液在-50 ℃下冷冻干燥2 d,在4 ℃下储存直至使用。同时对改性后的胶原蛋白进行流变学行为的研究,结果表明改性胶原蛋白溶液是假塑性流体,并且改性胶原蛋白溶液的热稳定性有所提高[36]。此外,细胞实验证实改性胶原蛋白表现出良好的细胞相容性。 YANG等[37]也设计了以聚丙烯酸和N-羟基琥珀酰亚胺为原料合成的一种新型双功能改性剂,改性过程具体为:将冻干后的胶原蛋白溶解于稀盐酸溶液中,用氢氧化钠溶液调节pH值至9.0。将聚丙烯酸-N-羟基琥珀酰亚胺酯溶于二甲基亚砜中,滴加到胶原蛋白溶液中,搅拌(聚丙烯酸-N-羟基琥珀酰亚胺酯与胶原蛋白的质量比为1/2),在反应过程中加入氢氧化钠溶液,使胶原蛋白溶液的pH值保持在9.0;24 h后,将粗制的改性胶原蛋白在去离子水中透析72 h,冷冻干燥,保存至使用。对改性胶原蛋白进行表征且结果显示:在相同的pH值下,当聚丙烯酸-N-羟基琥珀酰亚胺酯的酯化程度增加时,电动势会降低。根据曲线,原生胶原蛋白的等电点pI值为7.1±0.2,而在增加酯化程度后改性胶原蛋白的pI值明显下降到4.3±0.2,3.8±0.2,3.2±0.1和3.1±0.1,这表明用聚丙烯酸-N-羟基琥珀酰亚胺酯对胶原蛋白进行改性后其水溶性明显改善,其改善水溶性的机制如图7,在中性pH值下,天然胶原蛋白的酸/碱氨基的电离程度几乎相等,因此紧凑组装的胶原蛋白分子不能被水分子分离。聚丙烯酸-N-羟基琥珀酰亚胺酯的酯基与胶原蛋白的胺基之间的反应直接导致了自由胺基的消耗;此外,聚丙烯酸-N-羟基琥珀酰亚胺酯的大量自由羧基被引入到改性胶原蛋白分子中,改性的胶原蛋白分子在中性溶液中可以很容易地被电离的羧基之间的强静电排斥力所分离,从而导致胶原蛋白的理想溶解能力。相反,改性胶原蛋白分子在醋酸溶液中不能被分离,因为在酸性的pH值下羧基很难被电离。"
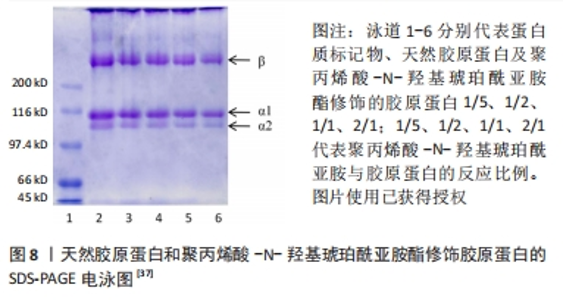
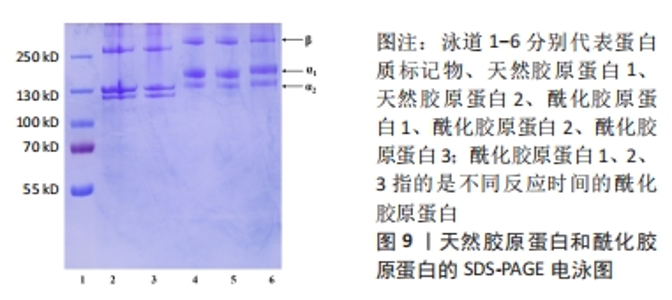
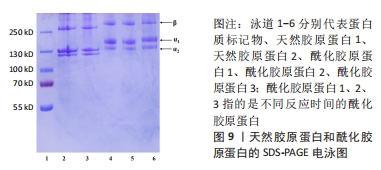
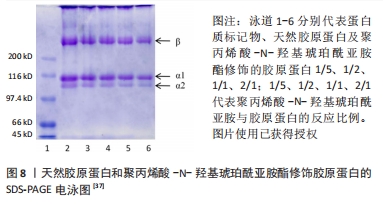
研究人员采用以天然高分子材料如透明质酸为媒介,将透明质酸与N-羟基琥珀酰亚胺\1-乙基-(3-二甲基氨基丙基)碳二亚胺反应进行改性,将改性后的透明质酸与天然胶原反应形成聚阴离子胶原蛋白,具体方案如下[38]:首先将胶原蛋白溶解在稀盐酸溶液(pH=4.0)中,加入氢氧化钠溶液使溶液的pH值为9.0,将透明质酸-N-羟基琥珀酰亚胺酯溶解在无水二甲基亚砜中,将其滴入胶原蛋白溶液中,以达到透明质酸-N-羟基琥珀酰亚胺/胶原蛋白的质量比为1/5;在反应过程中逐渐加入氢氧化钠溶液使胶原蛋白溶液的pH值维持在9.0,混合溶液搅拌24 h,然后用去离子水透析72 h,最后将改性胶原蛋白冻干并储存起来直到使用。 2.1.5 小结 酰化胶原蛋白作为改性胶原蛋白的一种,其制备方法主要是通过酰化反应来实现,而主要的反应物仍是以琥珀酸酐为主,近年来虽然有降冰片烯二酸酐等新的酸酐作为反应物,但是研究甚少。与琥珀酸酐对比,降冰片烯二酸酐可以与光引发剂反应生成水凝胶,而琥珀酸酐缺乏此功能,同时降冰片烯二酸酐低取代效果与琥珀酸酐高取代效果相当,改性之后的酰化胶原蛋白在中性溶液中的溶解度显著上升。总的来说,降冰片烯二酸酐可作为下一阶段性研究酰化胶原蛋白的主要反应物。而双官能团改性剂虽然也能使胶原蛋白的水溶性与热稳定性增强,但双官能团改性剂制备条件过于繁杂,并且引入材料过多,不可避免地使胶原蛋白掺杂过多基团。此外,对于酰化胶原蛋白的制备优化大多数针对于改性剂的选择与开发,而反应环境较统一。 2.2 酰化胶原蛋白表征及应用 2.2.1 2,4,6-三硝基苯磺酸比色法(TNBS比色法) 琥珀酸酐及双官能团改性剂的反应位点一般都是胶原蛋白分子中赖氨酸的N端-氨基及ε-氨基,根据pH值的不同,反应的位点也会随之变化。研究表明,在pH=8.0以上胶原蛋白赖氨酸残基的ε-氨基组是首选的酰化位点,而在pH=6.5时胶原蛋白N端α-氨基组是有效的酰化位点。2,4,6-三硝基苯磺酸被用作确定肽、蛋白质和食品中的一级氨基[39]。2,4,6-三硝基苯磺酸会与蛋白质中赖氨酸的N端-氨基及ε-氨基发生亲核取代反应,反应产物会在光谱上有2个吸收值相近的高峰,分别位于355 nm和420 nm附近。然而一旦溶液酸化,中间络合物转化成三硝基苯-氨基酸,420 nm处的吸收值显著下降,而350 nm附近的吸收峰则移至340 nm处。利用2,4,6-三硝基苯磺酸与氨基酸反应的这一特性,可在420 nm处(偏碱性溶液)或在340 nm(偏酸性溶液)对氨基酸进行定量测定。 有研究表明,胶原蛋白赖氨酸的功能化程度可用2,4,6-三硝基苯磺酸比色法来测定。TRONCI等[40]研究光活性胶原蛋白系统中,使用2,4,6-三硝基苯磺酸比色法、氢核磁共振及表面衰减全反射红外光谱证实了胶原蛋白赖氨酸的共价和可调整的功能化。2,4,6-三硝基苯磺酸比色法主要是以评估自由的、未反应的ε-氨基摩尔含量,从而量化胶原蛋白的功能化程度。ZHANG等[41]研究了丙烯酸接枝-胶原蛋白接枝密度对胶原蛋白自组装的影响,不同接枝密度也是通过2,4,6-三硝基苯磺酸比色法测量得出,研究结果表明侧链丙烯化对胶原蛋白的自组装影响很大。WANG等[28]研究发现,琥珀酰化胶原蛋白的接枝密度过高会提高其亲水性,但会削弱其自组装性。尽管琥珀酰化后胶原蛋白的三螺旋可以被保留,但修饰后的酰化胶原蛋白热稳定性略有下降。可以看出,2,4,6-三硝基苯磺酸比色法已被广泛用于测定胶原蛋白改性的接枝密度。 此外,作者所在课题组采用邻苯二甲醛方法去测定修饰后胶原蛋白的接枝率,该方法相对于2,4,6-三硝基苯磺酸比色法存在着一定优势:2,4,6-三硝基苯磺酸比色法所用试剂的稳定性差、有毒性且易爆炸,所以试剂在保存及配制过程中应避光,相比之下邻苯二甲醛法的显色剂稳定性好,避免了这方面的问题,并且反应迅速,测定结果相对稳定。 2.2.2 茚三酮显色法 茚三酮显色法虽然与2,4,6-三硝基苯磺酸比色法原理上都是与氨基酸反应,但茚三酮与2,4,6-三硝基苯磺酸的反应位点截然不同。茚三酮只与蛋白质中的游离N端-氨基反应,且茚三酮溶液需要与氨基酸共热,生成氨,氨与茚三酮和还原性茚三酮反应生成紫色化合物,颜色的深浅与氨基酸的含量呈正比,可通过测定570 nm处的吸光度测定氨基酸的含量[42]。因此,茚三酮显色法不能用于特殊氨基酸的表征。根据学者研究茚三酮显色法测定游离氨基含量的结果大致为2,4,6-三硝基苯磺酸比色法的50%[43],而这一结果与茚三酮不能与ε-氨基发生定量反应有一定关系,同时也说明了2,4,6-三硝基苯磺酸比色法的测定结果更能接近游离氨基的实际浓度,所以多数学者表征酰化胶原蛋白选择的方法为2,4,6-三硝基苯磺酸比色法而不是茚三酮显色法,并且茚三酮显色反应需要加热煮沸,而加热也会导致胶原蛋白的结构遭到破坏,对实验结果存在一定的影响。 2.2.3 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE) SDS-PAGE是一种根据分子质量分离蛋白质的技术,通常被用来识别蛋白质模式和确定胶原蛋白肽的分子质量分布。通过使用这一手段,可以根据蛋白质的分子质量大小将其和其他片段相互分离。在电泳中,分子质量越小的多肽移动得越快,分子质量越大的多肽移动得越慢,主要是由于两者在凝胶中所遇到的阻力不同。一般来说,不同类型的胶原蛋白,例如Ⅰ型的胶原蛋白是由2条α1链和1条α2链(约100 kD)组成(不同物种提取出来的胶原蛋白会有所差异)。 研究表明,改性后胶原蛋白的分子质量条带相较于改性前天然胶原蛋白的分子质量次条带会发生迁移或者条带颜色较弱,这可能是由于改性胶原蛋白的分子质量增加,阻碍了胶原蛋白分子通过聚丙烯酰胺凝胶微孔时的渗透作用,导致改性后胶原蛋白的条带会有所迁移以及条带颜色会变浅。而且凝胶上没有观察到分子质量较低的降解产物条带,说明胶原蛋白改性后仍保留有2条α1链和1条α2链,但仍需结合圆二色谱等其他结果证明胶原蛋白的三螺旋结构在改性后保持完整。由图8得知,酰化胶原蛋白与天然胶原蛋白相比分子质量有所增加。因而SDS-PAGE是改性后胶原蛋白的重要表征手段,尤其是涉及到胶原蛋白分子质量会随着改性而改变的情况,更加适宜用SDS-PAGE进行表征。此外,作者所在课题组对琥珀酸酐修饰的酰化胶原蛋白进行SDS-PAGE,结果如图9所示,相较于修饰前天然胶原蛋白的分子质量条带向上迁移,推测是修饰后导致胶原蛋白的分子质量增加。"

2.2.4 傅里叶变换红外光谱检测 红外光谱表征是物质定型的重要方法之一。红外光谱图能够提供许多关于官能团的信息,可以帮助确定部分乃至全部分子类型及结构。红外光谱可用于评估和识别胶原蛋白的结构完整性和化学成分,也被用来识别其类型。此外,多数学者为克服胶原蛋白本身所存在的缺陷,如水溶性差、机械性能弱等问题,会选择对胶原蛋白进行改性。对胶原进行改性,学者们不仅希望能够改善其机械性能、水溶性不足等问题,同时也希望能够保留住胶原蛋白的三螺旋结构,即保持胶原蛋白的生物活性。胶原蛋白也会随着来源不同导致傅里叶变换红外光谱检测结果有些许不同,而一般的Ⅰ型胶原蛋白主要有4个功能团的特征峰:C=O拉伸振动,N-H弯曲与C-N伸展相结合,N-H弯曲,N-H拉伸与氢键结合[44-45]。酰化胶原蛋白可以与天然胶原蛋白比较,从而得知胶原蛋白的三螺旋结构是否仍然保留。作者所在课题组将酰化胶原蛋白进行傅里叶变换红外光谱表征并与天然胶原蛋白对比,结果表明酰化胶原蛋白仍保留了5个功能团的特征峰,分别为酰胺A、酰胺B,酰胺Ⅰ、酰胺Ⅱ、酰胺Ⅲ,保留了胶原蛋白的三螺旋结构。而不同来源胶原蛋白的折叠方式不同,产生不同的分子内和分子间氢键相互作用,而氢键的强弱程度影响了吸收峰的波数位置。酰胺Ⅰ、酰胺Ⅱ、酰胺Ⅲ与肽链骨架结构密切相关,指示着胶原蛋白三螺旋结构状况。 2.2.5 等电点(pI)测定 等电点是蛋白质的一个重要参数,它与蛋白质含有的酸性氨基和碱性氨基残基比例有关。众所周知,当溶液的pH值处于pI时,蛋白质通常具有最差的溶解度[46]。同理,胶原蛋白属于两性蛋白质,也遵循这种原则。经文献报道,天然胶原蛋白的等电点一般在6.0-7.0 [47],位于中性区域,这也表明了天然胶原蛋白在中性溶液如中性PBS、纯化水等液体中难以溶解,这一特性限制了胶原蛋白在生物医学上的应用。改性后胶原蛋白的等电点与改性前天然胶原蛋白的等电点相比有所下降。酰化胶原蛋白的等电点一般在4.0,这也从侧面证明用琥珀酸酐或双官能团改性剂对胶原蛋白进行改性后,其水溶性显著提高。酰化胶原蛋白改善水溶性的机制为:琥珀酸酐或双官能团改性剂引入大量自由羧基到酰化胶原蛋白分子中,当处于中性溶液时,酰化胶原蛋白分子可以很容易地被电离的羧基之间的强静电排斥力所分离,从而导致胶原蛋白在中性溶液的理想溶解能力,同时也导致了其难以溶解在酸性溶液中,因为处于酸性溶液中时羧基很难被电离出来。如图10显示,酰化胶原蛋白在中性溶液中的溶解能力好,在酸性溶液中的溶解能力差,天然胶原蛋白反之。"


2.2.6 圆二色谱检测 圆二色谱是一种特殊的吸收谱,它通过测量蛋白质等生物大分子的圆二色光谱,从而得到生物大分子的二级结构相关信息,简单、快捷,被广泛应用于蛋白质折叠及构象研究、酶动力学等领域。有研究表明,胶原蛋白的圆二色性主要来源于胶原自身的活性生色基团和多肽的折叠,圆二色谱是研究胶原蛋白的热稳定性及三螺旋结构完整性方面的一个重要手段。 胶原蛋白是具有旋光性的蛋白质,在圆二色谱图像中胶原具有固定的特征峰位置,在220 nm附近会出现一个较为平缓的正峰,该峰为胶原蛋白三螺旋结构的一个特征峰。因此,圆二色谱是一种验证胶原蛋白是否变性的有效检测手段。研究人员可借助这种检测手段来表征酰化胶原蛋白分子是否还具有完整的三螺旋结构。天然胶原蛋白圆二色谱谱图在220 nm处出现一个正峰,在190 nm处出现一个负峰;酰化胶原蛋白也在220 nm处出现一个正峰,在190 nm处出现一个负峰,这也证明了酰化胶原蛋白仍保留着三螺旋结构,即保留胶原蛋白的生物活性。酰化程度不同,圆二色谱谱峰可能出现一定的偏差,酰化程度过高峰面会降低,会相对破坏胶原蛋白的一些三螺旋结构。 2.3 酰化胶原蛋白应用 2.3.1 酰化胶原蛋白在眼部疾病的应用 酰化胶原蛋白作为一种改性胶原蛋白,由于缺乏对其系统性的表征及性能评估,导致其应用研究相比天然胶原蛋白少。HADASSAH等[48]尝试了将琥珀酰化胶原蛋白绷带镜代替目前用于治疗各种角膜疾病的其他绷带镜,用于各种眼部疾病如丝状角膜炎、干眼症、复发性角膜糜烂、异物取出和上皮创伤。该研究结果表明,琥珀酰化胶原蛋白绷带镜在人眼中具有完全的角膜贴合性和良好的舒适性;透明度可保持较长时间,同时患者视力尚可,泪液水平也有所改善。目前用于治疗各种角膜疾病的其他绷带镜片的缺点可以通过琥珀酰化胶原蛋白绷带镜镜片来克服。同时,HADASSAH等[49]还研究了用琥珀酰化胶原蛋白点滴塞治疗干眼症的临床评估,结果表明所有患者在使用琥珀酰化胶原蛋白点滴塞闭塞小孔后症状都得到了一定程度的缓解,在治疗干眼症的过程中琥珀酰化胶原蛋白点滴塞是一种很有前途的替代方法,可以替代其他的点状塞子。RYU等[50]评价局部应用琥珀酰化胶原蛋白治疗眶周皱纹的效果,并与腺苷治疗结果相比较,对眶周皱纹硅胶铸型的分析显示,琥珀酰化胶原蛋白对眶周皱纹有部分作用。琥珀酰化胶原蛋白可能是一种有效治疗上侧皱纹的选择,需要进一步研究,包括更长的治疗时间和更大的受试者群体来验证这些结果。 2.3.2 酰化胶原蛋白作为生物材料的应用 酰化胶原蛋白不仅在眼部疾病有应用潜力,其良好水溶性拓宽了胶原蛋白作为生物材料的应用。SRIPRIYA等[51]研究了一种用于控制药物释放的改良型胶原蛋白双层敷料,敷料由琥珀酰化胶原蛋白制备,敷料中含有抗生素环丙沙星,而敷料作为一个阴离子储库来容纳阳离子环丙沙星,药物停留在双层系统中,当接触到伤口时开始释放,达到缓释作用;体内研究结果证实了该敷料在控制大鼠感染方面的效率。NOISHIKI等[52]研究用琥珀酰化胶原蛋白水凝胶作为密封胶包裹着血管假体,结果表明超过95%的涂层胶原蛋白可被吸收,大量成纤维细胞迁移至移植物壁内,毛细血管浸润移植物壁内,无异体反应,说明琥珀酰化胶原蛋白可快速内皮化。重庆凝骄生物科技有限公司开发一种仿生基质水凝胶面膜以及一种生物仿生基质的3D打印墨水,这两种发明的原料都包括琥珀酰化胶原蛋白,研究结果证明该复合水凝胶材料具有良好的力学强度,并且软骨重建功能细胞在复合水凝胶内分散性良好,有望成为生物仿生基质的良好材料。PAMFIL等[53]在过硫酸铵和四甲基乙二胺的存在下,通过自由基聚合/交联取代的酸酐改性胶原蛋白与甲基丙烯酸2-羟乙酯获得了半互穿网络水凝胶,该水凝胶的热稳定性佳,且与水的结合能力也增加,水状态分析证明该材料具有很强的亲水特性,可能被用作生物材料。研究表明,酰化胶原蛋白既可以作为水凝胶包裹血管假体,也可作为敷料防止伤口表面干燥,说明酰化胶原蛋白作为生物材料的应用潜力巨大。此外,作者所在课题组针对酰化胶原和胶原蛋白进行一系列的对比表征,表征结果显示:酰化胶原改性之后仍保留胶原蛋白独特的三螺旋结构和大部分生物活性;酰化胶原蛋白与天然胶原蛋白均具有促进细胞增殖的能力,并且在细胞划痕实验中发现酰化胶原蛋白相较于天然胶原蛋白促进细胞迁移的能力更强。酰化胶原蛋白有作为细胞培养营养物质的潜力。作者所在课题组探索酰化胶原蛋白对伤口愈合的治疗效果,与天然胶原蛋白对比,酰化胶原蛋白良好的水溶性导致伤口吸收更快、伤口愈合也相对加快。 2.3.3 酰化胶原蛋白在化妆品领域的应用 酰化胶原蛋白在化妆品领域也展现出了极大的应用潜力。琥珀酰缺端胶原蛋白也是酰化胶原蛋白的一种,它作为一种化妆品原料并已获得中国食品药品监督管理局(CFDA)证书。琥珀酰缺端胶原蛋白一般是作为表面活性剂可降低水油界面张力,具有润湿、增溶、起泡等作用,可用于保湿产品。上海益好纳米科技有限公司开发的一种新型固体护肤品以及免洗全吸收型纳米纤维功能面膜里面的原料都包含着琥珀酰缺端胶原蛋白,同时也有许多化妆品成分里包含了琥珀酰缺端胶原蛋白,如Cossen公司的部分化妆品以酰化胶原蛋白作为原料,东莞胶原生物科技有限公司也有酰化胶原蛋白的相关产品。虽然已经取得了一些商业上的成功,但仍有许多化妆品公司正在开发酰化胶原蛋白的更多用途,因此将会在将来看到更多的酰化胶原蛋白产品。"

| [1] SORUSHANOVA A, SKOUFOS I, TZORA A, et al. The influence of animal species, gender and tissue on the structural, biophysical, biochemical and biological properties of collagen sponges. J Mater Sci Mater Med. 2021; 32(1):12. [2] RIZK MA, MOSTAFA NY. Extraction and Characterization of Collagen from Buffalo Skin for Biomedical Applications. Orient J Chem. 2016;32(3):1601-1609. [3] WANG J, PEI X, LIU H, et al. Extraction and characterization of acid-soluble and pepsin-soluble collagen from skin of loach (Misgurnus anguillicaudatus). Int J Biol Macromol. 2018;106:544-550. [4] LIU Z, OLIVEIRA ACM, SU Y. Purification and characterization of pepsin-solubilized collagen from skin and connective tissue of giant red sea cucumber (Parastichopus californicus). J Agric Food Chem. 2010;58(2): 1270-1274. [5] YAN M, QIN S, LI B. Purification and Structural Aspects of Type I Collagen from Walleye Pollock (Theragra chalcogramma) Skin. J Aquat. 2017;26(10): 1166-1174. [6] RITTIÉ L. Type I Collagen Purification from Rat Tail Tendons. Methods Mol Biol. 2017;1627:287-308. [7] RICARD-BLUM S. The collagen family. Cold Spring Harb Perspect Biol. 2011; 3(1):a004978. [8] ZHAO C, XIAO Y, LING S, et al. Structure of Collagen. Methods Mol Biol. 2021;2347:17-25. [9] LIU D, NIKOO M, BORAN G, et al. Collagen and gelatin. Annu Rev Food Sci Technol. 2015;6:527-557. [10] MANON-JENSEN T, KJELD NG, KARSDAL MA. Collagen-mediated hemostasis. J Thromb Haemost. 2016;14(3):438-448. [11] WONG HL, WANG MX, CHEUNG PT, et al. A 3D collagen microsphere culture system for GDNF-secreting HEK293 cells with enhanced protein productivity. Biomaterials. 2007;28(35):5369-5380. [12] THUANTHONG M, SIRINUPONG N, YOURAVONG W. Triple helical structure of acid-soluble collagen derived from Nile tilapia skin as affected by extraction temperature. J Sci Food Agric. 2016;96(11):3795-3800. [13] FUJII KK, TAGA Y, TAKAGI YK, et al. The Thermal Stability of the Collagen Triple Helix Is Tuned According to the Environmental Temperature. Int J Mol Sci. 2022;23(4):2040. [14] YUAN M, LEONG KW, CHAN BP. Three-dimensional culture of rabbit nucleus pulposus cells in collagen microspheres. Spine J. 2011;11(10):947-960. [15] KOZLOWSKA J, STACHOWIAK N, PRUS W. Stability studies of collagen-based microspheres with Calendula officinalis flower extract. Polym Degrad Stabil. 2019;163:214-219. [16] 徐娜,邢燕梅,王学川.乙烯基胶原蛋白微球的制备及其应用[J].功能材料,2021,52(4):4214-4220. [17] VARDAR E, LARSSON HM, ALLAZETTA S, et al. Microfluidic production of bioactive fibrin micro-beads embedded in crosslinked collagen used as an injectable bulking agent for urinary incontinence treatment. Acta Biomater. 2018;67:156-166. [18] LIU T, DAN N, DAN W, The effect of crosslinking agent on sustained release of bFGF–collagen microspheres. RSC Adv. 2015;5(44):34511-34516. [19] MATSUHASHI A, NAM K, KIMURA T, et al. Fabrication of fibrillized collagen microspheres with the microstructure resembling an extracellular matrix. Soft Matter. 2015; 11(14): 2844-2851. [20] LAMPARELLI EP, CASAGRANDA V, PRESSATO D, et al. Synthesis and Characterization of a Novel Composite Scaffold Based on Hyaluronic Acid and Equine Type I Collagen. Pharmaceutics. 2022;14(9):1752. [21] TARAVEL MN, DOMARD A. Collagen and its interaction with chitosan: II. Influence of the physicochemical characteristics of collagen. Biomaterials. 1995;16:665-671. [22] ZHENG T, TANG P, SHEN L, et al. Rheological behavior of collagen/chitosan blended solutions. J Appl Polym Sci. 2021;138(34):e50840. [23] GAO D, LI X, CHENG Y, et al. The modification of collagen with biosustainable POSS graft oxidized sodium alginate composite. Int J Biol Macromol. 2022; 200:557-565. [24] JIAO T, LIAN Q, LIAN W, et al. Properties of Collagen/Sodium Alginate Hydrogels for Bioprinting of Skin Models. J Bionic Eng. 2023;20:105-118. [25] HONG YJ, CHUN JS, LEE WK. Association of collagen with calcium phosphate promoted osteogenic responses of osteoblast-like MG63 cells. Colloids Surf B Biointerfaces. 2011;83(2):245-253. [26] 徐洲,刘洁,陈意,等.丁二酰化对胶原生物活性结构的影响[J].食品科学,2016,37(1):12-16. [27] KIM SH, LEE JH, YUN SY, et al. Reaction monitoring of succinylation of collagen with matrix-assisted laser desorption/ionization mass spectrometry. Rapid Commun Mass Spectrom. 2000;14(22):2125-2128. [28] WANG W, SHU F, PAN L, et al. Impact of Grafting Density on the Self-Assembly and Hydrophilicity of Succinylated Collagen. Macromol Res. 2020; 28:636-643. [29] 张军涛,汪海波,未本美,等.一种天然胶原的N端精准接枝改性方法[P].中国:202111352994.2023-05-26. [30] ZHANG J, SUI P, YANG W, et al. Site-specific modification of N-terminal alpha-amino groups of succinylated collagen. Int J Biol Macromol. 2023; 225:310-317. [31] PAMFIL D, NISTOR M, ZEMLJIČ, L, et al. Preparation and Characterization of Methyl Substituted Maleic Anhydride: Modified Collagens Destined for Medical Applications. Ind Eng Chem Res. 2014;53:3865-3879. [32] LI C, TIAN Z, LIU W, et al. Structural properties of pepsin-solubilized collagen acylated by lauroyl chloride along with succinic anhydride. Mater Sci Eng C Mater Biol Appl. 2015;55:327-334. [33] LI C, TIAN H, DUAN L, et al. Characterization of acylated pepsin-solubilized collagen with better surface activity. Int J Biol Macromol. 2013;57:92-98. [34] GUO K, WANG H, LI S, et al. Collagen-Based Thiol-Norbornene Photoclick Bio-Ink with Excellent Bioactivity and Printability. ACS Appl Mater Interfaces. 2021;13(6):7037-7050. [35] ZHANG M, YANG J, DING C, et al. A novel strategy to fabricate water-soluble collagen using poly(γ-glutamic-acid)-derivatives as dual-functional modifier. React Funct Polym. 2018;122:131-139. [36] DING C, YANG J, LAN F, et al. Insight into the rheological behaviors of a polyanionic collagen fabricated with poly(gamma-glutamic acid)-NHS ester. Biotechnol Appl Biochem. 2019;66(4):564-573. [37] YANG J, DING C, TANG L, et al. Novel Modification of Collagen: Realizing Desired Water Solubility and Thermostability in a Conflict-Free Way. ACS Omega. 2020;5(11):5772-5780. [38] ZHANG M, YANG J, DENG F, et al. Dual-functionalized hyaluronic acid as a facile modifier to prepare polyanionic collagen. Carbohydr Polym. 2019; 215:358-365. [39] BUBNIS WA, OFNER CM 3RD. The Determination of ε-Amino Groups in Soluble and Poorly Soluble PRoteinaceous Materials by a Spectrophotometric Method Using Trinitrobenzenesulfonic Acid. Anal Biochem. 1992;207(1):129-133. [40] TRONCI G, RUSSELL SJ, WOOD DJ. Photo-active collagen systems with controlled triple helix architecture. J Mater Chem B. 2013;1(30):3705-3715. [41] ZHANG J, TU X, WANG W, et al. Insight into the role of grafting density in the self-assembly of acrylic acid-grafted-collagen. Int J Biol Macromol. 2019; 128:885-892. [42] 李兴武.猪皮胶原蛋白的提取及琥珀酰化改性研究[D].重庆:西南大学,2011. [43] 冯岩,冯志彪,王楠.乳清蛋白水解物游离氨基浓度测定方法比较[J].中国乳品工业,2010,38(5):46-48. [44] STANI C, VACCARI L, MITRI E, et al. FTIR investigation of the secondary structure of type I collagen: New insight into the amide III band. Spectrochim Acta A Mol Biomol Spectrosc. 2020;229:1386-1425. [45] JAFARI H, LISTA A, SIEKAPEN MM, et al. Fish Collagen: Extraction, Characterization, and Applications for Biomaterials Engineering. Polymers (Basel). 2020;12(10):2230. [46] KORLACH J, HAGEDORN R, FUHR G. pH-Regulated electroretention chromatography: Towards a new method for the separation of proteins according to their isoelectric points. Electrophoresis. 1998;19:1135-1139. [47] NALINANON S, BENJAKUL S, KISHIMURA H, et al. Type I collagen from the skin of ornate threadfin bream (Nemipterus hexodon): Characteristics and effect of pepsin hydrolysis. Food Chem. 2011;125(2):500-507. [48] HADASSAH J, PRAKASH D, SEHGAL PK, et al. Clinical Evaluation of Succinylated Collagen Bandage Lenses for Ophthalmic Applications. Ophthalmic Res. 2008;40(5):257-266. [49] HADASSAH J, BHUVANESHWARI N, SINGH D, et al. Preparation and Clinical Evaluation of Succinylated Collagen Punctal Plugs in Dry Eye Syndrome: A Pilot Study. Ophthalmic Res. 2010;43(4):185-192. [50] RYU DJ, JUNG JY, CHUNG YK, et al. The Efficacy and Safety of Succinylated Atelocollagen and Adenosine for the Treatment of Periorbital Wrinkles. J Cosmet Dermatol. 2013;3:234-241. [51] SRIPRIYA R, KUMAR MS, SEHGAL PK. Improved collagen bilayer dressing for the controlled release of drugs. J Biomed Mater Res B Appl Biomater.2004; 70B(2):389-396. [52] NOISHIKI Y, MA XH, YAMANE Y, et al. Succinylated Collagen Crosslinked by Thermal Treatment for Coating Vascular Prostheses. Artif Organs. 1998; 22(8):672-680. [53] PAMFIL D, SCHICK C, VASILE C. New Hydrogels Based on Substituted Anhydride Modified Collagen and 2-Hydroxyethyl Methacrylate. Synthesis and Characterization. Ind Eng Chem Res. 2014;53(28):11239-11248. |
| [1] | Yu Weijie, Liu Aifeng, Chen Jixin, Guo Tianci, Jia Yizhen, Feng Huichuan, Yang Jialin. Advantages and application strategies of machine learning in diagnosis and treatment of lumbar disc herniation [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1426-1435. |
| [2] | Lin Zeyu, Xu Lin. Research progress in gout-induced bone destruction mechanism [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1295-1300. |
| [3] | Shen Jiangyong, He Xi, Tang Yuting, Wang Jianjun, Liu Jinyi, Chen Yuanyuan, Wang Xinyi, Liu Tong, Sun Haoyuan. RAS-selective lethal small molecule 3 inhibits the fibrosis of pathological scar fibroblasts [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1168-1173. |
| [4] | Ma Shuwei, He Sheng, Han Bing, Zhang Liaoyun. Exosomes derived from mesenchymal stem cells in treatment of animals with acute liver failure: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1137-1142. |
| [5] | Zhang Kefan, Shi Hui. Research status and application prospect of cytokine therapy for osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(6): 961-967. |
| [6] | Xu Rong, Wang Haojie, Geng Mengxiang, Meng Kai, Wang Hui, Zhang Keqin, Zhao Huijing. Research advance in preparation and functional modification of porous polytetrafluoroethylene artificial blood vessels [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 759-765. |
| [7] | Chen Xiaofang, Zheng Guoshuang, Li Maoyuan, Yu Weiting. Preparation and application of injectable sodium alginate hydrogels [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 789-794. |
| [8] | Liu Chuang, Shan Shuo, Yu Tengbo, Zhou Huan, Yang Lei. Advantages, discomfort and challenges of clinical application of orthopedic hemostatic materials [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 795-803. |
| [9] | Wang Wu, Fan Xiaolei, Xie Jie, Hu Yihe, Zeng Min. Hydroxyapatite-polyvinyl alcohol/collagen-chitosan-gelatin composite hydrogel for repairing rabbit osteochondral defect [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 682-689. |
| [10] | Li Jiaqi, Huang Yuanli, Li Yan, Wang Chunren, Han Qianqian. Mechanism and influencing factors in molecular weight degradation of non-cross-linked hyaluronic acid [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 747-752. |
| [11] | Zhang Ming, Wang Bin, Jia Fan, Chen Jie, Tang Wei. Application of brain-computer interface technology based on electroencephalogram in upper limb motor function rehabilitation of stroke patients [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 581-586. |
| [12] | He Yuanjie, Chen Yuheng, Zhao Yongchao, Wang Zhenglong. Progress in epigenetic regulation of vascular smooth muscle cell remodeling in the occurrence and development of aortic aneurysms [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 602-608. |
| [13] | Ma Sicong, Chen Jing, Li Yunqing. Functions and roles of connective tissue growth factor in nervous systems [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 615-620. |
| [14] | Yan Binghan, Li Zhichao, Su Hui, Xue Haipeng, Xu Zhanwang, Tan Guoqing. Mechanisms of traditional Chinese medicine monomers in the treatment of osteoarthritis by targeting autophagy [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 627-632. |
| [15] | Sun Qingfeng, Bai Shuo, Zhang Zhen, Shen Liang, Gao Beiyao, Ge Ruidong. Research progress in the effect of estrogen on tendinopathy [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(32): 5231-5237. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||