Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (23): 3759-3765.doi: 10.12307/2024.384
Previous Articles Next Articles
Mechanisms of exercise-regulated telomere length and health promotion
Qi Yuqing, Liu Xiaoran
- School of Kinesiology and Health, Capital University of Physical Education and Sports, Beijing 100191, China
-
Received:2023-05-25Accepted:2023-07-07Online:2024-08-18Published:2023-09-14 -
Contact:Liu Xiaoran, PhD, Associate professor, School of Kinesiology and Health, Capital University of Physical Education and Sports, Beijing 100191, China -
About author:Qi Yuqing, Master candidate, School of Kinesiology and Health, Capital University of Physical Education and Sports, Beijing 100191, China -
Supported by:Key Basic Research Project of the Basic Strengthening Program of the Military Science Commission, No. 2020-JCJQ-ZD264-3-1 (to LXR)
CLC Number:
Cite this article
Qi Yuqing, Liu Xiaoran. Mechanisms of exercise-regulated telomere length and health promotion[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(23): 3759-3765.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
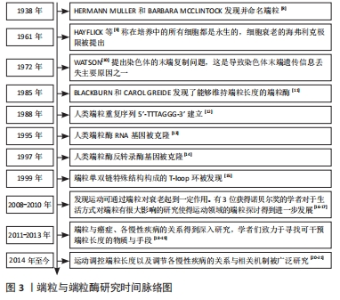
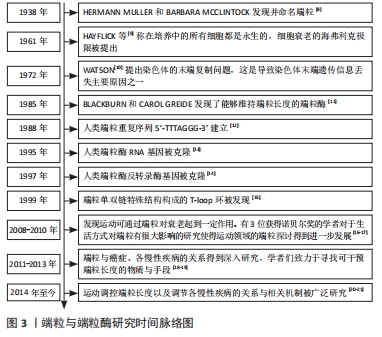
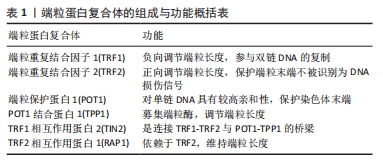
现如今,基于前人的研究基础,进一步促进了文章对端粒在衰老与相关疾病中的研究进展,并且还在不断地探索与实践。 哺乳动物的端粒双链DNA是由TTAGGG重复序列构成,在富含G碱基的一侧链中向外突出形成3’端的单链结构,3’端单链以随意的方式侵入双链DNA间取代G碱基链与C碱基相配对,形成隐藏染色体末端、具有保护作用的T环与D环[22-23]。由于DNA的半保留复制方式与3’端单链的存在,使得染色体的每一次分裂都会丢失掉部分单链端,端粒DNA逐渐缩短,当到达“Hayflick”极限时,细胞分裂周期出现停滞现象、进入衰老与凋亡阶段。 端粒蛋白复合体由6种不同的蛋白组成,见表1。端粒重复结合因子1,2构成同源二聚体结合在端粒DNA的双链上[24],端粒保护蛋白1与其结合蛋白构成异二聚体则是与3’端单链相结合[25]。如此,端粒蛋白复合体将染色体末端部分遮蔽覆盖,解决端粒存在的末端保护问题。同时,端粒蛋白复合体与端粒酶反转录相互作用,能够募集端粒酶引导DNA的从头合成,以调节端粒的长度,解决端粒存在的末端复制问题[26]。"
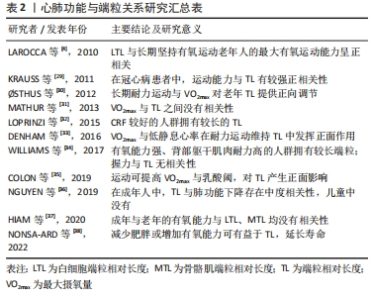
2.2 端粒与身体素质 2.2.1 心肺功能 心肺功能与端粒:心肺功能,又称心肺耐力、有氧运动能力,它是人体进行长时间运动的基础,是在持续运动中为各组织器官提供氧气的能力[27]。因其对身体功能能力以及健康的重要性,已被列为人体的第五大临床生命体征[28]。VO2max被认为是评价心肺耐力的金标准。 目前已有多项研究探讨了心肺耐力与端粒长度之间的关系[4,29-38],但呈现结果并不统一,见表2。KRAUSS等[29]以944例冠心病患者为研究对象,以平板运动试验检测其最大运动能力并用梅托值将受试者分为低、中、高运动能力组,在相关指标结果分析中发现:身体活跃与运动能力较强的受试者拥有较长的端粒长度;并且在调整运动能力之后,端粒长度与冠心病患者的死亡率仍有较高相关性。这表明可以通过提高人体的有氧能力来延缓端粒磨损、降低疾病的死亡率。美国在对成年人的评价中,同样发现VO2max所代表的心肺耐力越高,端粒长度也就越长[32];老年人亦是,其最大有氧能力和端粒长度呈正向相关关系[4]。心肺耐力的强弱会对端粒长度产生一定的影响。但是也有学者得出与之相反的结论。HIAM等[37]检测了较大跨度的年龄段内以VO2max为金标准的有氧能力与白细胞端粒长度、骨骼肌端粒长度的关系,发现白细胞中端粒长度与年龄而不是有氧能力有关;骨骼肌中端粒长度也与有氧能力无关。"
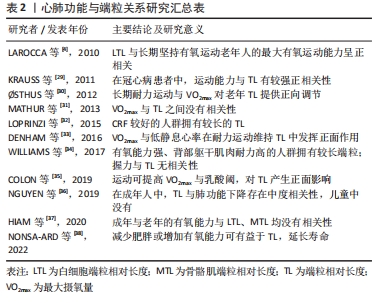
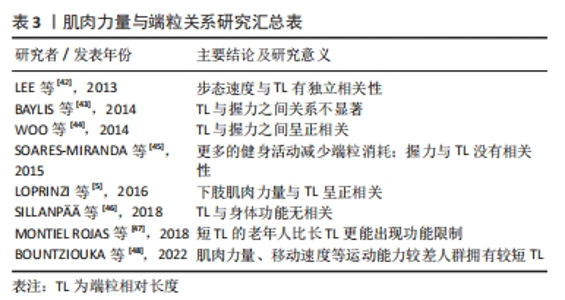
受试人群、有氧能力与端粒长度的测量方法以及其他生活因素的干扰,都可能是造成结果不一致的原因。由表2可以看出,大部分研究显示有氧能力较高的人群拥有较长的端粒长度,因此,较强的有氧能力可以通过对端粒长度的积极作用来降低端粒磨损速率、延缓生物老化、促进人体健康。 端粒与心肺功能的可训性:能够影响端粒长度的因素有很多,而运动作为一种低经济高效益的干预措施,与端粒之间有着正相关、倒U型、无相关3种关系[39]。相比于其他形式的运动,有氧耐力运动是延缓端粒磨损最有效的运动方式[40-41]。且长期进行有氧耐力训练,有益于人体最大有氧运动能力的提高。 有研究发现,无论是年轻人还是老年人,长期进行有氧耐力训练的运动员其VO2max要远高于进行中等强度娱乐活动的非运动员;且骨骼肌中端粒磨损速率随着有氧耐力训练后心肺功能的增加而降低[30]。COLON等[35]对铁人三项运动员进行VO2max、乳酸阈和端粒长度的检验,如前所述,VO2max、乳酸阈与端粒长度均高于非运动员。心肺耐力通过运动训练提高并对端粒长度产生有益影响。人体的心率会随着长久的运动适应而降低,长期进行耐力训练拥有较低静息心率的运动员,其端粒长度也相对较长[33]。另有研究发现,相对于年轻人来说,最大有氧运动能力的提高更能影响老年的端粒长度变化[4]。文章认为是由于端粒随年龄的增加而磨损,老年人的端粒长度与有氧能力均低于成年人,通过运动训练所获得的收益要更大。 因此,运动训练可以通过提高心肺功能来维持端粒长度。身体衰老包含着有氧能力的下降,有氧能力与端粒长度之间的显著关联再次表明了端粒长度可作为生物年龄、生理老化的有力指标。最大有氧能力的可训性为运动延缓端粒、改善衰老过程中的健康状况提供了更有信服力的科学依据。 2.2.2 肌肉力量 肌肉力量与端粒:至今已有多项研究探讨了肌肉力量与端粒长度之间的关系,见表3[5,42-48]。衰老伴随着肌肉力量的逐渐下降,在整个老化过程中,肌肉的横截面积出现大量流失,成为导致肌肉力量障碍产生的直接因素[49]。手部握力通常是评价身体肌肉力量变化的一个常用指标。有研究发现,在社区老年女性中,握力与端粒长度呈显著正相关[44]。在欧洲5个国家的部分老年男性和女性的研究也显示较短端粒长度的老年人要比端粒较长的老年人拥有更严重的握力等身体功能限制[47]。肌肉质量与力量的下降可能会导致行走速度减慢、体力活动减少,引发虚弱衰退综合征。与非虚弱者相比,虚弱者的握力、下肢力量较差且拥有更短的端粒长度[48]。LOPRINZI等[5]的研究得出了在成年人中下肢肌肉力量同样会对端粒长度产生影响的结论,这说明肌肉力量的强弱与端粒长度的维持存在相关性。但也有研究表明,长期激素代替治疗不一致的老年双胞胎人群中,以握力、膝关节伸展强度为主的身体功能与端粒长度之间并无显著关联[46]。文章推测可能是由于激素的补充治疗对结果产生了一定的影响。"
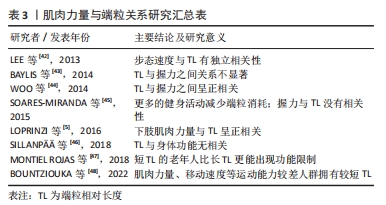
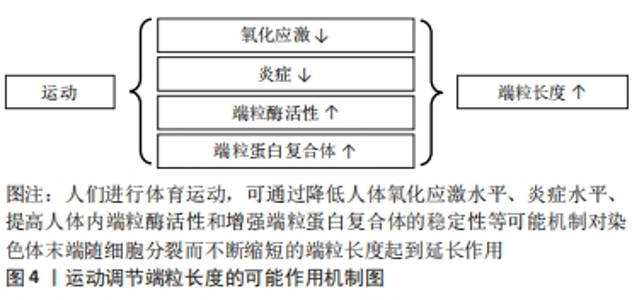
由于相关指标测量方式以及受试者自身状况的影响,使得端粒磨损与肌肉力量之间产生了不同的作用效果,但总体而言,年龄增加引起的老年人肌肉能力下降,与端粒磨损有关。加强肌肉力量可延缓端粒引起的生理老化、促进人体健康。 端粒与肌肉力量的可训性:随着年龄的增长,老年人骨骼肌中线粒体、端粒等形态与抗氧化能力、自噬能力和卫星细胞活力等功能下降[50]。身体活动水平较低是促进肌肉衰老的关键因素之一。延缓骨骼肌老化的两种最佳运动方式为抗阻运动与耐力训练[51],可维持衰老肌肉的体积与功能能力。 对骨骼肌有着保护作用的卫星细胞随年龄的增长而减少,其复制能力与骨骼肌端粒长度呈正向相关[52]。运动训练可刺激卫星细胞的增多,对骨骼肌质量与端粒长度的维持起着积极作用。肌少症以肌肉力量下降为特征。运动训练对肌少症患者的肌肉力量、肌肉耐力以及活动能力起着促进作用[53]。有研究发现,肌少症患者由端粒转录而成、具有保护作用的非编码端粒RNA表达水平要显著高于健康人群,在12周运动和饮食干预后,肌少症人群中非编码端粒RNA的表达水平升高到与健康组相似水平上[54],但遗憾的是作者并未对握力等肌肉力量进行后续检测。 总之,衰老过程包含着骨骼肌能力的下降,肌肉力量与端粒之间的正相关关系再次表明了端粒可作为生物年龄、生理老化的有力指标。肌肉力量的可训性为运动延缓端粒提供了更有信服力的科学依据。 综上所述提示心肺功能、肌肉力量与端粒长度之间存在相互作用关系,体育运动可通过提高人体的身体素质水平来抵消随年龄增长而发生的端粒磨损,延缓生物老化。 2.3 运动调控端粒的可能调节机制 运动与端粒长度之间存在正相关、倒U型、无相关3种作用关系,大多数的研究认为适度的体育运动可延缓端粒随细胞分裂而发生的磨损。目前关于运动调控端粒长度有降低氧化应激与炎症水平、提高端粒酶活性、增强端粒蛋白复合体稳定性等可能作用机制,见图4。"
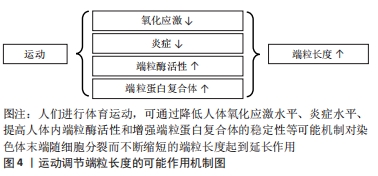
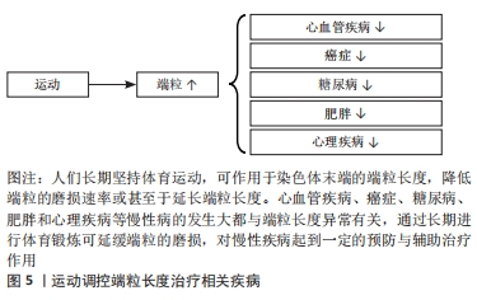
2.3.1 氧化应激 一般来讲,活性氧在体内参与调节多种信号通路、维持人体稳态,但当活性氧过度累积时就会引起氧化应激导致线粒体损伤与衰老[55]。端粒双链DNA富含对氧化应激极其敏感的鸟嘌呤三联体结构,由此成为DNA损伤的有利攻击目标[56]。高血压患者体内氧化应激水平升高,加速端粒长度的缩短[57]。较高水平的氧化应激可危害端粒酶反转录酶的表达,降低端粒酶活性,不利于端粒长度的维持[58]。所以氧化应激与端粒长度存在负向相关,降低体内氧化应激水平对于端粒的保护至关重要。研究表明,长期有氧运动可增强人体抗氧化能力,维持细胞氧化还原系统平衡,降低端粒磨损速率[59-61]。总的来说,长期进行体育运动是增强人体抗氧化能力、减少与端粒磨损有关的生化原因的有效手段。 2.3.2 炎症 慢性全身性炎症增加外周血白细胞的更新速度,致使端粒磨损速率加快[62],同时炎症也会引起体内的氧化应激,从而导致一系列与端粒磨损有关的疾病发生。在慢性阻塞性肺疾病中,患者促炎因子白细胞介素6的表达水平与端粒长度呈显著负向关系[63],因此,降低体内炎症的表达是维持端粒长度的途径之一。而运动已被证实可下调促炎因子的表达[64],维持人体稳态。总的来说,降低炎症标志物水平是运动训练延缓端粒磨损的可能调节机制之一。 2.3.3 端粒酶活性 端粒酶主要由端粒酶RNA和端粒酶反转录酶两个亚基组成,通过反转录合成端粒DNA,是端粒长度维持的重要途径之一。在正常人体细胞中,端粒酶一直维持着低活性状态,致使端粒长度随细胞分裂缩短而无法弥补。因此,端粒酶活性的提高对延长端粒长度至关重要。单次运动与长期训练对端粒酶活性的增加均有积极作用。在急性运动中,老年人和青年进行一次性高强度运动后的不同时间点端粒酶反转录酶活性均出现上调,且年轻人端粒酶活性的增加要高于老年人[65],推测是由于老年人细胞发生复制性衰老导致的。在长期运动中,8周有氧运动可上调小鼠心肌端粒酶反转录酶mRNA与端粒酶活性的表达,促进细胞增殖[66]。所以,运动作为一种非药物治疗手段可能通过调控端粒酶活性达到维持端粒长度的目的。 2.3.4 端粒保护蛋白 端粒蛋白复合体依附于染色体末端保护端粒的结构和功能完整,同时端粒酶对端粒的延长作用需要依靠端粒蛋白复合体对端粒酶的募集。因此,端粒保护蛋白对于端粒长度的维持是不可或缺的一个环节。运动训练对端粒保护蛋白具有调节作用。对于适度强度运动,小鼠运动3周后端粒重复结合因子1与端粒酶反转录酶的蛋白表达均出现上调、同时运动也使端粒重复结合因子2的mRNA表达增加[67]。对于7天7次马拉松的大强度极限运动后,运动员白细胞中端粒重复结合因子1与2的mRNA水平亦出现上调[68]。总的来说,上调端粒相关保护蛋白的表达是运动维持端粒长度稳定的可能调节机制之一。 2.4 端粒相关疾病与运动调控 染色体末端的端粒可防止DNA损伤与基因组降解。端粒过长或过短可导致心脏代谢性疾病、癌症等疾病发病风险的增加。端粒磨损程度是生物年龄预测的重要指标之一,体育运动可延缓端粒磨损速率、维持端粒长度,降低多种与端粒相关疾病的发病风险,见图5,对于个体健康与幸福生活有着重要意义。"
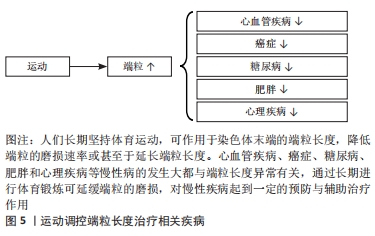

2.4.1 心血管疾病 衰老过程中发生的如端粒磨损等生物老化,被认为是心血管疾病的风险因素之一。高血压作为中国较为常见的慢性心血管疾病之一,其舒张压、收缩压均与端粒长度呈负向相关[69]。高血压患者白细胞端粒长度要短于正常人群,且端粒越短,个体患高血压风险就越高[70]。此外,早发冠心病患者的外周血白细胞端粒长度相比于非冠心病患者明显缩短[71]。因受环境因素影响,采用孟德尔随机化等位基因检测发现,由基因决定的短端粒同样与冠心病风险增加相关[72]。由此,较短的端粒长度会增加心血管疾病的患病风险。 心血管疾病的发生因素多种多样。端粒酶反转录酶活性的降低加速血管老化、导致血管功能障碍[73];端粒保护蛋白的过表达与促炎因子的升高反向调控端粒长度引起动脉粥样硬化[74-75]。这些不利因素均能促进心血管疾病的发生与发展。同时,这也是加速端粒长度缩短的不利因素,说明影响端粒长度的可能因素亦在一定程度上加速心血管疾病的发生。 基于端粒长度与心血管疾病的相关关系,确定一种安全有效的方式来延缓端粒长度的缩短是非常重要的。体育锻炼的缺乏与大多数心血管疾病的患病风险呈正相关,且部分心血管疾病患者允许根据实际身体状况进行一些适当的有氧运动以延缓血管老化[76-77]。如前文所述,体育运动可上调抗氧化酶的表达,抗氧化能力的提高抑制氧化应激与端粒缩短对冠心病起到较好的减轻作用[78]。另有研究表明,体育活动水平较高(> 7 METS)的稳定型冠心病患者拥有较好的身体素质且其端粒相对长度要更长,这显著降低了冠心病患者的死亡率[29]。由此,科学的体育运动可通过维持端粒长度来降低心血管疾病的发生与死亡率,但此过程必须在专业人员指导下进行。 2.4.2 癌症 较短的端粒长度与肺癌、乳腺癌和结直肠癌等癌症之间具有较强的相关性[79-80]。与正常体细胞具有的复制性衰老相反,癌细胞克服了海弗利克极限获得无限增殖。端粒酶的激活与端粒的选择性延长是癌细胞维持端粒长度及获得永生表型的两条途径。部分细胞在端粒的选择性延长修复端粒长度的过程中发生突变导致癌细胞产生。而大部分的肿瘤细胞与较高的端粒酶活性共存,可维持细胞端粒长度一定、使其具有持续分裂的能力[81]。由此,端粒与癌症的发生与发展息息相关。 氧化应激诱导的DNA损伤促进端粒致使癌症进程的发展,内源性抗氧化能力的提高是抵抗肿瘤氧化应激的因素之一[82]。研究发现拥有较短端粒和外部摄入较少抗氧化剂的中年女性患乳腺癌的风险增加[83]。提示,端粒长度与肿瘤细胞的产生密不可分,氧化应激及端粒酶活性等影响端粒长度的因素亦会加速癌症的病变,影响人体健康。 科学适当的体育运动已被证实可以延缓细胞内端粒的磨损、维持端粒长度。在这种情况下,运动对于端粒长度的调控与癌症的预防和治疗至关重要。运动在减轻癌症患者癌因性疼痛、改善骨骼健康等功能障碍表现;作为辅助手段协同临床治疗抑制肿瘤发生进展等方面有着积极作用[84]。定期进行科学体育锻炼可降低乳腺癌患者体内氧化应激水平[85],虽然端粒长度并未发生改变,但其影响因素的减缓为运动通过影响端粒辅助乳腺癌的治疗提供了更多信息。 2.4.3 糖尿病 1型糖尿病是一种胰腺β细胞被破坏而无法分泌胰岛素所导致的疾病。2型糖尿病则是由多种原因导致的胰岛素抵抗和胰岛素分泌不足产生[86]。端粒磨损加速细胞老化进程,糖尿病发病率以及多种并发症随着年龄增长逐年加剧。杨雁等[87]的研究表明体内发生胰岛素抵抗人群与患2型糖尿病人群的白细胞端粒长度均出现明显缩短。另外同样有研究发现缩短的端粒长度与2型糖尿病发病风险存在显著关联且在孟德尔随机化研究中亦发现较长的端粒长度对降低1型糖尿病发病率具有积极作用[88]。因此,较短的端粒长度会加大糖尿病的发病风险,肯定了短端粒与糖尿病之间的相互关系。 由于糖尿病的初发原因是高血糖的产生,较高血糖致使细胞内活性氧浓度升高,高水平的脂质过氧化会加速糖尿病患者端粒长度的缩短[89]。除此之外,前文所述虚弱个体拥有较短的端粒长度,胰岛素抵抗的发生亦与以握力为代表的虚弱综合征有关[90],提示,影响端粒长度的可能因素亦在一定程度上加速糖尿病的发生,危害人体健康。 有研究表明,抗阻运动训练可使全身和骨骼肌的胰岛素敏感性增加从而对人体内血糖浓度产生有益影响,且对减轻拥有较短端粒个体的胰岛素抵抗作用效果更为显著[91]。除抗阻运动外,2型糖尿病患者长期坚持有氧耐力运动表现出更长的端粒长度,且对氧化应激导致DNA损伤有较好的改善作用[92]。由此,体育运动可作为维持端粒长度是控制糖尿病发病风险的有效途径,鼓励糖尿病患者在专业医师的指导下进行有针对性的体育活动,以达到改善健康的目的。 2.4.4 肥胖 肥胖是由于过量的脂肪堆积导致体内的氧化应激与炎症水平升高、端粒缩短的一种异常过程[93],其会加大如肌肉骨骼疾病、心血管疾病等慢性疾病发病概率。研究表明肥胖人群的白细胞端粒长度低于正常体质量人群[94]。高腰围指数与较短的端粒长度呈现显著关联[95]。在生命早期,拥有较短端粒而非较高磨损速率的幼儿,其体脂率、体质量指数与血糖指数较高,加速肥胖与相关并发症在儿童时期的形成,为老年健康状况积累恶性经验[96]。中年时期,随着体质量指数与体质量升高,进一步加速端粒磨损速率,促进人体衰老进程。由此,较短端粒会增加各个年龄段人群的肥胖风险。 由于肥胖的发生与糖尿病息息相关,体内较高血糖浓度使得氧化应激水平升高、促炎因子释放增多[97],致使多种并发症产生。有研究表明,氧化应激水平升高、慢性炎症增加均是促进肌少性肥胖的发病因素[98]。提示,影响端粒长度的作用因素也会在一定程度上促进肥胖的发生,两者共同危害人体健康。 肥胖的发生通常是由于缺乏体育运动所导致。肥胖女性的腰围围度与端粒长度存在负性相关,在8周力量与有氧联合运动训练后腰围与体质量明显下降,其最大摄氧量与端粒长度显著增加[99]。但这种作用效果在长期处于肥胖状态的人群中有所抵消[100]。此外,长期坚持体育运动可通过提高人体心肺耐力与健康,对减少肥胖与端粒磨损起到积极作用[101]。但也有研究在16周运动后得出了端粒长度未发生改变的结论,推测是由于受试者选取了多囊卵巢综合征患者,疾病的影响使得16周的运动还不足以对端粒长度产生改变[102]。由此,长期进行运动训练可减轻肥胖人群细胞中端粒长度的缩短,对人体产生有益影响。 2.4.5 抑郁、焦虑等心理疾病 人们长时间存在的心理问题所引起的心理应激会导致细胞过早过快的衰老,五羟色胺作为情绪与行为的关键调节因子,其短纯合等位基因变异对环境刺激的敏感性增强,加速变异携带者细胞端粒磨损速率[103]。多项研究证实抑郁症、焦虑障碍等心理疾病与端粒长度之间呈负向相关[104-105]。由此,短端粒可导致心理状况较差的人群具有更高的焦虑、抑郁风险。 端粒酶作为延缓端粒磨损的主要途径之一,其活性的上调可改善人们的负性心理状况[106]。当个体长期处于高水平压力下,儿茶酚胺分泌增多从而导致细胞氧化应激,危害人体端粒系统。结果提示,端粒长度与心理状况密不可分,影响端粒长度的因素亦会增加负性心理的产生,不利于身心健康。 良好的心理状况与科学的体育运动已被证实均是影响端粒长度的重要因素。一项动物实验表明自主参加游泳运动的大鼠拥有较高的端粒长度[107]。自主进行运动训练的人群其心理会产生愉悦满足感,反之强迫性地体育锻炼则会加重人们的心理负担。遭受家庭暴力女性的压力与抑郁症状在自愿进行22周八段锦运动干预后显著缓解,且端粒酶活性也表现出上升趋势[108],这也印证了运动调控端粒与心理的积极作用关系。由此,自愿参加体育运动可延缓端粒长度的缩短,对心理健康产生有益的影响。 综上所述,运动对延缓随年龄增长而缩短的端粒长度有着积极作用。端粒异常可导致多种疾病的发生,运动训练可以在维持端粒长度的同时预防与减轻端粒相关疾病的发生,这进一步证实了端粒在运动治疗有关疾病中的可能,氧化应激、炎症、端粒酶活性与端粒蛋白等可能调节机制的发现更为此提供了有力的证据支撑。"

| [1] 许志刚,刘晓蕾,董碧蓉,等.衰老的意义、特征及相关生物标记与评估模式[J].中国临床保健杂志,2022,25(4):472-476. [2] WHITTEMORE K, VERA E, MARTíNEZ-NEVADO E, et al. Telomere shortening rate predicts species life span. Proc Natl Acad Sci U S A. 2019;116(30):15122-15127. [3] LANSDORP PM. Telomeres, aging, and cancer: the big picture. Blood. 2022;139(6): 813-821. [4] LAROCCA TJ, SEALS DR, PIERCE GL. Leukocyte telomere length is preserved with aging in endurance exercise-trained adults and related to maximal aerobic capacity. Mech Ageing Dev. 2010;131(2):165-167. [5] LOPRINZI PD, LOENNEKE JP. Lower extremity muscular strength and leukocyte telomere length: implications of muscular strength in attenuating age-related chronic disease. J Phys Act Health. 2016;13(4):454-457. [6] 黄宏兴,吴青,李跃华,等.肌肉、骨骼与骨质疏松专家共识[J].中国骨质疏松杂志,2016,22(10):1221-1229+1236. [7] 董云峰,邱俊强.运动抗衰老:端粒机制的研究进展[J].中国体育科技,2021, 57(2):49-57. [8] MCCLINTOCK B. The behavior in successive nuclear divisions of a chromosome broken at meiosis. Proc Natl Acad Sci U S A. 1939;25(8):405-416. [9] HAYFLICK L, MOORHEAD PS. The serial cultivation of human diploid cell strains. Exp Cell Res. 1961;25:585-621. [10] WATSON JD. Origin of concatemeric T7 DNA. Nat New Biol. 1972;239(94):197-201. [11] GREIDER CW, BLACKBURN EH. Identification of a specific telomere terminal transferase activity in Tetrahymena extracts. Cell. 1985;43(2 Pt 1):405-413. [12] MOYZIS RK, BUCKINGHAM JM, CRAM LS, et al. A highly conserved repetitive DNA sequence, (TTAGGG)n, present at the telomeres of human chromosomes. Proc Natl Acad Sci U S A. 1988;85(18):6622-6626. [13] FENG J, FUNK WD, WANG SS, et al. The RNA component of human telomerase. Science. 1995;269(5228):1236-1241. [14] NAKAMURA TM, MORIN GB, CHAPMAN KB, et al. Telomerase catalytic subunit homologs from fission yeast and human. Science. 1997;277(5328):955-959. [15] GRIFFITH JD, COMEAU L, ROSENFIELD S, et al. Mammalian telomeres end in a large duplex loop. Cell. 1999;97(4):503-514. [16] CHERKAS LF, HUNKIN JL, KATO BS, et al. The association between physical activity in leisure time and leukocyte telomere length. Arch Intern Med. 2008;168(2): 154-158. [17] PUTERMAN E, LIN J, BLACKBURN E, et al. The power of exercise: buffering the effect of chronic stress on telomere length. PLoS One. 2010;5(5):e10837. [18] 王福龙,王甄真,陈雁.衰老的分子机制与干预研究的最新进展[J].中国细胞生物学学报,2012,34(8):739-748. [19] ZHU H, BELCHER M, VAN DER HARST P. Healthy aging and disease: role for telomere biology? Clin Sci (Lond). 2011;120(10):427-440. [20] VERMA AK, SINGH P, AL-SAEED FA, et al. Unravelling the role of telomere shortening with ageing and their potential association with diabetes, cancer, and related lifestyle factors. Tissue Cell. 2022;79:101925. [21] KUMAR DEV P, GRAY AJ, SCOTT-HAMILTON J, et al. Co-expression analysis identifies networks of miRNAs implicated in biological ageing and modulated by short-term interval training. Mech Ageing Dev. 2021;199:111552. [22] RUIS P, BOULTON SJ. The end protection problem-an unexpected twist in the tail. Genes Dev. 2021;35(1-2):1-21. [23] GIARDINI MA, SEGATTO M, DA SILVA MS, et al. Telomere and telomerase biology. Prog Mol Biol Transl Sci. 2014;125:1-40. [24] CICCONI A, CHANG S. Shelterin and the replisome: at the intersection of telomere repair and replication. Curr Opin Genet Dev. 2020;60:77-84. [25] NANDAKUMAR J, BELL CF, WEIDENFELD I, et al. The TEL patch of telomere protein TPP1 mediates telomerase recruitment and processivity. Nature. 2012; 492(7428):285-289. [26] MYLER LR, KINZIG CG, SASI NK, et al. The evolution of metazoan shelterin. Genes Dev. 2021;35(23-24):1625-1641. [27] 刘若江,张翔,连庆元.心肺适能运动处方运动强度确定方法研究述评[J].体育科技文献通报,2023,35(2):248-252. [28] ROSS R, BLAIR SN, ARENA R, et al. Importance of assessing cardiorespiratory fitness in clinical practice: a case for fitness as a clinical vital sign: a scientific statement from the american heart association. Circulation. 2016;134(24): e653-e699. [29] KRAUSS J, FARZANEH-FAR R, PUTERMAN E, et al. Physical fitness and telomere length in patients with coronary heart disease: findings from the Heart and Soul Study. PLoS One. 2011;6(11):e26983. [30] ØSTHUS IB, SGURA A, BERARDINELLI F, et al. Telomere length and long-term endurance exercise: does exercise training affect biological age? A pilot study. PLoS One. 2012;7(12):e52769. [31] MATHUR S, ARDESTANI A, PARKER B, et al. Telomere length and cardiorespiratory fitness in marathon runners. J Investig Med. 2013;61(3):613-615. [32] LOPRINZI PD. Cardiorespiratory capacity and leukocyte telomere length among adults in the united states. Am J Epidemiol. 2015;182(3):198-201. [33] DENHAM J, O’BRIEN BJ, PRESTES PR, et al. Increased expression of telomere-regulating genes in endurance athletes with long leukocyte telomeres. J Appl Physiol (1985). 2016;120(2):148-158. [34] WILLIAMS DM, BUXTON JL, KANTOMAA MT, et al. Associations of leukocyte telomere length with aerobic and muscular fitness in young adults. Am J Epidemiol. 2017;185(7):529-537. [35] COLON M, HODGSON A, DONLON E, et al. Effects of competitive triathlon training on telomere length. J Aging Phys Act. 2019;27(4):510-514. [36] NGUYEN MT, SAFFERY R, BURGNER D, et al. Telomere length and lung function in a population-based cohort of children and mid-life adults. Pediatr Pulmonol. 2019;54(12):2044-2052. [37] HIAM D, SMITH C, VOISIN S, et al. Aerobic capacity and telomere length in human skeletal muscle and leukocytes across the lifespan. Aging (Albany NY). 2020;12(1):359-369. [38] NONSA-ARD R, ANEKNAN P, TONG-UN T, et al. Telomere length is correlated with resting metabolic rate and aerobic capacity in women: a cross-sectional study. Int J Mol Sci. 2022;23(21):13336. [39] 杨玲,黄森.端粒与端粒酶:运动延缓衰老的端粒机制[J].中国组织工程研究,2022,26(35):5733-5740. [40] SONG S, LEE E, KIM H. Does exercise affect telomere length? a systematic review and meta-analysis of randomized controlled trials. Medicina (Kaunas). 2022;58(2):242. [41] 杨裴.不同运动方式对人体DNA损伤、DNA甲基化和端粒长度的影响[J].中国组织工程研究,2024,28(1):147-152. [42] LEE JY, BANG HW, KO JH, et al. Leukocyte telomere length is independently associated with gait speed in elderly women. Maturitas. 2013;75(2):165-169. [43] BAYLIS D, NTANI G, EDWARDS MH, et al. Inflammation, telomere length, and grip strength: a 10-year longitudinal study. Calcif Tissue Int. 2014;95(1):54-63. [44] WOO J, YU R, TANG N, et al. Telomere length is associated with decline in grip strength in older persons aged 65 years and over. Age (Dordr). 2014;36(5):9711. [45] SOARES-MIRANDA L, IMAMURA F, SISCOVICK D, et al. Physical activity, physical fitness, and leukocyte telomere length: the cardiovascular health study. Med Sci Sports Exerc. 2015;47(12):2525-2534. [46] SILLANPää E, LAAKKONEN EK, VAARA E, et al. Biological clocks and physical functioning in monozygotic female twins. BMC Geriatr. 2018;18(1):83. [47] MONTIEL ROJAS D, NILSSON A, PONSOT E, et al. Short telomere length is related to limitations in physical function in elderly european adults. Front Physiol. 2018; 9:1110. [48] BOUNTZIOUKA V, NELSON CP, CODD V, et al. Association of shorter leucocyte telomere length with risk of frailty. J Cachexia Sarcopenia Muscle. 2022;13(3): 1741-1751. [49] 王光旭.弹力带抗阻训练对老年人肌力、行走能力和生活质量影响的实验研究[D].上海:上海体育学院,2018. [50] 首健,陈佩杰,肖卫华.运动对老年骨骼肌的改善效应及其机制[J].中国康复医学杂志,2020,35(9):1140-1145. [51] CARTEE GD, HEPPLE RT, BAMMAN MM, et al. Exercise promotes healthy aging of skeletal muscle. Cell Metab. 2016;23(6):1034-1047. [52] 陈昱圻,郭昌龙,袁国红,等.衰老个体骨骼肌卫星细胞的研究进展[J].中国老年学杂志,2022,42(17):4354-4360. [53] WANG H, HUANG W Y, ZHAO Y. Efficacy of exercise on muscle function and physical performance in older adults with sarcopenia: an updated systematic review and meta-analysis. Int J Environ Res Public Health. 2022;19(13):8212. [54] CHANG KV, CHEN YC, WU WT, et al. Expression of telomeric repeat-containing rna decreases in sarcopenia and increases after exercise and nutrition intervention. Nutrients. 2020;12(12):3766. [55] WANG L, LU Z, ZHAO J, et al. Selective oxidative stress induces dual damage to telomeres and mitochondria in human T cells. Aging Cell. 2021;20(12):e13513. [56] HEWITT G, JURK D, MARQUES FD, et al. Telomeres are favoured targets of a persistent DNA damage response in ageing and stress-induced senescence. Nat Commun. 2012;3:708. [57] DEMISSIE S, LEVY D, BENJAMIN EJ, et al. Insulin resistance, oxidative stress, hypertension, and leukocyte telomere length in men from the Framingham Heart Study. Aging Cell. 2006;5(4):325-330. [58] 张丽欣,王琪,于爽,等.女性关键时期端粒-端粒酶系统的影响因素研究进展[J].中国临床药理学与治疗学,2021,26(11):1328-1334. [59] CHEN D, ZHAO G, FU J, et al. Effects of traditional chinese exercise on oxidative stress in middle-aged and older adults: a network meta-analysis. Int J Environ Res Public Health. 2022;19(14):8276. [60] 于政超.抗阻、有氧运动对衰老小鼠骨骼肌铁死亡及NRF2介导的抗氧化系统的影响[D].上海:华东师范大学,2022. [61] 张淑静,王玥,周雨玫,等.跑步运动对小鼠端粒长度和体内氧化抗氧化的影响[J].世界中医药,2019,14(2):330-335. [62] KHAN S, CHUTURGOON AA, NAIDOO DP. Telomeres and atherosclerosis. Cardiovasc J Afr. 2012;23(10):563-571. [63] SAVALE L, CHAOUAT A, BASTUJI-GARIN S, et al. Shortened telomeres in circulating leukocytes of patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2009;179(7):566-571. [64] NIMMO MA, LEGGATE M, VIANA JL, et al. The effect of physical activity on mediators of inflammation. Diabetes Obes Metab. 2013; 15 Suppl 3:51-60. [65] CLUCKEY TG, NIETO NC, RODONI BM, et al. Preliminary evidence that age and sex affect exercise-induced hTERT expression. Exp Gerontol. 2017;96:7-11. [66] 张冬茹.有氧运动对MI后大鼠心肌细胞端粒酶活性及细胞增殖的影响研究[D].扬州:扬州大学,2017. [67] WERNER C, FüRSTER T, WIDMANN T, et al. Physical exercise prevents cellular senescence in circulating leukocytes and in the vessel wall. Circulation. 2009; 120(24):2438-2447. [68] LAYE MJ, SOLOMON TP, KARSTOFT K, et al. Increased shelterin mRNA expression in peripheral blood mononuclear cells and skeletal muscle following an ultra-long-distance running event. J Appl Physiol (1985). 2012;112(5):773-781. [69] INSEL KC, MERKLE CJ, HSIAO CP, et al. Biomarkers for cognitive aging part I: telomere length, blood pressure and cognition among individuals with hypertension. Biol Res Nurs. 2012;14(2):124-132. [70] 张舒媛.老年高血压患者血压控制影响因素探究及衰老相关生物标志物端粒损耗对降压疗效的影响[D].北京:北京协和医学院,2021. [71] 田然,张磊楠,张婷婷,等.外周血白细胞端粒长度与早发冠心病的相关性及其影响因素分析[J].中国循环杂志,2016,31(6):541-545. [72] CODD V, NELSON CP, ALBRECHT E, et al. Identification of seven loci affecting mean telomere length and their association with disease. Nat Genet. 2013;45(4):422-427e4272. [73] RICHARDSON GD, BREAULT D, HORROCKS G, et al. Telomerase expression in the mammalian heart. FASEB J. 2012;26(12):4832-4840. [74] ZHANG Y, GUO Y, ZHOU G, et al. Regulation of telomere length and atherosclerosis by protection of telomeres 1 protein. J Nanosci Nanotechnol. 2019;19(12):7953-7959. [75] SAGRIS M, THEOFILIS P, ANTONOPOULOS AS, et al. Inflammatory Mechanisms in COVID-19 and Atherosclerosis: current pharmaceutical perspectives. Int J Mol Sci. 2021;22(12):6607. [76] 芦建东,苏浩,刘敬祺,等.有氧训练和联合训练对成年人心血管健康改善效果差异的比较:meta分析[J].中国康复医学杂志,2022,37(12):1659-1668. [77] 何荣,张丽,李鹏,等.有氧运动对不同血糖水平男性人群动脉僵硬度的即时影响研究[J]. 中国全科医学,2023,26(24):2997-3004. [78] ZHANG Y, WANG C, JIN Y, et al. Activating the PGC-1α/TERT pathway by catalpol ameliorates atherosclerosis via modulating ROS production, DNA damage, and telomere function: implications on mitochondria and telomere link. Oxid Med Cell Longev. 2018;2018:2876350. [79] POOLEY KA, SANDHU MS, TYRER J, et al. Telomere length in prospective and retrospective cancer case-control studies. Cancer Res. 2010;70(8):3170-3176. [80] 张毅,武雨思,宋睿睿,等.外周血白细胞端粒DNA长度与肺癌的关系[J].陕西师范大学学报(自然科学版),2018,46(4):78-82. [81] SHAY JW, WRIGHT WE. Telomeres and telomerase: three decades of progress. Nat Rev Genet. 2019;20(5):299-309. [82] LONGOBUCCO Y, MASINI A, MARINI S, et al. Exercise and oxidative stress biomarkers among adult with cancer: a systematic review. Oxid Med Cell Longev. 2022;2022:2097318. [83] GAMMON MD, NEUGUT AI, SANTELLA RM, et al. The Long Island Breast Cancer Study Project: description of a multi-institutional collaboration to identify environmental risk factors for breast cancer. Breast Cancer Res Treat. 2002; 74(3):235-254. [84] 以功能障碍为中心的中国癌症患者运动康复专家共识[J].中国康复医学杂志,2023,38(1):1-7. [85] BROWN JC, STURGEON K, SARWER DB, et al. The effects of exercise and diet on oxidative stress and telomere length in breast cancer survivors. Breast Cancer Res Treat. 2023;199(1):109-117. [86] TAMURA Y, TAKUBO K, AIDA J, et al. Telomere attrition and diabetes mellitus. Geriatr Gerontol Int. 2016;16 Suppl 1:66-74. [87] 杨雁,王玉萍,刘喆隆,等.胰岛素抵抗患者外周血白细胞端粒长度检测[J].中国医院药学杂志,2011,31(19):1609-1613. [88] 曹岚,李志强,师咏勇,等.端粒长度与2型糖尿病:孟德尔随机化研究与多基因风险评分分析[J].遗传,2020,42(9):882-888. [89] ADAIKALAKOTESWARI A, BALASUBRAMANYAM M, MOHAN V. Telomere shortening occurs in Asian Indian Type 2 diabetic patients. Diabet Med. 2005; 22(9):1151-1156. [90] ABBATECOLA AM, PAOLISSO G. Is there a relationship between insulin resistance and frailty syndrome? Curr Pharm Des. 2008;14(4):405-410. [91] BUCCI M, HUOVINEN V, GUZZARDI MA, et al. Resistance training improves skeletal muscle insulin sensitivity in elderly offspring of overweight and obese mothers. Diabetologia. 2016;59(1):77-86. [92] DIMAURO I, SGURA A, PITTALUGA M, et al. Regular exercise participation improves genomic stability in diabetic patients: an exploratory study to analyse telomere length and DNA damage. Sci Rep. 2017;7(1):4137. [93] TZANETAKOU IP, KATSILAMBROS NL, BENETOS A, et al. “Is obesity linked to aging?”: adipose tissue and the role of telomeres. Ageing Res Rev. 2012;11(2): 220-229. [94] BUXTON JL, WALTERS RG, VISVIKIS-SIEST S, et al. Childhood obesity is associated with shorter leukocyte telomere length. J Clin Endocrinol Metab. 2011;96(5): 1500-1505. [95] ZGHEIB NK, SLEIMAN F, NASREDDINE L, et al. Short telomere length is associated with aging, central obesity, poor sleep and hypertension in lebanese individuals. Aging Dis. 2018;9(1):77-89. [96] TOUPANCE S, KARAMPATSOU SI, LABAT C, et al. Longitudinal association of telomere dynamics with obesity and metabolic disorders in young children. Nutrients. 2022;14(23):5191. [97] 赵连泽,安友仲.端粒长度与冠心病危险因素的研究进展[J].中国循环杂志, 2018,33(5):507-509. [98] 郭怡洵,关晓印,王博,等.肌少性肥胖的发病机制及潜在治疗靶点研究进展[J].中国临床药理学与治疗学,2023,28(3):341-346. [99] BRANDAO CFC, NONINO CB, DE CARVALHO FG, et al. The effects of short-term combined exercise training on telomere length in obese women: a prospective, interventional study. Sports Med Open. 2020;6(1):5. [100] DANKEL SJ, LOENNEKE JP, LOPRINZI PD. The impact of overweight/obesity duration and physical activity on telomere length: an application of the WATCH paradigm. Obes Res Clin Pract. 2017;11(2):247-252. [101] SHIN YA. How does obesity and physical activity affect aging? Focused on telomere as a biomarker of aging. J Obes Metab Syndr. 2019;28(2):92-104. [102] BARBOSA RV, CHIELLI PDC, SATYKO KG, et al. Short-term aerobic exercise did not change telomere length while it reduced testosterone levels and obesity indexes in PCOS: a randomized controlled clinical trial study. Int J Environ Res Public Health. 2021;18(21):11274. [103] LI P, LIU T, LIU J, et al. Promoter polymorphism in the serotonin transporter (5-HTT) gene is significantly associated with leukocyte telomere length in Han Chinese. PLoS One. 2014;9(4):e94442. [104] HOEN PW, ROSMALEN JG, SCHOEVERS RA, et al. Association between anxiety but not depressive disorders and leukocyte telomere length after 2 years of follow-up in a population-based sample. Psychol Med. 2013;43(4):689-697. [105] RIDOUT KK, RIDOUT SJ, PRICE LH, et al. Depression and telomere length: A meta-analysis. J Affect Disord. 2016;191:237-247. [106] 赵源,马姗姗,束晨晔,等.从端粒和端粒酶探析冥想对压力的缓解作用[J].心理科学,2020,43(4):1010-1016. [107] 王庭慧.大鼠大强度游泳、运动自愿程度和端粒长度的关联性研究[D].北京:北京体育大学,2019. [108] CHEUNG DST, DENG W, TSAO SW, et al. Effect of a qigong intervention on telomerase activity and mental health in chinese women survivors of intimate partner violence: a randomized clinical trial. JAMA Netw Open. 2019; 2(1):e186967. |
| [1] | Chen Mengmeng, Bao Li, Chen Hao, Jia Pu, Feng Fei, Shi Guan, Tang Hai. Biomechanical characteristics of a novel interspinous distraction fusion device BacFuse for the repair of lumbar degenerative disease [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1325-1329. |
| [2] | Li Yongjie, Fu Shenyu, Xia Yuan, Zhang Dakuan, Liu Hongju. Correlation of knee extensor muscle strength and spatiotemporal gait parameters with peak knee flexion/adduction moment in female patients with knee osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1354-1358. |
| [3] | Wu Jing, Yao Yingce, Yang Xiaowei, Xue Boshi, Zhao Jianbin, Yang Chen, Luan Tianfeng, Zhou Zhipeng. Intervention of muscle strength training combined with neuromuscular electrical stimulation on lower limb function and biomechanical changes in patients with patellofemoral pain [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1365-1371. |
| [4] | Shan Jiaxin, Zhang Yilong, Wu Hongtao, Zhang Jiayuan, Li Anan, Liu Wengang, Xu Xuemeng, Zhao Chuanxi. Changes in muscle strength and pain in patients receiving Jianpi Yiqi Huoxue Formula after total knee arthroplasty [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1378-1382. |
| [5] | Feng Tianxiao, Bu Hanmei, Wang Xu, Zhu Liguo, Wei Xu. Interpretation of key points of International Framework for Examination of the Cervical Region for potential of vascular pathologies of the neck prior to Orthopaedic Manual Therapy (OMT) Intervention: International IFOMPT Cervical Framework [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1420-1425. |
| [6] | Wei Juan, Li Ting, Huan Mengting, Xie Ying, Xie Zhouyu, Wei Qingbo, Wu Yunchuan. Mechanism by which static exercise improves insulin resistance in skeletal muscle of type 2 diabetes [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1271-1276. |
| [7] | Lou Guo, Zhang Yan, Fu Changxi. Role of endothelial nitric oxide synthase in exercise preconditioning-induced improvement of myocardial ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1283-1288. |
| [8] | Qi Xue, Li Jiahui, Zhu Yuanfeng, Yu Lu, Wang Peng. Abnormal modification of alpha-synuclein and its mechanism in Parkinson’s disease [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1301-1306. |
| [9] | Cheng Jie, Wang Jihong, Zhang Pei. Functional exercise for tendon adhesion in a model of deep flexor tendon II injury of the third toe [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1161-1167. |
| [10] | Wang Ji, Zhang Min, Li Wenbo, Yang Zhongya, Zhang Long. Effect of aerobic exercise on glycolipid metabolism, skeletal muscle inflammation and autophagy in type 2 diabetic rats [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1200-1205. |
| [11] | Ruan Rong, Lou Xujia, Jin Qiguan, Zhang Libing, Xu Shang, Hu Yulong. Effect of resveratrol on gluconeogenesis in exercise-induced fatigue rats [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1229-1234. |
| [12] | Pan Xiaolong, Fan Feiyan, Ying Chunmiao, Liu Feixiang, Zhang Yunke. Effect and mechanism of traditional Chinese medicine on inhibiting the aging of mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1091-1098. |
| [13] | Liu Hanfeng, Wang Jingjing, Yu Yunsheng. Artificial exosomes in treatment of myocardial infarction: current status and prospects [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1118-1123. |
| [14] | Li Longyang, Zhang Songjiang, Zhao Xianmin, Zhou Chunguang, Gao Jianfeng. Electroacupuncture intervention on the proliferation and differentiation of hippocampal neurons and oligodendrocytes in Alzheimer’s disease model mice [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1029-1035. |
| [15] | Wang Tihui, Wang Xu, Wu Jinqing, Chen Jiliang, Wang Xiaolu, Miao Juan. Application of three-dimensional simulated osteotomy of the distal femur in total knee arthroplasty [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(6): 905-910. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||