1.1 设计 随机对照动物实验,组间比较时采用单因素方差分析。
1.2 时间及地点 实验于2023年3月至2024年3月在新疆医科大学动物实验中心完成。
1.3 材料
1.3.1 实验动物 雌性SD大鼠48只,6-8周龄,SPF级,体质量(220±20) g,采购于新疆医科大学动物中心,许可证号:SYXK(新) 2016-0002,研究方案已通过新疆医科大学动物伦理委员会审批,审批编号为
IACUC-20230321-07。实验过程遵循了国际兽医学编辑协会《关于动物伦理与福利的作者指南共识》和本地及国家法规。实验动物在麻醉下进行所有的手术,并最大限度地减少其疼痛、痛苦和死亡。
1.3.2 实验细胞 人脐带间充质干细胞购自新疆西部赛澳生物科技有限责任公司,经过流式细胞术及三系分化实验检测符合标准。
1.3.3 实验仪器和试剂 CO2恒温培养箱(美国Thermo Fisher,HERAcell240i);-80 ℃超低温冰箱(中国合肥美菱,DW-HL388);低温高速离心机(德国Eppendorf,5430R);超速离心机(德国Beckman,Avanti XE-100);电泳仪(美国BIO RAD,164-5050);凝胶成像系统(美国BIO RAD,ChemiDoc MP);切片机(德国徕卡公司,RM2235);自动恒温漂片仪(湖北泰维科技,TK-212);倒置荧光显微镜(日本OLYMPUS,IX73);荧光定量PCR仪(美国Thermo Fisher,QuantStudio 5);酶标仪(美国Thermo Fisher,MultiskanGo);神经内镜(科众医疗,QKⅢ-16090);脑源性神经营养因子抗体(武汉三鹰,25699-1-AP);血管内皮生长因子A抗体(武汉三鹰,19003-1-AP);诱导型一氧化氮合酶抗体(武汉三鹰,22226-1-AP);精氨酸酶1抗体(武汉三鹰,16001-1-AP);GAPDH抗体(武汉三鹰,10494-1-AP);β-Actin抗体(武汉三鹰,20536-1-AP)。
1.4 实验方法
1.4.1 人脐带间充质干细胞来源外泌体的提取
(1)无外泌体血清的制备:将胎牛血清在4 ℃、120 000×g离心17 h,胎牛血清分为2层:底层含有胎牛血清来源的微囊泡沉淀,上层为无外泌体的血清。小心吸取上层血清,置于4 ℃冰箱中保存。
(2)细胞上清液的提取:第3代人脐带间充质干细胞于T75培养瓶内培养,待细胞融合度达到70%时,换用含体积分数10%无外泌体血清的DMEM培养基继续培养48 h,收集细胞培养基上清,置于-80 ℃冰箱中保存。
(3)外泌体的制备(超速离心法):①将上步骤得到的上清液置于冰上融化;②4 ℃、2 000×g离心10 min,取上清;4 ℃、10 000×g离心30 min,去除细胞碎片,取上清液转移至新的离心管中;③4 ℃、100 000×g离心90 min,吸去上清,留沉淀,得到沉淀主要为外泌体和干扰蛋白;④加入PBS吹打,4 ℃、140 000×g离心90 min,吸去上清,留沉淀,漂洗2遍,得到的沉淀即为外泌体;⑤加入100 μL PBS,置于-80 ℃超低温冰箱中保存。
1.4.2 人脐带间充质干细胞来源外泌体的鉴定
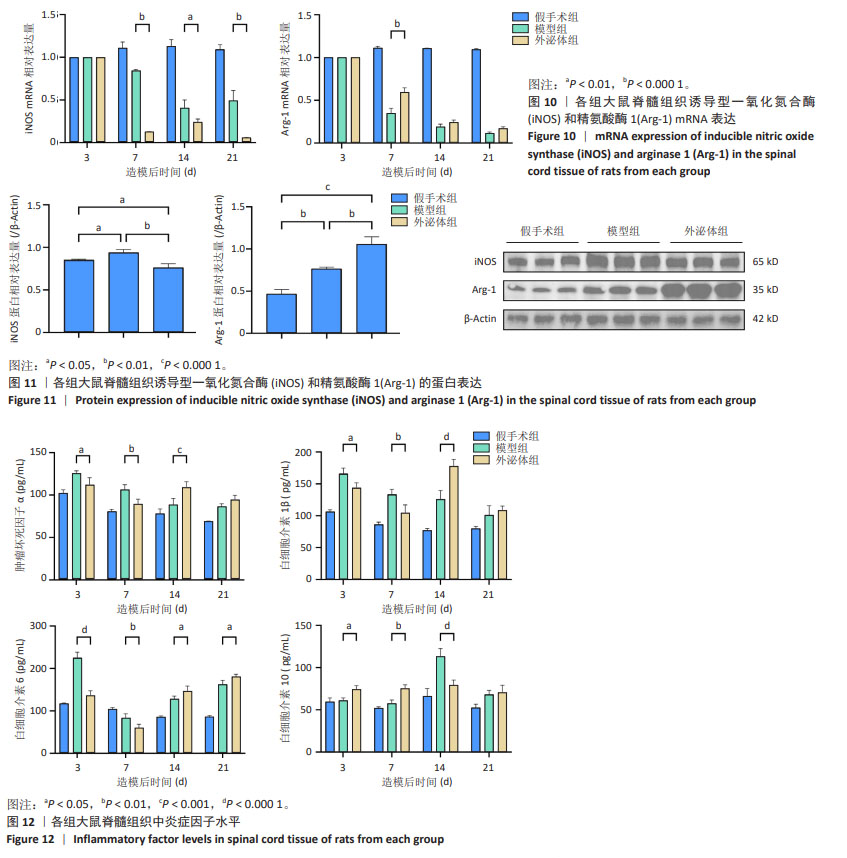
(1)透射电镜观察:用移液器吸取20 μL外泌体悬液滴加于电镜铜网状栅中,沉淀2 min后,使用滤纸吸去多余液体。然后,在铜网状栅上滴加10 μL 2%磷钨酸溶液,室温下染色2 min。在室温下干燥10 min后,上机观察,使用200 kV观察电压进行拍照,即可获得外泌体的透射电镜图像。
(2)粒径分析:取10 μL外泌体样品,用PBS稀释至30 μL。首先使用标准品进行纳米颗粒追踪分析的性能测试,确保测试系统正常运行。性能测试合格后,将外泌体样品进行梯度稀释,以避免样本堵塞进样针。待样品检测完成后,即可获得外泌体的粒径分布和浓度信息。
(3) Western blot 检测 CD63、TSG-101、Alix的表达:取50 μL外泌体溶液加入等体积的RIPA裂解液,在冰上进行裂解,每5 min吹打1次,裂解50 min,离心后取上清,即为外泌体蛋白,将所得外泌体蛋白进行蛋白定量后,样品与5×LoadingBuffer混合以达相同浓度后,100 ℃煮沸10 min,进行SDS凝胶电泳后转至PVDF膜,快速封闭液封闭30 min,加入CD63(1∶1 000)、TSG-101(1∶3 000)、Alix(1∶20 000)、GAPDH(1∶20 000)一抗,4 ℃孵育过夜,第2天1×TBST洗3次,每次10 min,加入相应二抗(1∶25 000),室温孵育1 h,1×TBST洗3次,每次10 min,进行ECL化学发光,拍照。使用Image J软件进行条带处理及分析,结果以目的蛋白灰度值/相应内参灰度值表示,使用GraphPad Prism 9进行可视化展示。
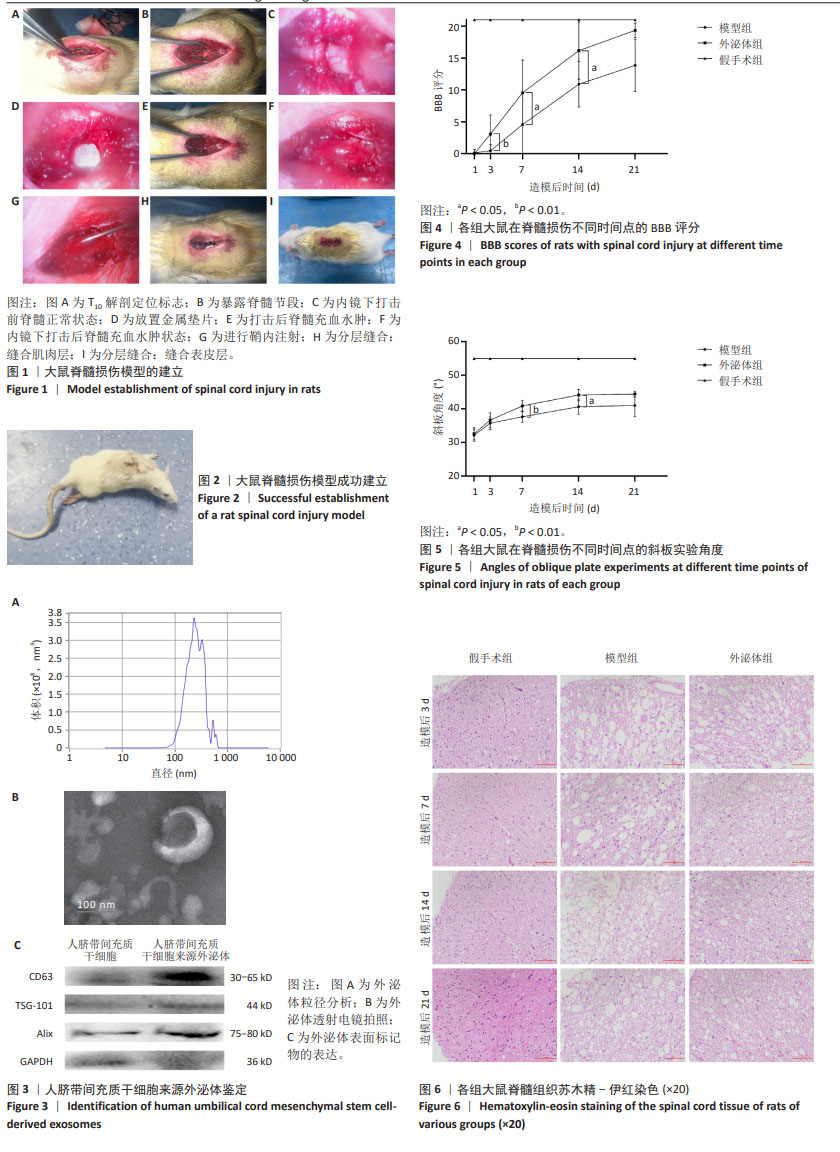
1.4.3 大鼠脊髓损伤模型的制作及分组 将SD大鼠随机分为假手术组、模型组和外泌体组,每组16只。1%戊巴比妥钠溶液腹腔麻醉后,在T13肋骨与脊柱中线处切开皮肤及皮下筋膜,显露T9-T11的3个棘突。解剖特征显示T9棘突倾向尾侧,T10棘突处于中立位,而T11棘突倾向头侧,这3个棘突簇集在一起作为解剖定位的标志(图1A)。移入神经内镜进行后续操作,使用小咬骨钳移除T10棘突,并用齿镊轻提起T9横突。在T11两侧横突处剪开两个小口,随后剪断T10椎弓根,再用小咬骨钳从下往上剪开缺口处的椎板,扩窗过程中可用神经剥离子拨开脊髓,最终用小咬骨钳移除双侧T10椎板,充分暴露目标脊髓段T10(图1B,C)。将1 mm厚的垫片贴附在硬脊膜上(图1D),用自制打击器打击T10段脊髓(30 g,2.5 cm),打击冲量为75 g/cm,并保持克氏针停留5 s,建立脊髓损伤模型(图1E-I)。假手术组:暴露脊髓后即缝合切口,余无其他处理。模型组:暴露脊髓后建立大鼠脊髓损伤模型,鞘内注射20 μL PBS。外泌体组:暴露脊髓后建立大鼠脊髓损伤模型,损伤24 h后鞘内注射20 μL人脐带间充质干细胞来源外泌体(1.3 μg/μL)。
1.4.4 术后护理 手术后大鼠分笼饲养,防止互咬伤口,伤口每天碘伏消毒1次,给予10万U青霉素腹腔注射,持续3 d,人工辅助排尿,每日3次。
1.4.5 大鼠神经功能评价 在造模后第1,3,7,14,21天,对各组大鼠进行BBB评分[22],以动态监测各组大鼠后肢运动功能的恢复情况。实验环境保持安静,光线均匀,测试区域为一个开阔的平坦区域,以便于观察大鼠的运动情况。大鼠在每次测试前被允许在测试区域内自由活动数分钟,以适应环境。由3名独立实验者进行每只大鼠的BBB评分,实验者不知晓分组情况,观察大鼠后肢运动状态(图2),最终结果取三者平均值。
1.4.6 Rivlin斜板实验 在造模后第3,7,14,21天,对各组大鼠进行Rivlin斜板实验,以评估各组大鼠后肢运动功能随时间的变化。实验采用角度可调的斜板,初始角度设置为0°,即与地面平行。将大鼠置于自制Rivlin斜板上,确保其四肢均接触板面,并能够自由活动。缓慢增加斜板角度,每次增加5°,直至大鼠无法继续维持身体稳定并滑下斜板。记录大鼠滑落时的最大角度。每只大鼠重复测试3次,取3次测试的平均值。
1.4.7 苏木精-伊红染色 造模后第3,7,14,21天麻醉后处死大鼠,每个时间点每组4只大鼠,取损伤部位1.0-2.0 cm脊髓节段放置于40 g/L多聚甲醛中浸泡固定。经过脱水处理和包埋后,将脊髓组织切片(厚度5 μm)以待染色。每只大鼠随机选取3张切片,按照苏木精-伊红染色的步骤进行染色。显微镜下观察损伤部位的胶质区空洞及瘢痕组织的形成情况。
1.4.8 尼氏染色 采用步骤1.4.7中的蜡块进行切片,对各组脊髓组织切片进行尼氏染色,观察神经元的形态和数量分布,从而对损伤后神经元的功能状态进行评估。尼氏染色方法主要用于染色神经元细胞体中的尼氏物质(粗面内质网),这有助于评估神经元的结构完整性和数量变化。
1.4.9 Western blot 检测 按照1.4.2步骤采用Western blot检测造模后第3,7,14,21天时各组大鼠脊髓组织中脑源性神经营养因子、血管内皮生长因子A蛋白表达,使用一抗及稀释比例如下:脑源性神经营养因子(1∶1 000)、血管内皮生长因子A (1∶6 000)、内参GAPDH (1∶20 000);采用Western blot检测造模后第7天时各组大鼠脊髓组织中诱导型一氧化氮合酶、精氨酸酶1蛋白表达,使用一抗及稀释比例如下:诱导型一氧化氮合酶(1∶500)、精氨酸酶1 (1∶20 000)、内参β-Actin(1∶8 000)。
1.4.10 免疫荧光检测 将脊髓组织使用40 g/L多聚甲醛固定24 h,随后在蔗糖溶液中脱水,脱水后用冰冻切片机切成厚度为20 µm的连续切片,并将切片铺贴在预处理好的载玻片上。切片室温晾干后,使用0.3% Triton X-100透化细胞膜30 min,用含体积分数10%正常山羊血清的PBS在室温下封闭非特异性结合位点1 h,随后依次孵育一抗(诱导型一氧化氮合酶、精氨酸酶1抗体),4 ℃孵育过夜。次日,使用PBS洗涤切片3次,每次5 min,然后分别孵育对应的荧光标记二抗,室温下避光孵育1 h,再次用PBS洗涤切片3次,每次5 min,用含DAPI的抗荧光淬灭剂封固,使用共聚焦显微镜进行成像。实验设置阴性对照组以排除非特异性荧光和背景信号。
1.4.11 qRT-PCR检测 造模后第3,7,14,21天,从大鼠脊髓组织中提取总RNA,使用Trizol试剂按照制造商的说明进行操作。提取的RNA样品通过NanoDrop分光光度计检测纯度和浓度。将500 ng总RNA反转录为cDNA,使用反转录试剂盒按照制造商的说明进行操作。随后,使用SYBR Green Master Mix在96孔板上进行qRT-PCR反应,每个样本设立3个重复。qRT-PCR反应体系总量为20 µL,包含2 µL cDNA模板、10 µL SYBR Green Master Mix、0.4 µL前向引物(10 µmol/L)、0.4 µL反向引物(10 µmol/L)以及7.2 µL无核酸酶水。PCR反应在ABI 7500快速荧光定量PCR仪上进行,反应条件为:95 ℃预变性2 min,接着40个循环的95 ℃变性15 s,60 ℃退火延伸30 s。数据采用2-ΔΔCt方法进行分析,并使用GAPDH作为内参基因。各基因和内参引物序列见表1。

1.4.12 ELISA检测 造模后第3,7,14,21天,将大鼠脊髓组织匀浆并使用RIPA裂解液裂解以提取总蛋白,将100 µL含有已知浓度蛋白的标准品或样本蛋白加入96孔ELISA板中,每组设置3个重复;随后,封闭未结合的结合位点,使用含5% BSA的PBS在室温下孵育1 h;用PBS洗涤板孔3次,每次5 min,加入100 µL肿瘤坏死因子α、白细胞介素1β、白细胞介素6、白细胞介素10一抗(稀释度按照制造商说明),在4 ℃孵育过夜;次日,用PBS洗涤板孔3次,每次5 min,加入100 µL酶联二抗溶液,在室温下孵育1 h;用PBS洗涤板孔3次,每次5 min,加入100 µL TMB底物溶液,避光孵育10-15 min,直到显色反应达到预期程度;通过加入50 µL终止液终止反应,并在450 nm波长下使用酶标仪测量吸光度值。根据标准曲线计算样本中炎症因子水平。
1.5 主要观察指标 ①各组大鼠脊髓损伤后神经功能评分;②各组大鼠斜板实验结果;③各组大鼠脊髓组织苏木精-伊红染色、尼氏染色结果;④各组大鼠脊髓组织中脑源性神经营养因子、血管内皮生长因子A蛋白表达;⑤各组大鼠脊髓组织中诱导型一氧化氮合酶和精氨酸酶1的表达;⑥各组大鼠脊髓组织中炎症因子水平。
1.6 统计学分析 实验数据均以x±s表示,使用SPSS 20.0进行统计学分析。组间比较采用单因素方差分析(ANOVA),并进行LSD多重比较,同时进行方差齐性检验,P < 0.05为差异有显著性意义。
中国组织工程研究杂志出版内容重点:干细胞;骨髓干细胞;造血干细胞;脂肪干细胞;肿瘤干细胞;胚胎干细胞;脐带脐血干细胞;干细胞诱导;干细胞分化;组织工程