中国组织工程研究 ›› 2025, Vol. 29 ›› Issue (13): 2641-2647.doi: 10.12307/2025.051
• 骨髓干细胞 bone marrow stem cells • 下一篇
miR-192-5p靶向CKIP-1促进骨质疏松患者骨髓间充质干细胞成骨分化
鄂正康,辛红伟,于清波,张允帅
- 开封市中心医院(河南大学附属人民医院)骨六科,河南省开封市 475000
miR-192-5p targets CKIP-1 to promote osteogenic differentiation of bone marrow mesenchymal stem cells in osteoporosis patients
E Zhengkang, Xin Hongwei, Yu Qingbo, Zhang Yunshuai
- Sixth Department of Orthopedics, Kaifeng Central Hospital (Affiliated People’s Hospital, Henan University), Kaifeng 475000, Henan Province, China
摘要:
文题释义:
酪蛋白激酶2结合蛋白1(casein kinase 2-interaction protein-1,CKIP-1):是蛋白激酶CK2的结合蛋白,在调控骨发育与骨质疏松症、心脏发育与心肌肥大和肿瘤发生发展过程中发挥重要作用,是一种重要的骨形成负调控基因,敲除该基因后,小鼠整体骨质明显增强、骨形成和骨密度显著增高。微小RNA(MicroRNA,miRNA):在真核生物中由19-25个核苷酸组成的非编码小分子 RNA,主要参与细胞的增殖、分化和凋亡等生理活动。初级转录物经过一系列核酸酶的剪切加工产生成熟的miRNA,通过碱基互补配对的方式识别靶基因mRNA,沉默复合体降解靶基因或阻遏靶基因的翻译。
摘要
背景:酪蛋白激酶2结合蛋白1(casein kinase 2-interaction protein-1,CKIP-1)是一种重要的骨形成负调控基因,其敲除鼠骨质显著增强、骨形成和骨密度也显著提高。而miRNA作为较早发现的小分子调控物,对大多数编码基因具有调控作用,在成骨分化中发挥重要作用。
目的:探讨miRNA/CKIP-1对骨质疏松患者骨髓间充质干细胞成骨分化的影响及其分子机制。
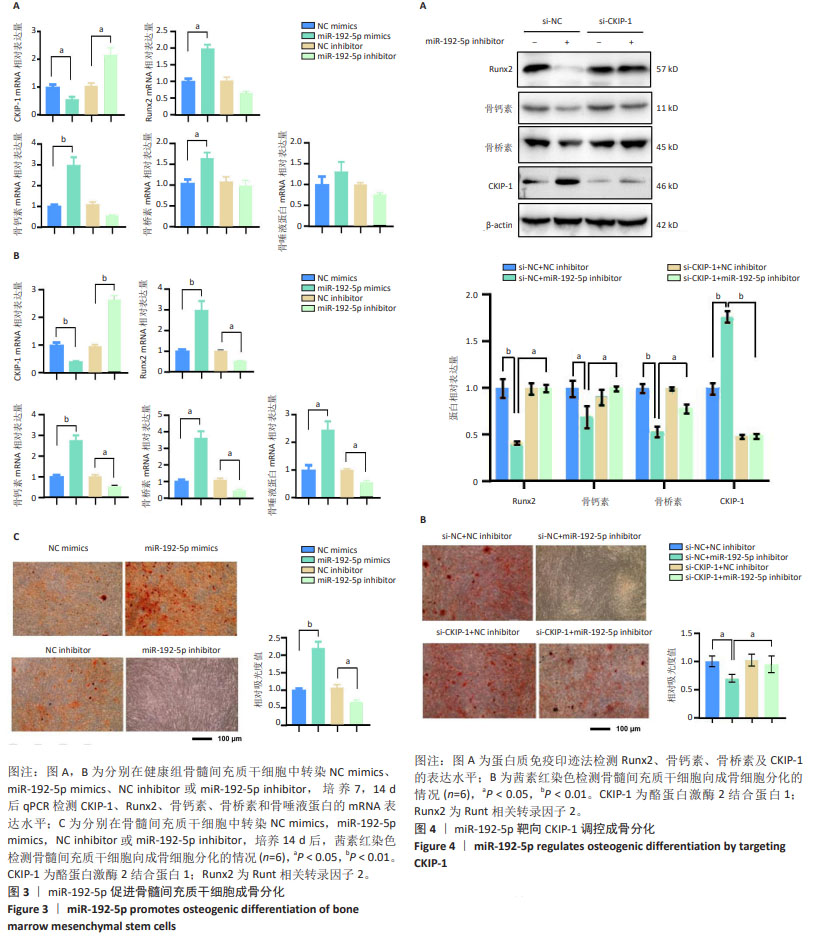
方法:采用miRNA-Seq技术检测2022年3-6月在开封市中心医院骨外科就诊32例骨质疏松患者及同期体检中心健康人群骨髓间充质干细胞中miRNA的变化情况;利用Targetscan网站预测靶向调控CKIP-1的miRNA,利用荧光素酶报告基因实验检测miRNA与CKIP-1启动子区DNA的结合;在骨髓间充质干细胞中转染miR-192-5p类似物(miR-192-5p mimics)/阴性对照(NC mimics)或miR-192-5p抑制剂(miR-192-5p inhibitor)/阴性对照(NC inhibitor),成骨诱导后第7,14天,通过实时荧光定量PCR技术及茜素红染色检测成骨标志基因Runt相关转录因子2(Runx2)、骨钙素、抗骨桥蛋白、骨唾液蛋白及CKIP-1的表达水平和骨髓间充质干细胞向成骨细胞分化的情况;采用蛋白质免疫印迹实验及茜素红染色检测miR-192-5p/CKIP-1/轴对细胞成骨分化的的调控作用。
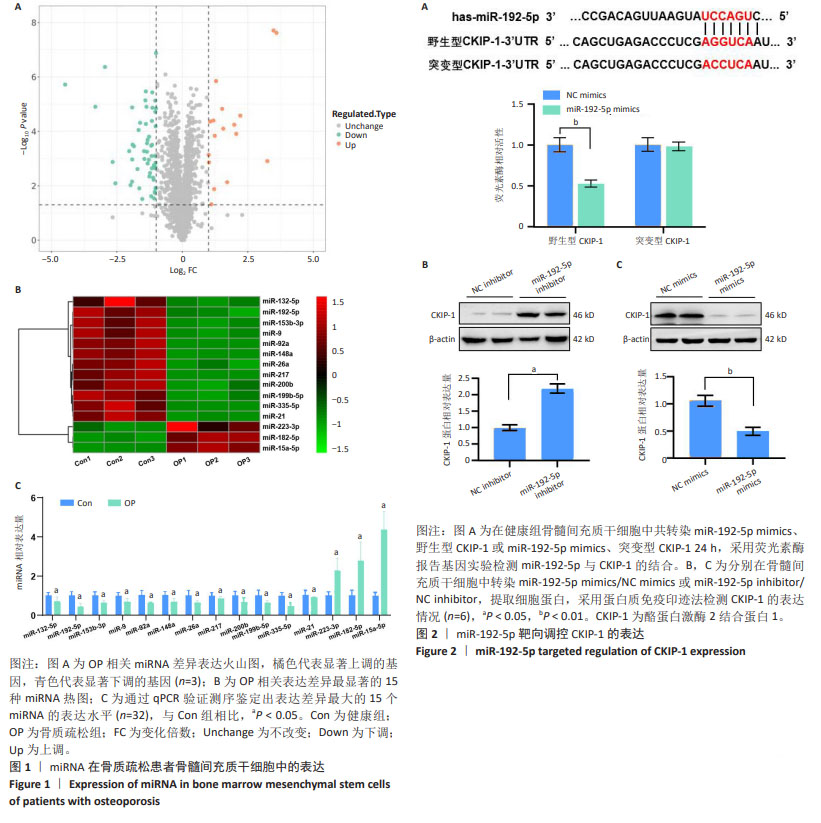
结果与结论:与健康组相比,骨质疏松组有16个miRNA表达明显升高,53个miRNA表达明显降低(P < 0.05);利用Targetscan网站预测,并通过荧光素酶报告基因实验验证,发现miR-192-5p与CKIP-1有互补的核苷酸序列(P < 0.05);过表达miR-192-5p,Runx2、骨钙素、骨桥素和骨唾液蛋白的表达水平显著升高(P < 0.05),抑制miR-192-5p,Runx2、骨钙素、骨桥素和骨唾液蛋白的表达水平显著降低(P < 0.05),而沉默CKIP-1的表达后,Runx2、骨钙素及骨桥素的蛋白水平增加(P < 0.05),逆转了敲低miR-192-5p对细胞成骨分化的抑制作用。上述结果证实,miR-192-5p在骨质疏松症中表达降低;miR-192-5p通过靶向抑制CKIP-1的表达,促进骨髓间充质干细胞成骨分化。
https://orcid.org/0009-0003-2382-343X (鄂正康);https://orcid.org/0009-0003-4460-1326 (辛红伟)
中国组织工程研究杂志出版内容重点:干细胞;骨髓干细胞;造血干细胞;脂肪干细胞;肿瘤干细胞;胚胎干细胞;脐带脐血干细胞;干细胞诱导;干细胞分化;组织工程
中图分类号: