1.1 设计 体外细胞学实验,两组间数据比较采用独立样本t 检验。
1.2 时间及地点 实验于2023年2-11月在新疆维吾尔自治区人民医院医学研究与转化中心实验室完成。
1.3 材料 DMEM基础培养基、胎牛血清(Gibco,美国);0.25%胰蛋白酶,青霉素链霉素混合液、Ⅰ型胶原酶、BCA蛋白浓度测定试剂盒、PKH26红色细胞膜染色试剂盒(Solarbio,中国);外泌体提取试剂盒(贝贝生物,中国);CD45、CD146、CD90、CD105(eBioscience,美国);CD63、CD81、TSG101、骨桥蛋白、Runt相关转录因子2抗体和羊抗兔二抗(Abcam,美国);OSX、β-actin抗体(博士德,中国);油红O染色试剂盒(索莱宝,中国);离心机、CO2培养箱、酶标仪、超净工作台(Thermo,美国);透射电镜(Hitachi-4800,日本);倒置显微镜系统(Nikon,日本)。
1.4 实验方法
1.4.1 hPDLSCs提取及培养 在新疆维吾尔自治区人民医院口腔科收集16-24 岁健康因正畸拔牙患者(均获得知情通知书)的前磨牙或智齿,将收集到的牙齿放入含5%双抗的PBS中4 ℃保存,送到实验室,准备5个15 mL离心管,每管加入5 mL含2%双抗的PBS,将收集到的牙齿依次在5个离心管内反复洗涤,转移到培养皿,加入2 mL完全培养基(DMEM基础培养基+体积分数20%胎牛血清+1%青-链霉素),用高压灭菌后的拔牙钳夹住牙冠,用刮治器刮取根中1/3的牙周膜组织,800 r/min离心2 min,弃上清,加入1 mLⅠ型胶原酶(2 mg/mL),充分混匀,于37 ℃培养箱中消化110 min,每隔15 min摇匀EP管内的混合物,直至组织消化为透明絮状,加入含体积分数20%胎牛血清的DMEM培养基终止消化,颠倒混匀,1 000 r/min离心5 min后缓慢倒去上清,沉淀用500 μL完全培养基轻柔吹打,细胞悬液按1×106个/瓶的密度种于T25培养瓶中,置于37 ℃培养箱中培养。当细胞融合度达到80%-90%后加入1 mL PBS清洗1次,再加入1 mL 0.25%胰酶消化1 min,然后加入3 mL完全培养基终止消化并吹打细胞(注:在吹打过程中不能产生气泡),经1 000 r/min离心5 min后按1∶2比例传代,取第3-5代hPDLSCs进行进一步实验。
该研究的实施符合新疆维吾尔自治区人民医院的相关伦理要求(医院伦理批件号:KY2023121201)。
1.4.2 hPDLSCs的多向分化
(1)成脂诱导:将第3-5代细胞以2.5×104个/孔的密度接种到12孔板中,待细胞融合度达到80%时,弃去原有培养基,用PBS洗涤后更换为成脂诱导培养基(DMEM完全培养基中添加10 μmol/L地塞米松、10 μmol/L人胰岛素、0.5 mmol/L IBMX和200 μmol/L吲哚美辛),每隔3 d更换1次培养基,在显微镜下观察到孔内出现较多脂滴时(21 d左右),每孔加入500 μL 40 g/L多聚甲醛溶液固定30 min,PBS洗涤3次,加入油红O工作液染色
30 min,显微镜观察并拍照。
(2)成骨诱导:将第3-5代细胞以2×104个/孔的密度种植到12孔板中,待细胞融合度达到80%时,弃去原有培养基,用PBS洗涤后更换为成骨诱导培养基(DMEM完全培养基中添加50 μmol/L抗坏血酸、10 μmol/L地塞米松和10 mmol/L β-磷酸甘油钠),每隔3 d更换1次培养基,在显微镜下观察到有相当数量的骨钙化结节形成时(14 d左右),每孔加入1 mL PBS洗涤3次,再加入500 μL 40 g/L多聚甲醛溶液固定30 min,PBS洗涤3次,加入茜素红染色液染色3-5 min,PBS洗涤3次,保留最后1次的PBS在显微镜下观察并拍照。
1.4.3 hPDLSCs表面标志物的鉴定 取第3-5代hPDLSCs,用含体积分数2%胎牛血清的PBS重悬细胞洗涤2次,以1×109 L-1的细胞浓度分装至5个1.5 mL离心管中(每管500 µL),除阴性对照组外,其余每管分别加入5 µL CD34、CD90、CD105、CD146、HLA-DR鼠抗人单抗,避光孵育45 min,1 000 r/min离心5 min洗涤多余的抗体,弃上清后再次加入洗涤液离心,重悬细胞并上流式细胞仪检测。
1.4.4 OB-EXOs提取及鉴定 取第3-5代hPDLSCs接种在T25培养瓶中(1×106个/瓶),待细胞生长融合至80%左右时更换成无血清的成骨诱导培养基,诱导3 d后收集上清至离心管中。按照外泌体提取试剂盒的说明操作提取外泌体,以5 000 r/min离心10 min弃去悬浮的细胞以及细胞碎片,将上清过0.22 µm滤膜,再与EP Solution在4 ℃恒温摇床上孵育1 h,12 000 r/min离心15 min后得到OB-EXOs。透射电镜观察外泌体:将铜网置于滤纸上,吸取10 μL OB-EXOs滴加于铜网上静止3-5 min,在液滴边缘用滤纸吸去多余液体,稍干燥;滴加10 μL磷钨酸复染两三分钟,常温干燥数分钟,透射电镜观察。
外泌体特异性蛋白鉴定:将提取的OB-EXOs与蛋白上样缓冲液按5∶1的比例混合,在 95 ℃下孵育5 min使蛋白变性,制备10% SDS聚丙烯酰胺凝胶电泳分离胶和浓缩胶进行蛋白分离,将胶上的蛋白印迹到PVDF膜上(300 mA,2 h),完成转膜后将PVDF膜置于10%多脂奶粉37 ℃封闭1 h,加入按1∶2 000稀释的CD81、CD9以及TSG101抗体,4 ℃过夜孵育;将一抗回收后用1×TBST洗涤膜(10 min×3次),加入按1∶5 000稀释的辣根过氧化物酶标记的二抗,室温孵育1 h后再次用1×TBST洗涤膜(10 min×3次),滴加ECL化学发光试剂于化学发光成像系统中进行成像显影。
1.4.5 外泌体摄取实验 使用PKH26红色亲脂性染料标记OB-EXOs。按照说明书使用200 μL稀释液C重悬外泌体,加入5 μL PKH26混匀后避光静止5 min;加入800 μL 5% BSA溶液终止反应,离心弃上清,除去未结合的染料,用300 μL PBS重悬外泌体。取第3-5代hPDLSCs以2×104个/孔接种在12孔板中,细胞融合度达到80%时每孔加入100 μL PKH标记的OB-EXOs,37 ℃培养4 h,弃去培养基,每孔加入1 mL 40 g/L多聚甲醛溶液固定30 min,PBS洗涤3次,每孔加入200 μL DAPI染色15 min,PBS冲洗3次,每次5 min,荧光显微镜下观察并保存图像。
1.4.6 细胞分组及处理 取第3-5代hPDLSCs以2×104个/孔、接种在4个12孔板中,细胞融合度达到80%时,分为对照组、炎症模型组、外泌体组、炎症模型+外泌体组。对照组更换为成骨诱导培养基,外泌体组更换为含5 μg/mL OB-EXOs的成骨诱导培养基[3],炎症模型和炎症模型+外泌体组以1 μg/mL脂多糖处理24 h构建细胞炎症微环境[13],炎症模型组在脂多糖处理后更换为成骨诱导培养基,炎症模型+外泌体组在脂多糖处理后更换为含5 μg/mL OB-EXOs的成骨诱导培养基[3]。
1.4.7 细胞成骨分化检测 成骨诱导培养7 d后,弃去培养基,PBS洗涤,用40 g/L多聚甲醛溶液固定30 min,然后采用碱性磷酸酶染色试剂盒进行染色。成骨诱导培养21 d后,弃去原有的培养基,PBS洗涤,用40 g/L多聚甲醛溶液固定细胞30 min,加入1 mL PBS洗涤3次,加入0.2%茜素红S染色液进行染色,PBS洗涤,倒置显微镜观察并拍照。然后,使用Image J软件对各组的碱性磷酸酶染色和矿化结节染色相对面积进行定量分析。
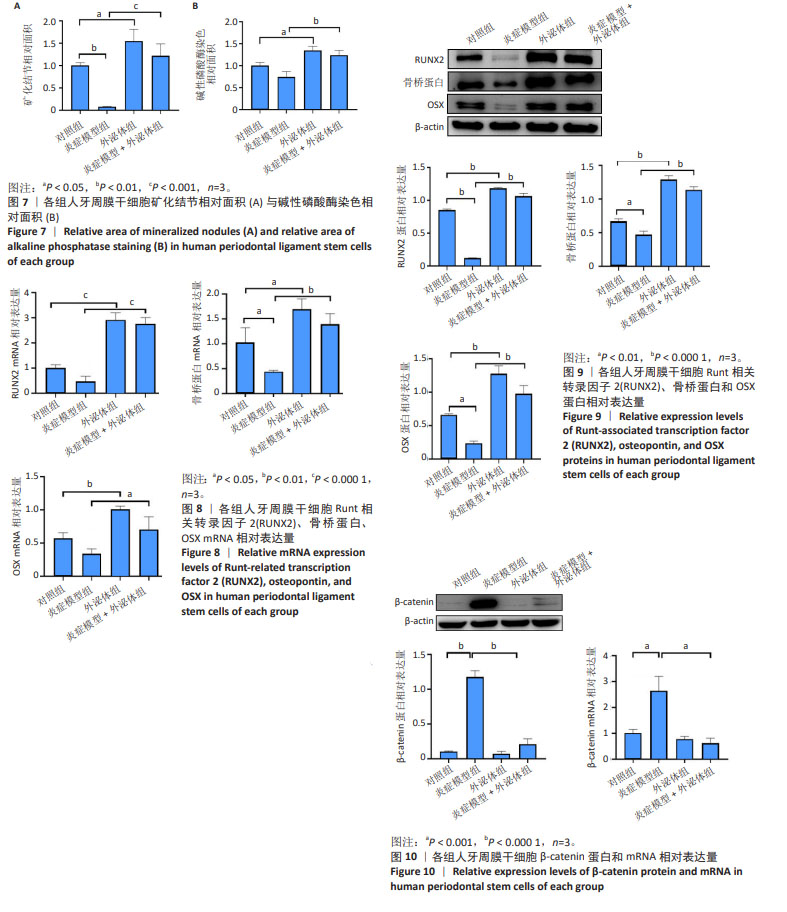
1.4.8 Western blot检测Runt相关转录因子2、骨桥蛋白、OSX以及wnt/β-catenin通路相关蛋白表达量 成骨诱导培养7 d后收集各组细胞,加入100 μL RIPA裂解液提取总蛋白,用BCA法测蛋白浓度,取15 μg蛋白95 ℃变性后进行凝胶电泳,然后电转至PVDF膜上,以10%脱脂奶粉封闭1 h,加入Runt相关转录因子2、骨桥蛋白、OSX、β-catenin、β-actin一抗(1∶2 000)4 ℃孵育过夜,次日,回收一抗后用1×TBST洗涤膜(10 min×3次),加入HRP标记的二抗(1∶5 000)室温孵育1 h,用1×TBST洗涤膜(10 min×3次),以化学发光试剂对各蛋白印迹显色,用Image J软件量化其灰度值。
1.4.9 qPCR检测Runt相关转录因子2、骨桥蛋白、OSX以及wnt/β-catenin通路相关mRNA表达量 成骨诱导培养7 d后收集各组细胞,使用Trizol提取细胞总RNA,Nanodrop进行浓度测定,利用Takara的反转录试剂盒进行反转录,然后进行荧光定量PCR反应,以GADPH基因对照,通过2-ΔΔCt算法分析各组基因的相对表达量。引物序列见表1。

1.5 主要观察指标 ①hPDLSCs鉴定结果;②外泌体鉴定结果;③hPDLSCs摄取外泌体结果;④在炎症微环境下OB-EXOs对hPDLSCs成骨分化的影响;⑤在炎症微环境下OB-EXOs对wnt/β-catenin通路的影响。
1.6 统计学分析 数据采用SPSS 26.0及GraphPad Prism 8软件进行统计学分析,多组间比较采用单因素方差分析,组间两两比较采用Tukey事后检验。P < 0.05为差异有显著性意义。文章统计学方法已经通过新疆维吾尔自治区人民医院生物统计学专家审核。
中国组织工程研究杂志出版内容重点:干细胞;骨髓干细胞;造血干细胞;脂肪干细胞;肿瘤干细胞;胚胎干细胞;脐带脐血干细胞;干细胞诱导;干细胞分化;组织工程