1.1 设计 随机对照动物实验。多组间的对比采用单因素方差分析(One-way,ANOVA)。
1.2 时间及地点 实验于2022年9-11月在上海中医药大学动物实验中心完成。
1.3 材料
1.3.1 实验动物 25只6-8周龄SPF级雌性SD大鼠,体质量120-140 g。购于上海斯莱克公司提供,生产许可证号:SCXK(沪)2022-0004。SD大鼠饲养在上海中医药大学实验动物中心特定的无病原体(SPF)环境中,并给予自由饮食、水、温度、光照时间。
所有动物实验均符合上海中医药大学实验动物伦理委员会动物伦理规范(伦理编号:PZSHUTCM220905001)。实验过程遵循了国际兽医学编辑协会《关于动物伦理与福利的作者指南共识》和本地及国家法规。实验动物在麻醉下进行所有的手术,并尽一切努力最大限度地减少其疼痛、痛苦和死亡。
1.3.2 试剂 PD173074(S1264,Selleck);注射用甲氨蝶呤粉剂(仁合熙德隆药业有限公司,批准文号:国药准字H20074231);免疫级牛Ⅱ型胶原蛋白、弗氏不完全佐剂(20022,7002,Chondrex);10%EDTA脱钙液(ST1149,Wabcan);改良番红固绿染色试剂盒、抗酒石酸酸性磷酸酶染色试剂盒(G1371,G1492,索莱宝);RIPA裂解液(WB0101)、BCA蛋白定量试剂盒(WB0123)、
SDS-PAGE凝胶配置试剂盒(WB0130)、5*SDS蛋白上样缓冲液(WB0133)、ECL超敏发光试剂盒(WB0164)、电泳液(WB0132)、转膜液(WB0154)、一抗稀释液(WB0158)、二抗稀释液(WB0159)、封闭液(WB0161)、彩色预染蛋白Marker(WB0173)、GAPDH内参(WB0197)、HRP标记抗兔/抗小鼠二抗(WB0177/WB0176)均为上海威奥生物科技有限公司产品;TBS 20X buffer、Tween-20 (H830KA1427,A100777-0500,上海生工);EDTA抗原修复液(MVS-0099,迈新);H2O2(73113760,沪试);苏木精染色液(南昌雨露);p-FGFR1 Tyr654 (341735,ZenBio);血管内皮生长因子A、TRAF2 (AF5131,AF5382,Affinity Biosciences);核因子κB受体活化因子配体(receptor activator of nuclear factor kappa B ligand,RANKL;23408-1-AP,Proteintech);vWF (ab287962,abcam);辣根过氧化物酶(HRP)标记的羊抗兔二抗(Jackson);DAPI染料(D9542,Sigma);Opal 520荧光染料、Opal 650荧光染料、1X Plus Manual Amplification Diluent (FP1487001KT,FP1496001KT,FP1498,Akoya);Permanent mounting medium(ZG0826,Vector);ImmPRESS HRP Goat Anti-Rabbit IgG Polymer Detection Kit (Vector Laboratories)。
1.3.3 仪器和设备 手动轮转式切片机、Leica DM3000显微镜(Leica);PerkinElmer Vectra3 platform(PerkinElmer);摇床(上海知楚仪器);小型垂直电泳槽、小型Trans-Blot转印槽(165-8001,170-3930,Bio-Rad);组织匀浆器(北京鼎昊源,TL-2010S);Micro-CT (平生医疗,VENUS 001型)。
1.4 实验方法
1.4.1 动物分组及给药 将25只大鼠采用完全随机法随机分为5组(每组5只):正常对照组、模型组、甲氨蝶呤组、PD173074低剂量组、PD173074高剂量组。正常组及模型组腹腔注射无菌PBS,甲氨蝶呤组按1.04 mg/kg剂量腹腔注射,根据前期预实验结果[3],PD173074低剂量组按5 mg/kg剂量腹腔注射,PD173074高剂量组按20 mg/kg剂量腹腔注射,1次/周。适应性饲养1周后,开始进行造模,每组大鼠给药4周后取材。
1.4.2 大鼠Ⅱ型胶原诱导关节炎模型的建立 将免疫级牛Ⅱ型胶原蛋白(2 mg/mL,溶解在0.05 mol/L醋酸中)与弗氏不完全佐剂等体积1∶1混合,Ⅱ型胶原最终质量浓度为1 mg/mL,使用高速搅拌器置于冰上乳化。异氟烷麻醉大鼠后进行乳液注射。适应性饲养1周后开始造模,初次免疫:记为第-7天,将200 µL乳液注射到大鼠尾部皮内进行一次免疫;再次免疫:记为第0天(同时开始进行临床评估),将200 µL乳液注射到小鼠背部的不同部位进行二次免疫。

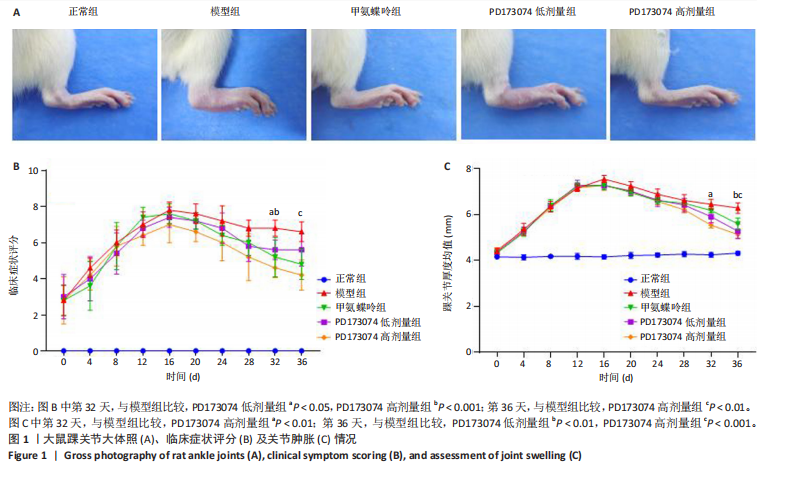
从第2次免疫后开始每4 d测量体质量、踝关节肿胀厚度以及关节症状评分。症状评分标准为:0分=没有发红或肿胀;1分=脚踝轻微肿胀或脚发红;2分=脚踝进行性肿胀、发炎和发红到脚的中间;3分=整个足部肿胀和发炎;4分=肿胀和整个足部发炎并丧失活动能力。最高评分为8分(每肢4分),取两爪之和作为关节评分。为了避免误差,在所有实验中都使用了相同的工具和标记位置。踝关节厚度测量使用数字游标卡尺,每只大鼠踝关节位置固定,标记并测量。
2次免疫后第7天进行大鼠踝关节评分,≥6分为成功建立胶原诱导性关节炎大鼠模型。各组大鼠间评分无统计差异,开始进行动物给药,每周给药1次,给药4周。在第4周末对大鼠禁食,于次日麻醉大鼠后取材。将肝脾肾用PBS冲洗后,吸水纸吸去水分并称质量。大鼠双侧下肢、肝、脾和肾置于40 g/L多聚甲醛固定48 h,将左下肢置于体积分数70%乙醇中,进行Micro-CT检测,右踝关节放入10% EDTA脱钙液于摇床上脱钙45 d,每隔3 d更换1次脱钙液。脱钙结束后冲洗标本,置于组织包埋盒中。分别将内脏及右侧踝关节标本置于自动组织脱水机进行梯度脱水处理,并用石蜡包埋,石蜡切片机进行连续切片,每张切片厚度为4 μm。
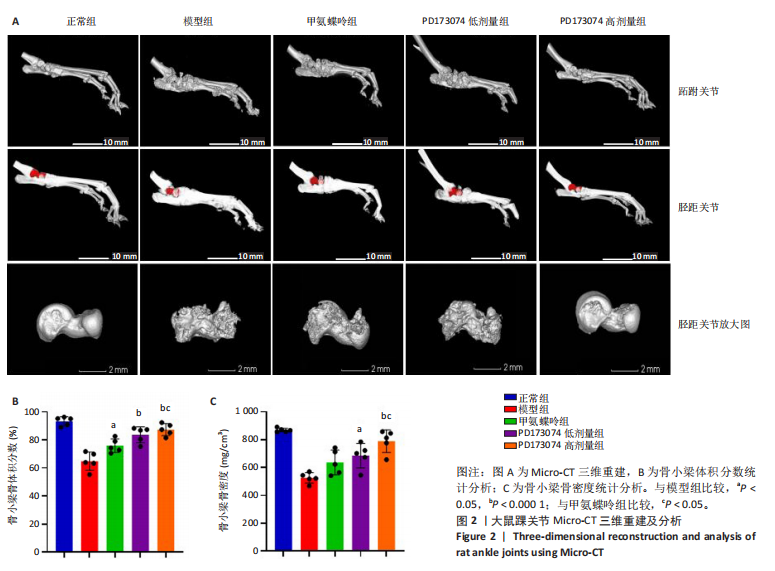
1.4.3 Micro-CT检测及分析 利用Micro-CT对大鼠左下肢踝关节进行扫描,设置参数如下:分辨率12 μm,10帧/s,电压90 kV,电流0.07 mA。重建和分析使用
Avatar 3软件进行,采用Feldkamp-Davis-Kress (FDK) 算法进行重建。对每个踝关节得到的参数进行计算并统计分析,Tb.BV/TV表示骨小梁体积与组织体积之比,Tb.BMD表示骨小梁骨密度。
1.4.4 组织病理染色及分析
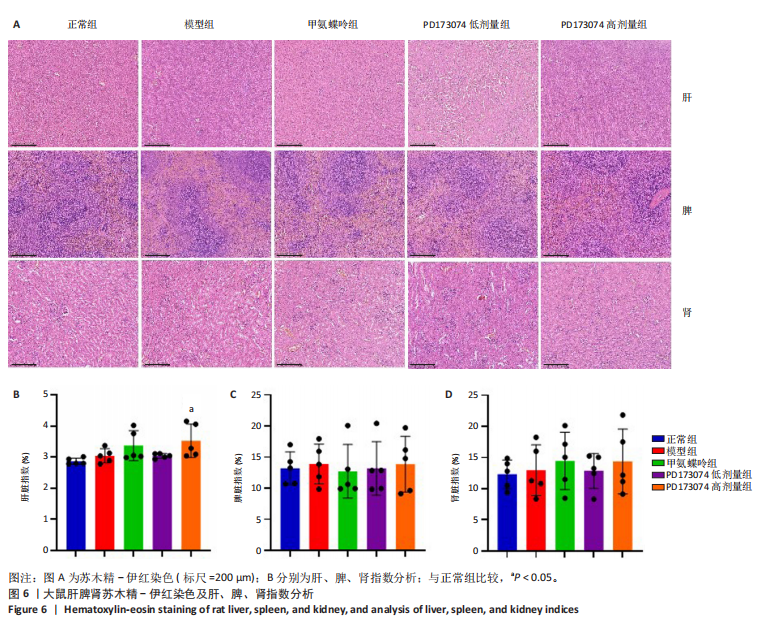
(1)苏木精-伊红染色:将石蜡切片在60 ℃烘箱中烘烤一两个小时,置于二甲苯和梯度体积分数的乙醇(100%,95%,80%,75%)进行脱蜡至水,水清洗3遍;将切片于苏木素染液中染色5 min,水洗,再于盐酸乙醇中分化一两秒,水洗3遍;在氨水中返蓝1 min并再次用水洗3遍;随后置于体积分数95%乙醇中平衡,于伊红染液中反应
8 s,先后置于体积分数95%,100%乙醇中浸泡2 min,二甲苯中浸泡45 s透明,在通风橱中晾干2 h。中性树脂封固,干燥过夜,光学显微镜下进行观察和拍照。
(2)番红固绿染色:常规脱蜡至水,加入配制好的Weigert染液染色3-5 min,水洗;置于酸性分化液中分化15 s,蒸馏水洗10 min;在固绿染色液内浸染5 min,用弱酸溶液洗涤10-15 s,室温自然晾干;加入番红染色液内浸染5 min;先后置于体积分数95%乙醇两三秒、无水乙醇两三秒,无水乙醇1 min,二甲苯透明,中性树脂封固,干燥过夜,显微镜观察、拍照。
(3)抗酒石酸酸性磷酸酶染色:石蜡切片常规脱蜡至水,自然晾干,加入TRAP固定液2-8 ℃固定1 min,水洗3遍,稍微晾干(不宜过分干燥)。将切片置于TRAP 孵育液中,转移至37 ℃恒温箱中,染色45-60 min,水洗。置于苏木素染色液染色5-8 min。水洗、晾干、中性树脂封固,显微镜下观察、拍照。
(4)多色荧光染色:采用酪酰胺信号放大技术,即TSA(Tyramide signal amplification)技术,按照制造商的说明进行多色染色。简而言之,按照脱蜡至水、高温修复、组织内源过氧化物酶封闭、血清封闭等流程进行。所有一抗在4 ℃下孵育过夜;二抗及血清封闭用ImmPRESS HRP Goat Anti-Rabbit IgG Polymer Detection试剂盒,按说明操作;DAPI用于标记细胞核。使用PerkinElmer Vectra3平台扫描玻片,Image J软件半定量分析阳性区域所占的比例,每张组织随机选取5个视野。
(5)滑膜炎症评分:采用Krenn滑膜炎评分系统[14],滑膜的组织学变化分为0-9级,包括衬里层增生分项(0-3分)、炎症浸润分项(0-3分)和滑膜基质激活分项(0-3)。软骨侵蚀的评估基于Douni等[15]描述的评分系统(0-3级),该系统评估软骨表面被侵蚀的百分比(0=无侵蚀,1=轻度侵蚀[1%-10%],2=中度侵蚀[11%-50%],2=重度侵蚀[51%-100%])。
1.4.5 计算大鼠肝、脾、肾指数 测量大鼠肝脏、脾脏、肾脏的质量,计算出大鼠肝脾肾质量与各自体质量的比值×100%,分别得到肝脏指数、脾脏指数和肾脏指数。
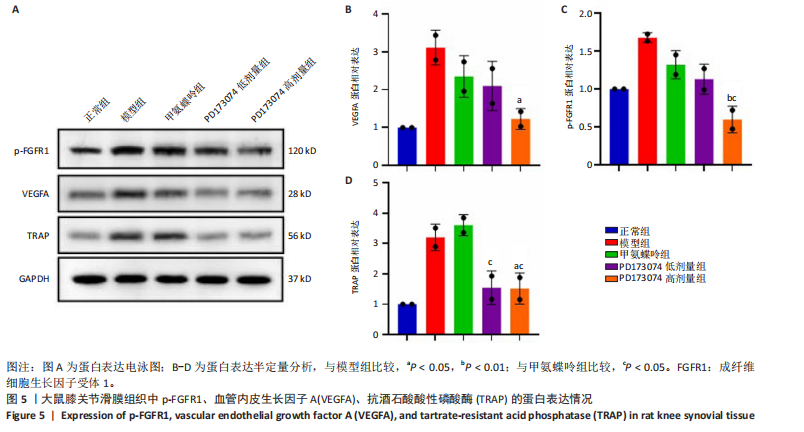
1.4.6 Western blot检测 滑膜组织破碎后加入RIPA裂解液(含蛋白酶及磷酸酶抑制剂),用BCA法测定蛋白浓度。配胶、上样,70 V恒压电泳,约30 min,当指示剂溴芬蓝进入分离胶后改用90 V恒压电泳,200 mA恒流转膜90 min,5%BSA室温封闭2 h,TBST洗膜,分别加入一抗稀释液稀释的抗体:p-FGFR1(1∶500)、血管内皮生长因子A(1∶700)、抗酒石酸酸性磷酸酶(1∶500)和GAPDH(1∶2 000),4 ℃孵育过夜。第二天,TBST洗膜5 min×3次,辣根过氧化物酶(HRP)标记的羊抗兔二抗(1∶2 000);辣根过氧化物酶(HRP)标记的羊抗小鼠二抗(1∶2 000),室温孵育2 h。TBST洗膜15 min×3次。膜于化学发光检测试剂(试剂A∶试剂B=1∶1)反应2 min,在全自动成像分析仪下进行曝光成像。Western blot的条带使用Image J软件进行统计分析。
1.5 主要观察指标 ①大鼠临床症状以及关节肿胀情况;②踝关节Micro-CT三维重建及分析;③踝关节病理观察;④关节周围血管生成情况及RANKL的表达;⑤滑膜中p-FGFR1、血管内皮生长因子A、抗酒石酸酸性磷酸酶表达;⑥肝、脾、肾病理变化及肝脾肾指数分析。
1.6 统计学分析 统计分析和制图采用GraphPad Prism (V9.4.1)软件。多组间的对比采用单因素方差分析
(One-way,ANOVA),P < 0.05 为差异有显著性意义。在进行ANOVA之前,采用 Shapiro-Wilk 检验是否符合正态分布。符合正态分布的实验数据用x±s进行统计描述。文章统计学方法已经上海中医药大学医学生物统计学专家审核。