1.1 设计 材料的合成与表征,体外细胞学实验。
1.2 时间及地点 实验于2022年6月至2024年6月在苏州大学附属第一医院骨科研究所完成。
1.3 材料
1.3.1 主要试剂与仪器 ZLN005、白细胞介素1β(MCE公司);F127、1,3,5-三甲苯(Sigma-Aldrich 公司,美国);二甲基亚砜(阿拉丁,中国);PBS、胎牛血清、DMEM/F12培养基、青-链霉素双抗(Thermo公司);CCK-8(新赛美公司);Ⅱ型胶原蛋白、聚集蛋白多糖、基质金属蛋白酶13、基质金属蛋白酶3、SOX9、血小板反应蛋白解整合素金属肽酶5(a disintegrin and metalloproteinase with thrombospondin motifs-5,ADAMTS5)、β-Actin抗体(Abcam公司);细胞活死试剂盒、封闭液(碧云天公司);盐酸多巴胺、Ⅱ型胶原酶(Merck公司);a-MEM培养基(Hyclone,美国);酶标仪(BioTek);动态光散射仪器(Regulus 8230,日本);扫描电子显微镜(Sigma 300,美国);透射电子显微镜(Tecnai G2 20 TWIN,美国);紫外可见光分光光度计(SHIMADZU,日本);倒置荧光显微镜(Olympus Corporation,日本);PCR仪(Bio-Rad公司)。
1.3.2 实验动物 1周龄C57BL/6J小鼠10只,购自苏州大学动物中心,许可证号:SYXK(苏)2022-0042。小鼠饲养于标准环境中,室温26 ℃,湿度约55%,每天光照 12 h,自由活动,自主进食。实验方案已通过苏州大学伦理委员会批准(批准号:SUDA 202307A0052)。
1.4 实验方法
1.4.1 软骨细胞培养 将小鼠置于过量二氧化碳环境中进行安乐死,消毒后放置在无菌铺巾上,剥离小鼠腿部外侧皮肤,取出髋关节和膝关节内的软骨,放入培养皿中,用含10%青霉素-链霉素的PBS清洗2次,再用PBS清洗2次。将软骨组织置入0.25%Ⅱ型胶原酶溶液中消化4 h,通过细胞筛过滤,1 000 r/min离心5 min后弃去上清液,将细胞沉淀均匀分配到3个培养皿中,加入a-MEM完全培养基(含体积分数10胎牛血清与1%青霉素-链霉素)培养[20]。根据生长情况进行传代,后续实验使用第4代软骨细胞。
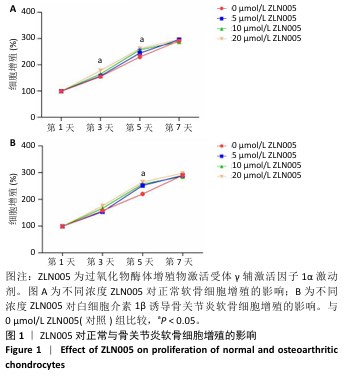
1.4.2 ZLN005对正常与骨关节炎软骨细胞增殖的影响 ZLN005对正常软骨细胞增殖的影响:将软骨细胞以1 000个/孔的密度种植于96孔板内,分别加入0(对照),5,10,20 μmol/L ZLN005,培养1,3,5,7 d后弃去原培养基,使用PBS清洗1次,加入100 μL无血清a-MEM培养基和10 μL CCK-8溶液继续孵育2 h,使用酶标仪在450 nm波长下测定吸光度值,计算细胞增殖率。细胞增殖率=(实验组吸光度值-空白组吸光度值)/(对照组吸光度值-空白组吸光度值)×100%。空白组仅加入培养基,无细胞、无药物干预。
ZLN005对骨关节炎软骨细胞增殖的影响:将软骨细胞以1 000个/孔的密度种植于96孔板内,加入10 ng/mL白细胞介素1β培养6 h后,分别加入0(对照),5,10,20 μmol/L ZLN005,培养1,3,5,7 d后弃去原培养基,使用PBS清洗1次,加入100 μL无血清a-MEM培养基和10 μL CCK-8溶液继续孵育2 h,使用酶标仪在450 nm波长下测定吸光度值,计算细胞增殖率。
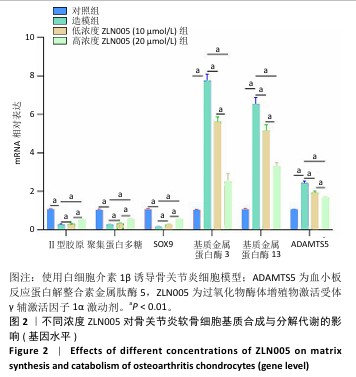
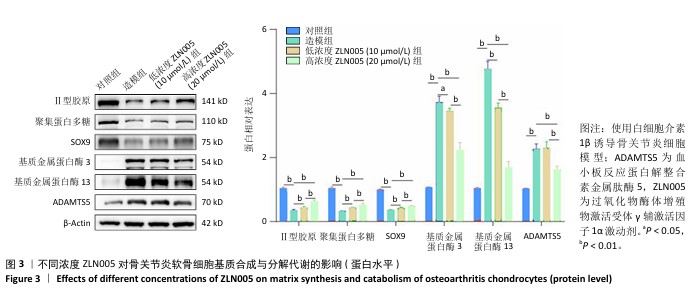
1.4.3 ZLN005对骨关节炎软骨细胞基质合成与分解代谢的影响 将软骨细胞以2×105/孔的密度种植于24孔板内,分4组干预:对照组不进行任何干预,造模组加入10 ng/mL白细胞介素1β干预12 h,低、高浓度ZLN005组加入10 ng/mL 白细胞介素1β干预6 h后分别加入10,20 μmol/L ZLN005干预6 h。
RT-qPCR检测:干预结束后,使用总RNA快速提取试剂盒提取细胞内总RNA,根据反转录试剂盒说明合成cDNA,利用SYBR Green Supermix试剂盒进行基因扩增(95 ℃3 min,95 ℃10 s,60℃30 s,循环40次),检测基质合成基因(聚集蛋白多糖、Ⅱ型胶原蛋白与SOX9)与基质降解基因(基质金属蛋白酶13、基质金属蛋白酶3和ADAMTS5 mRNA表达。相关引物见表1。
Western Blot检测:干预结束后,每孔加入150 μL含有磷酸酶和蛋白酶抑制剂的裂解液裂解10 min。将裂解液转移至EP管中,使用刮刀轻轻刮取细胞以确保完全收集,使用BCA法测定蛋白浓度。蛋白样品经处理后进行上样、电泳、跑胶与转膜,转膜后用洗涤液清洗膜3次,用封闭液封闭膜15 min。加入针对目标蛋白(聚集蛋白多糖、Ⅱ型胶原蛋白、SOX9、基质金属蛋白酶3、基质金属蛋白酶13、ADAMTS5、β-Actin,稀释比例均为1∶3 000)的一抗于4 ℃孵育过夜,使用洗涤液清洗膜3次;加入相对应的兔或鼠二抗(稀释比例1∶1 000)避光孵育,使用暗室显影观察蛋白条带,利用Image J软件进行灰度值分析。
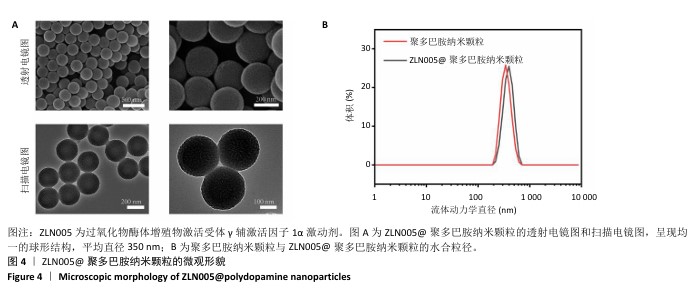
1.4.4 介孔ZLN005@聚多巴胺纳米颗粒的制备及表征 将200 mg F127溶解于10 mL水和10 mL乙醇混合溶液中,置于25 ℃搅拌至完全溶解;加入0.2 mL 1,3,5-三甲苯溶液(0.5 mg/mL),继续搅拌一段时间;加入100 mg多巴胺和1 mL氨水,搅拌反应4 h;12 000 r/min离心5 min后弃上清,重复3次,真空干燥(40-70 ℃,12 h)得到聚多巴胺纳米颗粒。称量10 mg ZLN005溶解于1 mL二甲基亚砜中,制备ZLN005溶液;将ZLN005溶液加入1 mL聚多巴胺纳米颗粒溶液(20 μg/mL,溶剂为PBS,pH=7.4)中,避光条件下搅拌24 h;13 000 r/min离心120 min后弃上清,重复3次,使用超纯水分散产物,得到ZLN005@聚多巴胺纳米颗粒溶液。
纳米颗粒形貌表征:取少量ZLN005@聚多巴胺纳米颗粒溶液,用铜网载玻片轻轻吸附,氮气轻轻吹干,确保样品不被污染。将样品放入透射电子显微镜设备中,选择合适的加速电压进行观察(一般80-200 kV),根据需求选择高分辨率成像模式。采用扫描电子显微镜观察样品形貌。将聚多巴胺纳米颗粒、ZLN005@聚多巴胺纳米颗粒分别分散在去离子水中,确保均匀分散,将样品置入动态光散射仪器中,测量溶液中颗粒的光散射强度随时间的变化;根据动态光散射分析结果得到粒径分布曲线,推算出水合粒径和多分散度指数。
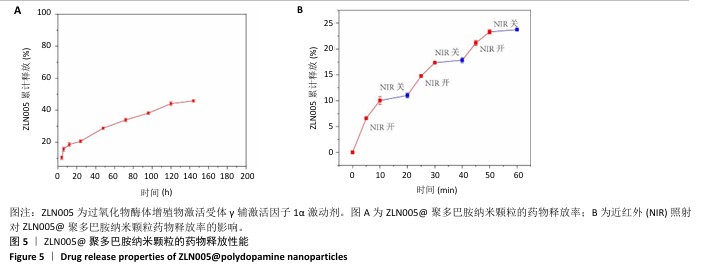
纳米颗粒的药物释放性能检测:称取10 mg ZLN005@聚多巴胺纳米颗粒置入10 mL PBS(pH=7.4)中,通过超声使之均匀分散;将ZLN005@聚多巴胺纳米溶液转移到透析袋或类似设备中,密封好并放入装有PBS的容器中,在室温条件下摇晃孵育。于4,8,12,24,48,72,96,128,144 h分别取出1 mL PBS,通过紫外可见光分光光度法测定ZLN005浓度,计算累计释放率。另外,增加近红外照射,在10-20 min打开近红外仪器,然后关闭;在30-40 min打开近红外仪器,然后关闭;在50-60 min打开近红外仪器,然后关闭。于5,10,20,25,30,40,45和50 min时分别取出1 mL PBS,通过紫外可见光分光光度法测定ZLN005浓度,计算累计释放率。
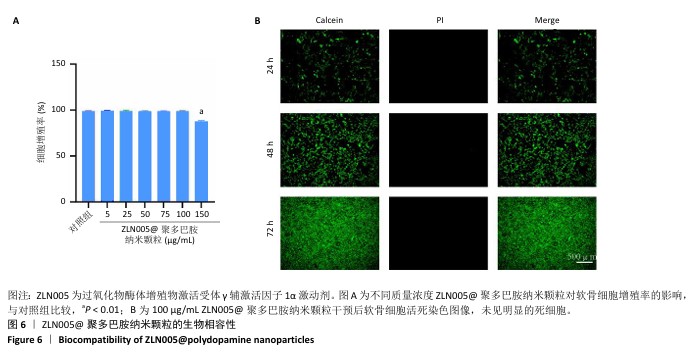
1.4.5 ZLN005@聚多巴胺纳米颗粒的生物相容性 将软骨细胞以9×105/孔的密度种植于6孔板内,分别加入0(对照),5,25,50,75,100,150 μg/mL ZLN005@聚多巴胺纳米颗粒。培养72 h后弃原培养基,更换为含10%CCK-8的无血清DMEM/F12培养基孵育1 h,使用酶标仪在450 nm波长下测定吸光度值,计算细胞增殖率。24,48,72 h后,选取150 μg/mL ZLN005@聚多巴胺纳米颗粒干预组进行钙黄绿素乙酰甲氧基(calcein-AM)和碘化丙啶(PI)染色30 min,用PBS冲洗细胞2次,通过倒置荧光显微镜观察细胞活死染色结果。
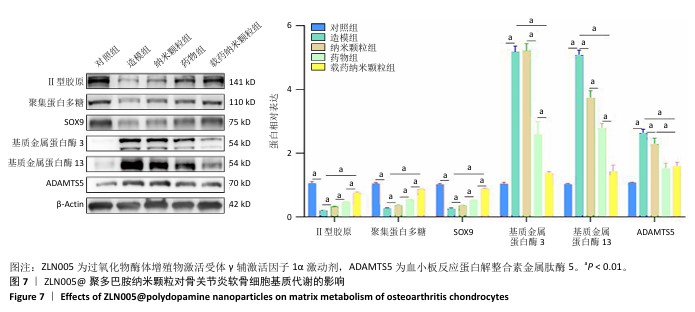
1.4.6 ZLN005@聚多巴胺纳米颗粒对骨关节炎软骨细胞基质代谢的影响 将软骨细胞以9×105/孔的密度种植于6孔板内,分5组干预:对照组不进行任何干预,造模组加入10 ng/mL白细胞介素1β,纳米颗粒组加入10 ng/mL白细胞介素1β干预6 h后加入20 μg/mL聚多巴胺纳米颗粒,药物组加入10 ng/mL白细胞介素1β干预6 h后加入20 μmol/L ZLN005,载药纳米颗粒组加入10 ng/mL白细胞介素1β干预6 h后加入20 μg/mL ZLN005@聚多巴胺纳米颗粒。干预24 h后,Western Blot检测细胞外基质相关蛋白(聚集蛋白多糖、Ⅱ型胶原蛋白、SOX9、基质金属蛋白酶3、基质金属蛋白酶13和ADAMTS5)的表达,检测方法同上。
1.5 主要观察指标 ZLN005对骨关节炎软骨细胞增殖、基质合成与分解代谢的影响,ZLN005@聚多巴胺纳米颗粒的生物相容性及对骨关节炎软骨细胞基质代谢的影响。
1.6 统计学分析 采用SPSS 13.0软件进行统计分析,各项数据以均值±标准误表示。多组间比较采用单因素方差分析,两组间比较采用t检验。P < 0.05为差异有显著性意义。文章统计学方法已经通过苏州大学生物统计学专家审核。