2.1 运动促进周围神经损伤恢复的历史研究进展 20世纪初,医护人员注意到运动对于康复的积极影响,早期的研究及应用主要集中在肌肉力量和关节灵活性的改善方面,而对于神经损伤的具体效应还未被深入研究。1942年,HINES等通过对比大鼠的肌肉肌酸含量以及肌肉质量,发现活动可提高周围神经麻痹的恢复速度和程度[7]。有氧运动作为一种常见的运动方式,被广泛研究其对周围神经损伤康复的影响,1974年,HERBISON等[8]通过观察大鼠的神经组织学形态,认为高强度游泳(每天2 h)不能促进再神经支配肌肉的修复,在再神经支配的早期阶段高负荷运动可能是危险的。运动方式是有氧运动在康复中的研究热点之一。2017年,ARBAT-PLANA等[9]探索了强迫、被动和自愿运动对周围神经损伤的影响,发现运动强度是防止轴突断裂后运动神经元突触剥离的关键因素,而不是运动方式。也有有氧运动的临床应用及转化研究,2003年,MENNEN[10]发现人类在神经损伤术后进行感觉再训练和运动收缩练习后的功能恢复效果更好。相对于有氧运动而言,镜像运动研究及应用提出较晚,1996年,RAMACHANDRAN等[11]首次在截肢后出现幻肢痛的患者中使用镜像运动训练;2008年,SELLES等[12]通过对2例周围神经损伤患者的研究发现,镜像运动可以明显减轻患者的灼痛感。血流限制运动在肌肉骨骼损伤或运动训练中的研究较多,1973年,佐藤等使用血流限制方法结合等长收缩训练减轻了失用性肌萎缩程度[13],近年来此方法也逐渐应用到航天领域当中;2021年,YASUDA等[14]将血流限制运动应用到了周围神经损伤患者当中并发现增强了运动功能,见图3。
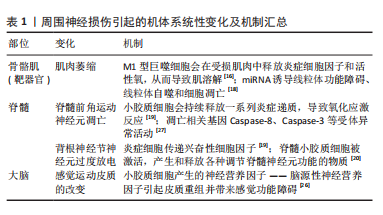
2.2 周围神经损伤引起的系统性机体变化 周围神经损伤会造成靶器官、脊髓、大脑的系统性病理变化。当周围神经损伤引起Waller变性后,近端段形成生长锥体,开始轴突再生。增殖的施万细胞形成Bungner带[6],引导新萌发的轴突生长。但是,自发恢复的过程缓慢而复杂,在人类中,轴突再生几乎以每天1 mm的速度发生,损伤区域的轴突再生速度要慢得多,使目标器官长期处于失

神经支配状态,造成支配肌肉萎缩。先前的一项研究表明,周围神经损伤使骨骼肌的横截面积在2个月内减少70%[15],同时周围神经损伤还常引起感觉的障碍。感觉受体可分为机械感受器、温度感受器和伤害性感受器,周围神经损伤可以引起感觉受体萎缩,继发感觉丧失。对于周围神经损伤后产生的骨骼肌萎缩变化,其相关机制相对复杂,周围神经损伤后,受影响肌肉远端的不同 Toll 样受体和NOD样受体会识别到损伤相关分子模式的不同部分[16],导致分泌大量炎症趋化因子,并刺激促炎基因的转录表达或进一步诱导无菌性炎症反应,导致局部肌肉进一步受伤。大量实验表明,免疫细胞介导的炎症反应是造成继发性损伤的主要原因。M1(促炎型巨噬细胞) 会在受损肌肉中释放炎症细胞因子和活性氧,从而导致肌溶解[17]。利用细胞因子(如白细胞介素10)激活M1型巨噬细胞转化,可以减轻肌肉的这种病理变化。在单侧坐骨神经横断的动物模型中,观察到线粒体数量显著减少和线粒体自噬激活,RNA测序结果证实miRNA-142a-5p在萎缩性腓肠肌中表达上调[18],表明 miRNA-142a-5p诱导线粒体功能障碍、线粒体自噬和细胞凋亡,是去神经诱导的骨骼肌萎缩的重要调节因子。
周围神经损伤会诱导脊髓发生一系列的病理性变化。神经损伤引起运动神经元胞体与其骨骼肌靶向断开,导致小胶质细胞的招募和激活。脊髓小胶质细胞是中枢神经系统中的一种常驻免疫细胞,在慢性炎症过程中,小胶质细胞会持续释放一系列炎症递质,导致氧化应激反应,这会引起脊髓前角运动神经元的凋亡[19]。此外,脊髓中的小胶质细胞会产生和释放各种调节脊髓神经元功能的物质,其中脑源性神经营养因子被证明可以使背角神经元过度兴奋,最终导致疼痛过敏[20]。周围神经损伤引起的炎症反应通常会导致感觉神经节神经元过度放电。周围神经损伤后的感觉神经节中检测到大量炎症细胞,包括白细胞、神经胶质细胞、T淋巴细胞等,即使原来的周围神经得到恢复,这些炎症细胞仍会继续传递兴奋性细胞因子,从而导致感觉障碍。同时有研究表明,周围神经损伤后,脊髓背角中的星形胶质细胞会增殖[21],导致神经元坏死,抑制星形胶质细胞的增殖可以防止神经元丢失并防止向感觉异常的过渡[22]。
同时,周围神经损伤与皮质可塑性也有潜在关系,神经损伤后皮质功能重组的快速过程已在多项神经科学和神经影像学研究中报道。MRI成像是观察皮质重组的有效方法,在大鼠正中神经损伤模型中观察到损伤后患肢早期感觉区域扩大,后期缩小[23];在人体中发现,周围神经损伤和肢体制动可以导致受影响的主要运动和躯体感觉区域的皮质厚度减少[24],此外,截肢后在初级感觉运动皮质可以清楚地检测到局部皮质重组。使用脑电分析非周围神经损伤和周围神经损伤人群在感觉皮质区域的α波段和β波段功率衰减程度,发现对于周围神经损伤受试者来说,只有在强刺激下他们的患侧比健侧对触觉刺激的敏感性更高,而健康受试者左右脑对于感觉刺激的反应无明显差异[25]。有研究表明,在整个大脑皮质特别是在初级体感皮质(S1)中,从小胶质细胞中耗尽脑源性神经营养因子可以减少树突棘重建和皮质锥体神经元的过度活动,以及雄性小鼠的机械性痛觉异常,这些发现证明,小胶质细胞产生的脑源性神经营养因子不仅在脊髓当中引起神经元过度兴奋,在大脑皮质当中也会有相似的机制,从而导致大脑皮质的重组并最终导致感觉功能障碍[26]。
周围神经损伤引起的机体系统性变化及机制汇总,见表1。
研究表明,不同类型的运动对神经修复有不同影响。常见的促进周围神经再生运动方式包括有氧运动、血流限制运动、镜像运动等,然而其促进周围神经恢复的原理也各不相同。
2.3 有氧运动对周围神经损伤的影响 关于有氧运动对轴突再生的有效性存在着相互矛盾的结果,还没有应用标准化的治疗方法,特别是在计划的强度、持续时间和开始运动的时间选择上存在差异。
2.3.1 有氧运动在周围神经损伤中的应用 一些研究一致认为,早期运动计划促进了动物的轴突再生反应[28]。有研究探索了不同运动方案对大鼠比目鱼肌神经支配及周围神经损伤再生后恢复的影响,发现间歇性中等强度跑步机训练增强了比目鱼肌神经支配,而缓慢的连续跑步方案会恶化功能结果[28]。BARHAM等[29]认为大鼠坐骨神经移植后的跑步机训练不会改变肌肉神经再支配的准确性,但是发现在损伤前进行跑台训练的大鼠术后功能恢复更好。因此,推测长时间坚持体育锻炼的人与无运动习惯的人相比,能够在周围神经损伤后有更好、更快速的功能改善。综上所述,周围神经损伤后跑台运动的不同参数以及介入时间仍然是值得深入研究的问题。
2.3.2 有氧运动对周围神经损伤的影响机制 有氧运动通过增强机体的血液流速、改善氧气供应、促进神经营养因子释放、激活神经元,能够对靶器官、脊髓、大脑均产生改善作用,可以系统性促进损伤恢复、改善功能水平。具体各部位变化见表2。
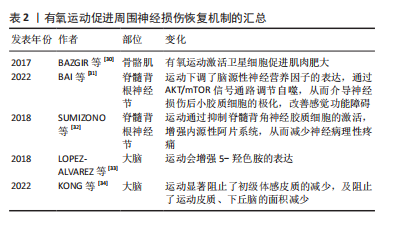
关于有氧运动促进机体系统性变化的相关研究主要集中在有氧运动对免疫反应、神经胶质细胞、神经营养因子的影响这几个方面。
有氧运动对神经免疫的作用:有大量研究一致表明,有氧运动对创伤性周围神经损伤的神经免疫反应具有显著的促进作用[35]。创伤性周围神经损伤会破坏内源性生物电环境的动态平衡,导致生物电场的产生,这一过程引导着巨噬细胞向损伤部位迁移[36]。研究表明,有氧运动能够显著促使巨噬细胞从促炎状态极化到抗炎状态,进而降低促炎细胞因子的水平,减少周围神经损伤后的不良反应[37]。在创伤性周围神经损伤后,损伤部位常常会释放大量的促炎细胞因子。针对这一现象,研究者对有氧运动对神经中促炎细胞因子和抗炎细胞因子的影响进行了深入研究,他们发现在有氧运动后肿瘤坏死因子α的水平显著降低,这一发现提示了有氧运动在调节抗炎免疫反应中的重要作用[38]。因此,有氧运动通过调节巨噬细胞的极化状态以及对肿瘤坏死因子α的调控,发挥着重要的抗炎作用。这些研究成果为运动康复在周围神经损伤治疗中的应用提供了理论基础,也为开发针对性的康复方案提供了重要参考。
有氧运动对神经胶质细胞的影响并进一步改善疼痛过敏:周围神经损伤后脊髓中被激活的小胶质细胞释放脑源性神经营养因子,而脑源性神经营养因子水平的增加会影响γ-氨基丁酸介导的神经元抑制过程,从而产生感觉过敏[39]。而在有氧运动后,小鼠脊髓背角的脑源性神经营养因子表达下调[40](图4),小胶质细胞活化逆转,并且运动训练后自噬通量增加;鞘内注射脑源性神经营养因子可显著抑制自噬,触发脊髓小胶质细胞M1极化,加重痛觉过敏。此外,脑源性神经营养因子通过AKT/mTOR途径
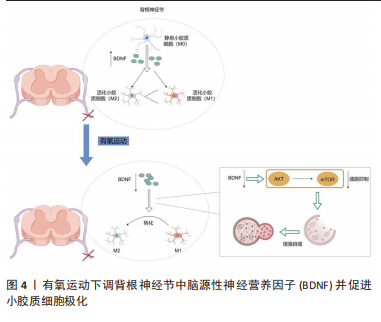
调节自噬,从而参与运动训练介导的神经损伤后小胶质细胞的极化[31]。因此得出结论,运动训练可以有效缓解小鼠的疼痛相关行为。此外,运动训练减少了神经损伤后脊髓背角脑源性神经营养因子的表达,逆转了痛觉过敏。有研究发现,有氧运动后星形胶质细胞标志物胶质纤维酸性蛋白水平有所下降[32]。综上所述,有氧运动似乎对促进神经胶质细胞自噬有积极的影响。在大脑中发现运动会增强5-羟色胺的表达[33],5-羟色胺是一种对情绪、睡眠、脑功能影响较大的神经递质,传递大脑之间的信息,同时也被认为与周围神经损伤后的镇痛机制有关。
有氧运动对神经营养因子的影响:有氧运动诱导细胞适应,增加线粒体容量,增加神经营养因子的表达[41]。生长因子是控制细胞功能各个方面的蛋白质,涉及生存、增殖、迁移和分化。脑源性神经营养因子是哺乳动物家族中研究最广泛的神经营养因子之一[42],然而对于有氧运动引起机体脑源性神经营养因子变化的说法并不一致,在人体模型实验中,大部分实验结果证明有氧运动会导致脑源性神经营养因子血药浓度的升高[43-46],但也有一少部分实验结果呈现出有氧运动后血液中脑源性神经营养因子减少或浓度不变的现象[47-50]。而脑源性神经营养因子的变化趋势似乎也和性别相关,有研究发现与对照组相比,有氧运动增加了男性患者脑源性神经营养因子的水平,降低了女性患者的脑源性神经营养因子水平[51]。相关研究发现,雄激素可以调节运动神经元中的脑源性神经营养因子及其受体TrkB,运动引起睾酮水平上调,这种上调是持续的,并可能导致脑源性神经营养因子和TrkB表达持续时间延长。对于动物实验,大部分结果也证明了在有氧运动后脑源性神经营养因子的血药浓度升高[52-54]。
以上的结果均是对人体或动物的血液样本进行分析,并没有观察运动前后不同解剖位置的免疫细胞及神经生长因子的含量。研究人员发现,有氧运动组动物感觉神经节中的神经营养因子水平较低,尤其是脑源性神经营养因子蛋白与mRNA水平显著降低[40],鉴于神经损伤后背角脑源性神经营养因子的上调与促炎反应和痛觉过敏增强有关,这些发现表明神经营养因子水平在运动后恢复正常,从而产生抗炎反应。同样,与对照组相比,运动组动物的脊髓脑源性神经营养因子水平显著降低,脊髓中活化的小胶质细胞在神经损伤时会释放脑源性神经营养因子等分子,从而影响γ-氨基丁酸介导的神经元抑制过程,促进感觉功能障碍, 因此,在运动动物中发现的较低脑源性神经营养因子水平意味着有氧运动的有益效果[38]。针对运动对大脑中脑源性神经营养因子含量影响的相关研究证明,运动似乎没有改变大脑中脑源性神经营养因子的含量,但是发现5-羟色胺及其受体的mRNA表达显著增加[33], 增强的5-羟色胺能神经传递是通过促进背角的下行抑制过程来促进运动诱导感觉功能改善、减轻疼痛过敏的机制之一。有研究发现,运动组动物肌肉中的脑源性神经营养因子水平显著升高[55],有氧运动后肌肉中脑源性神经营养因子水平升高被认为是神经损伤后肌肉再神经支配过程的重要组成部分。此外,运动导致的体内神经生长因子含量变化也取决于运动的类型、强度和持续时间,以触发不同的细胞内信号通路[33]。
2.4 血流限制运动对周围神经损伤的影响 血流限制运动是通过充气袖带或弹性绷带等特殊装置对肢体近端施加外部压力的方式,减少血流引起机体缺血,增加快肌纤维的募集,增多骨骼肌局部激素的释放以及骨骼肌细胞产生,达到增强肌力的效果,常用于运动员的增肌训练。
2.4.1 血流限制运动在周围神经损伤中的应用 血流限制运动的压力参数对肌肉的生理反应和训练适应非常重要,这需要考虑袖带的材质、宽度以及施加的压力值。
MENDONCA等[56]通过观察H波和M波潜伏期的差异来估计神经传导情况,发现在血流限制运动压力为60%AOP或80%AOP(AOP,完全限制动脉血流所需的最低压力)的情况下进行低强度运动,不会对坐骨神经、胫神经功能产生负面影响。因此,从神经学的角度来看,低强度血流限制运动可以被视为抗阻训练的安全模式。一名钢琴家在经历车祸后存在上肢残留的神经症状[14],在进行血流限制运动之前至少5年没有进行阻力训练,研究人员在其上臂施加130-170 mmHg的压力,发现钢琴家演奏后的前臂和上臂周长均明显增加,并且握力增大,最后得出结论血流限制运动对于上肢残留神经症状的钢琴家的康复很有可能有效。目前,血流限制运动在周围神经损伤患者当中的应用较少,但血流限制运动已在其他神经系统疾病,例如有学者进行了血流限制运动在脊髓损伤患者当中可行性及安全性的相关研究,袖带压力为28.8%AOP,发现并没有出现自主神经反射障碍或深静脉血栓形成的迹象[57]。鉴于周围神经损伤后靶肌肉长期处于失神经支配的状态会造成严重肌肉萎缩,尤其是下肢神经损伤会严重降低患者的生活质量,因此康复计划主要侧重于增强肌肉力量、耐力和工作能力,最终目的是提高周围神经损伤患者的生活质量和独立性。血流限制运动可能是满足这一需求的一种选择,并且较为安全,因此可以将此运动应用到周围神经损伤患者当中。总体而言,血流限制运动对于周围神经损伤患者来说具有很多好处,然而为了确保安全和有效性,建议在专业人士的指导下进行血流限制运动。
2.4.2 血流限制运动对周围神经损伤的影响机制 研究发现,血流限制运动会引起肌肉内合成路径发生变化,涉及mTOR信号通路的变化[58]。mTOR是细胞生长和增殖的重要调节因子,血流限制运动能够激活 mTOR 信号通路来调节肌肉生长因子的合成与分泌[59]。血流限制运动驱动骨骼肌肥大的另一种机制是通过激活肌源性干细胞[60],即卫星细胞。在某些条件下,卫星细胞被激活以促进肌肉修复和再生,以及在肥大期间提供新的肌球蛋白。有学者认为尽管卫星细胞激活似乎是一个短暂的过程,并且在低强度血流限制运动10-14 d后可能会很快恢复到基线水平,但新获得的肌球蛋白似乎得到了维持。研究发现,血流限制运动引起的内环境改变可进一步增强一氧化氮合成酶和热休克蛋白72分泌的信号通路[59]。热休克蛋白72有助于蛋白质的转运组装,在维持细胞稳态中发挥作用,其可通过抑制肌肉萎缩相关分子信号通路来降低肌肉蛋白降解[61]。由于机体产生的代谢废物无法及时清除,部分回心受阻的血液和骨骼肌中乳酸含量升高,受限肌肉中的代谢型谷氨酸受体受到刺激后进入下游神经纤维,调节交感神经以及化学感受器的反射协调作用,促进垂体前叶分泌生长激素,生长激素进一步促进肝脏器官分泌胰岛素样生长因子1[62],胰岛素样生长因子1和生长激素的分泌可促进肌肉的增长[63]。也有研究表明,生长激素和胰岛素样生长因子1均具有激活肌肉细胞中mTOR信号通路的作用,因此热休克蛋白72可以抑制骨骼肌细胞凋亡、增强骨骼肌细胞自噬,将细胞内大分子降解为氨基酸、脂类、核苷酸和能量后释放供细胞再利用,同时这些产物又可发挥负反馈作用重新激活mTOR信号通路,从而逐渐终止自噬过程,避免在营养不足时自噬过度[64]。
2.5 镜像运动对周围神经损伤的影响 周围神经损伤后,不仅会导致其支配的靶器官发生功能障碍,也会发生从外周到中枢神经系统的神经重塑,为了保护失神经区域的大脑功能并限制皮质重组,周围和中枢神经系统的连通性训练对于促进周围神经损伤后感觉及运动的恢复具有重要意义。镜像运动又称镜像视觉反馈疗法,早期运用在脑卒中患者的功能恢复中,近年来也有将此方法应用到周围神经损伤的患者当中。
2.5.1 镜像运动在周围神经损伤中的应用 镜像运动被证明在周围神经损伤后影响感觉和运动控制[65]。HSU等[66]对从肘部到手掌中部受伤的患者进行了12周的治疗,发现与经典的感觉再教育治疗方式相比,镜像治疗方案有可能对神经损伤患者的手部运动和功能表现产生更好的治疗效果,但是感觉功能上没有显著提高。CHEN等[67]的研究发现,在干预后立即恢复轻触觉和触觉知觉方面,镜像运动组得效果并没有比感觉再学习组好;但在干预后即刻的握力、手指灵活性和手动灵活性以及干预后3个月的感觉运动功能方面,镜像组的效果优于经典感觉再学习组,3个月的干预期后神经影像研究提供了两组患者神经可塑性的证据,镜像组观察到更多的双侧联系和皮质激活。对于脑部的变化,功能MRI的结果显示镜像运动的长期行动执行可以实现2个半球之间更对称的状态[68]。有研究探索将振动刺激整合到镜像运动中,为其的潜在机制提供证据,通过记录的脑电信号发现这种方式对网络连通性和神经通信效率有积极影响,镜像运动联合振动触觉刺激可以增强患者的身体知觉,增加运动皮质的激活[69]。
2.5.2 镜像运动对周围神经损伤的影响机制 有证据支持这样的理论,即参与运动执行的皮质区域可以通过观察他人执行的动作来激活,这归因于镜像神经元系统的功能。镜像神经元系统是一类在动作观察和动作执行过程中放电的神经元[70],分布于不同脑区,彼此之间构成镜像神经元系统,镜像神经元主要分布在枕叶、颞叶、顶叶视觉相关区域以及顶下小叶、中央前回和额下回后部等区域[71]。周围神经损伤后进行镜像运动会出现激活感觉运动皮质的情况,更是印证了镜像神经元系统的位置及作用。为了在临床上更好地使用镜像视觉反馈疗法,许多研究都进行了其相关潜在神经机制的研究,通过脑电和功能MRI成像观察到的运动皮质区域的激活,如初级运动皮质和辅助运动区[69];此外在镜像视觉反馈疗法期间,还观察到中央后回、额顶区、顶后皮质、视觉皮质和背外侧前额叶皮质的活动增加[72]。有学者发现,镜像神经元系统的激活可能与谷氨酸及神经营养相关,从而促进大脑的可塑性改变[73]。关于镜像运动影响大脑皮质的相关机制探讨目前相对较少,有研究使用磁共振波谱MRS对大鼠有氧运动前后大脑中代谢产物进行了分析,发现周围神经损伤会引起大脑中总胆固醇、谷氨酸等代谢产物的变化,而运动可以逆转这样的改变[74],因此推测镜像运动的机制也可以采用分析代谢产物的方式进行更深入的探索。





