2.1 实验动物数量分析 共有48只成年家兔纳入实验,随机分成6组,每组8只。在实验早期(术后2周内)有2只兔手术中死亡,按序补入。
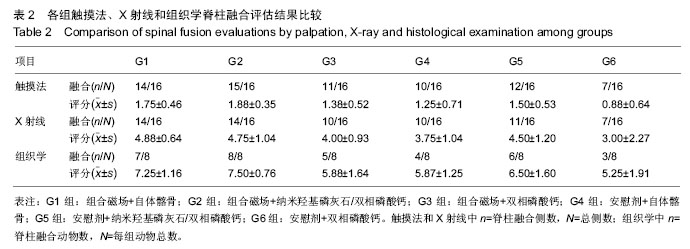
2.2 大体观察及触摸法融合评估结果 触摸法融合率和评分见表2。各组融合率以G2组最高(94%),G6组最低(44%),2组相比差异有显著性意义(P=0.006),G1组也显著高于G6组(P=0.023),G5和G3组略高于G4组,但差异无显著性意义。析因分析显示A和B两因素没有交互作用(F=0.56,P=0.949),A因素主效应提高融合率23%,差异有显著性意义(F=6.747,P=0.011),B因素主效应是提高融合率19%,差异也有显著性意义(F=3.513, P=0.034)。
G1,2,5组融合评分都显著高于G6组(P=0.003,0.001,0.028),G2组也高于G4组(P=0.028),余各组间比较差异无显著性意义。析因分析结果显示A因素和B因素没有交互作用(F=0.073,P=0.930),A因素主效应提高融合评分0.33,差异有显著性意义(F=4.667,P=0.037);B因素的主效应提高0.38,差异有显著性意义(F=4.594,P=0.016)。
2.3 X射线片结果 术后5周各组均可见到横突间有多少不等的骨痂形成,但不连续;术后7周,在G1和G2组中可见到横突间连续骨痂出现,各有3只实验动物达到了影像学融合标准,但各组间骨痂形成量没有明显差别。术后9周,组合磁场治疗组形成的骨痂量相对要多一些,G1,G2和G5组骨痂形成稍多,G3,G4和G6组形成较少。
2.3.1 X射线融合评价 X射线融合率和评分见表2。
G1和G2组融合率最高,显著高于G6组(
P=0.023),其他各组之间差异无显著性意义。析因分析结果显示A因素和B因素没有交互作用(
F=0.51,
P=0.95),A因素(组合磁场治疗)主效应提高融合率为21%,差异有显著性意义(
F=5.102,
P=0.026);B因素提高融合率为17%,差异无显著性意义(
F=2.908,
P=0.06)。
比较各组间融合评分结果显示G1,G2,G5组融合评分显著高于G6组(P=0.006,0.01,0.025),余各组间比较差异无显著性意义(P > 0.05)。析因分析显示A因素和B因素没有交互作用(F=0.538,P=0.588),A和B因素主效应分别为0.79和0.75,差异有显著性意义(F=4.521,P=0.039;F=3.243,P=0.49)。
2.3.2 融合区校正吸光度指数 由图2所示融合区校正吸光度指数度指数,自体髂骨组(G1组和G4组)校正吸光度指数始终显著低于其他各组(P < 0.05),但保持增高的趋势。而G2,G3,G5和G6四组校正吸光度指数经历升高、下降后再缓慢升高的过程。第5周G3组校正吸光度指数高于其他各组,此后G2组校正吸光度指数升高加快,第7,9周始终明显高于其他各组(P < 0.05)。
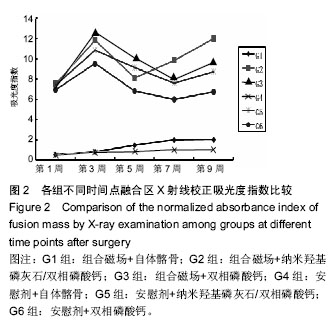
由
图3可以看出术后9周,组合磁场治疗组校正吸光度指数均显著高于对照组,G2组显著高于其他各组(
P < 0.05),G3和G5组也明显高于G6组(
P=0.009,
P=0.63)。析因分析结果显示A因素和B因素之间没有交互作用(
P=0.835),A因素主效应提高校正吸光度指数3.15 (
P=0.000),B因素主效应提高了2.15(
P=0.008)。

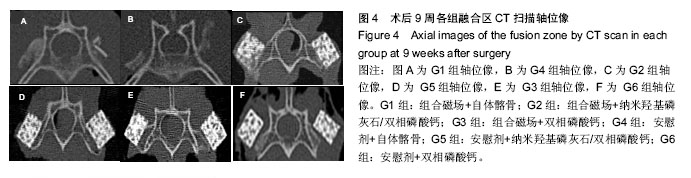
2.4 CT分析结果 CT扫描显示自体髂骨组植骨大部分被吸收,在相邻横突之间新生骨痂形成骨桥连接。在G1组新生骨痂量要多于G4组,密度也高于G4组,这与X射线的校正吸光度指数结果一致(
图4A,
B)。人工骨组可见到新生骨自横突和小关节突与人工骨紧密连接并长入人工骨内部,形成连续骨桥连接相邻横突。G2组与其他组相比,人工骨变得稀疏、松散,人工骨残留减少明显,有更多的骨痂形成包绕人工骨,人工骨与自体骨形成紧密骨整合(
图4C)。G3和G5组人工骨与自体骨形成骨整合,但新生骨痂相对G2组少,人工骨稍松散,孔隙变大,结构尚规整(
图4D,
E),G6组新生骨骨痂更少,有时在界面区可见到线状缝隙,这说明人工骨与自体骨之间新生骨矿化不完全,密度稍低于周围组织,人工骨较规整(
图4F)。
2.5 生物力学结果
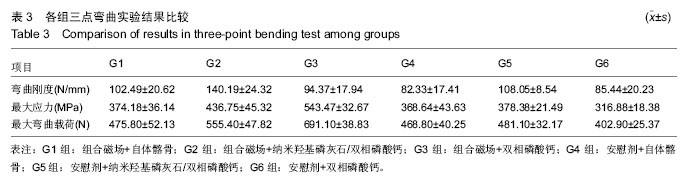
如
表3所示,G2组脊柱弯曲刚度最高,显著高于其他各组(
P < 0.05),G4组脊柱弯曲刚度最低,亦显著低于G1和G5组(
P < 0.05),G5组脊柱弯曲刚度还显著高于G6组(
P < 0.05)。余各组间比较差异无显著性意义(
P > 0.05)。析因分析结果显示A因素和B因素没有交互作用(
F=1.521,
P=0.068),A因素(组合磁场治疗)主效应为提高弯曲刚度20.41 N/mm,差异有显著性意义(
F=14.12,
P=0.01);B因素的主效应是提高弯曲刚度23.85 N/mm,差异有显著性意义(
F=16.43,
P=0.000)。
由表3可见,G3组的最大应力和最大弯曲载荷最大,显著高于其他各组(P < 0.05);G6组最大应力和最大弯曲载荷最小,显著小于其他各组(P < 0.05);G2组显著高于G1,G4和G5组(P < 0.05),余各组间比较差异无显著性意义。G1,G4和G5组之间差异无显著性意义(P > 0.05)。组合磁场治疗组可显著提高人工骨组最大应力和最大弯曲载荷(P < 0.05),但对自体髂骨组没有明显作用。
2.6 组织学分析结果
2.6.1 脊柱融合评价结果 各组脊柱融合率见图5。G2组融合率高于其他各组,但只显著高于G6组(P=0.029),其他各组间融合率差异无显著性意义(P > 0.05)。析因分析显示A和B两因素没有交互作用(F=0.108, P=0.898)。A因素主效应能够显著提高融合率,为29% (F =5.277, P=0.027);B因素主效应能够提高融合率,为25%(P=0.06)。
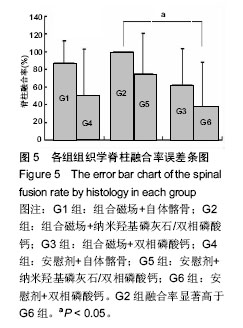
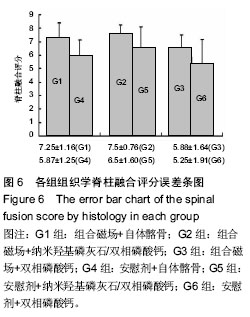
各组脊柱融合评分见
图6。G2组融合评分显著高于G3,G4和G6组(
P < 0.05),G1组亦显著高于G6组(
P=0.008),余各组之间比较差异无显著性意义(
P > 0.05)。析因分析显示A和B两因素之间没有交互作用(
F=0.272,
P=0.763)。A因素主效应提高融合评分1.0(
F=5.81,
P=0.02),B因素主效应提高融合评分0.96(
F=4.206,
P=0.022)。
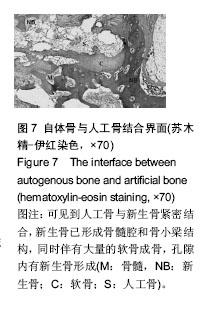
横突间可见连续骨桥形成,人工骨周围生成新生骨痂,并长入人工骨内,形成骨性相连,有成熟骨髓腔和骨小梁结构。界面区域内有大量的成骨细胞、软骨细胞存在、骨髓(
图7)。人工骨孔隙内由新生骨、纤维组织组成,可见骨细胞陷窝和骨细胞,有成熟骨小梁并相互连通,可见到骨小管,人工骨变得稀疏,松散,边缘模糊(
图8),成骨细胞围绕在新生骨周围,破骨细胞和软骨细胞少见,并可见到较多血管长入,骨样基质沉积在成骨样细胞周围并逐渐钙化,在人工骨周围和内部可见到多核细胞围绕。G2组人工骨自体骨整合效果最佳,有连续新生骨小梁长入人工骨孔隙内,可见到成熟新生骨小梁结构形成的网络,而且孔内新生骨形成也高于其他人工骨组,周围骨痂以成熟骨组织为主。G6组新生骨小梁最少,孔隙内以纤维组织为主,伴有新生骨形成,在新生骨边缘可见成骨细胞和破骨细胞围绕,人工骨周围骨痂纤维组织较多。G3和G5组相对G6组来说,新生骨增加,胶原纤维减少,新生骨与纤维组织的比例在50%左右。人工骨周围包绕的骨痂以软骨为主。

2.6.2 人工骨孔隙内骨长入比 G2组骨长入比最高并显著高于其他各组(
P < 0.05),G6组最低并显著低于G3组(
P < 0.05)和G5组(
P=0.054)。析因分析结果显示A和B因素的主效应分别为10.305和9.865(
P=0.001)(
图9)。
2.6.3 人工骨残留率 在新生骨形成的同时伴随着人工骨的降解,IPP软件计算的人工骨残留面积百分率结果显示(图10),G2组人工骨残留率最少为38%,显著低于G3和G6组(P < 0.05),余各组残留率比较差异无显著性意义(P > 0.05)。析因分析结果显示,A因素对人工骨降解没有显著促进作用(P=0.13),B因素能够显著促进人工骨降解(P=0.003)。


.jpg)











.jpg)
.jpg)
.jpg)