Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (15): 2404-2409.doi: 10.12307/2024.378
Previous Articles Next Articles
Preparation methods, advantages, and disadvantages of cartilage scaffold materials
Wang Zewen1, Li Chenzhi1, Liu Jiahe1, Li Yancheng1, Wu Mingjian1, Cui Yan1, Li Zhenhao1, Xiong Wanqi1, He Ting1, Liu Baoyi1, Yang Fan1, 2
- 1Zhongshan Hospital Affiliated to Dalian University, Dalian 116001, Liaoning Province, China; 2Institute of Metal Research, Chinese Academy of Sciences, Shenyang 110000, Liaoning Province, China
-
Received:2023-05-08Accepted:2023-07-04Online:2024-05-28Published:2023-09-23 -
Contact:Liu Baoyi, PhD, Chief physician, Zhongshan Hospital Affiliated to Dalian University, Dalian 116001, Liaoning Province, China Yang Fan, PhD, Associate researcher, Zhongshan Hospital Affiliated to Dalian University, Dalian 116001, Liaoning Province, China; Institute of Metal Research, Chinese Academy of Sciences, Shenyang 110000, Liaoning Province, China -
About author:Wang Zewen, Master candidate, Zhongshan Hospital Affiliated to Dalian University, Dalian 116001, Liaoning Province, China -
Supported by:Postdoctoral Science Foundation of Dalian, No. 285395 (to YF); Dalian Medical Science Research Project, No. 2111038 (to YF); Key Research Project of Education Department of Liaoning Province, No. LJKZZ20220148 (to LBY)
CLC Number:
Cite this article
Wang Zewen, Li Chenzhi, Liu Jiahe, Li Yancheng, Wu Mingjian, Cui Yan, Li Zhenhao, Xiong Wanqi, He Ting, Liu Baoyi, Yang Fan. Preparation methods, advantages, and disadvantages of cartilage scaffold materials[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(15): 2404-2409.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
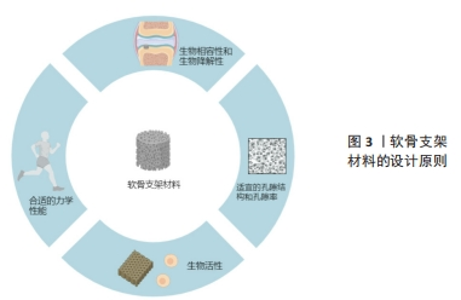
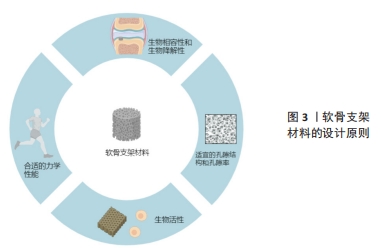
2.1 组织工程中软骨支架材料的设计原则 软骨支架材料是软骨组织工程的核心组成部分,对软骨再生有着至关重要的影响。一个理想的软骨支架应该具备多种特点,其中最重要的包括以下几个方面: 生物相容性和生物降解性:软骨支架应该具有良好的生物相容性和生物降解性,能够与周围组织形成紧密结合,同时材料的降解速率应与软骨组织的再生速度相匹配,以提供适当的支持和空间,并为新生组织的生长和重塑提供条件[3]。这包括选择生物可降解材料或生物惰性材料[12],以减少对组织的刺激和免疫反应。材料的表面特性、溶解物质和降解产物也需要考虑其对细胞和组织的影响。 适宜的孔隙结构和孔隙率:软骨支架的设计应考虑其孔隙结构和孔隙率,以确保提供足够的细胞附着、增殖和分化所需的空间和表面积,并同时促进养分和代谢产物的有效扩散[13]。这是由于软骨细胞需要适宜的空间和支持来维持正常的生长和分化,并且需要养分和氧气的供应以及代谢产物的排泄。孔隙结构的大小和分布可以通过调控材料制备过程中的参数来精确控制。 合适的力学性能:软骨支架材料应具备与自然软骨组织相似的机械性能,以提供足够的支撑和稳定性[14]。这涵盖了合适的弹性模量、形变能力和抗压性能[15],这是由于软骨组织需要承受体质量和各种力的作用,因此支架材料的力学性能至关重要,需要与天然软骨相匹配。机械性能的调节可以通过材料成分、结构设计和交联程度等方面的控制来实现。 生物活性:软骨支架应该具有一定的生物活性,能够刺激或诱导细胞分泌软骨基质并与之相互作用。这是因为软骨细胞需要受到外界信号的刺激才能够正常地分泌软骨基质,因此支架材料的生物活性对软骨再生的成功非常重要。 总之,软骨支架材料的设计需要综合考虑生物相容性和生物降解性、孔隙结构和孔隙率、力学性能、生物活性等因素,如图3所示,以实现有效的软骨组织修复和再生。这些设计原则将促进材料与周围组织的相互作用,并为细胞的黏附、增殖、分化和基质合成提供合适的支持和环境。为了实现这些设计目标,研究者需要选择合适的软骨支架材料制备方法。"

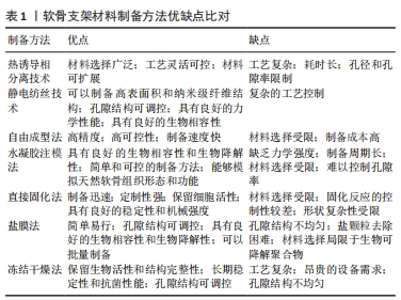
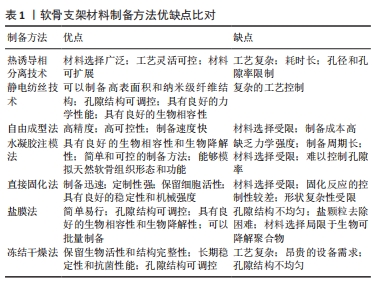
传统的制备方法如冷冻干燥技术[16]、发泡技术[17]、颗粒浸出技术等已经被研究人员广泛应用于软骨组织工程支架材料的制备[18],然而在近年来的研究中,这些传统技术的应用已经相对较少。随着软骨组织工程的研究不断深入,新兴的制备方法不断涌现,如静电纺丝技术和3D/4D打印技术等。静电纺丝技术可以制备具有高孔隙率、均匀孔径分布和连续孔道结构的支架材料。3D/4D打印技术可以实现支架材料的梯度结构和定制化制备。这些新技术的引入将进一步推动软骨组织工程支架材料的制备和应用,有望在未来为软骨组织的修复和再生提供更有效的解决方案。 2.2.1 热诱导相分离技术 热诱导相分离技术是一种制备高分子微孔支架材料的方法,该技术的基本原理是利用高温下聚合物和溶剂的均相溶解以及低温下溶液的相分离,形成具有多孔结构的聚合物凝胶,通过萃取或冻干等方法去除溶剂后得到多孔支架材料。 近年来,诱导相分离技术在软骨组织工程领域得到了广泛应用,并取得了一系列研究进展。制备高分子微孔支架材料的首要任务是选择适合的聚合物材料。目前常用的聚合物材料有天然高分子材料、合成高分子材料、生物可降解高分子材料等,其中生物可降解高分子材料由于其良好的生物相容性和可降解性,受到了广泛关注。研究表明,聚乳酸、聚乳酸-羟基乙酸、聚己内酯等生物可降解高分子均可通过诱导相分离技术制备出具有多孔结构的支架材料[19]。接下来,将聚合物溶解在适当的溶剂中,形成均匀的聚合物溶液。根据需要可以添加其他辅助剂,如溶剂、增稠剂或生物活性物质等,以调节支架材料的性能和功能。在适当的温度下保持聚合物溶液处于液态。初始阶段,通常保持较高的温度,使聚合物溶液呈现单相状态。随着温度的降低,聚合物溶液达到临界温度点,发生相分离现象。在相分离过程中,聚合物分子聚集并形成相互交错的聚集体,导致溶液分离成富含聚合物的凝胶相和富含溶剂的连续相。凝胶相的形成可以通过快速冷却或添加凝胶剂等方式实现,凝胶相的形成在连续相中形成多个孔隙结构,从而构成软骨支架材料的多孔结构。最后,通过逐渐去除凝胶相中的溶剂或通过交联反应固化凝胶相,在固化过程中聚合物形成交联网络,增强支架的力学性能和稳定性。制备高分子微孔支架材料的核心是调控其孔径和孔隙率,以满足不同软骨修复需求。研究表明,孔径和孔隙率的大小与温度、聚合物浓度、溶剂种类和比例等因素密切相关[20]。一般来说,温度越高,孔径和孔隙率越大;聚合物浓度越高,孔径和孔隙率越小[21];溶剂种类和比例对孔径和孔隙率的影响较为复杂,需要进行综合考虑。 关于生物相容性,热诱导相分离技术制备的高分子支架材料通常是由天然或合成高分子材料制成的[22],例如聚乳酸、聚丙烯酸、明胶、明胶-聚乳酸共聚物等,这些材料在人体内可以被逐渐降解和代谢,而且不会对周围组织产生不良影响;此外,这些材料的表面也可以通过化学改性或生物修饰等方法来增强其生物相容性,例如引入羟基磷灰石等生物活性物质[23-24]。 在力学性能方面,热诱导相分离技术制备的高分子支架材料通常具有较低的强度和刚度,因此需要根据不同的应用需求进行调整。例如在软骨组织工程中,支架材料需要具有一定的柔韧性和可压缩性,以适应软组织的应力环境。同时,为了保证修复后的组织长期稳定性,支架材料还需要具有足够的耐久性和抗裂性。通过控制溶液成分、温度变化和凝固条件等参数可以调节软骨支架材料的孔隙结构、孔隙率和力学性能,以满足不同的组织工程需求。CONOSCENTI等[25]利用热诱导相分离技术制备了两种不同孔径的聚乳酸支架,并将软骨细胞固定于支架上进行培养,发现软骨细胞在该支架上生长状态良好,该支架在软骨修复中有着良好的应用潜力。由此可见,热诱导相分离技术是一种有效且灵活制备软骨组织工程支架材料的方法,它为实现软骨缺损的再生修复提供了新的可能性,但其调控孔径及孔隙率的优点随着3D/4D打印技术的成熟也渐渐式微。 此外,热诱导相分离技术涉及到温度控制、溶液组成和凝固速率等多个参数的调控,需要较高的技术要求和设备支持。因此,该制备方法在操作上较为复杂,对研究人员的技术能力有一定要求。总的来说,热诱导相分离技术作为制备高分子微孔支架材料的一种常用方法,具有灵活性、可控性和可扩展性等优点。随着技术的发展和完善,其在软组织修复、骨组织工程、血管再生等领域的应用前景将会更加广泛。 2.2.2 静电纺丝技术 静电纺丝技术通过对聚合物溶液或熔体施加高压电场使其在电场作用下流动成纳米级纤维,并在收集器上形成多孔支架材料。由于静电纺丝技术所制备的支架材料具有高比表面积和良好的生物相容性,因此具有很大的应用前景。静电纺丝技术制备的支架材料已被广泛应用于软骨组织工程领域,如制备软骨修复材料、软骨再生材料、人工软骨等。此外,静电纺丝技术还可以结合其他技术(如3D打印、胶原蛋白等)来制备具有更好性能和功能的支架材料[26]。静电纺丝技术的不断发展和完善,为软骨组织工程提供了更多的可能性和希望。SEMITELA等[27]利用静电纺丝技术制备了聚己内酯-明胶纳米纤维支架,并且在制作过程中通过在同步电喷雾中引入聚乙二醇颗粒,随后再把这些颗粒去除,从而使纤维支架具有较大的孔径,该支架在软骨修复中具有良好的应用潜力。静电纺丝技术制备的支架材料具有许多优点:首先,静电纺丝技术制备的支架材料具有高度的可控性和可调性,可以通过调节聚合物的浓度、分子质量、表面活性剂、电场强度、喷射距离等参数来控制纤维的形貌、组成、取向和孔隙度等性能;其次,由于静电纺丝技术制备的支架材料纤维直径很小,通常在100 nm以下,因此具有较高的比表面积和大量的孔隙结构,能够模拟人体组织的微结构,提供了更好的生物相容性和细胞生长环境;此外,静电纺丝技术制备的支架材料还具有优异的力学性能,如高强度、高韧性和优异的弯曲性能,可以满足不同软骨组织工程的需求。以静电纺丝技术为主的纳米纤维材料已被广泛应用于软骨组织工程支架材料的制作[28],为制作更好的仿软骨细胞外基质支架的研究提供了希望[29]。但是在静电纺丝过程中,纤维膜的形成受到多种因素的影响[30],如电压、流速、距离、温度、湿度等,这些因素之间存在复杂的相互作用,导致静电纺丝过程难以控制和重现,影响纤维膜的均匀性和可重复性。 2.2.3 自由成型法 自由成型法的原理是基于逐层堆叠材料以创建所需形状和结构的三维模型。这种方法通常与立体打印技术(3D/4D打印技术)相关联:首先,通过计算机辅助设计软件或其他建模工具,设计满足特定应用需求的软骨支架的几何形状和结构;然后,将设计好的软骨支架模型切割成一系列薄片,每个薄片代表着软骨支架在垂直方向上的一个层次,并使用立体打印设备,按照设计好的模型,逐层将材料堆叠在一起,固化和黏合各个层次之间的材料以保持整个支架结构的稳定性;最后,进行适当的后处理步骤,如去除辅助支撑材料、消毒和清洁、物理性能测试等。 LI等[31]设计了一种聚己内酯/聚乙烯吡咯烷酮复合生物支架,通过调整3D打印过程中的各项参数对其进行优化,最终设计出来的支架有良好的细胞相容性,并且可促细胞的生长与增殖,在软骨组织工程领域有着良好的应用潜力。3D打印技术有着高度定制性,并且可以根据需求创建个性化的软骨支架结构,包括形状、尺寸、孔隙度和内部结构等,以满足个体化医疗需求和不同患者的特定要求,在软骨组织工程支架材料的制作中该技术有着其独特的优越性[32]。与3D打印类似,4D打印也依赖于新型的生物材料,但是这些材料通常会因为一些刺激(湿度、温度或化学物质)而发生一些相应的反应[33]。所以在3D打印材料的基础上,4D打印材料会随着时间的推移根据来自环境的刺激而改变,因此这种方法为支架材料的制作与设计提供了更多的可能以及附加功能。HENDRIKSON等[34]使用增材制造技术制作了4D聚氨酯支架,并通过植入细胞来评估该支架的形状记忆能力,发现随着该支架形状的恢复细胞明显被拉长,结果表明其形状恢复引起的机械应力会影响细胞行为。自由成型法利用的计算机辅助设计和先进的制造技术,具有高精度和可控性,能够实现材料的精确堆叠和控制,确保软骨支架的几何形状和结构的精确复制,以及材料的均匀分布和黏附[35]。相对于传统的制备方法,自由成型法具有较快的制备速度,逐层堆叠和固化的方式可以在相对短的时间内完成,提高了制备效率。但是其材料选择有限,目前可用于自由成型法的软骨支架材料有限,主要是生物可降解聚合物和生物活性因子,这些材料的性能和稳定性需要进一步研究和改进以满足临床应用的要求[36];制备成本较高,自由成型法涉及先进的制造设备和技术,导致制备成本较高,限制了在大规模生产和广泛应用中的可行性[37];材料的力学性能限制,某些自由成型法所用的材料在力学性能方面可能存在限制,软骨支架材料需要具备足够的强度、韧性和弹性以支撑和模拟天然软骨组织的功能。 2.2.4 水凝胶注模法 在软骨组织工程中水凝胶支架是一种常用的材料,用于促进软骨组织的再生和修复。水凝胶是一种高水含量的材料,具有类似于软骨组织的水合特性和生物相容性[38],它能够提供一个适宜的环境促进软骨细胞的附着、增殖和分化,并且支持细胞与细胞之间的相互作用[39]。软骨支架的水凝胶注模法通过将水凝胶溶液注入到设计好的模具中,然后使其凝胶化或交联形成软骨支架所需的形状和结构。首先,选择适合软骨组织工程的水凝胶材料,并将其溶解或悬浮在溶剂中制备成水凝胶溶液;然后,设计模具,以确保软骨支架的形状和尺寸符合要求,在注模过程中,将水凝胶溶液注入到模具中并确保填充每个细节和空腔;随后,通过凝胶化或交联反应将水凝胶溶液转变为凝胶状态,这一过程可以通过改变温度、pH值、添加交联剂或引入外部刺激等方法触发[40];最后,从模具中取出凝胶化的软骨支架,其具有模具所设计的几何形状和内部结构。 软骨支架的水凝胶注模法具有制备灵活、能够模拟天然软骨组织形态和功能的优点,是一种相对简单和可控的制备方法,它不需要复杂的设备和制备过程,易于掌握和操作;可以根据需要设计模具,灵活调整软骨支架的形状、尺寸和内部结构,以满足不同患者的需求;能够制备复杂的三维结构,如微孔洞和通道,有助于模拟天然软骨组织的形态和功能[41];常用的水凝胶材料具有良好的生物相容性和生物降解性,有利于支架在体内的适应性和组织修复。水凝胶注模法制备软骨支架存在一些缺点:包括缺乏力学强度、制备周期长、材料选择有限和难以控制孔隙度等,某些水凝胶材料在力学性能方面限制较大,无法满足软骨支架对强度和韧性的要求;目前可用的材料选项相对有限,主要以生物可降解聚合物为主,其他材料选择较少;在孔隙度的控制方面较为困难,可能导致孔隙结构不均匀或过大,影响细胞附着和组织工程修复效果。 2.2.5 直接固化法 直接固化法的原理是通过在材料中添加适当的交联剂或引发剂使材料在一定条件下进行交联或固化,这种固化过程可以通过化学反应[42]、光聚合或热交联等方式实现[43-44],从而形成具有所需形状和结构的固定支架。固化后的支架材料具有良好的稳定性和机械强度,可以用于支持和模拟软骨组织的功能。直接固化法不需要复杂的制备过程,可在较短时间内完成支架制备;定制性强,可根据需求和设计要求调整交联剂或引发剂的种类、浓度和反应条件,实现软骨支架的定制化制备;保留了细胞活性,通过选择和控制交联剂或引发剂的条件,减少对细胞的不良影响,更好地保留细胞的活性和功能。然而,直接固化法也存在一些缺点:包括材料选择受限,需要选择适合固化反应的材料和交联剂/引发剂,可用的材料范围相对较窄;固化反应的控制性较差,容易受到环境因素、材料的批次差异和操作技术的影响,导致固化效果的不稳定性和一致性的问题;形状复杂性受限,对于形状复杂的结构和空间分布要求较高的支架制备可能存在困难和限制。 2.2.6 盐膜法 盐膜法的原理是基于溶剂蒸发和盐颗粒的模板作用:①首先,将生物可降解聚合物溶液(如聚乳酸或聚乙二醇酸)制备成溶液或凝胶状,同时加入细小的盐颗粒(如氯化钠)。②随后,将混合物倒入模具或培养皿中,使其均匀分布。在制备过程中溶剂逐渐蒸发,使得聚合物溶液逐渐凝胶化。同时盐颗粒起到模板的作用,形成具有孔隙结构的支架。盐颗粒的大小和分布可以影响最终支架的孔隙结构。随着溶剂的完全蒸发,凝胶固化并形成固体结构,其中盐颗粒留下空隙。③接下来,使用适当的方法(如浸泡在水中或超声波处理),将盐颗粒从支架中去除,留下具有孔隙结构的软骨支架。该方法的关键在于通过盐颗粒的模板作用,实现支架内部的孔隙结构形成[45],这些孔隙有助于细胞的附着、增殖和营养物的扩散,促进软骨组织的生长和修复[46-47]。 盐膜法在软骨组织工程中制备软骨支架具有简单易行、可调控孔隙结构、良好的生物相容性和生物降解性以及批量制备的优点[48]。然而该方法也存在一些缺点:包括孔隙结构不均匀性、盐颗粒去除困难以及材料选择受限,孔隙结构的不均匀性可能影响细胞附着和组织工程修复效果,完全去除支架中的盐颗粒可能需要采用特殊处理方法以保证支架的完整性和纯净性,而盐膜法所使用的材料主要局限于生物可降解聚合物,其他材料的选择相对较少,可能受到力学性能和稳定性的限制。 2.2.7 冻结干燥法 冻结干燥法的原理是通过将含有细胞或生物材料的溶液或凝胶样品迅速冷冻,并在低温下施加真空,使水分从固态冰直接转变为气态水蒸气,绕过液态阶段,实现了无水化的干燥过程。具体而言,包括以下步骤:首先,将溶液或凝胶样品迅速冷冻,使水分形成冰晶;接着,在低温下施加真空,通过升华的方式将冰晶中的水分直接转变为气态水蒸气;最后,将干燥的样品退冻到常温,以恢复其原始形态。 冻结干燥法在软骨组织工程中制备软骨支架材料具有以下优点:①首先,它能保留细胞和生物材料的生物活性和结构完整性,通过无水化的干燥过程避免了细胞损伤和形态改变。②其次,冻结干燥法制备的软骨支架材料具有多孔的结构,有利于细胞的生长、营养物质的输送以及细胞定植[49-50]。通过调节冻结和干燥过程的参数可以灵活控制支架的孔隙大小、分布和连接性,以满足特定应用的需求[51]。③此外,冻结干燥法制备的软骨支架材料具有较低的水含量,从而提高了材料的长期稳定性和抗菌性能。然而冻结干燥法也存在一些缺点:①首先,它的工艺复杂性较高,需要精确控制冷冻和干燥过程中的温度、压力和速度等参数,增加了操作的难度;②其次,为了实现有效的冷冻和干燥过程,需要使用昂贵的设备,如真空冷冻干燥器,增加了制备成本;③此外,冻结干燥法制备的软骨支架材料的孔隙结构可能存在不均匀性,因为冰晶的形成和水分的升华过程可能导致孔隙分布的不一致,从而影响细胞的附着和组织工程修复效果。"

| [1] CAMPOS Y, ALMIRALL A, FUENTES G, et al. Tissue Engineering: An Alternative to Repair Cartilage. Tissue Eng Part B Rev. 2019;25(4):357-373. [2] LIU S, DENG Z, CHEN K, et al. Cartilage tissue engineering: From proinflammatory and anti inflammatory cytokines to osteoarthritis treatments (Review). Mol Med Rep. 2022;25(3):99. [3] ARMIENTO AR, STODDART MJ, ALINI M, et al. Biomaterials for articular cartilage tissue engineering: Learning from biology. Acta Biomater. 2018; 65:1-20. [4] EMANUEL KS, KELLNER LJ, PETERS MJM, et al. The relation between the biochemical composition of knee articular cartilage and quantitative MRI: a systematic review and meta-analysis. Osteoarthritis Cartilage. 2022; 30(5):650-662. [5] WU Z, KORNTNER SH, MULLEN AM, et al. Collagen type II: From biosynthesis to advanced biomaterials for cartilage engineering. Biomater Biosyst. 2021; 4:100030. [6] O’DRISCOLL SW. The healing and regeneration of articular cartilage. J Bone Joint Surg Am. 1998;80(12):1795-1812. [7] GRANDE DA, BREITBART AS, MASON J, etal. Cartilage tissue engineering: current limitations and solutions. Clin Orthop Relat Res. 1999;(367 Suppl): S176-185. [8] ZHU M, ZHONG W, CAO W, et al. Chondroinductive/chondroconductive peptides and their-functionalized biomaterials for cartilage tissue engineering. Bioact Mater. 2021;9:221-238. [9] AGARWAL T, CHIESA I, PRESUTTI D, et al. Recent advances in bioprinting technologies for engineering different cartilage-based tissues. Mater Sci Eng C Mater Biol Appl. 2021;123:112005. [10] WANG Y, ZHANG W, YAO Q. Copper-based biomaterials for bone and cartilage tissue engineering. J Orthop Translat. 2021;29:60-71. [11] LARSEN CG, STAPLETON EJ, SGAGLIONE J, et al. Three-Dimensional Bioprinting in Orthopaedics. JBJS Rev. 2020;8(4):e0204. [12] SANCHO-TELLO M, FORRIOL F, MARTÍN DE LLANO JJ, et al. Biostable scaffolds of polyacrylate polymers implanted in the articular cartilage induce hyaline-like cartilage regeneration in rabbits. Int J Artif Organs. 2017;40(7):350-357. [13] CHEN G, KAWAZOE N. Porous Scaffolds for Regeneration of Cartilage, Bone and Osteochondral Tissue. Adv Exp Med Biol. 2018;1058:171-191. [14] SCHULZ RM, BADER A. Cartilage tissue engineering and bioreactor systems for the cultivation and stimulation of chondrocytes. Eur Biophys J. 2007;36(4-5):539-568. [15] SOUZA MT, TANSAZ S, ZANOTTO ED, et al. Bioactive Glass Fiber-Reinforced PGS Matrix Composites for Cartilage Regeneration. Materials (Basel). 2017;10(1):83. [16] HO MH, KUO PY, HSIEH HJ, et al. Preparation of porous scaffolds by using freeze-extraction and freeze-gelation methods. Biomaterials. 2004;25(1): 129-138. [17] KIM SS, SUN PARK M, JEON O, et al. Poly(lactide-co-glycolide)/hydroxyapatite composite scaffolds for bone tissue engineering. Biomaterials. 2006;27(8): 1399-1409. [18] ROYCHOWDHURY P, KUMAR V. Fabrication and evaluation of porous 2,3-dialdehydecellulose membrane as a potential biodegradable tissue-engineering scaffold. J Biomed Mater Res A. 2006;76(2):300-309. [19] SONG Y, CHOI JH, TUMURSUKH NE, et al. Macro- and microporous polycaprolactone/duck’s feet collagen scaffold fabricated by combining facile phase separation and particulate leaching techniques to enhance osteogenesis for bone tissue engineering. J Biomater Sci Polym Ed. 2022; 33(8):1025-1042. [20] SAMADIAN H, KHASTAR H, EHTERAMI A, et al. Bioengineered 3D nanocomposite based on gold nanoparticles and gelatin nanofibers for bone regeneration: in vitro and in vivo study. Sci Rep. 2021;11(1):13877. [21] RIEPPO J, HALLIKAINEN J, JURVELIN JS, et al. Practical considerations in the use of polarized light microscopy in the analysis of the collagen network in articular cartilage. Microsc Res Tech. 2008;71(4):279-287. [22] PISZKO P, WŁODARCZYK M, ZIELIŃSKA S, et al. PGS/HAp Microporous Composite Scaffold Obtained in the TIPS-TCL-SL Method: An Innovation for Bone Tissue Engineering. Int J Mol Sci. 2021;22(16):8587. [23] 杨宁文,何星.羟基磷灰石/氧化石墨烯复合支架在骨缺损修复治疗中的研究进展[J].复合材料学报,2023. doi: 10.13801/j.cnki.fhclxb.20230423.001 [24] MO X, ZHANG D, LIU K, et al. Nano-Hydroxyapatite Composite Scaffolds Loaded with Bioactive Factors and Drugs for Bone Tissue Engineering. Int J Mol Sci. 2023;24(2):1291. [25] CONOSCENTI G, SCHNEIDER T, STOELZEL K, et al. PLLA scaffolds produced by thermally induced phase separation (TIPS) allow human chondrocyte growth and extracellular matrix formation dependent on pore size. Mater Sci Eng C Mater Biol Appl. 2017;80:449-459. [26] WANG Z, WANG Y, YAN J, et al. Pharmaceutical electrospinning and 3D printing scaffold design for bone regeneration. Adv Drug Deliv Rev. 2021; 174:504-534. [27] SEMITELA Â, GIRÃO AF, FERNANDES C, et al. Electrospinning of bioactive polycaprolactone-gelatin nanofibres with increased pore size for cartilage tissue engineering applications. J Biomater Appl. 2020;35(4-5):471-484. [28] YE K, KUANG H, YOU Z, et al. Electrospun Nanofibers for Tissue Engineering with Drug Loading and Release. Pharmaceutics. 2019;11(4):182. [29] EFTEKHARI A, MALEKI DIZAJ S, SHARIFI S, et al. The Use of Nanomaterials in Tissue Engineering for Cartilage Regeneration; Current Approaches and Future Perspectives. Int J Mol Sci. 2020;21(2):536. [30] PERANIDZE K, SAFRONOVA TV, KILDEEVA NR. Fibrous Polymer-Based Composites Obtained by Electrospinning for Bone Tissue Engineering. Polymers (Basel). 2021;14(1):96. [31] LI K, WANG D, ZHAO K, et al. Electrohydrodynamic jet 3D printing of PCL/PVP composite scaffold for cell culture. Talanta. 2020;211:120750. [32] SULTAN S, THOMAS N, VARGHESE M, et al. The Design of 3D-Printed Polylactic Acid-Bioglass Composite Scaffold: A Potential Implant Material for Bone Tissue Engineering. Molecules. 2022;27(21):7214. [33] SU JW, TAO X, DENG H, et al. 4D printing of a self-morphing polymer driven by a swellable guest medium. Soft Matter. 2018;14(5):765-772. [34] HENDRIKSON WJ, ROUWKEMA J, CLEMENTI F, et al. Towards 4D printed scaffolds for tissue engineering: exploiting 3D shape memory polymers to deliver time-controlled stimulus on cultured cells. Biofabrication. 2017; 9(3):031001. [35] SHANJANI Y, DE CROOS JN, PILLIAR RM, et al. Solid freeform fabrication and characterization of porous calcium polyphosphate structures for tissue engineering purposes. J Biomed Mater Res B Appl Biomater. 2010; 93(2):510-519. [36] XU T, BINDER KW, ALBANNA MZ, et al. Hybrid printing of mechanically and biologically improved constructs for cartilage tissue engineering applications. Biofabrication. 2013;5(1):015001. [37] AYAN B, CELIK N, ZHANG Z, et al. Aspiration-assisted freeform bioprinting of prefabricated tissue spheroids in a yield-stress gel. Commun Phys. 2020;3:183. [38] GUO C, CAO Z, PENG Y, et al. Subchondral bone-inspired hydrogel scaffold for cartilage regeneration. Colloids Surf B Biointerfaces. 2022;218:112721. [39] YANG J, ZHANG YS, YUE K, et al. Cell-laden hydrogels for osteochondral and cartilage tissue engineering. Acta Biomater. 2017;57:1-25. [40] CHANG SC, TOBIAS G, ROY AK, et al. Tissue engineering of autologous cartilage for craniofacial reconstruction by injection molding. Plast Reconstr Surg. 2003;112(3):793-799; discussion 800-801. [41] KOBAYASHI M, OKA M. Characterization of a polyvinyl alcohol-hydrogel artificial articular cartilage prepared by injection molding. J Biomater Sci Polym Ed. 2004;15(6):741-751. [42] LEE CS, HWANG HS, KIM S, et al. Inspired by nature: facile design of nanoclay-organic hydrogel bone sealant with multifunctional properties for robust bone regeneration. Adv Funct Mater. 2020;30(43):2003717. [43] ZHU H, YANG H, MA Y, et al. Spatiotemporally Controlled Photoresponsive Hydrogels: Design and Predictive Modeling from Processing through Application. Adv Funct Mater. 2020;30(32):2000639. [44] NONOYAMA T, LEE YW, OTA K, et al. Instant Thermal Switching from Soft Hydrogel to Rigid Plastics Inspired by Thermophile Proteins. Adv Mater. 2020;32(4):e1905878. [45] KANIMOZHI K, BASHA SK, KAVIYARASU K, et al. Salt Leaching Synthesis, Characterization and In Vitro Cytocompatibility of Chitosan/Poly(vinyl alcohol)/Methylcellulose - ZnO Nanocomposites Scaffolds Using L929 Fibroblast Cells. J Nanosci Nanotechnol. 2019;19(8):4447-4457. [46] SANGKATIP R, SRISEUBSAI W, KIATKITTIPONG K, et al. Optimization of Salt-Leaching Parameters for Gelatin/Na2Ti3O7 Scaffolds Using a Mixture Design Experiment. Polymers (Basel). 2022;14(3):559. [47] ZHOU F, ZHANG X, CAI D, et al. Silk fibroin-chondroitin sulfate scaffold with immuno-inhibition property for articular cartilage repair. Acta Biomater. 2017;63:64-75. [48] EGLIN D, GRAD S, GOGOLEWSKI S, et al. Farnesol-modified biodegradable polyurethanes for cartilage tissue engineering. J Biomed Mater Res A. 2010;92(1):393-408. [49] LU H, KO YG, KAWAZOE N, et al. Cartilage tissue engineering using funnel-like collagen sponges prepared with embossing ice particulate templates. Biomaterials. 2010;31(22):5825-5835. [50] KOENS MJ, GEUTJES PJ, FARAJ KA, et al. Organ-specific tubular and collagen-based composite scaffolds. Tissue Eng Part C Methods. 2011;17(3):327-335. [51] SCHOOF H, APEL J, HESCHEL I, et al. Control of pore structure and size in freeze-dried collagen sponges. J Biomed Mater Res. 2001;58(4):352-357. [52] 刘天,王臻,储彬,等.人工软骨支架材料、结构设计与制备技术研究进展[J].功能材料,2023,54(3):3001-3011. [53] 贵浩然,李澎,张卫国.制备软骨组织工程支架的材料和方法[J].中国组织工程研究,2013,17(3):509-516. [54] LI WJ, COOPER JA JR, MAUCK RL, et al. Fabrication and characterization of six electrospun poly(alpha-hydroxy ester)-based fibrous scaffolds for tissue engineering applications. Acta Biomater. 2006;2(4):377-385. [55] HUTMACHER DW, SCHANTZ JT, LAM CX, et al. State of the art and future directions of scaffold-based bone engineering from a biomaterials perspective. J Tissue Eng Regen Med. 2007;1(4):245-260. [56] XUE X, HU Y, WANG S, et al. Fabrication of physical and chemical crosslinked hydrogels for bone tissue engineering. Bioact Mater. 2021;12:327-339. [57] PAWELEC KM, HUSMANN A, BEST SM, et al. Understanding anisotropy and architecture in ice-templated biopolymer scaffolds. Mater Sci Eng C Mater Biol Appl. 2014;37:141-147. |
| [1] | Wang Mingming, Zhang Zhong, Sun Jianhua, Zhao Gang, Song Hua, Yan Huadong, Lyu Bin. Finite element analysis of three different minimally invasive fixation methods for distal tibial fractures with soft tissue injury [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(6): 879-885. |
| [2] | Zhang Kefan, Shi Hui. Research status and application prospect of cytokine therapy for osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(6): 961-967. |
| [3] | Huang Yixuan, Chen Hao, Xue Peng, Xi Hongzhong, He Shuai, Sun Guangquan, Du Bin, Liu Xin. Applicable techniques for subchondral separation of femoral head necrosis treated by tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(21): 3385-3392. |
| [4] | Wang Buyu, Zhang Yong, Ruan Shiqiang, Deng Jiang. Preparation of collagen-binding domain-bone morphogenetic protein 2-collagen cartilage scaffold and its chondrogenic induction [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(15): 2378-2384. |
| [5] | Tian Linling, Guo Hairui, Du Xiaoming, Feng Jie, Zhang Xianzhe, Zhang Wenbin, Sun Haoran, Zhang Xiaobin, Wang Jingxia, Hu Yimei, Wang Yi. Advantages and features of nanocomposite hydrogel in treatment of osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(15): 2410-2415. |
| [6] | Su Kunyang, Chen Bineng, Chen Yiliang, Jin Shaofeng. Strontium ranelate-loaded sodium alginate/collagen hydrogel promotes bone defect repair in osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(10): 1568-1574. |
| [7] | Zhang Bentuo, Yang Xin. Application of synthetic and biological materials in articular cartilage repair [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(10): 1599-1605. |
| [8] | Sun Kexin, Zeng Jinshi, Li Jia, Jiang Haiyue, Liu Xia. Mechanical stimulation enhances matrix formation of three-dimensional bioprinted cartilage constructs [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(在线): 1-7. |
| [9] | Zhang Tong, Cai Jinchi, Yuan Zhifa, Zhao Haiyan, Han Xingwen, Wang Wenji. Hyaluronic acid-based composite hydrogel in cartilage injury caused by osteoarthritis: application and mechanism [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 617-625. |
| [10] | Liu Hui, Liu Aifeng, Zhang Yu, Zhang Chao. Advantages and application strategies of hyaluronic acid scaffold in cartilage repair engineering [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(34): 5518-5524. |
| [11] | Liu Yingsong, Guo Xiaopeng, Wei Mingzhu. Transforming growth factor beta 3 and alginate hydrogel complex on the repair of articular cartilage defects of the knee [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(16): 2504-2509. |
| [12] | Yang Tengyun, Li Yanlin, Liu Dejian, Wang Guoliang, Zheng Zhujun. Chondrogenic differentiation of peripheral blood-derived mesenchymal stem cells induced by transforming growth factor beta 3: a dose-effect relationship [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(1): 45-51. |
| [13] | Liu Xiaogang, Li Tian, Zhang Duo. Research hotspot of seed cell selection in cartilage tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(31): 5059-5064. |
| [14] | Zhu Bikang, Luo Shanchao, Luo Shixing. Progress and main application of fish skin collagen in tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(28): 4561-4566. |
| [15] | Liao Sida, Meng Haoye, Li Junkang, Xu Yichi, Li Huo, Tian Xiaoyu, Feng Yong, Wang Aiyuan, Peng Jiang. Preparation of alginate-gelatin-adipose-derived stem cells microspheres by electrospray and feasibility on repairing articular cartilage injury [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(28): 4473-4479. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||