Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (8): 1307-1312.doi: 10.12307/2023.860
Chronic inflammation regulates adipose tissue fibrosis
Wang Weiqing, Zhou Yue
- School of Sports and Human Sciences, Beijing Sport University, Beijing 100084, China
-
Received:2022-11-21Accepted:2023-01-05Online:2024-03-18Published:2023-07-19 -
Contact:Zhou Yue, PhD, Professor, School of Sports and Human Sciences, Beijing Sport University, Beijing 100084, China -
About author:Wang Weiqing, Master candidate, School of Sports and Human Sciences, Beijing Sport University, Beijing 100084, China
CLC Number:
Cite this article
Wang Weiqing, Zhou Yue. Chronic inflammation regulates adipose tissue fibrosis[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1307-1312.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
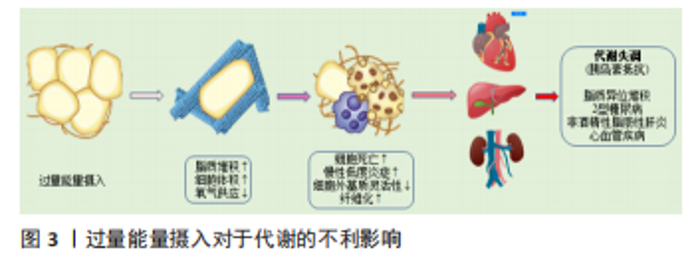
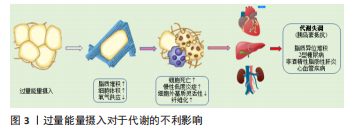
2.1 白色脂肪组织 白色脂肪组织是脂肪组织的主要成分之一,在白色脂肪组织中除了有主要的脂肪细胞还有其他细胞,如脂肪祖细胞、间充质干细胞、前脂肪细胞、成纤维细胞、内皮细胞和巨噬细胞等,在生命过程中分别执行不同的功能[6]。脂肪生成是脂肪细胞从血液中提取游离脂肪酸和甘油合成三酰甘油然后储存起来的过程;相反,脂肪分解是三酰甘油分解成游离脂肪酸和甘油,释放到血液中并被其他器官用作能量消耗的过程。白色脂肪组织不仅通过调节脂肪生成和分解在体内储存或释放能量,而且还分泌多种激素、信号分子,在调控全身能量稳态和新陈代谢中发挥着关键作用[8-10]。正常生理条件下,白色脂肪组织具有调节能量消耗与摄入保持平衡、维持内环境稳态的能力,如果因为摄入量过多使合成大于分解则会引发肥胖症及其他代谢性疾病。在肥胖发展过程中,由于摄入脂肪以及其他能源物质过多,脂肪细胞储存三酰甘油的能力超过最大限度,脂肪水解导致大量的游离脂肪酸向肾脏、肝脏和骨骼肌等其他器官运输,这一过程称为脂质异位沉积,通过引发脂肪毒性促进细胞凋亡、炎症发生,进而损伤器官/组织的正常生理功能[11-12]。 在肥胖期间,棕色和米色脂肪组织减少,白色脂肪组织通过脂肪细胞增生和肥大进行扩张以储存多余的能量,发生重塑或功能改变后引起的缺陷主要包括血管新生受损、白色脂肪组织缺氧促进脂肪细胞坏死、细胞外基质过度积累、巨噬细胞浸润以及脂肪组织纤维化。细胞外基质过度沉积会增加胶原蛋白、纤维连接蛋白等表达,对于白色脂肪组织自然生长具有不利的影响[6,13-14],见图3。"
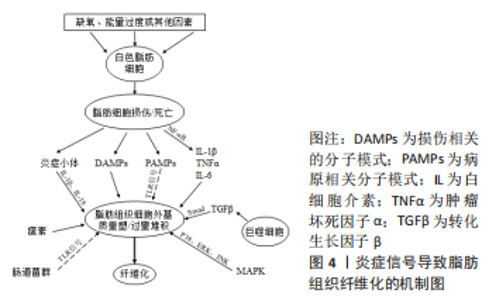
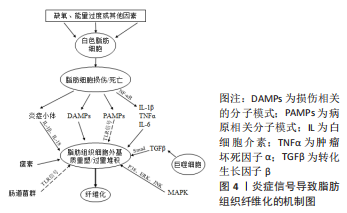
2.2 肥胖与脂肪组织炎症 肥胖引起的炎症与传统炎症并不相同,不会出现“红、肿、热、痛”等症状,研究者将其命名为“慢性低度炎症”[15]。白色脂肪组织中的慢性低度炎症是肥胖的显著特征,具体表现在以下3个方面。首先,肥胖患者血清脂肪源性炎性因子呈现明显变化,包括促炎因子白细胞介素1、肿瘤坏死因子α、C型凝集素明显增加,抗炎因子脂联素显著下降,这些炎症因子通过调节脂肪组织炎症影响纤维化进程以及器官之间的相互作用[16];其次,脂肪细胞体积扩大到氧气扩散的极限时,脂肪细胞在细胞外基质的机械应力和缺氧的低氧应力共同作用下容易发生凋亡,白色脂肪组织中的巨噬细胞能够识别并吞噬凋亡的脂肪细胞,在脂肪细胞之间形成“冠状结构”,因此有学者将冠状结构作为脂肪组织炎症的生物学标志[17-18]。在正常个体的白色脂肪组织中,“M2”型巨噬细胞高表达精氨酸酶Ⅱ,并且产生抗炎分子,如白细胞介素10,因此能够抑制促炎症细胞激活,有效平衡炎症反应。然而,在肥胖的发展过程中,脂肪细胞之间冠状结构中的巨噬细胞特异性表面抗原F4/80+、“M1”型巨噬细胞的相对数量增加,调节性T细胞、抗炎因子白细胞介素10的相对数量减少,以此诱发慢性低度炎症[19]。此外,在肥胖发生时巨噬细胞向“M1”促炎症表型发生极化,“M1”型巨噬细胞浸润程度与脂肪细胞大小之间存在正相关,并且炎性巨噬细胞的浸润能够导致全身性炎症。WEISBERG等[20]在高脂膳食喂养的C57BL/6J和B6.Cg Ay/+基因型小鼠的研究中发现,白色脂肪组织中巨噬细胞浸润对促炎症因子的释放具有很大贡献。脂肪组织巨噬细胞能够产生并分泌炎性因子,通过自分泌、旁分泌的方式激活NF-κB信号通路、TGF-β/Smad信号通路,从而调节全身代谢、局部和全身炎症以及细胞外基质的动态重塑[21]。 综上所述,白色脂肪组织中的慢性低度炎症是饮食诱导肥胖以及代谢性疾病的特征之一。作为对高脂饮食的反应,脂肪细胞首先经历体积扩大,与邻近细胞以及细胞外基质成分接触后承受更大的机械应力,容易表现出缺氧、脂肪分解增加和细胞外基质重塑改变[6]。然而,这种细胞外基质重塑通常不是良性的,在脂肪细胞体积扩大到氧气扩散的极限时,脂肪细胞在机械应力和缺氧应力的共同作用下容易发生死亡,死亡后的脂肪细胞具有吸引促炎性巨噬细胞的能力,从而导致白色脂肪组织慢性低度炎症以及脂肪组织纤维化。 2.3 肥胖与脂肪组织纤维化 肥胖诱导的白色脂肪组织扩张驱动细胞外基质的持续产生和沉积,称为细胞外基质重塑。这一过程涉及多种生物学过程,包括脂肪前体细胞增殖、成熟的脂肪细胞肥大、巨噬细胞极化、炎症免疫细胞浸润和脂肪组织纤维化。正常生理条件下,细胞外基质能够与脂肪组织的形态功能相适应,但是在白色脂肪组织发生缺氧和炎症后,则会导致细胞外基质发生病理性扩张,降低白色脂肪组织的灵活性和可塑性,这被认为是多种代谢性疾病的潜在危险因素[22]。纤维化越来越被视为白色脂肪组织功能障碍的主要标志。通过Masson三色和天狼猩红染色检测,饮食诱导的肥胖小鼠白色脂肪组织中出现过度的细胞外基质沉积[23]。转录组标记分析显示,肥胖小鼠腹部脂肪组织中Ⅰ型胶原α1、Ⅵ型胶原α3、纤维连接蛋白显著上调,在肥胖患者脂肪组织中与细胞外基质组分相关的基因表达较非肥胖者显著上调[24-25]。免疫印记显示,白色脂肪组织中纤维化相关蛋白表达程度与肥胖程度呈正相关,肥胖时脂肪组织纤维化程度增加[23,26-27]。免疫组织化学染色显示,与非肥胖者相比,肥胖患者网膜脂肪组织中脂肪细胞间Ⅰ型胶原、Ⅵ型胶原蛋白含量显著增加[28]。振动控制瞬时弹性成像技术是一种非侵入性测量生物组织硬度的方法,通过该方法测得肥胖患者脂肪组织硬度与免疫组化测得的脂肪组织纤维化程度存在显著正相关[29]。 综上所述,众多研究从内脏脂肪组织形态学、细胞外基质成分的基因表达、蛋白表达以及脂肪组织硬度等方面证实肥胖时脂肪组织纤维化增加,提示通过控制肥胖对于治疗脂肪组织纤维化的意义重大。 2.4 调节白色脂肪组织纤维化炎症相关的分子机制 在脂肪组织纤维化发生进程中脂肪组织慢性炎症的触发可能来自不同的信号刺激,包括缺氧导致的脂肪细胞死亡、细胞外基质重塑引起的机械转导以及脂肪源性的因子失调[6]。白色脂肪组织中炎症调节因子,包括白细胞介素1β、肿瘤坏死因子α、C型凝集素及脂联素等炎症因子的分泌和募集能够平衡脂肪组织慢性炎症;同时,脂肪组织慢性炎症的发生过程也受到多种信号通路的调控,从而共同调控脂肪组织纤维化进程,见图4。"
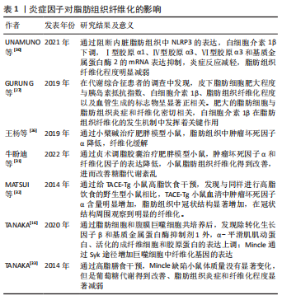
2.4.1 脂肪细胞因子与脂肪组织纤维化 白细胞介素1β:目前发现的白细胞介素1家族包括12个成员,其中主要成员白细胞介素1亚家族包括白细胞介素1α、白细胞介素1β、白细胞介素18、白细胞介素1受体A和白细胞介素 33,在多种疾病的免疫发病机制中起到重要作用,与肥胖和胰岛素抵抗相关。白细胞介素1α、白细胞介素1β、白细胞介素18、白细胞介素33是经典的促炎症细胞因子,而白细胞介素1受体A具有抗炎功能。脂肪组织中研究最多的是白细胞介素1β,已经确定其存在与脂肪组织纤维化及相关代谢疾病密切相关。如UNAMUNO等[30]通过阻断内脏脂肪组织中NLRP3的表达,发现下游关键炎症因子白细胞介素1β下调,参与脂肪组织纤维化的关键蛋白Ⅰ型胶原α1、Ⅳ型胶原α3、Ⅵ型胶原α3和基质金属蛋白酶2的mRNA表达抑制,炎症反应减轻,脂肪组织纤维化程度明显减弱。此外,GURUNG等[27]在代谢综合征患者的调查中发现,脂肪细胞肥大程度与胰岛素抵抗稳态模型、白细胞介素1β、脂肪组织纤维化程度以及血管生成的标志物呈显著正相关。上述研究提示,肥大的脂肪细胞与脂肪组织炎症和纤维化密切相关,白细胞介素1β在脂肪组织纤维化的发生机制中发挥着关键作用。 肿瘤坏死因子α:肿瘤坏死因子α是非糖基化蛋白质细胞因子,能够激活白细胞以调节炎症和免疫反应。在白色脂肪组织中作为炎症反应的关键细胞因子,肿瘤坏死因子α能通过激活炎症相关的信号通路促进白色脂肪组织炎症的发生诱导炎症反应,随后诱发脂肪组织纤维化。近年来还发现,肿瘤坏死因子α的表达增加会影响正常的糖脂代谢。王杨等[26]选用SPF级昆明小鼠建立肥胖模型之后给予小檗碱治疗,发现肥胖小鼠脂肪组织纤维化的减轻与抑制肿瘤坏死因子α有关。牛盼迪等[31]在肥胖模型小鼠中通过贞术调脂胶囊治疗,发现可以减弱炎症因子肿瘤坏死因子α和纤维化因子的表达,从而改善小鼠脂肪组织纤维化,进而改善糖脂代谢紊乱。MATSUI等[32]研究发现,肿瘤坏死因子α转化酶(TNF-α converting enzyme,TACE)过表达后得到的TACE转基因(TACE-transgenic,TACE-Tg)小鼠给予高脂饮食后,与同样高脂饮食的野生型小鼠相比,TACE-Tg小鼠血清中肿瘤坏死因子α含量明显增加,脂肪组织中冠状结构显著增加,并且在冠状结构周围观察到明显的纤维化,表明高脂饮食引起的肥胖能够增加肿瘤坏死因子α转化酶的表达,引起脂肪细胞的纤维化。 C型凝集素:巨噬细胞诱导的c型凝集素(macrophage-inducible C-type lectin,Mincle)是一种在脂肪组织中被发现的新型炎症调节因子,在白色脂肪组织中的促炎性“M1”型巨噬细胞中广泛表达[16]。据报道,脂肪细胞之间的冠状结构含有大量炎性“M1”型巨噬细胞,并且可以通过冠状结构反映脂肪组织的炎症程度,脂肪细胞-巨噬细胞之间的交互作用可能发生在冠状结构中。在高脂食干预后,与野生小鼠相比,Mincle敲除小鼠的体质量没有明显变化,但是葡萄糖代谢得到改善、肝脏脂质积累也明显减少,脂肪组织炎症和纤维化程度显著减弱[33]。Mincle可通过脾酪氨酸激酶(spleen tyrosine kinase,Syk)途径增加巨噬细胞中纤维化基因的表达。脂肪细胞和腹膜巨噬细胞共培养后,除转化生长因子β和基质金属蛋白酶抑制剂1外,α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、活化的成纤维细胞和胶原蛋白的表达上调[16]。值得注意的是,在野生型小鼠的肥胖脂肪组织中,发现α-平滑肌肌动蛋白阳性成纤维细胞在冠状结构周围聚集,但是Mincle缺陷小鼠中则明显减少。此外,当给予野生型小鼠海藻糖-6,6二甲酸盐(trehalose-6,6 Di mycolate,TDM)处理后,可诱导脂肪组织冠状结构形成和成纤维细胞活化[33]。以上结果表明,冠状结构是反映脂肪组织炎症以及纤维化的重要结构,提示脂肪组织巨噬细胞中的Mincle不仅参与炎症,而且还能够激活脂肪组织成纤维细胞,引发脂肪组织纤维化。 脂联素:脂联素是从脂肪细胞中分泌的一种分泌型血浆蛋白质,其通过修复损伤的内皮、增加胰岛素敏感性、调节糖类和脂质代谢,起到抗炎症、抗动脉粥样硬化的作用,形成多种生物学效应并且参与多种生理功能,已被证实通过调节转化生长因子β、MPK等信号通路来抑制细胞外基质沉积以及脂肪组织纤维化进程[34]。尽管这种由脂肪细胞分泌的蛋白在脂肪组织纤维化中的作用鲜有研究,但是在其他组织中发挥抗炎及抗纤维化的作用已经被广泛报道。如LUO等[35]通过研究发现,脂联素可以减弱转化生长因子β1介导的Ⅰ型胶原和纤维连接蛋的表达,并且上调基质金属蛋白酶1在成纤维细胞中的表达,在皮下脂肪组织纤维化的发展中发挥抗炎和抗纤维化的作用。WANG等[36]通过给雄性BALB/c小鼠注射博来霉素同时用脂联素干预处理,发现脂联素显著降低了肺组织中α-平滑肌肌动蛋白和Ⅰ型胶原的表达,降低了肿瘤坏死因子α、白细胞介素6、白细胞介素1β和白细胞介素18的浓度,并且抑制了IκB-α (Inhibitor kappa B alpha)的磷酸化和p65的核易位,因此减弱了博来霉素诱导的小鼠肺组织中胶原蛋白积累和炎症。 综上所述,现有的研究为脂联素在脂肪组织纤维化中的作用机制提供了有效的启发,并且可能是肾脏纤维化潜在的预防和治疗靶点。脂联素在脂肪组织纤维化中的作用及机制有必要进行深入研究,为探索脂肪组织纤维化及相关病症的发生提供新的潜在治疗靶点和理论依据,见表1。"
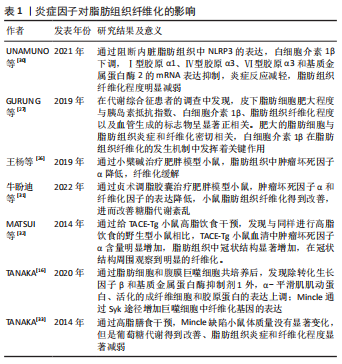

2.4.2 脂肪组织慢性炎症信号通路与脂肪组织纤维化 NF-κB信号通路:NF-κB是一种核转录因子,能够调节炎症和细胞凋亡,在炎症性疾病中发挥重要作用。Toll样受体、白细胞介素1β、肿瘤坏死因子α等多种炎症递质可激活NF-κB信号通路,促进促炎基因的表达以及巨噬细胞向“M1”促炎型转变,因此导致脂肪组织炎症和细胞死亡。通过抑制NF-κB信号可有效抑制细胞发生死亡,抑制脂肪组织炎症和纤维化[37]。WATANABE等[38]用异甘草素干预与脂肪细胞共同培养的巨噬细胞后,发现肿瘤坏死因子α诱导的脂肪细胞活化得到有效抑制,并且与NF-κB的抑制蛋白IκB-α磷酸化抑制高度相关。前脂肪细胞是一类成纤维细胞,在生长过程中不断吸收脂质,最终成为成熟的脂肪细胞;前脂肪细胞的迁移是白色脂肪组织发育的基础,但是过度的迁移可能会导致脂肪组织异常发育和纤维化相关疾病。LIU等[39]研究表明,抗癌药物水飞蓟宾(Silibinin)可通过诱导自噬负性调节NF-κB的磷酸化抑制Ⅰ型胶原α1的表达,从而促进小鼠前脂肪细胞的迁移。KEOPHIPHATH等[40]发现,前脂肪细胞中NF-κB p65亚基被敲除后其增殖能力降低、纤维连接蛋白表达和细胞外基质网络形成减少,脂肪组织纤维化减轻。表明NF-κB可能是调控人前脂肪细胞增殖、炎症和细胞外基质重构的重要分子。 以上研究强调了NF-κB在脂肪组织纤维化进展中起关键作用,未来可深入探析NF-κB在脂肪组织纤维化及相关疾病中的作用,有望为相关临床疾病的防治提供有益参考,见表2。"

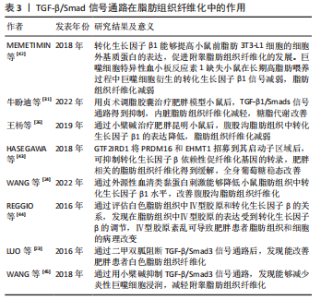
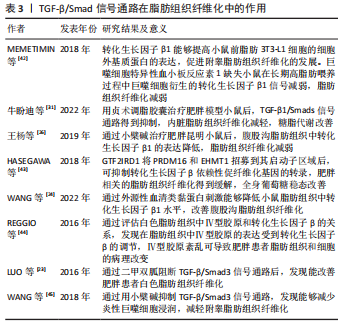
TGF-β/Smad信号通路:转化生长因子β在调节炎症、细胞增殖和维持组织稳态方面发挥关键作用。转化生长因子β可以通过多种信号途径促进纤维化的发生,其中TGF-β/Smad是促进纤维化发生最经典的途径。转化生长因子β通过刺激成纤维细胞的活化和增殖有利于细胞外基质蛋白的沉积并抑制其降解,并且表达水平与纤维化和疾病的严重程度密切相关[31,41]。例如,在细胞层面,MEMETIMIN等[42]发现转化生长因子β1能够提高小鼠前脂肪3T3-L1细胞的细胞外基质蛋白的表达水平,促进纤维化的发展。巨噬细胞特异性血小板反应素1在脂肪组织中高度表达,并与脂肪组织炎症和转化生长因子β1呈正相关,巨噬细胞特异性血小板反应素1缺失小鼠在长期高脂肪喂养过程中也观察到巨噬细胞衍生的转化生长因子β1信号传导减弱,脂肪组织纤维化缓解。在动物研究层面,牛盼迪等[31]利用C57BL/6肥胖模型小鼠,发现贞术调脂胶囊治疗后TGF-β1/Smads信号通路得到抑制并且减轻了内脏脂肪组织纤维化,糖脂代谢也得到改善。此外,王杨等[26]发现小檗碱能够降低肥胖小鼠脂肪组织中转化生长因子β1的表达并且减轻肥胖小鼠脂肪组织纤维化。HASEGAWA等[43]研究表明,GTF2IRD1将PRDM16和EHMT1招募到其启动子/增强子区域来抑制转化生长因子β依赖性促纤维化基因的转录,通过PRDM16复合物抑制肥胖相关的脂肪组织纤维化可以改善全身葡萄糖稳态。WANG等[24]发现血清类黏蛋白缺陷小鼠表现出肥胖表型,脂肪组织中胶原蛋白过度沉积,细胞外基质调节因子如基质金属蛋白酶2、基质金属蛋白酶13、基质金属蛋白酶14的表达升高。通过外源性血清类黏蛋白刺激能够降低小鼠脂肪组织中转化生长因子β1水平并改善脂肪组织纤维化。在人体实验研究层面,REGGIO等[44]通过评估白色脂肪组织中Ⅳ型胶原和转化生长因子β的关系,发现在脂肪组织中Ⅳ型胶原的表达与转化生长因子β基因的表达密切相关,Ⅳ型胶原紊乱可能导致肥胖患者脂肪组织和细胞的病理改变,并且受到转化生长因子β的调节。LUO等[23]研究发现,抗糖尿病的一线药物二甲双胍通过阻断TGF-β/Smad3通路能够改善肥胖患者白色脂肪组织纤维化;WANG等[45]得出了类似的结果,发现小檗碱通过抑制TGF-β/Smad3通路能够减少炎性巨噬细胞浸润,减轻附睾脂肪组织纤维化。 综上,TGF-β/Smad信号通路的激活具有促进脂肪组织纤维化的作用,因此限制转化生长因子β的活化可能是防止脂肪组织纤维化的机制之一。这些研究为转化生长因子β在脂肪组织纤维化进展中的作用提供了参考。值得注意的是,在脂肪组织纤维化的相关研究中,除了与转化生长因子β相关的经典通路依赖Smad信号发挥作用以外,非Smad信号途径也会发挥作用。转化生长因子β与受体相互作用可以触发Ras同源基因 Rho/ROCK信号、p38信号、JNK信号等非Smad信号途径的调控,进而参与炎症和脂肪组织纤维化的发生及发展,见表3。"

MAPK信号通路:MAPK信号通路是细胞中一条重要的分子通路,包含三级信号传递过程:MAPK激酶激酶、MAPK激酶和MAPK组成,这3种激酶依次激活,在上游激活蛋白的作用下以三级磷酸化激活的方式依次活化将信号转入细胞核内,共同调节细胞的生长、分化、对于环境的应激适应、炎症反应等多种生理病理过程[46]。 细胞外信号调节蛋白激酶(ERK1/2)、c-Jun N末端激酶(JNK)和p38构成经典的MAPK通路,参与肥胖诱导的白色脂肪组织炎症和胰岛素抵抗[46-47]。P38 MAPK信号通路可以在炎症和细胞凋亡等应激反应中激活,并且在脂肪组织重塑中发挥作用。有研究表示,精氨酸酶Ⅱ通过p38 MAPK促进老龄小鼠内脏脂肪组织中白细胞介素6的表达和分泌,靶向抑制P38 MAPK则有助于减少年龄相关的白色脂肪组织炎症[48]。GURUNG等[27]在患有代谢综合征患者的皮下脂肪细胞中发现,脂肪细胞的肥大程度与白色脂肪组织的胰岛素抵抗、炎症程度和循环单核细胞中NF-κB活性呈显著正相关,用小檗碱治疗后,增加了脂肪细胞AMPK的活性,抑制转化生长因子β信号通路,改善脂肪组织纤维化。 JNK在肥胖和2型糖尿病患者的脂肪组织、肝脏中广泛表达。JNK信号通路在肥胖过程中参与成纤维细胞的凋亡、增殖和胶原蛋白的合成过程,并且与脂肪组织纤维化密切相关。据报道,特异性抑制小鼠脂肪组织中JNK1和JNK2能够抵抗高脂饮食诱导的肥胖及相关的代谢失调,减少脂肪组织中炎症巨噬细胞浸润[49]。此外,VAN PELT等[50]通过基因芯片和通路分析表明,与高脂肪酸出现率高的肥胖患者相比,低脂肪酸出现率高的肥胖患者JNK通路活性更低,并且脂肪组织纤维化程度也低。WATANABE等[38]研究发现,异甘草素能抑制棕榈酸诱导的“M1”型巨噬细胞活化,降低JNK的表达水平,改善由于高脂肪饮食诱导的脂肪组织纤维化。值得注意的是,SUGA等[51]发现,通过抑制JNK信号通路可阻止肝细胞生长因子的升高,诱导损伤脂肪组织的成纤维细胞增加。由此可见,在JNK信号通路中,并非抑制后就会对于脂肪组织细胞外基质的重塑有利,反而会增加腹股沟皮下脂肪组织中的成纤维细胞含量,起到促进脂肪组织纤维化的作用,提示JNK信号通路对于脂肪组织纤维化的作用及机制是复杂的,有待进一步研究。 3T3-L1脂肪细胞分化为胰岛素抵抗和肥大的脂肪细胞后用二甲双胍处理,发现整合素/ERK通路被抑制,并且细胞外基质成分如Ⅵ型胶原、基质金属蛋白酶2和基质金属蛋白酶9等蛋白和基因的表达出现下调,从而发挥对胰岛素抵抗和脂肪组织纤维化的保护作用[52],提示通过靶向抑制ERK能够缓解脂肪组织纤维化的发生,从而可能限制代谢性疾病的发生和发展。 总之,以上研究表明了MAPK信号通路在白色脂肪组织中发挥直接影响纤维化的作用。因此,通过靶向抑制MAPK有望成为治疗脂肪组织纤维化的新靶点。"

| [1] YING W, FU W, LEE YS, et al. The role of macrophages in obesity-associated islet inflammation and β-cell abnormalities. Nat Rev Endocrinol. 2020;16(2):81-90. [2] FUCHS A, SAMOVSKI D, SMITH GI, et al. Associations Among Adipose Tissue Immunology, Inflammation, Exosomes and Insulin Sensitivity in People With Obesity and Nonalcoholic Fatty Liver Disease. Gastroenterology. 2021;161(3):968-981.e12. [3] SUN H, SAEEDI P, KARURANGA S, et al. IDF Diabetes Atlas: Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045. Diabetes Res Clin Pract. 2022;183:109119. [4] MARCELIN G, GAUTIER EL, CLÉMENT K. Adipose Tissue Fibrosis in Obesity: Etiology and Challenges. Annu Rev Physiol. 2022;84:135-155. [5] SPERRIN M, MARSHALL AD, HIGGINS V, et al. Slowing down of adult body mass index trend increases in England: a latent class analysis of cross-sectional surveys (1992-2010). Int J Obes (Lond). 2014;38(6):818-824. [6] LIU W, LI D, CAO H, et al. Expansion and inflammation of white adipose tissue - focusing on adipocyte progenitors. Biol Chem. 2020;402(2):123-132. [7] THOMAS D, APOVIAN C. Macrophage functions in lean and obese adipose tissue. Metabolism. 2017;72:120-143. [8] LI S, GAO H, HASEGAWA Y, et al. Fight against fibrosis in adipose tissue remodeling. Am J Physiol Endocrinol Metab. 2021;321(1):E169-E175. [9] HEINONEN S, JOKINEN R, RISSANEN A, et al. White adipose tissue mitochondrial metabolism in health and in obesity. Obes Rev. 2020;21(2): e12958. [10] KITA S, MAEDA N, SHIMOMURA I. Interorgan communication by exosomes, adipose tissue, and adiponectin in metabolic syndrome. J Clin Invest. 2019; 129(10):4041-4049. [11] MOTA M, BANINI BA, CAZANAVE SC, et al. Molecular mechanisms of lipotoxicity and glucotoxicity in nonalcoholic fatty liver disease. Metabolism. 2016;65(8):1049-1061. [12] MILJKOVIC I, KUIPERS AL, CVEJKUS R, et al. Myosteatosis increases with aging and is associated with incident diabetes in African ancestry men. Obesity (Silver Spring). 2016;24(2):476-482. [13] KOENEN M, HILL MA, COHEN P, et al. Obesity, Adipose Tissue and Vascular Dysfunction. Circ Res. 2021;128(7):951-968. [14] LAWLER HM, UNDERKOFLER CM, KERN PA, et al. Adipose Tissue Hypoxia, Inflammation, and Fibrosis in Obese Insulin-Sensitive and Obese Insulin-Resistant Subjects. J Clin Endocrinol Metab. 2016;101(4): 1422-1428. [15] HOTAMISLIGIL GS. Inflammation, metaflammation and immunometabolic disorders. Nature. 2017;542(7640):177-185. [16] TANAKA M. Molecular mechanism of obesity-induced adipose tissue inflammation; the role of Mincle in adipose tissue fibrosis and ectopic lipid accumulation. Endocr J. 2020;67(2):107-111. [17] 陆敏,袁琳,胡娜,等.双歧杆菌三联活菌对肥胖小鼠慢性低度炎症的影响[J].卫生研究,2022,51(5):797-802. [18] HAKA AS, BARBOSA-LORENZI VC, LEE HJ, et al. Exocytosis of macrophage lysosomes leads to digestion of apoptotic adipocytes and foam cell formation. J Lipid Res. 2016;57(6):980-992. [19] 罗维,艾磊,王俐颖,等.下坡跑调节TRIB3/AKT通路和巨噬细胞极化改善肥胖小鼠脂肪组织慢性炎症[J].北京体育大学学报,2021,44(10): 110-120. [20] WEISBERG SP, MCCANN D, DESAI M, et al. Obesity is associated with macrophage accumulation in adipose tissue. J Clin Invest. 2003;112(12): 1796-1808. [21] SCHERER PE. The Multifaceted Roles of Adipose Tissue-Therapeutic Targets for Diabetes and Beyond: The 2015 Banting Lecture. Diabetes. 2016;65(6): 1452-1461. [22] HAMMARSTEDT A, GOGG S, HEDJAZIFAR S, et al. Impaired Adipogenesis and Dysfunctional Adipose Tissue in Human Hypertrophic Obesity. Physiol Rev. 2018;98(4):1911-1941. [23] LUO T, NOCON A, FRY J, et al. AMPK Activation by Metformin Suppresses Abnormal Extracellular Matrix Remodeling in Adipose Tissue and Ameliorates Insulin Resistance in Obesity. Diabetes. 2016;65(8):2295-2310. [24] WANG PY, FENG JY, ZHANG Z, et al. The adipokine orosomucoid alleviates adipose tissue fibrosis via the AMPK pathway. Acta Pharmacol Sin. 2022; 43(2):367-375. [25] JONES JEC, RABHI N, OROFINO J, et al. The Adipocyte Acquires a Fibroblast-Like Transcriptional Signature in Response to a High Fat Diet. Sci Rep. 2020; 10(1):2380. [26] 王杨,孔敏,宋晓瑜,等.小檗碱对肥胖小鼠脂肪组织纤维化及肠道菌群的调节作用研究[J].食品研究与开发,2019,40(20):201-206. [27] GURUNG P, MOUSSA K, ADAMS-HUET B, et al. Increased mast cell abundance in adipose tissue of metabolic syndrome: relevance to the proinflammatory state and increased adipose tissue fibrosis. Am J Physiol Endocrinol Metab. 2019;316(3):E504-E509. [28] SOTÁK M, RAJAN MR, CLARK M, et al. Healthy Subcutaneous and Omental Adipose Tissue Is Associated with High Expression of Extracellular Matrix Components. Int J Mol Sci. 2022;23(1):520. [29] ABDENNOUR M, REGGIO S, LE NAOUR G, et al. Association of adipose tissue and liver fibrosis with tissue stiffness in morbid obesity: links with diabetes and BMI loss after gastric bypass. J Clin Endocrinol Metab. 2014;99(3):898-907. [30] UNAMUNO X, GÓMEZ-AMBROSI J, RAMÍREZ B, et al. NLRP3 inflammasome blockade reduces adipose tissue inflammation and extracellular matrix remodeling. Cell Mol Immunol. 2021;18(4):1045-1057. [31] 牛盼迪,郑皎碧,张盛昔,等.贞术调脂胶囊对脂肪组织纤维化小鼠的改善作用[J].中药材,2022,45(9):2216-2220. [32] MATSUI Y, TOMARU U, MIYOSHI A, et al. Overexpression of TNF-α converting enzyme promotes adipose tissue inflammation and fibrosis induced by high fat diet. Exp Mol Pathol. 2014;97(3):354-358. [33] TANAKA M, IKEDA K, SUGANAMI T, et al. Macrophage-inducible C-type lectin underlies obesity-induced adipose tissue fibrosis. Nat Commun. 2014;5:4982. [34] KHORAMIPOUR K, CHAMARI K, HEKMATIKAR AA, et al. Adiponectin: Structure, Physiological Functions, Role in Diseases, and Effects of Nutrition. Nutrients. 2021;13(4):1180. [35] LUO L, LI J, WU Y, et al. Adiponectin, but Not TGF-β1, CTGF, IL-6 or TNF-α, May Be a Potential Anti-Inflammation and Anti-Fibrosis Factor in Keloid. J Inflamm Res. 2021;14:907-916. [36] WANG X, YANG J, WU L, et al. Adiponectin inhibits the activation of lung fibroblasts and pulmonary fibrosis by regulating the nuclear factor kappa B (NF-κB) pathway. Bioengineered. 2022;13(4):10098-10110. [37] RAMOS-TOVAR E, MURIEL P. Molecular Mechanisms That Link Oxidative Stress, Inflammation, and Fibrosis in the Liver. Antioxidants (Basel). 2020; 9(12):1279. [38] WATANABE Y, NAGAI Y, HONDA H, et al. Isoliquiritigenin Attenuates Adipose Tissue Inflammation in vitro and Adipose Tissue Fibrosis through Inhibition of Innate Immune Responses in Mice. Sci Rep. 2016;6:23097. [39] LIU X, XU Q, LONG X, et al. Silibinin-induced autophagy mediated by PPARα-sirt1-AMPK pathway participated in the regulation of type I collagen-enhanced migration in murine 3T3-L1 preadipocytes. Mol Cell Biochem. 2019;450(1-2):1-23. [40] KEOPHIPHATH M, ACHARD V, HENEGAR C, et al. Macrophage-secreted factors promote a profibrotic phenotype in human preadipocytes. Mol Endocrinol. 2009;23(1):11-24. [41] ONG CH, THAM CL, HARITH HH, et al. TGF-β-induced fibrosis: A review on the underlying mechanism and potential therapeutic strategies. Eur J Pharmacol. 2021;911:174510. [42] MEMETIMIN H, LI D, TAN K, et al. Myeloid-specific deletion of thrombospondin 1 protects against inflammation and insulin resistance in long-term diet-induced obese male mice. Am J Physiol Endocrinol Metab. 2018;315(6):E1194-E1203. [43] HASEGAWA Y, IKEDA K, CHEN Y, et al. Repression of Adipose Tissue Fibrosis through a PRDM16-GTF2IRD1 Complex Improves Systemic Glucose Homeostasis. Cell Metab. 2018;27(1):180-194.e6. [44] REGGIO S, ROUAULT C, POITOU C, et al. Increased Basement Membrane Components in Adipose Tissue During Obesity: Links With TGFβ and Metabolic Phenotypes. J Clin Endocrinol Metab. 2016;101(6):2578-2587. [45] WANG L, YE X, HUA Y, et al. Berberine alleviates adipose tissue fibrosis by inducing AMP-activated kinase signaling in high-fat diet-induced obese mice. Biomed Pharmacother. 2018;105:121-129. [46] LU HD, LIU ZC, ZHOU LY, et al. Influence of the TLR4-mediated p38MAPK signaling pathway on chronic intermittent hypoxic-induced rat’s oxidative stress and inflammatory cytokines in rats. Eur Rev Med Pharmacol Sci. 2019;23(1):352-360. [47] OZAKI KI, AWAZU M, TAMIYA M, et al. Targeting the ERK signaling pathway as a potential treatment for insulin resistance and type 2 diabetes. Am J Physiol Endocrinol Metab. 2016;310(8):E643-E651. [48] HUANG J, LIU C, MING XF, et al. Inhibition of p38mapk Reduces Adipose Tissue Inflammation in Aging Mediated by Arginase-II. Pharmacology. 2020;105(9-10):491-504. [49] ZHANG X, XU A, CHUNG SK, et al. Selective inactivation of c-Jun NH2-terminal kinase in adipose tissue protects against diet-induced obesity and improves insulin sensitivity in both liver and skeletal muscle in mice. Diabetes. 2011;60(2):486-495. [50] VAN PELT DW, GUTH LM, WANG AY, et al. Factors regulating subcutaneous adipose tissue storage, fibrosis, and inflammation may underlie low fatty acid mobilization in insulin-sensitive obese adults. Am J Physiol Endocrinol Metab. 2017;313(4):E429-E439. [51] SUGA H, ETO H, SHIGEURA T, et al. IFATS collection: Fibroblast growth factor-2-induced hepatocyte growth factor secretion by adipose-derived stromal cells inhibits postinjury fibrogenesis through a c-Jun N-terminal kinase-dependent mechanism. Stem Cells. 2009;27(1):238-249. [52] MALEKPOUR-DEHKORDI Z, TEIMOURIAN S, NOURBAKHSH M, et al. Metformin reduces fibrosis factors in insulin resistant and hypertrophied adipocyte via integrin/ERK, collagen VI, apoptosis, and necrosis reduction. Life Sci. 2019;233:116682. |
| [1] | Wang Ji, Zhang Min, Li Wenbo, Yang Zhongya, Zhang Long. Effect of aerobic exercise on glycolipid metabolism, skeletal muscle inflammation and autophagy in type 2 diabetic rats [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1200-1205. |
| [2] | Ruan Rong, Lou Xujia, Jin Qiguan, Zhang Libing, Xu Shang, Hu Yulong. Effect of resveratrol on gluconeogenesis in exercise-induced fatigue rats [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1229-1234. |
| [3] | Zeng Fanzhuo, Li Yuxin, Sun Jiachen, Gu Xinyang, Wen Shan, Tian He, Mei Xifan. Efficient strategies for microglia replacement in spinal cord injury models [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1007-1014. |
| [4] | Mu Bingtao, Yu Jingwen, Liu Chunyun, Guo Minfang, Meng Tao, Yang Pengwei, Wei Wenyue, Song Lijuan, Yu Jiezhong, Ma Cungen. Immunomodulatory effect of astragaloside IV on T cells of experimental autoimmune encephalomyelitis mice [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1057-1062. |
| [5] | Kaiyisaier•Abudukelimu, Maimaitimin•Abulimiti, Li Lei, Yang Xiaokai, Zhang Yukun, Liu Shuai. Effect of lumbar CT values in the diagnosis of osteoporosis in women patients with lumbar degenerative diseases [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(6): 945-949. |
| [6] | Zhang Kefan, Shi Hui. Research status and application prospect of cytokine therapy for osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(6): 961-967. |
| [7] | Zhu Xiaofeng, Chen Weiwei, Huang Jian. Effects of maternal high-fat diet and exercise intervention on insulin sensitivity and the hypothalamic arcuate nucleus in male offspring mice [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 556-561. |
| [8] | Wang Shijie, Wen Dengtai, Wang Jingfeng, Gao Yinghui. Mammalian target of rapamycin in relation to exercise, high fat/high salt diet, and aging [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 574-580. |
| [9] | Yang Yuqing, Chen Zhiyu. Role and application of early transient presence of M1 macrophages in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 594-601. |
| [10] | Sun Yuan, Wang Qingbo, Pi Yihua, Lu Chunmin, Xu Chuanyi, Zhang Yan. Effects of early and late aerobic exercise on right heart failure induced by monocrotaline in rats with pulmonary hypertension [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(2): 177-185. |
| [11] | Dai Xinyu, Yan Jihong, Hua Lingjun, Zheng Xiaohong. Resistance exercise improves body composition in overweight and obese people: an umbrella review [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(2): 267-271. |
| [12] | Guo Xiangying, Peng Zifu, He Yimin, Fang Hongbo, Jiang Ning. MiRNA-122 contributes to the effect of exercise on non-alcoholic fatty liver [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(2): 272-279. |
| [13] | Meng Zhicheng, Qiao Weiping, Zhao Yang, Liu Hongfei, Li Kaijie, Ma Bo. Effects of immune cells and related cytokines in the pathogenesis and treatment of osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(2): 280-287. |
| [14] | Yang Qihang, Pu Rui, Chen Ziyang, Leng Siyi, Song Yongjing, Liu Hui, Du Guangyou. Role and mechanism of intestinal flora metabolites in obesity regulation [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(2): 308-314. |
| [15] | Long Yi, Yang Jiaming, Ye Hua, Zhong Yanbiao, Wang Maoyuan. Extracellular vesicles in sarcopenic obesity: roles and mechanisms [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(2): 315-320. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||