Chinese Journal of Tissue Engineering Research ›› 2017, Vol. 21 ›› Issue (30): 4893-4900.doi: 10.3969/j.issn.2095-4344.2017.30.023
Previous Articles Next Articles
Application of chitosan scaffolds in tissue engineering
- School of Life Science and Medicine, Panjin Campus, Dalian University of Technology, Panjin 124221, Liaoning Province, China
-
Received:2017-05-19Online:2017-10-28Published:2017-11-07 -
Contact:Jiang Li-li, School of Life Science and Medicine, Panjin Campus, Dalian University of Technology, Panjin 124221, Liaoning Province, China -
About author:Chen Dao-yu, Studying for master’s degree, School of Life Science and Medicine, Panjin Campus, Dalian University of Technology, Panjin 124221, Liaoning Province, China -
Supported by:the Fundamental Research Funds for the Central Universities, No. DUT16RC(4)73; the General Research Project of the Department of Education of Liaoning Province, No. L2015111
CLC Number:
Cite this article
Chen Dao-yu, Zhang Zhong-min, Jiang Li-li .
share this article
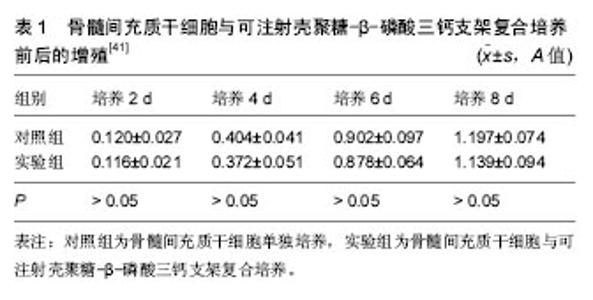
壳聚糖支架目前已在神经组织工程[15]、眼角膜组织工程、牙周组织工程、软骨组织工程[16]、骨组织工程[17]、皮肤组织工程[18]、心肌组织工程等方面有了广泛应用。但随着科技的进步,组织工程支架有利于组织修复的机制仍然存在许多争议,人们尝试分析壳聚糖支架在不同组织重建中发挥作用的机制,以求进一步拓宽生物材料的来源。 2.1 壳聚糖支架在神经组织工程中的应用 神经受损可能会影响机体之间的信号传导、正反馈或负反馈是否正常。尽管当今神经外科中显微手术取得巨大进步,但要在受损神经末梢将受损神经重新连接起来仍然是一个巨大的挑战。损伤的神经组织通常伴随着树突细胞功能退化,最终可能导致相应的肌肉萎缩。当前临床治疗中最佳的治疗方式是移植自体神经组织以修复受损的神经组织,但这样伴随着附加损伤,可能最终结果得不偿失。因此最经济适用又能在功能上满足患者需求的就是移植可降解支架材料,支架材料在受损的两个神经末端之间起到桥梁的作用,为两部分组织之间的愈合生长提供相应依托[19]。由于壳聚糖生物相容性好、容易降解而在神经组织重建中应用成熟。例如,Skop等[20]以壳聚糖为支架、人类脐血干细胞为种子细胞、脑源性神经营养修复因子为生长因子构建了体外神经恢复模型,将脑源性神经营养修复因子携载在多孔壳聚糖支架上,缓释效果良好,有利于人类脐血干细胞向神经细胞分化。但壳聚糖支架仍然存在一些缺陷,例如在支架制备过程中需要使用交联剂,而如今的交联剂多为京尼平、戊二醛,具有一定的细胞毒性,脆性较大,可能对周围神经组织产生压迫等,这些都有可能给接受神经组织移植患者带来不良反应。 为了克服壳聚糖材料本身特性对神经修复的影响,有报道指出采用壳聚糖和明胶两种材料制备神经导管以代替支架,不仅缩短了支架降解速率,而且降低了支架本身的硬度[21],减少了移植物对自身神经组织的压迫,增强了支架材料的相容性。分析壳聚糖/明胶材料的复合也许可归因于明胶的碱性基团和壳聚糖阳离子的结合,而明胶含有大量羟基,亲水性极强且易溶胀[22],因此降低了壳聚糖支架材料的硬度、加快了壳聚糖支架的降解速度同时,克服了明胶形态易变化的缺陷。后续研究表明,这种支架构建的神经修复组织移植取得了可喜的治疗效果[23]。 此外,神经组织修复最好的预期是能够恢复神经细胞之间的电信号传导,而壳聚糖是天然多聚糖,导电性能很差,针对这个问题,笔者考虑在后续的研究中可聚合壳聚糖和易导电的物质,以适应神经组织支架电信号传导的需求。 2.2 壳聚糖支架在眼角膜组织工程中的应用 角膜疾病是最常见的致盲原因,全球有超过1 000万人因为缺乏角膜捐献者不能进行角膜移植导致失明[24]。因此,长期以来,医疗工作者们一直渴望建立一个不仅形态类似于人类角膜同时功能上和人类角膜相似的人工角膜。早在20世纪末期就有研究者采用兔角膜细胞、牛角膜细胞、上皮细胞、内皮细胞用于研究眼角膜组织重建,然而由于缺少必要的弹性而难以固定、形成有弧度的角膜形状,难以用于外科手术操作。Huang等[24]采用弹性性能较好的壳聚糖和胶原蛋白结合,一方面增强了人造角膜的机械应力、弹性模量,另一方面加入的胶原蛋白能和蛋白酶作用使得支架降解速率减慢;此外,壳聚糖还具有足够的抗拉强度来支持胶原蛋白形成不同的形状,经验证该人工角膜具有天然角膜的光学性能和机械性能,并且能够再生机体天然角膜细胞,容易用于批量生产、储存和运输。这些特点使壳聚糖/胶原支架制备的人工角膜有应用在临床的潜在价值。 为了具体分析壳聚糖浓度对人工角膜形态、依附力及细胞分化的影响,Guan等[25]对由蚕丝蛋白和壳聚糖制备的有角膜基质细胞参与的人工角膜进行了功能性分析,将蚕丝蛋白/壳聚糖以不同比例制备成作为衬底的角膜基质。研究结果表明,蚕丝蛋白/壳聚糖角膜基质的附着能力和天然角膜相差不大,但随着壳聚糖比例的增高,该角膜基质的抗拉强度越大;Western blot 结果显示角膜蛋白表达量增加,并且将该人工角膜基质移植在兔角膜缺口中长时间观察没有任何炎症反应。这说明该蚕丝蛋白/壳聚糖人工角膜基质不仅能够促进角膜基质蛋白的高表达,有利于天然角膜形成,同时可能具有免疫调控功能,能够降低移植时机体的免疫排斥反应。由上述研究可总结出:壳聚糖作为机械应力适中的材料应用于角膜组织工程中,能够为人工角膜提供一定的机械应力,同时由于壳聚糖呈无色透明状,具有一定的抗菌性质,应用在动物实验中没有出现明显浑浊,而这些性质都将为壳聚糖人工角膜的临床治疗打下夯实的基础。同时,对于人工角膜移植外科手术中人工角膜不足以抵抗镊子的机械应力问题,笔者认为可利用壳聚糖制备温敏性人工角膜,使其在低于37 ℃时处于固态,37 ℃时处于凝胶状,即可满足临床应用的需要,不过,后续研究及具体分析仍需各方专家进一步进行探讨。 人工角膜的重建具有非凡意义,它不单单是对有视觉障碍的患者而言,如果人工角膜在今后能够应用在临床中且能达到和天然角膜相同的视觉效果,也许就意味着“三只眼”的二郎神将不再是神话中才有的人物。 2.3 壳聚糖支架在牙周组织工程中的应用 中国人的牙龈组织损伤高达18%[26],更为严重的是口腔易受外界细菌感染,一旦牙龈组织损伤,没有引起重视采取一定的治疗手段,损伤会进一步扩大、恶化。牙周组织重建涉及的问题比较多,比如,要考虑牙周神经组织众多,尽量减少压迫;其次,牙髓细胞不易增殖,组织重建周期较长;最重要的是牙周组织易受细菌感染,导致牙髓细胞坏死。壳聚糖已被证明有天然抗菌性质,并且早在十几年前就有人证明壳聚糖作用于牙周组织重建后存在新生的细胞外基质[27]。这说明壳聚糖支架不仅可为细胞生长提供微环境,还有可能在壳聚糖支架降解以后生成天然的细胞外基质。这对于组织工程而言意味着替代材料在降解的同时也促进了被替代物的生长,两个过程同时进行,在功能上满足患者需要的同时可减少自身免疫排斥的风险。基于这一研究,该课题组又在壳聚糖/胶原支架中携载了质粒纳米粒子编码的血小板衍生生长因子,该生长因子可在支架材料中持续6周缓慢释放,在接种两周之后,有明显的牙周组织重生[28],进一步证明了壳聚糖不仅可作为细胞生长的细胞外基质,同时能够作为携载生长因子促进组织生长的载体,壳聚糖的多功能性使其在组织工程中的应用范围进一步扩大。 另外,有报道称,碱性成纤维细胞生长因子被证明能增强血管内皮细胞、上皮细胞、成肌细胞等多种起源于中胚层、外胚层的细胞分化增殖,具有能够促进皮肤组织再生和治疗骨折潜能[29],同时也有研究表明碱性成纤维细胞生长因子能够促进牙髓细胞的成活概率,并作了一系列的动物实验证明自己的结论[30],并且当前碱性成纤维细胞生长因子已被证明能够促进缺陷牙周再生。地塞米松能够抑制人牙髓细胞的增殖,促进其分化,同时能够提高碱性磷酸酶的含量,有利于牙周组织重建[31]。然而携载地塞米松和碱性成纤维细胞生长因子的壳聚糖支架,地塞米松在5 d内缓慢释放,碱性成纤维细胞生长因子却在20 h内释放完全[32]。随后有人将羟基磷灰石和壳聚糖复合后,研究发现碱性成纤维细胞生长因子的缓释周期延长至7 d。猜测产生该现象的原因是加入的羟基磷灰石能和碱性成纤维细胞生长因子很好地以非共价键结合,保障碱性成纤维细胞生长因子结构不变的同时,能够稳定、缓慢释放。这种生长因子/壳聚糖/羟基磷灰石复合支架能够为细胞生长、增殖及矿化过程提供相应的微环境[33],非常适合应用于牙周组织重建。 牙周组织重建不仅要营造相应的细胞生长微环境,同时要促进牙髓细胞增殖,这就催生了各种由于不同目的而制备的功能各异的组织工程支架,例如,能促进细胞分化、促进细胞增殖、促进细胞功能性蛋白分泌等等。支架的功能多样化,也在某种程度上促进了特色化医疗的发展。 2.4 壳聚糖支架在骨组织工程中的应用 骨组织重建和修复复杂而具有挑战性,因为它不仅是模拟细胞外基质为细胞的生长、分化提供适宜的环境,还要求重建的骨组织具有一定的机械应力,同时能够克服切口的炎症反应[34],防止骨愈合的推迟效应[35]。相较于凝胶、胶原作为支架材料,壳聚糖不仅生物相容性好,还拥有更好的机械应力[36],因而应用在骨组织工程中具有得天独厚的优势。有实验证明骨成形蛋白家族在体外能够诱导成骨细胞的分化。然而,骨成形蛋白结构复杂,性质不稳定,半衰期短,能被免疫系统快速清除[37-38],这些因素都阻碍了它在骨组织工程中的应用。有趣的是,壳聚糖和骨成形蛋白2具有相同的等电点,壳聚糖作为骨成形蛋白2的载体,能够达到长周期的缓释效果。研究表明骨成形蛋白2经由壳聚糖-透明质酸聚合物包载,在聚合物支架上接种的成骨前体细胞成骨前体基因表达过量[39]。这就证明了骨成形蛋白和壳聚糖结合确实能够提高骨组织重建能力。但是,不得不说的是,壳聚糖作为骨组织工程的支架材料显示出良好的重建能力,除了由于壳聚糖为细胞生长提供细胞外基质、携载促进骨细胞分化的生长因子以外,也部分归因于壳聚糖的抗炎性质。体外移植物和自体总是会产生免疫排斥,进而引发炎症反应,而壳聚糖具有消炎功能,这在某种程度上减弱了免疫排斥反应,促进骨组织愈合。 但单纯以壳聚糖为材料制备组织工程支架,机械应力远远不能满足骨组织所应承接的力量。因此,壳聚糖支架的机械应力也可通过和天然骨组织含的羟基磷灰石材料进行复合得以提高。Pangon等[40]应用几丁质晶体/壳聚糖/羟基磷灰石来提高重建骨组织的机械性能,几丁质和羟基磷灰石结合对于成骨细胞的迁移和增殖起关键性作用,同时也显著提高了壳聚糖支架材料的机械性能。以壳聚糖为材料的组织工程支架不仅能够模拟成骨细胞的生存环境,提高重建组织的机械应力[41],同时作为携载骨成形蛋白的最佳备选材料在骨组织重建工程中有深远的应用前景,近几年的国内研究中,科学家发现,将壳聚糖保持在凝胶可注射状态有利于细胞增殖(表1),证明了壳聚糖材料的良好生物相容性,然而美中不足的是,该研究并没有进一步证明可注射壳聚糖能够促进干细胞向骨组织细胞的生长分化[42],在往后的发展中,有望探索骨组织工程壳聚糖支架作用于细胞的机制,以及是否能够促进种子细胞向某一特定的细胞类型分化,进而在临床上展开应用。同时,复合支架为壳聚糖在组织工程中的应用打开了新的大门,但复合支架是否改变了壳聚糖原有的性质,例如抗菌消炎、抗氧化性质目前还不得而知。 2.5 壳聚糖支架在软骨组织工程中的应用 骨关节炎是会随着时间推移日益恶化的慢性病[43],目前主要的治疗药物都只能起到缓解症状的作用,例如非固醇类抗炎药及糖皮质激素[44]。这些药物对于疾病本身的治疗作用并不是很明显,并且长期服用这种药物会对心肌造成损伤[45]。软骨组织工程成为骨关节炎患者的福音,为骨关节炎患者带来了治愈骨关节炎的希望。然而因其缺少血管和细胞,重建的软骨功能实现甚少[46-47],国内有研究学者证明通过复合软骨细胞、胶原、壳聚糖能够提高细胞增殖活性,然而该研究结果依然由于氧气和营养物质不均衡而受到限制,利用生物材料作为软骨组织工程支架,模拟软骨组织的微环境为重建组织提供充分的氧气和营养物质提高细胞的存活率成为当今软骨组织工程的首要难题[48]。 壳聚糖是自然界普遍存在的一种黏多糖,并且它的结构和软骨结构有一定相似性,黏多糖是构成细胞间结缔组织的主要成分,再加上Ⅱ型胶原和聚集蛋白聚糖是关节软骨中主要存在的蛋白聚糖[49],所以要制备生物相容性并能使Ⅱ型胶原和聚集蛋白聚糖含量增加的壳聚糖支架成为治疗骨关节炎的突破点。 Müller等[50]发表的最新研究成果表示,聚磷酸/藻酸盐/N,O-羧甲基壳聚糖复合支架不仅可在钙离子作用下提高自身硬度,增强相应的机械应力,以适应软骨组织的功能,同时能够使Ⅱ型胶原和聚集蛋白聚糖含量增加,使其模仿的生物环境更加接近软骨组织。具有生物活性的壳聚糖做为软骨组织工程支架的材料,不仅可参与抗炎症反应,具有杀菌消毒的功效[51],同时也能为再生的软骨组织提供相似的生长结构框架,这在某种程度上可以影响到细胞的生长、分化,进而诱导重建组织和真实组织更加相近。 2.6 壳聚糖在皮肤组织工程中的应用 受损的皮肤组织重建是最为长久的课题之一,由于真皮组织自愈合相对困难,瘢痕形成以后相对于完整的皮肤组织厚度明显减少,弹性降低,并且影响美观。因此,为受损皮肤组织寻找皮肤组织代替物是非常有必要的,当前主要可以通过同种移植或异种移植解决上述问题,然而捐赠源不充足,异种移植容易有免疫排斥反应,因此通过人工移植物对受损的皮肤组织进行修复才是切实可行的办法。早期研究表明,用于皮肤组织工程的支架的微观结构最好在100-200 μm,孔隙率达到90%以上,这样有利于控制支架的生物降解率和力学性能[52]。众所周知,胶原是皮肤移植的最佳材料因为在天然皮肤组织中胶原含量高,且胶原的生物相容性好,但由于胶原材料的降解率太高,力学性能不好,很容易变质、脱落,因此有研究小组拟采用机械性能相对较好的壳聚糖利用戊二醛和胶原材料进行交联,共焦激光扫描显微镜观察结果显示,胶原和壳聚糖均匀分布在支架材料中。胶原酶消化实验证明了壳聚糖的存在可明显改善支架材料形态及性能稳定性。同时,人皮肤成纤维细胞的体外培养证明,该壳聚糖/胶原复合支架可保留原始自体产生的胶原蛋白,有效加速细胞浸润和扩散,从结构和功能上都可长久应用在皮肤组织工程中[53]。 对于壳聚糖应用于皮肤组织工程中取得优良结果的具体机制一直是科学界的困扰,针对这一问题,有研究小组做了一系列如支架材料只采用胶原、只采用壳聚糖、两种材料共混、壳聚糖涂覆在胶原表面的对照试验[54],结果显示,壳聚糖的应用在促进天然细胞外基质的生成功效上并不如胶原显著,有趣的是,细胞在壳聚糖支架上的增殖浸润效率相较于胶原支架要明显增加,该研究的最终结论是将壳聚糖涂覆在胶原支架表面,是将该胶原/壳聚糖复合支架应用在皮肤组织重建工程的最优选方案。因此,猜想有可能是壳聚糖的机械应力比胶原材料要强,在一定程度上影响了细胞形态变化,进而促进了细胞增殖。 2.7 壳聚糖在心肌组织工程中的应用 心脏在人体中占据非常重要的地位,因为它能为其他组织器官输送氧气和血液,达到长久循环的作用。然而,尽管对于其他器官和整个机体来说心脏至关重要,哺乳动物的心肌损伤以后却不具备修复的功能,并且心肌细胞在成年以后基本不具备增殖能力,这个缺陷使得世界范围内每年有数百万的患者因为心脏衰竭死亡[55]。 鉴于心肌细胞不增殖,因此应对心肌组织修复工程大多数是引进新的心肌细胞或者由干细胞诱导分化为心肌细胞,Lu等[56]将胚胎干细胞在温敏性壳聚糖水凝胶支架上结合,将温敏性壳聚糖水凝胶注入大鼠梗死模型心脏中,以磷酸缓冲溶液为对照组,结果表明24 h以后,温敏性壳聚糖水凝胶支架组细胞保留明显高于对照组;移植4周以后大鼠心脏功能、心墙厚度、梗死面积及微血管密度改善,温敏性壳聚糖水凝胶支架均比磷酸缓冲溶液的效果更好,研究结果表明温敏性壳聚糖水凝胶是一种可注射的支架,可用于提供干细胞用于心肌梗死,它也可增加细胞保留和移植物大小,同时也能使受损大鼠心脏功能保存完好。 然而,对于心肌组织修复来说,只解决了心肌细胞再生问题是远远不够的,众所周知,心肌细胞能够以固定频率进行收缩,达到泵血作用,而收缩功能据研究表明是一系列机械-电耦合作用的结果,也就是说,心肌收缩功能的实现需要细胞之间能够进行通畅的电信号传导,而壳聚糖是不导电材料,壳聚糖水凝胶的导电性能很差,Martins等[57]尝试向壳聚糖支架中聚合能导电的碳纳米材料,以增强心肌重建组织的导电性。在这份研究工作中,纳米碳纤维作为高导电材料掺杂在壳聚糖粉末中合成,发现碳纳米纤维均匀分散在整个壳聚糖支架中,是高度多孔、孔隙完全连通复合支架,壳聚糖/碳支架的导电率为(0.25±0.09) s/m。基于壳聚糖和壳聚糖/碳复合材料支架做对照实验发现:细胞的代谢活动在壳聚糖/碳结构相比在壳聚糖支架内有显著提高;碳纳米纤维的掺入也导致心肌特异性蛋白的表达;这项研究表明掺入碳纳米纤维的多孔壳聚糖支架改善心脏组织结构的特性,参与肌肉收缩和电耦合,可增强细胞之间的电信号的传导。最新研究中,Baei等[58]以金纳米粒子代替碳纳米粒子,得出了金纳米粒子也有利于心肌细胞之间的电信号传导。 以上分析结果表明,壳聚糖材料作为心肌组织重建工程的支架材料,能携载细胞,为心肌细胞的收缩提供一定的机械应力,模拟天然外基质,是优良的心肌支架材料。碳纳米粒子和金纳米粒子虽然能够促进细胞之间的电信号传导,但是倘若没有壳聚糖与之聚合,碳纳米粒子和金纳米粒子都会改变细胞膜的通透性,有较强的细胞毒性,因此,作为当前应用在心肌组织中的支架材料而言,壳聚糖和导电粒子都是不可缺少的部分。 没有哪一种材料可满足所有组织工程的需要,同样地,并不是每种组织工程所需求的人工外基质都实现同一种功能,在当今的医疗环境中,必须针对不同的组织工程需要,汇集各种材料的优良性能,以满足患者不同的医疗需求。壳聚糖并不是完美无缺的生物材料,但因为属于天然黏多糖,生物相容性好,生物可降解,具有一定抗菌性质而被广泛应用,除此,壳聚糖还能够借助自身基团和各种物质聚合以拓宽它的应用范围,例如:相对于神经组织工程,其机械应力稍大,可由与胶原聚合以减小神经压迫;而相对于骨组织工程,壳聚糖机械应力明显不足,可通过和羟基磷灰石进行聚合以提高其承重能力。由此可见,壳聚糖有可能成为组织工程中应用最为广泛的支架材料。 除此之外,壳聚糖作为天然的氨基多糖,可和DNA形成聚电解质配合物以实现DNA的细胞靶向释放[59],壳聚糖也能够制备成球用来作为酶的固定化载体、金属废水处理剂等[60-61]。同时,壳聚糖支架表面可根据应用方向的不同,设计不同的物理、化学及酶的修饰[62],以便作为生物传感器[63]、药物载体等。近年来,采用温敏材料制备成温敏型支架[64],有望和壳聚糖材料结合,也许会有更好的效果。另外,包埋微球的壳聚糖支架可有效缓解药物随着正常新陈代谢流失太快的缺陷,实现其在体内的长久循环[65]。可以说,壳聚糖粒子大小、支架表面形态、酶的修饰、包埋微球等都有利于调控体外重建组织的微环境[66-68],为壳聚糖在组织工程中的应用范围得以拓展。当然,有关壳聚糖在体内是否会受到各种糖蛋白酶的水解也应该同时推进,以便于进一步研究壳聚糖在体内的代谢方式,尽早应用于临床组织工程。 "
| [1]Gowran A,McKayed K,Kanichai M,et al.Tissue Engineering of Cartilage; Can Cannabinoids Help?Pharmaceuticals(Basel). 2010;3(9):2970-2985.[2]Gaetani R,Doevendans PA,Metz CH,et al.Cardiac tissue engineering using tissue printing technology and human cardiac progenitor cells.Biomaterials. 2012;33(6): 1782-1790.[3]Rodríguez-Vázquez M,Vega-Ruiz B,Ramos-Zúñiga R,et al.Chitosan and Its Potential Use as a Scaffold for Tissue Engineering in Regenerative Medicine.Biomed Res Int. 2015;2015:821279. [4]Costa-Pinto AR,Salgado AJ,Correlo VM,et al.Adhesion, proliferation, and osteogenic differentiation of a mouse mesenchymal stem cell line (BMC9) seeded on novel melt-based chitosan/polyester 3D porous scaffolds.Tissue Eng Part A.2008;14(6):1049-1057. [5]Gu Y,Zhu J,Xue C,et al.Chitosan/silk fibroin-based, Schwann cell-derived extracellular matrix-modified scaffolds for bridging rat sciatic nerve gaps.Biomaterials. 2014;35(7): 2253-2263. [6]Sun Y,Yang Q,Wang H.Synthesis and Characterization of Nanodiamond Reinforced Chitosan for Bone Tissue Engineering.J Funct Biomater. 2016;7(3). pii: E27. doi: 10.3390/jfb7030027.[7]Cadete A,Figueiredo L,Lopes R,et al.Development and characterization of a new plasmid delivery system based on chitosan-sodium deoxycholate nanoparticles.Eur J Pharm Sci.2012;45(4):451-458. [8]Mikles DC,Bhat V,Schuchardt BJ,et al.pH modulates the binding of early growth response protein 1 transcription factor to DNA.FEBS J.2013;280(15):3669-3684. [9]Patel DD,Patel VN,Thakkar TV,et al.Preparation and evaluation of Levosalbutamol sulphate chitosan microsphere for the treatment of asthma.J Pharm Bioallied Sci. 2012; 4(Suppl 1):S46-47.[10]Mori M,Rossi S,Ferrari F,et al.Sponge-Like Dressings Based on the Association of Chitosan and Sericin for the Treatment of Chronic Skin Ulcers. I. Design of Experiments-Assisted Development.J Pharm Sci. 2016;105(3):1180-1187. [11]Wu T,Farnood R.Cellulose fibre networks reinforced with carboxymethyl cellulose/chitosan complex layer-by-layer. Carbohydr Polym.2014;114:500-505.[12]Gomathysankar S,Halim AS,Yaacob NS.et al.Proliferation of keratinocytes induced by adipose-derived stem cells on a chitosan scaffold and its role in wound healing, a review.Arch Plast Surg.2014;41(5):452-457. [13]Krajewska B.Membrane-based processes performed with use of chitin/chitosan materials.Sep Purif Technol. 2005;41(3): 305-312.[14]Martínez-Campos E,Civantos A,Redondo JA,et al.Cell Adhesion and Proliferation on Sulfonated and Non-Modified Chitosan Films.AAPS PharmSciTech. 2016. [Epub ahead of print][15]Biazar E,Heidari Keshel S.Development of chitosan-crosslinked nanofibrous PHBV guide for repair of nerve defects.Artif Cells Nanomed Biotechnol. 2014;42(6): 385-391. [16]Griffon DJ,Sedighi MR,Sendemir-Urkmez A,et al.Evaluation of vacuum and dynamic cell seeding of polyglycolic acid and chitosan scaffolds for cartilage engineering.Am J Vet Res. 2005;66(4):599-605.[17]Dan Y,Liu O,Liu Y,et al.Development of Novel Biocomposite Scaffold of Chitosan-Gelatin/Nanohydroxyapatite for Potential Bone Tissue Engineering Applications.Nanoscale Res Lett. 2016;11(1):487.[18]Prasad T,Shabeena EA,Vinod D,et al.Characterization and in vitro evaluation of electrospun chitosan/polycaprolactone blend fibrous mat for skin tissue engineering. J Mater Sci Mater Med.2015;26(1):5352. [19]Hsueh YY,Chang YJ,Huang TC,et al.Functional recoveries of sciatic nerve regeneration by combining chitosan-coated conduit and neurosphere cells induced from adipose-derived stem cells, Biomaterials.2014;35(7):2234-2244.[20]Skop NB,Calderon F,Levison SW,et al.Heparin crosslinked chitosan microspheres for the delivery of neural stem cells and growth factors for central nervous system repair.Acta Biomater.2013;9(6):834-843.[21]Pulieri E,Chiono V,Ciardelli G,et al.Chitosan/gelatin blends for biomedical applications.J Biomed Mater Res A. 2008;86(2): 311-322.[22]Falconi M,Salvatore V,Teti G,et al.Gelatin crosslinked with dehydroascorbic acid as a novel scaffold for tissue regeneration with simultaneous antitumor activity.Biomed Mater.2013;8(3):035011.[23]Nie X,Deng M,Yang M,et al.Axonal regeneration and remyelination evaluation of chitosan/gelatin-based nerve guide combined with transforming growth factor-beta1 and Schwann cells, Cell Biochem Biophys.2014;68(1):163-172.[24]Huang YX,Li H.An active artificial cornea with the function of inducing new corneal tissue generation in vivo-a new approach to corneal tissue engineering.Biomed Mater. 2007;2(3):S121-125.[25]Guan L,Tian P,Ge H,et al.Chitosan-functionalized silk fibroin 3D scaffold for keratocyte culture.J Mol Histol. 2013;44(5): 609-618.[26]Attam K,Tiwary R,Talwar S,et al.Palatogingival groove: endodontic-periodontal management--case report.J Endod. 2010;36(10):1717-1720.[27]Zhang Y, Cheng X,Wang J,et al.Novel chitosan/collagen scaffold containing transforming growth factor-beta1 DNA for periodontal tissue engineering, Biochem Biophys Res Commun.2006;344(1):362-369.[28]Peng L,Cheng X,Zhuo R,et al.Novel gene-activated matrix with embedded chitosan/plasmid DNA nanoparticles encoding PDGF for periodontal tissue engineering. J Biomed Mater Res A.2009;90(2):564-576.[29]Kanda N,Morimoto N,Takemoto S,et al.Efficacy of novel collagen/gelatin scaffold with sustained release of basic fibroblast growth factor for dermis-like tissue regeneration. Ann Plast Surg.2012;69(5):569-574.[30]Shirakata Y,Takeuchi N,Yoshimoto T,et al.Effects of enamel matrix derivative and basic fibroblast growth factor with μ-tricalcium phosphate on periodontal regeneration in one-wall intrabony defects: an experimental study in dogs, Int J Periodontics Restorative Dent.2013;33(5):641-649.[31]An S,Gao Y,Ling J.Characterization of human periodontal ligament cells cultured on three-dimensional biphasic calcium phosphate scaffolds in the presence and absence of L-ascorbic acid, dexamethasone and beta-glycerophosphate. Exp Ther Med.2015;10(4):1387-1393.[32]Tigli RS,Akman AC,Gumusderelioglu M,et al.In vitro release of dexamethasone or bFGF from chitosan/hydroxyapatite scaffolds.J Biomater Sci Polym Ed.2009;20(13):1899-1914.[33]Akman AC,Tigli RS,Gumusderelioglu M,et al.bFGF-loaded HA-chitosan: a promising scaffold for periodontal tissue engineering, J Biomed Mater Res A.2010; 92(3):953-962.[34]Dormer NH,Singh M,Zhao L,et al.Osteochondral interface regeneration of the rabbit knee with macroscopic gradients of bioactive signals.J Biomed Mater Res A.2012;100(1): 162-170.[35]Schmidt-Blee K,Kwee BJ,Mooney DJ,et al.Boon and Bane of Inflammation in Bone Tissue Regeneration and Its Link with Angiogenesis.Tissue Eng Part B Rev.2015;21(4):354-364.[36]Sharma C,Dinda K,Potdar PD,et al.Fabrication and characterization of novel nano-biocomposite scaffold of chitosan-gelatin-alginate-hydroxyapatite for bone tissue engineering.Mater Sci Eng C Mater Biol Appl.2016;64: 416-427.[37]Ghadi A,Tabandeh F,Mahjoub S,et al.Fabrication and characterization of core-shell magnetic chitosan nanoparticles as a novel carrier for immobilization of Burkholderia cepacia lipase.J Oleo Sci.2015;64(4):423-430.[38]Razzouk S,Sarkis R.BMP-2: biological challenges to its clinical use.N Y State Dent J.2012;78(5):37-39.[39]Nath SD,Abueva C,Kim B,et al.Chitosan-hyaluronic acid polyelectrolyte complex scaffold crosslinked with genipin for immobilization and controlled release of BMP-2.Carbohydr Polym.2015;115:160-169.[40]Pangon A,Saeso S,Saengkrit N,et al.Hydroxyapatite- hybridized chitosan/chitin whisker bionanocomposite fibers for bone tissue engineering applications.Carbohydr Polym. 2016;144:419-427.[41]Tseng SJ,Lee YH,Chen ZH,et al.Integration of optical clearing and optical sectioning microscopy for three-dimensional imaging of natural biomaterial scaffolds in thin sections.J Biomed Opt.2009;14(4):044004.[42]程文俊,金丹,裴国献,等.壳聚糖β_磷酸三钙作为可注射组织工程骨支架材料的可行性研究[J].解放军医学杂志, 2007,32(2): 141-143.[43]Alshami A.Knee osteoarthritis related pain: a narrative review of diagnosis and treatment.Int J Health Sci(Qassim). 2014; 8(1):85-104.[44]Cutolo M.Glucocorticoids and chronotherapy in rheumatoid arthritis.RMD Open. 2016;2(1):e000203. [45]Seeliger C,Balmayor ER,van Griensven M.miRNAs Related to Skeletal Diseases.Stem Cells Dev.2016;25(17):1261-1281.[46]Lynch B,Crawford K,Baruti O,et al.The effect of hypoxia on thermosensitive poly(N-vinylcaprolactam) hydrogels with tunable mechanical integrity for cartilage tissue engineering.J Biomed Mater Res B Appl Biomater.2016. doi: 10.1002/jbm.b.33705. [Epub ahead of print][47]Mathieu C,Chevrier A,Lascau-Coman V,et al.Stereological analysis of subchondral angiogenesis induced by chitosan and coagulation factors in microdrilled articular cartilage defects.Osteoarthritis Cartilage.2013;21(6):849-859.[48]Samarasinghe RM,RKanwar PK,Kumar K,et al.Antiarthritic and chondroprotective activity of Lakshadi Guggul in novel alginate-enclosed chitosan calcium phosphate nanocarriers. Nanomedicine(Lond).2014;9(6):819-837.[49]Rodrigues M,NOliveira MB,Costa RR,et al.Chitosan/ Chondroitin Sulfate Membranes Produced by Polyelectrolyte Complexation for Cartilage Engineering.Biomacromolecules. 2016;17(6):2178-2188. [50]Müller WEG,Neufurth M,Wang S,et al.Morphogenetically active scaffold for osteochondral Repair (polyphosphate/ alginate/n,o-carboxymethyl chitosan).Eur Cells Mater.2016; 16:174-190.[51]Man Z,Hu X,Liu Z,et al.Transplantation of allogenic chondrocytes with chitosan hydrogel-demineralized bone matrix hybrid scaffold to repair rabbit cartilage injury. Biomaterials.2016;108:157-167.[52]Dagalakis N,Flink J,Stasikelis P,et al.Design of an artificial skin. Part III. Control of pore structure.J Biomed Mater Res. 1980;14(4):511-528.[53]Ma L.Collagen/chitosan porous scaffolds with improved biostability for skin tissue engineering.Biomaterials. 2003; 24(26):4833-4841.[54]Romanova OA,Grigor'ev TE,Goncharov ME,et al.Chitosan as a Modifying Component of Artificial Scaffold for Human Skin Tissue Engineering.Bull Exp Biol Med. 2015;159(4): 557-566.[55]Kikuchi K,Poss KD.Cardiac regenerative capacity and mechanisms.Annu Rev Cell Dev Biol.2012;28:719-741.[56]Lu W,Lü S,Wang H,et al.Functional improvement of infarcted heart by co-injection of embryonic stem cells with temperature-responsive chitosan hydrogel.Tissue Eng Part A.2009;15(6):1437-1447.[57]Martins AM,Eng G,Caridade SG,et al.Electrically conductive chitosan/carbon scaffolds for cardiac tissue engineering. Biomacromolecules.2014;15(2):635-643.[58]Baei P, Jalili-Firoozinezhad S,Rajabi-Zeleti S,et al.Electrically conductive gold nanoparticle-chitosan thermosensitive hydrogels for cardiac tissue engineering, Mater Sci Eng C Mater Biol Appl.2016;63:131-141.[59]Jean M,Alameh M,Buschmann MD,et al.Effective and safe gene-based delivery of GLP-1 using chitosan/plasmid-DNA therapeutic nanocomplexes in an animal model of type 2 diabetes.Gene Ther.2011;18(8):807-816.[60]Chen H,Liu L,Lv S,et al.Immobilization of Aspergillus niger xylanase on chitosan using dialdehyde starch as a coupling agent, Appl Biochem Biotechnol.2010;162(1):24-32.[61]Dima JB,Sequeiros C,Zaritzky NE.Hexavalent chromium removal in contaminated water using reticulated chitosan micro/nanoparticles from seafood processing wastes. Chemosphere.2015;141:100-111.[62]Shukla SK,Mishra AK,Arotiba OA,et al.Chitosan-based nanomaterials: a state-of-the-art review.Int J Biol Macromol. 2013;59:46-58.[63]Bo Y,Wang W,Qi J,et al.A DNA biosensor based on graphene paste electrode modified with Prussian blue and chitosan. Analyst.2011;136(9):1946-1951.[64]Xie Q,Wang Z,Huang Y,et al.Characterization of human ethmoid sinus mucosa derived mesenchymal stem cells (hESMSCs) and the application of hESMSCs cell sheets in bone regeneration.Biomaterials.2015;66:67-82.[65]Zhang J,Hu ZQ,Turner NJ,et al.Perfusion-decellularized skeletal muscle as a three-dimensional scaffold with a vascular network template.Biomaterials.2016;89:114-126.[66]Karaki K,Aljawish A,Humeau C,et al.Enzymatic modification of polysaccharides: Mechanisms, properties, and potential applications:A review.Enzyme Microb Technol.2016;90:1-18.[67]Kumar SP,Birundh K,Kaveri K,et al.Antioxidant studies of chitosan nanoparticles containing naringenin and their cytotoxicity effects in lung cancer cells. Int J Biol Macromol. 2015;78:87-95.[68]Bitencourt Cda S,Silva LB,Pereira PA,et al.Microspheres prepared with different co-polymers of poly(lactic-glycolic acid) (PLGA) or with chitosan cause distinct effects on macrophages.Colloids Surf B Biointerfaces. 2015;136: 678-686. |
| [1] | Yao Xiaoling, Peng Jiancheng, Xu Yuerong, Yang Zhidong, Zhang Shuncong. Variable-angle zero-notch anterior interbody fusion system in the treatment of cervical spondylotic myelopathy: 30-month follow-up [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1377-1382. |
| [2] | Zhang Jinglin, Leng Min, Zhu Boheng, Wang Hong. Mechanism and application of stem cell-derived exosomes in promoting diabetic wound healing [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1113-1118. |
| [3] | An Weizheng, He Xiao, Ren Shuai, Liu Jianyu. Potential of muscle-derived stem cells in peripheral nerve regeneration [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1130-1136. |
| [4] | Le Guoping, Zhang Ming, Xi Licheng, Luo Hanwen. Preparation and in vitro evaluation of vancomycin hydrochloride@polylactic acid-glycolic acid copolymer-chitosan-hyaluronic acid composite sustained-release microspheres [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 528-534. |
| [5] | He Yunying, Li Lingjie, Zhang Shuqi, Li Yuzhou, Yang Sheng, Ji Ping. Method of constructing cell spheroids based on agarose and polyacrylic molds [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 553-559. |
| [6] | He Guanyu, Xu Baoshan, Du Lilong, Zhang Tongxing, Huo Zhenxin, Shen Li. Biomimetic orientated microchannel annulus fibrosus scaffold constructed by silk fibroin [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 560-566. |
| [7] | Yang Feng, Zhao Qian, Zhang Shixuan, Zhao Tienan, Feng Bo. Effectiveness and safety of rapamycin combined with CD133 antibody stent in preventing vascular restenosis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 579-584. |
| [8] | Chen Xiaoxu, Luo Yaxin, Bi Haoran, Yang Kun. Preparation and application of acellular scaffold in tissue engineering and regenerative medicine [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 591-596. |
| [9] | Kang Kunlong, Wang Xintao. Research hotspot of biological scaffold materials promoting osteogenic differentiation of bone marrow mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 597-603. |
| [10] | Shen Jiahua, Fu Yong. Application of graphene-based nanomaterials in stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 604-609. |
| [11] | Zhang Tong, Cai Jinchi, Yuan Zhifa, Zhao Haiyan, Han Xingwen, Wang Wenji. Hyaluronic acid-based composite hydrogel in cartilage injury caused by osteoarthritis: application and mechanism [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 617-625. |
| [12] | Li Hui, Chen Lianglong. Application and characteristics of bone graft materials in the treatment of spinal tuberculosis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 626-630. |
| [13] | Gao Cangjian, Yang Zhen, Liu Shuyun, Li Hao, Fu Liwei, Zhao Tianyuan, Chen Wei, Liao Zhiyao, Li Pinxue, Sui Xiang, Guo Quanyi. Electrospinning for rotator cuff repair [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 637-642. |
| [14] | Guan Jian, Jia Yanfei, Zhang Baoxin , Zhao Guozhong. Application of 4D bioprinting in tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(3): 446-455. |
| [15] | Liu Jiali, Suo Hairui, Yang Han, Wang Ling, Xu Mingen. Influence of lay-down angles on mechanical properties of three-dimensional printed polycaprolactone scaffolds [J]. Chinese Journal of Tissue Engineering Research, 2022, 10(16): 2612-2617. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||