Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (22): 3576-3482.doi: 10.12307/2024.525
Previous Articles Next Articles
Application of gelatin methacryloyl as a three-dimensional cell culture scaffold in bone tissue engineering
Wang Sainan1, Wang Xiaofei2, Zhang Li1
- 1Binzhou Medical College, Binzhou 256600, Shandong Province, China; 2Department of Stomatology, Affiliated Hospital of Binzhou Medical College, Binzhou 256600, Shandong Province, China
-
Received:2023-09-12Accepted:2023-10-25Online:2024-08-08Published:2024-01-20 -
Contact:Zhang Li, MD, Master’s supervisor, Binzhou Medical College, Binzhou 256600, Shandong Province, China -
About author:Wang Sainan, Master candidate, Binzhou Medical College, Binzhou 256600, Shandong Province, China -
Supported by:“Clinical+X” Science and Technology Innovation Project of Binzhou Medical College, No. BY2021LCX08 (to ZL)
CLC Number:
Cite this article
Wang Sainan, Wang Xiaofei, Zhang Li. Application of gelatin methacryloyl as a three-dimensional cell culture scaffold in bone tissue engineering[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(22): 3576-3482.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
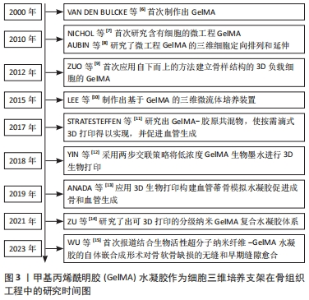
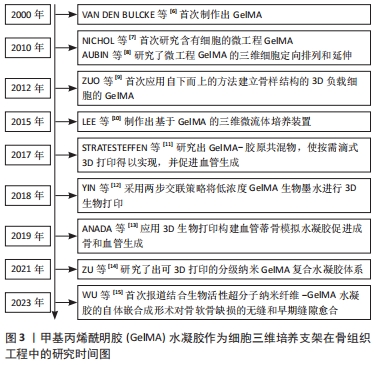
2.1 GelMA水凝胶作为细胞三维培养支架在骨组织工程中的研究时间脉络 根据纳入文献结果显示,VAN DEN BULCKE等[6]于2000年首次制作出GelMA后,至今已有多位学者们研究了GelMA在3D细胞培养领域的应用。2010年,NICHOL等[7]首次研究含有细胞的微工程GelMA,在此基础上,AUBIN等[8]研究了微工程GelMA的三维细胞定向排列和延伸,至此,基于GelMA的3D细胞培养迎来了新的时代。至2022年,已有多项研究报道了应用GelMA进行3D细胞负载以及制作三维微流体培养装置,此外,以GelMA制备的生物墨水及共混物在3D生物打印领域被广泛应用于骨再生,极大地促进了骨组织工程的发展[6-15],见图3。"

2.2 3D体外细胞培养模型 自体外细胞培养技术创立以来,已广泛应用于生物学及医学领域中,其中最常见的体外培养模型为2D及3D体外细胞培养模型。2D细胞培养是指单层细胞在非自然的环境条件下进行细胞与细胞之间的相互作用,在一个二维平面上进行延伸生长的培养方式[16]。但是该模型具有细胞异质性,营养浓度不均一以及细胞会与细胞外基质相互作用,细胞存活率低、细胞形态容易受损及细胞缺乏良好的组织结构等局限性[17]。3D细胞培养则克服了传统2D培养的缺点,用生物支架材料来构建三维立体空间,在体外模拟出细胞生长的微环境,使细胞能够更加接近在正常生理条件下的行为以及功能,在2D细胞培养模型与动物模型之间架起桥梁,同时弥补了动物模型成本高、周期长以及人与动物之间具有差异性等不足[18]。综合现有研究表明,3D体外细胞培养模型相较于2D体外细胞培养模型来说具有更多优势及更有价值的应用前景,应用该模型可以更好地推动体外组织再生领域的发展。 2.2.1 3D细胞培养方法 目前,3D细胞培养常用的方法主要有:球体悬浮培养法、微流控体系培养法、仿生支架模型培养法、三维生物打印法和水凝胶支架培养法[19]。它们各自都有不同的优势和局限性,如球体悬浮培养法无需材料的支撑,但对细胞活力有一定损害;微流控体系培养法虽然可以对细胞行为进行准确分析,但是成本也大幅增高;仿生支架及水凝胶支架虽然都能够为细胞提供有利的生长空间,但是其参数及力学性能较难控制;三维打印作为近年来常见的新兴技术,其组织形成能力较强,但是仍需要进一步探索[20-23],详见表1。"


2.2.2 3D细胞培养支架材料 在细胞3D培养的过程中,支架材料为细胞提供增殖、分化的微环境,同时作为生长因子的载体,在组织工程再生中发挥关键性作用。因此为了更好地模拟体内环境,支架材料的选择则显得尤为重要。目前常用的3D培养支架材料主要分为两大类:天然材料和合成材料[24]。天然生物材料主要来源于人以及动植物的机体,包括透明质酸、壳聚糖、藻酸盐、明胶和胶原蛋白等,合成材料是由两种或两种以上的物质复合而成并具有某些综合性能的材料,如聚己内酯、聚乙二醇、聚乳酸和聚乙烯醇等。这两种材料各自的优缺点,如天然材料的生物相容性好,免疫原性低,但无法大规模生产,合成材料可以对支架进行精准调控,然而某些材料有一定的毒性,会对细胞产生不利影响,详见表2。尽管中国在3D细胞培养支架材料领域的发展相对于国外较晚,但近年来有关该领域的研究呈现出激增态势,研究成果也十分丰硕。"

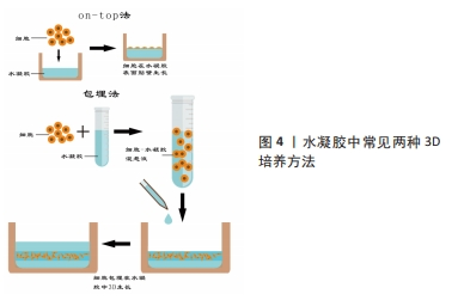
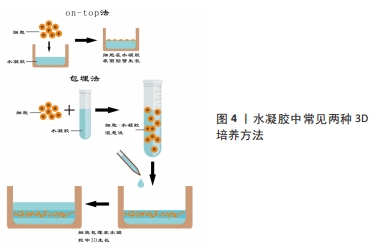
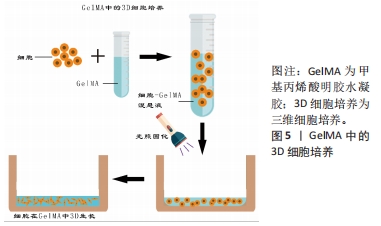
2.3 GelMA作为骨组织工程支架 2.3.1 水凝胶在骨组织工程中的应用 近年来,学者们多研究利用组织工程技术设计生产出具有生物相容性、骨传导及骨诱导等特性的支架,将其植入到骨缺损部位,以促进细胞增殖,诱导细胞的成骨向分化和加快血管形成从而修复骨缺损。水凝胶是一种发展迅速的新型高分子材料[25],它的来源很丰富,并且可生物降解且安全,具有良好的生物相容性,目前已经大量应用于骨缺损疾病的治疗中。同时,水凝胶的立体交联网络结构可以为细胞生长提供足够的三维空间[26],并且使其具有良好的力学性能,因此它可以对受损的组织起到一定的支撑的作用,能够辅助骨组织再生,提供良好的骨替代品[27]。因此,水凝胶已经被广泛应用于骨组织工程的研究中。 基于以上水凝胶材料的优势,国内外学者多年来对其进行了深入研究。根据分子间交联方式的不同,水凝胶可以分为离子交联型、酶触发交联型、温诱导交联型及共价交联型等[28]。其中,光交联水凝胶就是通过光引发剂在紫外光或者可见光照射下进行的,即自由基在光照下从光引发剂中解离出后,与大分子前驱体上的乙烯基形成共价键[29],能够在短时间内交联形成均匀并且可复制物理性质的聚合物的网络,这种交联方式的优点是非物理接触性和时空精准可控性[30],该水凝胶可以准确加工,并且可以实现实时原位交联。因此光交联水凝胶已成为骨组织工程研究的热点,并被广泛用于生物医学应用,如3D水凝胶支架制造、药物输送系统和3D生物打印柔性传感器、智能响应材料以及化学开关等。 2.3.2 GelMA的合成及性能 在再生医学领域,明胶因其良好的生物可降解性、生物相容性和可调控的机械强度等优点已被广泛应用,但是其单独使用作为生物材料往往不能满足骨组织工程修复的需要[31],因此目前的主流方法是将明胶进行改性以达到更好的组织再生及修复目的。GelMA就是以甲基丙烯酸酐和明胶为原料,并加入光交联剂制备出来的。最早是由VAN DEN BULCKE等[6]合成,他们将明胶溶解于磷酸盐缓冲液中,加入甲基丙烯酸酐并大力搅拌,反应所得溶液稀释,在40 ℃蒸馏水下透析24 h,然后将反应产物冷冻干燥,得到白色固体,将其溶于蒸馏水中,在40 ℃下加入水溶性光引发剂Irgacure 2959,使甲基丙烯酸酐和明胶在水介质中发生交联,得到GelMA前体液,将前体液在波长为360-480 nm的紫外光下进行固化,制备出具有一定强度三维结构的光交联水凝胶——GelMA。该水凝胶具有光敏特性,并且拥有良好的生物相容性及物理可调节性,以及便于化学和生物修饰的特性,它可以在37 ℃下保持稳定,能够增强细胞的活力并且限制细胞伸展[32],目前已作为良好的生物支架材料被广泛应用于组织工程中。GelMA的出现,使得改性水凝胶材料在生物医学领域的发展迎来了新的高潮。 GelMA的性能并不是一成不变的,它可以受到多种因素的影响。磷酸盐缓冲溶液是GelMA合成中应用最广泛的反应体系。然而,碳酸盐-碳酸氢盐缓冲溶液由于其较高的反应效率,最近被尝试用于合成GelMA,但是不同反应体系中合成的GelMA的结构与性能也不尽相同,CHEN等[33]分别在这两种反应系统及可比较的条件下,合成了具有两个甲基丙烯酰化度(20%和80%)的GelMA支架,结果显示在磷酸盐缓冲溶液中合成的GelMA水凝胶表现出更高的凝胶-溶胶转变温度和更好的光固化效率、机械强度和生物性能,在碳酸盐-碳酸氢盐缓冲溶液中生产的GelMA水凝胶在溶胀性能和微观结构(如孔径和孔隙率)方面则显示出更多的优势;此外,在磷酸盐缓冲溶液中合成的具有高度甲基丙烯酰化的GelMA在3D生物打印方面显示出巨大的潜力,这项研究为GelMA在3D打印和组织工程中的应用提供了更多指导。研究证明,随着 GelMA 的浓度增加,弹性模量明显增加,但材料的吸水率、溶胀率和交联率均降低,孔隙率明显减小[34]。同时有实验证明,将GelMA前体液分别在紫外光下照射 5 min 和 10 min ,随着光照时间的增加,凝胶的弹性模量增加,但其伸长率下降[35]。XU等[36]发现,Irgacure 2959 固化的 GelMA 比 LAP 固化的孔径更大,降解速度更快,溶胀率更大。近年来越来越多的研究表明,在GelMA中插入纳米结构会明显影响其整体机械和生物特性,具有纳米材料的多功能GelMA可以承受更高的形变,如压缩、弯曲、伸长率和撕裂等[37]。由此可见,甲基丙烯酸酐的反应体系、取代度、 光引发剂的浓度及种类,光照时间和复合纳米材料等因素都会影响到 GelMA 水凝胶的物理性能。 GelMA的机械性能是决定细胞命运的关键因素。WU等[38]研究了不同硬度(5%-30%浓度)GelMA对细胞黏附、生长和增殖的影响,发现随着基质硬度的增加,细胞黏附率单调下降,但细胞扩散面积和突起长度先增大后减小,最终证实10%浓度的GelMA是细胞再生的最佳选择。GelMA对细胞的作用也很容易受到所用光引发剂的类型的影响,LAP由于其优异的生物相容性和较小的免疫原性,目前已成为最常用的光引发剂[37]。目前,虽然GelMA在细胞培养领域的应用已有较全面的研究,但是对于3D培养结合骨再生的研究还存在一定的空白和不足。 2.3.3 GelMA成骨性能研究 通过大量阅读文献可知,GelMA在光照前具有一定的流动性,光照后又能在原位形成凝胶,因此其能够无空隙地填充骨缺损区域,此外,GelMA在固化后具有与生物组织相似的理化结构,且其水相结构能够模拟细胞外基质,不仅促进营养物质的通透性,也有利于成骨细胞的增殖及分化,为骨组织再生提供良好的微环境。MCBETH等[39]通过实验证明,在没有任何外源性促成骨因子诱导的情况下,GelMA能够在原代正常人成骨细胞中引发矿物质的沉积。在此基础上,CELIKKIN及其同事[40]研究了GelMA浓度对大鼠的骨髓间充质干细胞成骨潜力的影响,他们将大鼠的骨髓间充质干细胞分别接种于浓度为5%和10%的GelMA中,评估聚合物浓度对细胞成骨分化作用的影响。结果证明,虽然在成骨诱导分化培养基中的骨髓间充质干细胞在两种不同浓度的GelMA上均表现出良好的成骨向分化,但相较于10%浓度的GelMA,5%浓度的GelMA因具有更高的孔隙率和更大的孔径,有助于钙离子更好地扩散和更均匀的钙沉积,因此其体外成骨性能更优越。 骨是一种高度血管化的组织,在颌面骨缺损的修复中,血管化不足常常导致骨再生的失败。血管内皮细胞生长因子是目前公认的诱导血管再生能力最强的生长因子[41-42]。LAI等[30]制备出负载血管内皮细胞生长因子的GelMA水凝胶,评估了负载0%和3%血管内皮细胞生长因子的水凝胶在小鼠体内诱导血管生成的能力,结果表明,与对照组相比,在负载3%血管内皮细胞生长因子的水凝胶中均发现了更多和更大的血管形成,证明负载的血管内皮细胞生长因子在交联过程后仍然保持其生物活性。此外,与单纯血管内皮细胞生长因子溶液的突然释放相比,GelMA水凝胶的血管内皮细胞生长因子受控释放增强了血管生成的程度。REHMAN等[43]制备了负载不同浓度还原氧化石墨烯的GelMA,证明含有质量分数 0.002%还原氧化石墨烯的 GelMA 水凝胶显著增加了细胞的增殖和迁移。此外,还原氧化石墨烯浸渍的 GelMA 显著增强了鸡胚胎模型中的血管生成。由此可见,富含促血管生成因子的GelMA可以诱导更多的血管生成,不仅可以为新形成的骨组织提供氧气和营养物质,带走代谢废物,还能提供矿化必须的矿物质元素。 2.4 GelMA中的3D细胞培养在骨再生中的应用 2.4.1 GelMA中的3D细胞培养方法 目前细胞在水凝胶中的3D培养的常用接种方法主要有两种:on-top法与包埋法。on-top法指在细胞培养板中先铺上一层水凝胶,然后将细胞2D接种在上面,使细胞能够在基底膜的作用下在水凝胶平面上生长。包埋法也被称为三明治接种法或者指夹心接种法,先在细胞培养板中铺上一层水凝胶,然后将细胞悬液和溶胶状的水凝胶混合好后再接种到底层凝胶表面上,最后再在上面铺一层凝胶。见图4。"
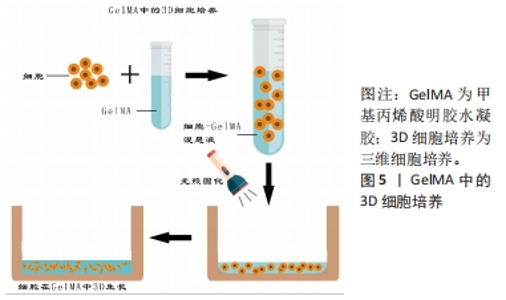
由于GelMA具有温敏性,甲基丙烯酰基取代基能够在光引发剂的存在下进行GelMA的光聚合,具有可调的物理性质,允许在各种充满细胞的组织中广泛应用。于是AUBIN等[8]于2010年首次提出了一种简单而直接的方法,将细胞3D封装在GelMA水凝胶来控制细胞的排列和延伸,结果表明如果将细胞限制在适当的GelMA的3D微结构中,可以使具有在体内形成排列组织的内在潜力的细胞在体外自组织成功能组织。该系统初步研究了在3D体外模型中细胞和组织形态发生,为创建复杂组织工程组织奠定了基础。ZUO等[44]在研究模拟天然骨的复杂微结构时,为了保证所构建系统的每个部分所起的功能都能完全发挥作用,基于可光交联的GelMA水凝胶,成功开发了两种“自下而上”(“环形交叉”和“逐层”)的3D细胞培养方法来构建具有微通道网络的三维骨样结构,提供了一种快速、有效和有用的替代方法来构建类骨结构单元,这些单元将进一步组装成仿生皮质骨。而随着组织工程的发展,目前常用的GelMA进行3D细胞培养的方法是在光照前将细胞悬液与GelMA前体液混合均匀,光照后则可将细胞封装在其中,得到3D负载细胞的多孔光交联水凝胶的支架,见图5。在该支架中,明胶提供水性环境,含有许多精氨酸-甘氨酸-天冬氨酸序列,可以支持细胞黏附和增殖[45-46],使该支架中负载的细胞活力可达80%[47],有研究表明,GelMA中的甲基丙烯酸酐的取代度影响细胞在其中的舒展、迁移及增殖[48]。浓度低于 5% 的GelMA固化较为困难,并且其固化后力学强度不佳,而浓度高于 20% 的GelMA虽力学强度较好,但细胞在其中的增殖和舒展均较为困难。 近年来,随着3D打印技术的出现和发展,学者们发现GelMA也可用于细胞3D打印封装,并以此为基础进行了多项研究。JIA等[49]设计了一种以GelMA、海藻酸钠和四臂聚(乙二醇)-四丙烯酸酯为基质的混合生物墨水,该墨水不仅具有理想的流变性和可打印性,而且具有足够的机械强度和生物活性。在使用前将细胞与预聚物生物墨水混合。生物打印完成后,将制备好的构建体暴露在360 nm紫外线下照射进行共价交联,细胞则被封装在该3D体系中。MELCHELS等[50]研究了基于数字光处理的立体光刻技术,提出该技术也是构建3D细胞水凝胶的理想方法,此方法可以通过使用可见光和快速生产来减少细胞损伤。目前,基于GelMA的3D生物打印技术以其良好的生物相容性、高度定制化及多功能化已被广泛应用于生物医学、医疗及架构领域,但尚存在弱力性能、制备复杂、成本较高等局限性,限制了其发展。"

2.4.2 GelMA中的3D细胞培养促进成骨 在骨组织工程的发展中,支架材料常因前期血管化不足以及成骨诱导活性较弱使之临床应用受限,因此促血管生成是人工骨移植材料的一大难题。有研究表明,通过将骨髓间充质干细胞封装入GelMA中进行3D培养,诱导形成生物相关的、高度组织化的、完整的血管,可以加速骨组织修复的过程[51]。有些研究者通过将GelMA和磷酸钙或聚己内酯支柱进行组合来诱导血管形成和骨形成[52-53]。ANADA等[13]基于数字光处理的立体光刻的3D生物打印技术,将3D培养的细胞和磷酸钙材料精确定位到用于骨组织再生的GelMA中,利用该材料进行血管内皮细胞的3D培养,形成了毛细管状网络,证明该水凝胶构建体可以促进成骨细胞和血管生成分化,在骨组织工程中具有巨大的应用潜力。JIANG等[54]使用数字微镜装置技术制备的3D打印富血小板血浆-GelMA支架,并研究了其在大鼠骨髓间充质干细胞和巨噬细胞极化中的作用,结果表明,将20%富血小板血浆掺入GelMA中,对大鼠骨髓间充质干细胞的增殖、迁移以及成骨和软骨分化均显示出良好的效果,3D打印的富血小板血浆-GelMA复合材料可以通过M2极化的免疫调节促进骨软骨修复,并可能成为骨软骨组织工程的潜在候选者。 然而在利用上述技术进行3D生物打印时,合成聚合物如聚乙二醇二丙烯酸酯和Pluronic F127二丙烯酸酯作为常用的生物墨水,具有令人满意的印刷性和机械性能,但通常对细胞和组织缺乏足够的黏附性。近年来,有学者制备了基于聚乙二醇二丙烯酸酯、Pluronic F127二丙烯酸酯和GelMA的3D打印复合BTE支架[55],并利用该支架进行大鼠骨髓间充质干细胞的3D培养,证明了该支架不仅促进了细胞的黏附和增殖,而且在骨诱导环境中有效地促进了细胞的成骨分化,将3D负载细胞的该复合支架植入股骨远端缺损部位,在没有干预的情况下,在第12周,同对照组相比观察到了更大的骨组织再生,并且新骨呈现出支架状网状形状。 由于人类的成骨细胞对紫外线的抵抗能力较低[56],因此由紫外光引发聚合的GelMA可能会造成细胞损伤,GOTO等[57]制备了使用核黄素作为光引发剂的GelMA,并将成骨细胞重悬于GelMA-核黄素溶液内,应用可见光照射后,将细胞3D封装于该水凝胶内,使其作为成骨细胞分化的骨再生支架,结果表明,GelMA–核黄素水凝胶的刚度范围适合成骨细胞分化,封装在用可见光聚合的GelMA水凝胶中的成骨细胞显示出比封装在用紫外光聚合的水凝胶中的细胞更高的细胞活力和更显著的成骨性能。 人尿液来源的干细胞外泌体在体外培养条件下具有多功能分化潜力,这些外泌体也被证明可以抑制骨溶解和促进成骨[58]。LU等[59]设计一种新型的干细胞外泌体/GelMA-透明质酸-纳米羟基磷灰石复合水凝胶作为药物递送系统及成骨支架,将其与大鼠骨髓间充质干细胞进行3D共培养后包埋在大鼠背部,使用大鼠模型评估颅骨缺损再生,获得3D重建和冠状图像,并通过显微CT进行分析,结果表明,干细胞外泌体/GelMA-透明质酸-纳米羟基磷灰石复合水凝胶组在缺损骨腔中骨小梁数量及成骨体积显著高于单纯水凝胶组和大鼠骨髓间充质干细胞组,并在新骨组织内观察到再生骨腔和中央管,同时通过小管形成实验观察到更多的血管形成,验证了将大鼠骨髓间充质干细胞与该复合水凝胶进行3D共培养后,表达出更优越的成骨和血管生成能力。 3D支架形式的定制聚合物水凝胶的生产及其在骨组织工程中的应用目前是一个非常热门的话题。PABLOS等[60]制备了具有两种不同甲基丙烯酰基化度的GelMa,提出了基于GelMa与乙烯基吡咯烷酮和甲基丙烯酸2-羟基乙酯的三元共聚物的新型3D泡沫支架,通过评估该支架对细胞活力和MC3T3-E1前成骨细胞系的分化等几个生物学参数的影响,结果显示它们对成骨前细胞系的生物反应和向成骨细胞的分化有所改善,为支架的获得及其在组织工程和骨再生中的应用开辟了一条有前途的策略。 外周神经可以通过分泌神经递质参与骨生长和修复,使新骨具有生理性骨传感能力[61],然而,目前在大型骨缺损的愈合过程中,很难实现同步的神经再生。还原氧化石墨烯作为一种生物活性纳米材料,可以促进施万细胞的神经元分化和髓鞘形成[62],同时通过其强大的非共价结合能力增强大鼠骨髓间充质干细胞的黏附和成骨向分化。ZHANG等[63]使用具有增强的骨源性和神经源性双重分化的基于3D打印的还原氧化石墨烯-GelMA水凝胶同时3D负载施万细胞和大鼠骨髓间充质干细胞,结果表明包埋在该水凝胶中的细胞具有高存活率(85%)和良好的黏附能力,并且同纯GelMA组和纯细胞组相比,还原氧化石墨烯-GelMA水凝胶表现出相同的低炎症反应,同时,还原氧化石墨烯-GelMA组的成骨蛋白和神经蛋白在免疫组织化学和免疫荧光中高度表达。在该研究中,3D负载双细胞的支架材料被用于促进神经和骨的协同再生,为制备个性化和功能化的仿生骨材料提供了一种有前途的策略。 骨性关节炎也是导致关节骨缺损的一个重要因素,主要以关节软骨破坏为特征[64]。由于其固有的无血管特性[65],关节软骨的内在修复非常有限,因此,关节中的软骨形成微环境对于保存健康的软骨细胞和骨性关节炎治疗至关重要。大量研究表明,衰老和异常机械应力都会促进活性氧的积累,并导致软骨过度氧化应激,进而导致软骨细胞外基质代谢失衡和软骨细胞凋亡,最终导致软骨破坏[66]。FENG等[67]在缺氧环境下使用GelMA微球对软骨祖细胞进行3D培养,结果表明3D培养的软骨祖细胞比常氧预处理的3D软骨祖细胞和2D培养的软骨祖细胞表现出更强的软骨生成能力。此外,缺氧预处理的GelMA微球有效促进软骨细胞增殖,挽救软骨变性,并保持软骨基质代谢平衡。在亚急性和慢性骨关节炎大鼠模型中,缺氧预处理的3D培养的软骨祖细胞更有效地维持了软骨基质代谢平衡,并减轻了软骨退化,此外还发现缺氧预处理的GelMA微球通过在体外和体内激活NRF2/HO-1途径显著减轻炎症和氧化应激,该三维缺氧软骨祖细胞培养系统提供了一种有效的软骨再生策略。 然而,体外3D组织工程应用的GelMA的孔隙率有限,限制了嵌入细胞的生理扩散、增殖和迁移行为,近日,有学者制造出一种由GelMA和葡聚糖组成的衍生自水两相系统ATPS的多孔水凝胶[68],形成具有3种不同微观结构的水凝胶:均匀无孔、规则断开的孔和具有互连孔的双连续孔,后两种水凝胶孔径可以从4 μm调节到100 μm,在3D组织工程应用中具有巨大潜力。"

| [1] SCHMITZ JP, HOLLINGER JO. The critical size defect as an experimental model for craniomandibulofacial nonunions. Clin Orthop Relat Res. 1986; (205):299-308. [2] PERIC KZ, RIDER P, ALKILDANI S, et al. An introduction to bone tissue engineering. Int J Artif Organs. 2020;43(2):69-86. [3] YUE K, TRUJILLO-DE SG, ALVAREZ MM, et al. Synthesis,properties,and biomedical applications of gelatin methacryloyl (GelMA) hydrogels. Biomaterials. 2015;73:254-271. [4] 林欢欢,刘肇兴,吴兴,等.明胶-甲基丙烯酰基水凝胶作为生物 材料在组织修复方面的应用进展[J].中国美容医学,2017,26(8):130-134. [5] 陶金,宋雪,王璐瑶,等.3D细胞培养的研究进展和应用前景[J].齐齐哈尔医学院学报,2022,43(18):1771-1775. [6] VAN DEN BULCKE AI, BOGDANOV B, DE ROOZE N, et al. Structural and rheological properties of methacrylamide modified gelatin hydrogels. Biomacromolecules. 2000;1(1):31-38. [7] NICHOL JW, KOSHY ST, BAE H, et al. Cell-laden microengineered gelatin methacrylate hydrogels. Biomaterials. 2010;31(21):5536-5544. [8] AUBIN H, NICHOL JW, HUTSON CB, et al. Directed 3D cell alignment and elongation in microengineered hydrogels. Biomaterials. 2010;31(27): 6941-6951. [9] ZUO Y, XIAO W, CHEN X, et al. Bottom-up approach to build osteon-like structure by cell-laden photocrosslinkable hydrogel. Chem Commun (Camb). 2012;48(26):3170-3172. [10] LEE Y, LEE JM, BAE PK, et al. Photo-crosslinkable hydrogel-based 3D microfluidic culture device. Electrophoresis. 2015;36(7-8):994-1001. [11] STRATESTEFFEN H, KOPF M, KREIMENDAHL F, et al. GelMA-collagen blends enable drop-on-demand 3D printablility and promote angiogenesis. Biofabrication. 2017;9(4):45002. [12] YIN J, YAN M, WANG Y, et al. 3D bioprinting of low-concentration cell-laden gelatin methacrylate (GelMA) bioinks with a two-step cross-linking strategy. ACS Appl Mater Interfaces. 2018;10(8):6849-6857. [13] ANADA T, PAN CC, STAHL AM, et al. Vascularized bone-mimetic hydrogel constructs by 3D bioprinting to promote osteogenesis and angiogenesis. Int J Mol Sci. 2019;20(5):1096. [14] ZU G, MEIJER M, MERGEL O, et al. 3D-printable hierarchical nanogel-GelMA composite hydrogel system. Polymers(Basel). 2021;13(15):2508. [15] WU H, SHANG Y, SUN W, et al. Seamless and early gap healing of osteochondral defects by autologous mosaicplasty combined with bioactive supramolecular nanofiber-enabled gelatin methacryloyl (BSN-GelMA) hydrogel. Bioact Mater. 2023;19:88-102. [16] TIBBITT MW, ANSETH KS. Hydrogels as extracellular matrix mimics for 3D cell culture. Biotechnol Bioeng. 2009;103(4):655-663. [17] 卢晓琴,刘晓凤,钟浩,等.三维细胞培养技术及其应用进展[J].生物医学工程学杂志,2023,40(3):602-608. [18] KOROLEVA A, DEIWICK A, EL-TAMER A, et al. In vitro development of human iPSC-derived functional neuronal networks on laser-fabricated 3D scaffolds. ACS Appl Mater Interfaces. 2021;13(7):7839-7853. [19] SUENAGA H, KAGAYA N, KAWADA M, et al. Phenotypic screening system using three-dimensional(3D)culture models for natural product screening. J Antibiot (Tokyo). 2021;74(10):660-666. [20] SCHAFER M, KHEYFETS VO, BARKER AJ, et al. Reduced shear stress and associated aortic deformation in the thoracic aorta of patients with chronic obstructive pulmonary disease. J Vasc Surg. 2018;68(1):246-253. [21] KLOSS D, FISCHER M, ROTHERMEL A, et al. Drug testing on 3D in vitro tissues trapped on a microcavity chip. Lab Chip. 2008;8(6):879-884. [22] 王晶波,陈晨,马妍,等.响应面法优化VitroGel体系上人源肝细胞三维培养条件的研究[J]. 卫生研究,2023,52(4):579-584. [23] KAZI G, RAHMAN KA, FARAHAT M, et al. Fabrication of single gel with different mechanical stiffness using three-dimensional mold. J Biomed Mater Res A. 2019;107(1):6-11. [24] GATHANI KM, RAGHAVENDRA SS. Scaffolds in regenerative endodontics: a review. Dent Res J (Isfahan). 2016;13(5):379-386. [25] WU Y, TANG Z, MA S, et al. The promising application of hydrogel microneedles in medical application. J Pharm Pharmacol. 2023;75(8): 1011-1020. [26] LA MANNA S, FLORIO D, DI NATALE C, et al. Modulation of hydrogel networks by metal ions. J Pept Sci. 2023;29(8):e3474. [27] ARTHUR A, GRONTHOS S. Clinical application of bone marrow mesenchymal stem/stromal cells to repair skeletal tissue. Int J Mol Sci. 2020;21(24):9759. [28] CAO H, DUAN L, ZHANG Y, et al. Current hydrogel advances in physicochemical and biological response-driven biomedical application diversity. Signal Transduct Target Ther. 2021;6(1):426. [29] 房娜.可注射光交联HAMA-Hep/GelMA水凝胶的构建及其性质研究[D].长春:吉林大学,2022. [30] LAI TC, YU J, TSAI WB. Gelatin methacrylate/carboxybetaine methacrylate hydrogels with tunable crosslinking for controlled drug release. J Mater Chem B. 2016;4(13):2304-2313. [31] 张依蕾. GelMA/PEDOT: PSS导电水凝胶负载神经干细胞对改善脑缺血再灌注损伤的实验研究[D].广州:南方医科大学,2022. [32] KHODADADI YM, TAGHIZADEH A, TAGHIZADEH M, et al. Agarose-based biomaterials for advanced drug delivery. J Control Release. 2020;326: 523-543. [33] CHEN S,WANG Y, LAI J, et al. Structure and properties of gelatin methacryloyl (GelMA) synthesized in different reaction systems. Biomacromolecules. 2023;24(6):2928-2941. [34] 李媛媛,温瑜,李俊,等.GelMA复合水凝胶的制备与性能[J].太原理工大学学报,2021,52(5):842-848. [35] 顾恒,连芩,王慧超,等.GelMA复合凝胶的挤出式3D打印工艺及其性能研究[J].机械工程学报,2020,56(1):196-204. [36] XU H, CASILLAS J, KRISHNAMOORTHY S, et al. Effects of Irgacure 2959 and lithium phenyl-2,4,6-trimethylbenzoylphosphinate on cell viability, physical properties,and microstructure in 3D bioprinting of vascular-like constructs. Biomed Mater. 2020;15(5):55021. [37] KURIAN AG, SINGH RK, PATEL KD, et al. Multifunctional GelMA platforms with nanomaterials for advanced tissue therapeutics. Bioact Mater. 2022;8: 267-295. [38] WU Y, XIANG Y, FANG J, et al. The influence of the stiffness of GelMA substrate on the outgrowth of PC12 cells. Biosci Rep. 2019;39(1): BSR20181748. [39] MCBETH C, LAUER J, OTTERSBACH M, et al. 3D bioprinting of GelMA scaffolds triggers mineral deposition by primary human osteoblasts. Biofabrication. 2017;9(1):15009. [40] CELIKKIN N, MASTROGIACOMO S, JAROSZEWICZ J, et al. Gelatin methacrylate scaffold for bone tissue engineering: the influence of polymer concentration. J Biomed Mater Res A. 2018;106(1):201-209. [41] SHANG L, LIU Z, MA B, et al. Dimethyloxallyl glycine/nanosilicates-loaded osteogenic/angiogenic difunctional fibrous structure for functional periodontal tissue regeneration. Bioact Mater. 2021;6(4):1175-1188. [42] 赵杰.具有BMP-2及VEGF缓释功能的组织工程骨膜的构建及其性能研究[D].苏州:苏州大学,2020. [43] REHMAN S, AUGUSTINE R,ZAHID AA, et al. Reduced graphene oxide incorporated GelMA hydrogel promotes angiogenesis for wound healing applications. Int J Nanomedicine. 2019;14:9603-9617. [44] ZUO Y, XIAO W, CHEN X, et al. Bottom-up approach to build osteon-like structure by cell-laden photocrosslinkable hydrogel. Chem Commun (Camb). 2012;48(26):3170-3172. [45] LIU Y, CHAN-PARK MB. A biomimetic hydrogel based on methacrylated dextran-graft-lysine and gelatin for 3D smooth muscle cell culture. Biomaterials. 2010;31(6):1158-1170. [46] LOESSNER D, MEINERT C, KAEMMERER E, et al. Functionalization,preparation and use of cell-laden gelatin methacryloyl-based hydrogels as modular tissue culture platforms. Nat Protoc. 2016;11(4):727-746. [47] SUN M, SUN X, WANG Z, et al. Synthesis and properties of gelatin methacryloyl (GelMA) hydrogels and their recent applications in load-bearing tissue. Polymers (Basel). 2018;10(11):1290. [48] 李明欣,李军,王文朝,等.载细胞多孔甲基丙烯酸酐化明胶三维支架及对细胞行为的影响[J].中国组织工程研究,2022,26(16):2532-2539. [49] JIA W, GUNGOR-OZKERIM PS, ZHANG YS, et al. Direct 3D bioprinting of perfusable vascular constructs using a blend bioink. Biomaterials. 2016; 106:58-68. [50] MELCHELS FP, FEIJEN J, GRIJPMA DW. A review on stereolithography and its applications in biomedical engineering. Biomaterials. 2010;31(24): 6121-6130. [51] 汤勇,罗科宇,陈玥琦,等.层粘连蛋白α4链功能肽修饰脱钙骨基质支架诱导H型血管及骨生成促进骨缺损修复的实验研究[J].中国修复重建外科杂志,2020,34(12):1594-1601. [52] KANG Y, MOCHIZUKI N, KHADEMHOSSEINI A, et al. Engineering a vascularized collagen-beta-tricalcium phosphate graft using an electrochemical approach. Acta Biomater. 2015;11:449-458. [53] SHANJANI Y, PAN CC, ELOMAA L, et al. A novel bioprinting method and system for forming hybrid tissue engineering constructs. Biofabrication. 2015;7(4):45008. [54] JIANG G, LI S, YU K, et al. A 3D-printed PRP-GelMA hydrogel promotes osteochondral regeneration through M2 macrophage polarization in a rabbit model. Acta Biomater. 2021;128:150-162. [55] GAO J, LI M, CHENG J, et al. 3D-printed GelMA/PEGDA/F127DA scaffolds for bone regeneration. J Funct Biomater. 2023;14(2):96. [56] DUA R, RAMASWAMY S. Relative survivability of human osteoblasts is enhanced by 39 degrees C and ascorbic acid after exposure to photopolymerization ingredients. Cytotechnology. 2013;65(4):587-596. [57] GOTO R, NISHIDA E, KOBAYASHI S, et al. Gelatin methacryloyl-riboflavin (GelMA-RF) hydrogels for bone regeneration. Int J Mol Sci. 2021;22(4):1635. [58] LI H, FAN XL, WANG YN, et al. Extracellular vesicles from human urine-derived stem cells ameliorate particulate polyethylene-induced osteolysis. Int J Nanomedicine. 2021;16:7479-7494. [59] LU W, ZENG M, LIU W, et al. Human urine-derived stem cell exosomes delivered via injectable GelMA templated hydrogel accelerate bone regeneration. Mater Today Bio. 2023;19:100569. [60] PABLOS JL, JIMENEZ-HOLGUIN J, SALCEDO SS, et al. New photocrosslinked 3D foamed scaffolds based on GelMA copolymers: potential application in bone tissue engineering. Gels. 2023;9(5):403. [61] NIMGAMPALLE M, CHAKRAVARTHY H, SHARMA S, et al. Neurotransmitter systems in the etiology of major neurological disorders: emerging insights and therapeutic implications. Ageing Res Rev. 2023;89:101994. [62] KANG MS, PARK R, JO HJ, et al. Stem cells by tuna-bone-derived hydroxyapatite composites withspontaneous osteogenic differentiation of human mesenchymal green tea polyphenol-reduced graphene oxide. Cells. 2023;12(11):1448. [63] ZHANG X, ZHANG H, ZHANG Y, et al. 3D printed reduced graphene oxide-GelMA hybrid hydrogel scaffolds for potential neuralized bone regeneration. J Mater Chem B. 2023;11(6):1288-1301. [64] LATOURTE A, KLOPPENBURG M, RICHETTE P. Emerging pharmaceutical therapies for osteoarthritis. Nat Rev Rheumatol. 2020;16(12):673-688. [65] HODGKINSON T, KELLY DC, CURTIN CM, et al. Mechanosignalling in cartilage: an emerging target for the treatment of osteoarthritis. Nat Rev Rheumatol. 2022;18(2):67-84. [66] PENG Z, SUN H, BUNPETCH V, et al. The regulation of cartilage extracellular matrix homeostasis in joint cartilage degeneration and regeneration. Biomaterials. 2021;268:120555. [67] FENG K, YU Y, CHEN Z, et al. Injectable hypoxia-preconditioned cartilage progenitor cells-laden GelMA microspheres system for enhanced osteoarthritis treatment. Mater Today Bio. 2023;20:100637. [68] BEN M G, AVEIC S, WACHENDOERFER M, et al. 3D printable gelatin methacryloyl (gelma)-dextran aqueous two-phase system with tunable pores structure and size enables physiological behavior of embedded cells in vitro. Small. 2023;19(44):e2208089. |
| [1] | Qian Yan, Liu Qisong. Enhancing potential of mesenchymal stem cell exosomes for osteoarthritis by adjusting cell culture condition [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(1): 164-174. |
| [2] | Yang Yufang, Yang Zhishan, Duan Mianmian, Liu Yiheng, Tang Zhenglong, Wang Yu. Application and prospects of erythropoietin in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1443-1449. |
| [3] | Dai Yuexing, Zheng Liqin, Wu Minhui, Li Zhihong, Li Shaobin, Zheng Desheng, Lin Ziling. Effect of vessel number on computational fluid dynamics in vascular networks [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1206-1210. |
| [4] | Wang Shanshan, Shu Qing, Tian Jun. Physical factors promote osteogenic differentiation of stem cells [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1083-1090. |
| [5] | Chen Xiaofang, Zheng Guoshuang, Li Maoyuan, Yu Weiting. Preparation and application of injectable sodium alginate hydrogels [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 789-794. |
| [6] | Wang Jiani, Chen Junyu. Angiogenesis mechanism of metal ions and their application in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 804-812. |
| [7] | Wang Wu, Fan Xiaolei, Xie Jie, Hu Yihe, Zeng Min. Hydroxyapatite-polyvinyl alcohol/collagen-chitosan-gelatin composite hydrogel for repairing rabbit osteochondral defect [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 682-689. |
| [8] | Zhang Ya, Mu Qiuju, Wang Zilin, Liu Hongjie, Zhu Lili. Hydrogel loaded with platelet-rich plasma promotes wound healing in diabetic rats [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 690-696. |
| [9] | Shen Ziqing, Xia Tian, Shan Yibo, Zhu Ruijun, Wan Haoxin, Ding Hao, Pan Shu, Zhao Jun. Vascularized tracheal substitutes constructed by exosome-load hydrogel-modified 3D printed scaffolds [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 697-705. |
| [10] | Lan Weiwei, Yu Yaodong, Huang Di, Chen Weiyi. In vitro degradation behavior of Mg-Zn-Ca alloys [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 717-723. |
| [11] | Tian Xin, Liu Tao, Yang Huilin, He Fan. In vitro evaluation of sustained release Kartogenin by gelatin methacryloyl microspheres for repairing nucleus pulposus degeneration [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 724-730. |
| [12] | Zhou Xiaowen, Fu Zuchang, Huang Fei, Ai Jianguo, Zhao Feng. Bone defect blocked by bone cement segmental filling in single-plane tibial bone transport [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 736-740. |
| [13] | Zhu Liwei, Wang Jiangyue, Bai Ding. Application value of nanocomposite gelatin methacryloyl hydrogels in different bone defect environments [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 753-758. |
| [14] | Yang Yuqing, Chen Zhiyu. Role and application of early transient presence of M1 macrophages in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 594-601. |
| [15] | Zhou Shibo, Guan Jianbin, Yu Xing, Zhao He, Yang Yongdong, Liu Tao. Animal models of femoral bone defects: preparation status and characteristics [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 633-638. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||