Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (22): 3569-3575.doi: 10.12307/2024.521
Previous Articles Next Articles
Application of bioelectric effect materials in design of bone tissue engineering scaffolds
Xi Hongzhong, Liu Xin, Sun Guangquan, Du Bin, Yuan Xinwei, Huang Yixuan, Guo Mingbin, Mai Jianbin
- 1Affiliated Hospital of Nanjing University of Chinese Medicine, Nanjing 210029, Jiangsu Province, China; 2Department of Orthopedics and Traumatology, Affiliated Hospital of Nanjing University of Chinese Medicine, Nanjing 210029, Jiangsu Province, China
-
Received:2023-09-02Accepted:2023-10-14Online:2024-08-08Published:2024-01-20 -
Contact:Du Bin, Doctoral supervisor, Professor, Chief physician, Department of Orthopedics and Traumatology, Affiliated Hospital of Nanjing University of Chinese Medicine, Nanjing 210029, Jiangsu Province, China -
About author:Xi Hongzhong, Doctoral candidate, Affiliated Hospital of Nanjing University of Chinese Medicine, Nanjing 210029, Jiangsu Province, China -
Supported by:General Project of National Natural Science Foundation of China, No. 82074471 (to DB); Jiangsu Provincial Health Commission Scientific Research Project, No. K2019027 (to DB)
CLC Number:
Cite this article
Xi Hongzhong, Liu Xin, Sun Guangquan, Du Bin, Yuan Xinwei, Huang Yixuan, Guo Mingbin, Mai Jianbin. Application of bioelectric effect materials in design of bone tissue engineering scaffolds[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(22): 3569-3575.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
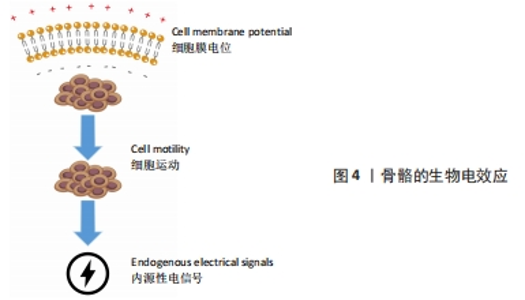
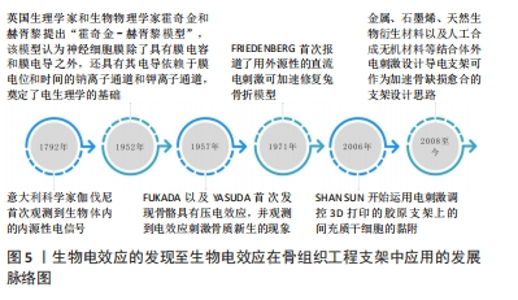
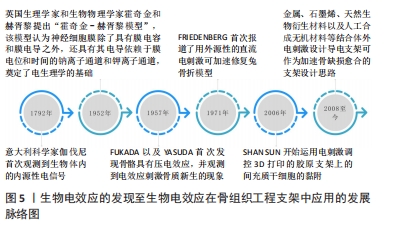
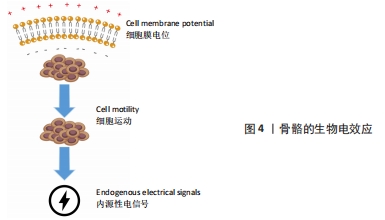
2.1 骨骼的生物电效应 1792年有学者观察到电信号能够导致青蛙肌肉纤维收缩[5],自此以后,人们普遍认为内源性电信号是生物体内的主要动力系统。早在胚胎的发育过程之中,内源性电信号就大量存在,帮助细胞增殖分化,促进生物组织生长发育[7]。这些电信号同时可作为细胞的自然控制系统,确保细胞的正常表达,促进细胞的迁移以及定向分化[8]。而维持胚胎稳定的生物电一旦被破坏,可能导致严重的发育障碍,包括颅骨缺损或者头部畸形等[9]。生物电是人体有机体重要的组成部分,在细胞层面上,生物电在调节细胞周期、迁移、增殖和分化中起重要作用[10]。同时,生物电被认为与组织生长和重塑密切相关,尤其在骨再生方面[11]。骨组织主要由羟基磷灰石、胶原、水、蛋白质以及骨细胞组成,其中羟基磷灰石以及胶原主要承担了骨组织感受机械应力所产生的压电效应[12]。如图4所示,骨的生物电效应主要来源于骨细胞的运动。几乎所有哺乳动物的细胞都有一个长期并相对稳定的电压电位,称为膜电位,骨细胞亦不例外。膜电位产生于不同的跨膜离子通道,有助于各种特定的离子和分子的跨膜运输[13]。有研究指出,由于大多数骨细胞具有负的膜电位水平,骨细胞的迁移、运动就会形成生物电[14]。当骨缺损发生时,缺损部位不停募集骨细胞,导致离子电流不断汇入缺损区域,骨生物电效应便更为显著[15]。此外,骨细胞具有感知周围环境中离子运动的能力,当各式各样的生物过程进行时,随着各种离子的重新定位以及迁移,骨细胞相应的产生运动,亦会形成生物电[16]。内源性电信号促进组织修复和再生的研究逐渐引起了骨科领域的重视,激发了众多学者对外源性电刺激加速骨愈合和骨重塑的探索。从科学家发现生物体内源性电信号到电刺激结合骨骼生物效应设计骨支架的发展脉络见图5。"
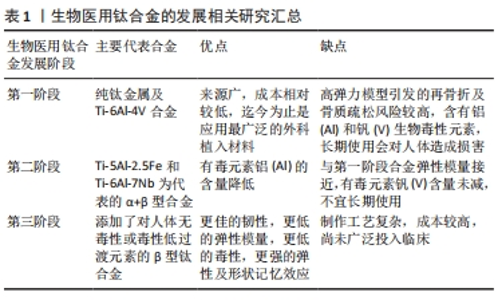
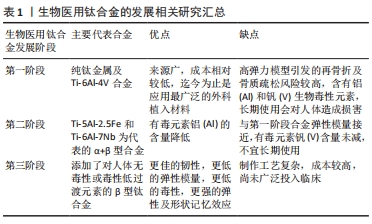
2.2 电刺激效应对骨修复的作用机制 电刺激的种类根据电极是否直接作用到骨组织可分为侵入性电刺激和非侵入性电刺激。侵入性电刺激由于直接侵入组织,不可避免有再次损伤或感染的风险,且新生的组织主要围绕在电极附近,临床上比较大的损伤修复效果不明显[17]。所以,此种电刺激主要运用在各种口腔种植体周围的骨修复或者牙周缺损等较小范围的修复上。非侵入性电刺激主要是电容耦合刺激与感应偶联刺激。电容耦合刺激是通过电容两级电场的电压梯度诱导产生电流,而感应偶联刺激是通过变化的磁场诱导电流产生。非侵入性电刺激感染风险较小,但由于是诱导电流,相对直流电刺激来说具有一定的不稳定性。目前关于电刺激修复骨缺损的机制尚无统一认识,公认的相关内涵及机制主要包括激活Ca2+通道、调节跨膜受体、加速ATP消耗、调控活性氧相关信号通路、调节细胞间隙连接、调节细胞外基质以及促进局部成血管表达等。 2.2.1 激活细胞质膜离子通道 在证实电刺激能促进骨质新生的基础之上,相继有学者发现电刺激增强骨愈合主要是通过激活成骨细胞质膜中电压门控的Ca2+通道实现的[18-20]。在电刺激作用下,细胞膜表面膜电位发生变化,从而细胞膜受体结构发生改变,相关受体通道打开,钙离子流入细胞质。此外,电刺激可通过磷脂酶C诱导膜蛋白重组,进而导致细胞内钙储层释放钙离子[21-22]。这两种情况下的钙离子瞬态都会激活细胞骨架钙调素,并进一步加速细胞增殖,改变生长因子的表达[23-25]。 2.2.2 调节跨膜受体 电刺激可以通过调节跨膜受体(如生长因子受体、整合素-β分子受体以及腺苷A2A受体等)的分布、表达以及构象,从而影响相关细胞内信号通路在细胞迁移或分化的表达影响成骨分化[14,26]。 2.2.3 加速ATP消耗 电刺激可以通过影响细胞代谢、加速ATP消耗的方式改变跨膜相关行为,如细胞的内吞和胞吐,黏附及迁移[27]。已有研究表明,在10-1 000 μA的直流电刺激下,细胞膜结合ATP的过程得到了加速,随后这些ATP被消耗,为单体G-肌动蛋白转化为聚合F-肌动蛋白供能,以重组肌动蛋白细胞骨架[28-30]。 2.2.4 调控活性氧相关信号通路 电刺激产生的活性氧可以激活与细胞增殖分化相关重要信号通路,包括MAPK,ERK1,ERK2,JNK以及P38信号级联[31-33]。有研究表明,电刺激轻度升高的活性氧可促进间充质干细胞增殖与分化,有利于骨形成[31]。 2.2.5 调节细胞间隙连接 细胞间间隙连接不仅使相邻细胞进行分子交换,而且还能形成电耦合或者代谢耦合。电刺激可以调节细胞间隙连接,影响钙、钾以及环核苷酸等信号分子交换,促进电活性相关细胞的发育及交换[34-35]。 2.2.6 影响细胞外基质 电刺激可以通过影响蛋白质、可溶性离子或者带电基团来改变细胞外基质组成,而细胞可以通过整合素来感知细胞外基质的变化,进而影响一系列生物过程[36-37]。 2.2.7 促进局部成血管表达 在电刺激的影响下,血管扩张,通透性增加,局部组织血流得到改善。骨缺损发生时,电刺激可以激发坏死区周围血管内皮生长因子生成新的血管并长入缺损处,为损伤组织提供血供。有研究证实,在电刺激激发血管内皮细胞新生血管的同时,可以通过血管内皮生长因子介导的反馈通路调节血管新生[38]。 2.3 生物电效应骨组织工程支架 所有骨组织工程支架在植入生物体内后,必然考虑的基本性能包括生物相容性、骨传导性、生物力学以及生物可降解性等,此外材料的内部结构、分子质量以及外部组成也是不可获取的考量因素[39-40]。在设计生物电效应骨组织工程支架时,导电性能则是支架设计思路的主要考量。金属支架以及石墨烯等天然具有导电性能的材料是其中的首选,而一些天然导电性能不佳的材料通过改性也能兼具导电性能。过去数年间,学者们开展了许多关于导电支架的研究,并取得了丰厚的成果。骨缺损的修复是一个复杂的过程,基于生物电效应的骨组织工程支架为了达到修复骨缺损的目的对各种材料都进行了不同程度的研究。 2.3.1 金属材料 金属是天然的导电材料,并且由于强度和韧性较高,具有耐腐蚀、耐磨、可锻性和再现性好以及浇铸成型强度不降低等优点,在骨组织工程中的应用由来已久,相对于其他材料,金属在机械力学和生物相容性上有更佳的表现[3]。然而,金属支架在植入人体后会产生一定的副反应,例如高弹力模型带来的再骨折和骨质疏松的可能,金属长期植入人体造成的一些潜在有毒元素如铝及钒的损害[41-42]。所以,金属支架一个研究的重点就是在降低高弹力模型的同时尽可能降低其潜在毒性,目前采用最多的方法就是利用合金,钛及其合金是当前研究的热点。 钛及其合金因为高机械强度及耐腐蚀性在生物医用种植体上应用广泛[43],人工髋、膝关节置换的假体一般采用钛合金。如表1所示,生物医用钛合金的发展迄今为止共经历了3个阶段[44]。从运用纯钛金属和Ti-6Al-4V合金过渡到合金中添加低毒性过渡元素的β型钛合金。杨铁威等[44]将钛铌锆钽(Ti-Nb-Zr-Ta)合金应用于兔肱骨骨折,同时观察应力遮挡和骨生物电,结果显示,相对于传统钢板,钛铌锆钽钛合金应力遮挡相对较小,更利于骨折端形成持续稳定和相对较高的负电位水平,形成相对更佳的内源性生物电环境能更佳地促进成骨。WU等[45]通过在3D打印的Ti-6Al-4V支架上合成均匀的钛酸钡层,制备出BaTiO3/Ti-6Al-4V支架,体外实验证实,电刺激极化后的BaTiO3/Ti-6Al-4V支架生物毒性低且能够增强小鼠胚胎成骨细胞(MC-3T3)的骨修复作用。由此可见,金属材料由于自身在强度和韧性等性能上具有优势,在骨组织工程支架中运用十分广泛,同时作为天然的导电材料,是导电支架的常选。目前针对金属骨组织工程支架的研究主要瞩目于钛合金等合金上,并通过形形色色的改性和修饰对其赋能,其作为导电支架具有一定的多样性,有着广阔的研究前景。"
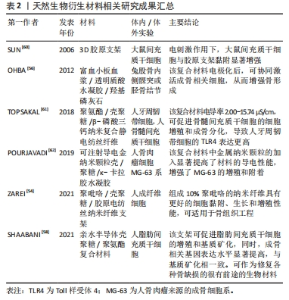
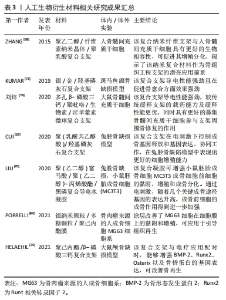
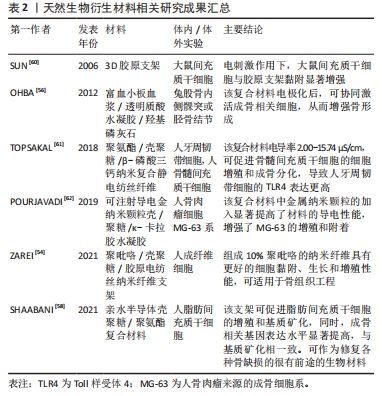
2.3.2 石墨烯材料 石墨烯是以sp2杂化连接的碳原子紧密堆积成单层二维蜂窝状晶格结构的材料,具有较大的比表面积、优异的力学性能、机械强度以及可降解性,尤其是导电导热的功能比较强劲,在骨组织工程中的应用相当广泛[46]。已有研究证明,多项氧化石墨烯(GO)混合支架可有效促进骨组织细胞的黏附、增殖和骨沉积,恢复其正常的组织功能[47-49]。陈琳[50]为了借助石墨烯的导电性能促进骨再生修复,制备了一种新型的还原氧化石墨烯(reduced graphene oxide,rGO)对硅酸钙(CS)生物陶瓷进行表面修饰。通过实验证明,在3 μA直流电和rGO/CS复合生物陶瓷的共同作用下,小鼠骨髓间质干细胞的碱性磷酸酶活性显著升高,且与成骨表达相关的基因(Ⅰ型胶原蛋白,骨钙蛋白和Runx2)的表达也明显上升,说明电刺激作用能进一步提升rGO/CS生物陶瓷的体外生骨能力。CHLANDA等[51]利用原子力显微镜研究rGO复合纤维的形态和表面的机电特性,从纳米尺度上评估材料的性能。结果表明,rGO复合纤维的表面电位与复合的rGO材料呈剂量依赖性关系,并且加入rGO薄片后,对聚已酸内酯的疏水性并没有影响,相反更加能促进骨缺损的愈合。可见,石墨烯在骨组织工程之中的主要用途是作为修饰材料引入支架之中的,由于其本身具有较强的导电性能,可显著增强支架的电活性。可贵的是,石墨烯修饰支架带来的副反应微乎其微,一般不影响修饰后复合支架的生物性能,且无毒副反应,相反还能增强支架的力学性能、电活性以及促进骨修复的能力,可说是生物电效应骨组织工程支架材料之中极佳的选择。 2.3.3 天然生物衍生材料 一些天然生物材料如胶原、透明质酸以及壳聚糖等由于具有良好的生物相容性、来源广、取材容易及可塑性优良的优点在骨组织工程中应用广泛[52]。 胶原作为一种天然的聚合物,在皮肤、骨骼、肌腱以及韧带等人体组织中广泛存在,占人体蛋白质总量的1/3,且具有高溶胀性、低抗原性、优异的生物相容性以及良好的组织再生性能,在细胞的黏附、迁移、增殖与分化中起到关键作用,可作为骨组织工程的理想材料[53]。有研究人员通过引入导电物质的方法,制备胶原蛋白的复合导电支架,通过增加支架的导电性进一步增加胶原蛋白的成骨性能。有研究者将具有导电性能的聚吡咯聚合物引入含有胶原蛋白的复合支架之中,制备出导电性能强劲的静电纺丝纳米纤维支架[54],对该支架的导电性进行测定,由于聚吡咯的存在,支架中纳米纤维的导电性能提高到164.274×10-3 s/m。 同时,一定的机械性能使得该复合支架适合于不同类型的组织工程,如皮肤、神经以及骨骼等。因此,胶原作为生物相容性优良的材料,可以通过引入导电性物质或者电极化的方式赋予其支架生物电活性,是生物电效应骨组织工程支架的适宜的制备材料。 透明质酸作为天然的生物材料,存在于诸如皮肤、软骨和玻璃体液等人体的大多数结缔组织中,所以其来源相对广泛,并且传播生物源性病原体的风险微乎其微,同时因为具有调节组织和基质中水分等生理功能,在骨组织工程中可用于具有结构和空间填充性能的支架[55]。OHBA等[56]发现透明质酸、富血小板血浆和羟基磷灰石组成的复合支架通过电极化后,成骨活性更强,骨的形成效果也更为明显。由此可见,透明质酸由于其极佳的生物相容性易与骨组织耦合,因此是导电支架材料的良好选择。 壳聚糖主要来源于甲壳类动物的外壳,是将甲壳素通过脱乙酰化处理而得的生物材料,由于具有良好的降解性以及无毒无抗原性等优势,在骨组织工程支架中得到了广泛的研究[57]。然而,因为壳聚糖生物相容性、抗菌性以及力学性能欠佳,其在骨缺损修复领域之中的潜力受到了一定的限制。因此,研究者们常通过引入其他材料同壳聚糖复合,实现壳聚糖生物材料的多功能化。SHAABANI等[58]开发了一种新型的亲水半导电壳聚糖衍生物,并将其载入具有自愈合的水性聚氨酯结构之中,利用壳聚糖的双弧结构增加支架的亲水性,同时也增强了支架的导电性,该复合支架具有良好的形状记忆功能,并且能促进人脂肪间充质干细胞向骨细胞的分化。同时,由于亲水半导电壳聚糖衍生物的引入,Ⅰ型胶原蛋白、碱性磷酸酶及Runx-2等与骨形成相关的基因的表达水平也显著升高。可以看出,即使壳聚糖作为骨组织工程支架材料存在一定的限制,也可以通过引入其他材料与其复合的方式实现支架的多功能化,是生物电效应骨组织工程可靠的制备材料。 已有研究证明,提高天然生物衍生材料的导电性能够提高其作为骨组织工程支架骨修复的能力[59]。而上述研究证实,通过引入导电物质到天然生物衍生材料中,不仅能增强其生物活性,还能增强其机械性能,更有利于促进骨修复。此类生物材料作为具有多种功能的工程结构,在修复骨缺损的应用上具有广阔前景。 2.3.4 人工合成生物材料 在骨组织工程支架的长久发展之中,除了上述自然界中衍生的生物材料,人工合成的生物材料也得到了充分的应用[60-62]。由于是人工合成,具有以下优点:①可以批量生产充分满足临床需求;②可以设计材料形状及强度;③可以预测材料的力学性能;④可以诱导材料的各种性能[63]。人工合成生物材料主要包括高分子有机材料以及人工合成无机材料,其在导电支架之中亦是研究重点。 高分子有机合成材料:在骨组织工程支架之中,运用较多的高分子合成材料包括聚乳酸、聚羟基乙酸以及聚乳酸羟基乙酸等[64-66]。CUI等[67]报道了一种由聚乳酸与羟基磷灰石结合生成的复合支架,这种复合支架在电刺激作用下,能够在兔胫骨缺陷模型中表现出更好的细胞增殖能力,并且能够增强成骨分化,在体内表现出更加有效的骨愈合。ZHANG等[68]利用静电纺丝技术合成了聚乙二醇/纤维素纳米晶体/聚乳酸复合支架,由于电纺丝溶液导电率的增加,有效地增加了人骨髓间充质干细胞的增殖分化,揭示了该纳米复合材料在骨组织工程中潜在的应用潜力。可见,通过运用各种方法来改善高分子有机合成材料的性能,通过与其他材料的复合,能够满足导电支架的需求。 其他的高分子有机合成材料,譬如聚己内酯、聚甲基丙烯酸甲酯、聚丙交酯以及聚乙交酯等,也是骨组织工程支架之中研究的热点,然而此类材料大多数都达不到骨组织工程支架对生物可降解性以及生物相容性的需求,因此对此类材料的研究大多专注于改性之上,以满足导电支架的需求。PORRELLI等[69]运用静电纺丝技术将银纳米颗粒以及多糖颗粒均匀沉积在聚己内酯膜上,结果表明,纳米银颗粒以及多糖颗粒能与聚己内酯膜紧密结合,且能够均匀稳定地释放,发挥抗菌和促进成骨细胞黏附并增殖的作用,且由于银离子的存在,该复合材料的电活性显著增强。LIU等[70]利用可生物降解的低聚物(聚(乙二醇)富马酸)作为交联基体,加入可交联的碳纳米管-聚(乙二醇)-丙烯酸酯,再联合二维的黑磷纳米片制备出一种碳纳米管黑磷复合导电水凝胶支架,该支架在兼具一定机械性能的基础上,表现出了良好的导电性能。体内的动物实验中,该支架能加速兔股骨缺损的修复,而在体外实验之中,该复合水凝胶支架能促进小鼠胚胎成骨细胞的增殖、黏附和分化。 人工合成无机材料:羟基磷灰石是人体骨组织中的主要无机物,在广泛的临床实用以及基础研究之中被证实具有良好的生物相容性、生物降解性以及细胞亲和力,可有效促进骨细胞的分化增殖和黏附,并且可与骨组织有效结合,是临床骨缺损修复重要替代材料[71]。然而,羟基磷灰石自身具有易碎性、不耐疲劳以及缺乏足够的机械应力,目前常将其与其他材料复合改善性能,在生物电活性支架之中的运用也相当广泛。WANG等[72]比较了不同结构的多孔羟基磷灰石的电极化对骨长入的影响,研究结果表明电极化能够导致羟基磷灰石多孔体的骨电导率与孔表面储存的大电荷诱导的成骨细胞活性增强,最终导致羟基磷灰石多孔体的骨生长增强。KUMAR等[73]将银与金元素通过共沉淀的方法掺入到羟基磷灰石中,由于金属元素的加入,复合支架的导电性能显著提高,相对于单纯的羟基磷灰石支架表现出更强的骨再生和骨愈合的能力。这些研究可以说明,羟基磷灰石作为同骨结构类似的材料,是设计生物电效应骨支架的理想选择。 磷酸三钙主要是钙、磷组成,其与骨成分的无机组成部分高度一致,且由于具有良好的生物相容性,在骨组织工程之中应用广泛,目前使用最多的是β-磷酸三钙,其应用许多甚至已经到了临床效应评估的阶段。刘锌等[74]以聚吡咯为亲和素制造了多孔β-磷酸三钙-聚吡咯-生物素-淫羊藿素微球复合支架,由于聚吡咯与β-磷酸三钙的混合,整体支架都具有导电性,支架表面更有利于细胞的黏附生长,从而更有利于骨修复。HELAEHIL等[75]制备了一种聚己内酯和β-磷酸三钙的复合支架,并且运用电刺激补偿了复合支架缺失的内源性电信号,以刺激细胞的增殖和分化。动物实验证实,电刺激该复合支架能够增强骨形态发生蛋白2、Runx2、Osterix以及骨桥蛋白的基因表达,骨再生也得到了改善。这些研究可以说明,β-磷酸三钙是生物电效应骨组织工程支架材料的极佳选择。 生物活性陶瓷目前的运用主要包括髋关节、膝关节、牙齿、肌腱和韧带的置换,以及充当牙周病的修复、颌面重建、颌骨的增强和稳定、脊柱融合术和肿瘤手术后的骨填充物,其潜在应用亦可包括药物传递系统:成为生长因子、生物活性肽和各种用于组织工程目的细胞有效载体[76]。由于具有良好的骨传导性、抗压强度以及骨整合性,生物活性陶瓷可用于制备骨组织工程支架。MATA等[77]发现生物活性陶瓷复合支架通过每天15 μA 15 min的电刺激后,细胞代谢活性和DNA含量分别增加了130%和60%;而刺激5 d后,Runx2、骨钙蛋白和碱性磷酸酶的成骨细胞基因表达分别提高了80%,50%和25%,可见选择性电刺激生物活性陶瓷复合支架能为临床电疗提供新的可能性。 目前天然生物衍生材料的生物电效应骨组织工程支架研究成果见表2,人工合成生物材料相关研究成果见表3。"
| [1] GARCÍA-GARETA E, COATHUP MJ, BLUNN GW. Osteoinduction of bone grafting materials for bone repair and regeneration. Bone. 2015;81:112-121. [2] HOFMANN GO, KIRSCHNER MH, WANGEMANN T, et al. Infections and immunological hazards of allogeneic bone transplantation. Arch Orthop Trauma Surg. 1995;114(3):159-166. [3] 廖欣宇,王福科,王国梁.骨组织工程支架的进展与挑战[J].中国组织工程研究,2021, 25(28):4553-4560. [4] FUKADA E, YASUDA I. On the piezoelectric effect of bone. J Phys Soc Jpn. 1957;12(10):1158-1162. [5] MARTONOSI AN. Animal electricity, Ca2+ and muscle contraction. A brief history of muscle research. Acta Biochim Pol. 2000;47(3):493-516. [6] HORAS K, ARNHOLDT J, STEINERT AF, et al. Acetabular defect classification in times of 3D imaging and patient-specific treatment protocols. Orthopade. 2017;46(2):168-178. [7] SAIZ CJ, ESCOBAR HJ, GARZÓN-ALVARADO DA, et al. Electric and magnetic field devices for stimulation of biological tissues. J Vis Exp. 2021. doi: 10.3791/62111. [8] LEVIN M. Bioelectric signaling: Reprogrammable circuits underlying embryogenesis, regeneration, and cancer. Cell. 2021;184(8):1971-1989. [9] KEYNES RD. The ionic channels in excitable membranes. Ciba Found Symp. 1975;(31):191-203. [10] DA SL, KUNDU SC, REIS L, et al. Electric phenomenon: a disregarded tool in tissue engineering and regenerative medicine. Trends Biotechnol. 2020;38(1):24-49. [11] WIELAND DC, KRYWKA C, MICK E, et al. Investigation of the inverse piezoelectric effect of trabecular bone on a micrometer length scale using synchrotron radiation. Acta Biomater. 2015;25:339-346. [12] DEVET T, JHIRAD A, PRAVATO L, et al. Bone bioelectricity and bone-cell response to electrical stimulation: a review. Crit Rev Biomed Eng. 2021;49(1):1-19. [13] YANG M, BRACKENBURY WJ. Membrane potential and cancer progression. Front Physiol. 2013; 4:185. [14] MYCIELSKA ME, DJAMGOZ MB. Cellular mechanisms of direct-current electric field effects: galvanotaxis and metastatic disease. J Cell Sci. 2004;117(Pt 9):1631-1639. [15] ROBINSON KR. The responses of cells to electrical fields: a review. J Cell Biol. 1985;101(6):2023-2027. [16] DIXON DT, GOMILLION CT. Conductive scaffolds for bone tissue engineering: current state and future outlook. J Funct Biomater. 2021;13(1):1. [17] BASSETT CA, PAWLUK RJ, BECKER RO. Effects of electric currents on bone in vivo. Nature. 1964; 204:652-654. [18] BEZANILLA F. The voltage sensor in voltage-dependent ion channels. Physiol Rev. 2000;80(2): 555-592. [19] ZAYZAFOON M. Calcium/calmodulin signaling controls osteoblast growth and differentiation. J Cell Biochem. 2006;97(1):56-70. [20] GRIFFIN M, BAYAT A. Electrical stimulation in bone healing: critical analysis by evaluating levels of evidence. Eplasty. 2011;11:e34. [21] Li JK, Lin JC, Liu HC, et al. Comparison of ultrasound and electromagnetic field effects on osteoblast growth. Ultrasound Med Biol. 2006;32(5):769-775. [22] MURILLO G, BLANQUER A, VARGAS-ESTEVEZ C, et al. Electromechanical nanogenerator-cell interaction modulates cell activity. Adv Mater. 2017. doi: 10.1002/adma.201605048. [23] KIM IS, SONG JK, SONG YM, et al. Novel effect of biphasic electric current on in vitro osteogenesis and cytokine production in human mesenchymal stromal cells. Tissue Eng Part A. 2009;15(9):2411-2422. [24] XU J, WANG W, CLARK CC, et al. Signal transduction in electrically stimulated articular chondrocytes involves translocation of extracellular calcium through voltage-gated channels. Osteoarthritis Cartilage. 2009;17(3):397-405. [25] BRENNAN MÁ, LAYROLLE P, MOONEY DJ. Biomaterials functionalized with MSC secreted extracellular vesicles and soluble factors for tissue regeneration. Adv Funct Mater. 2020; 30(37):1909125. [26] CIOMBOR DM, AARON RK. The role of electrical stimulation in bone repair. Foot Ankle Clin. 2005;10(4):579-593. [27] ORR AW, HELMKE BP, BLACKMAN BR, et al. Mechanisms of mechanotransduction. Dev Cell. 2006;10(1):11-20. [28] CHENG N, VAN HOOF H, BOCKX E, et al. The effects of electric currents on ATP generation, protein synthesis, and membrane transport of rat skin. Clin Orthop Relat Res. 1982;(171):264-272. [29] ATKINSON SJ, HOSFORD MA, MOLITORIS BA. Mechanism of actin polymerization in cellular ATP depletion. J Biol Chem. 2004;279(7):5194-5199. [30] TITUSHKIN I, CHO M. Regulation of cell cytoskeleton and membrane mechanics by electric field: role of linker proteins. Biophys J. 2009;96(2):717-728. [31] SCHMELTER M, ATEGHANG B, HELMIG S, et al. Embryonic stem cells utilize reactive oxygen species as transducers of mechanical strain-induced cardiovascular differentiation. FASEB J. 2006. 20(8):1182-1184. [32] DÍAZ-VEGAS A, CAMPOS CA, CONTRERAS-FERRAT A, et al. ROS production via P2Y1-PKC-NOX2 is triggered by extracellular ATP after electrical stimulation of skeletal muscle cells. PLoS One. 2015;10(6):e129882. [33] ZHANG C, LIU W, CAO C, et al. Modulating surface potential by controlling the β phase content in poly (vinylidene fluoridetrifluoroethylene) membranes enhances bone regeneration. Adv Healthc Mater. 2018;7(11):e1701466. [34] PEREDA AE. Electrical synapses and their functional interactions with chemical synapses. Nat Rev Neurosci. 2014;15(4):250-263. [35] VENKATESH HS, MORISHITA W, GERAGHTY AC, et al. Electrical and synaptic integration of glioma into neural circuits. Nature. 2019;573(7775):539-545. [36] KOTWAL A, SCHMIDT CE. Electrical stimulation alters protein adsorption and nerve cell interactions with electrically conducting biomaterials. Biomaterials. 2001;22(10):1055-1064. [37] VACA-GONZÁLEZ JJ, GUEVARA JM, MONCAYO MA, et al. Biophysical stimuli: a review of electrical and mechanical stimulation in hyaline cartilage. Cartilage. 2019;10(2):157-172. [38] SRIRUSSAMEE K, MOBINI S, CASSIDY NJ, et al. Direct electrical stimulation enhances osteogenesis by inducing Bmp2 and Spp1 expressions from macrophages and preosteoblasts. Biotechnol Bioeng. 2019;116(12):3421-3432. [39] SHEIKH Z, HAMDAN N, IKEDA Y, et al. Natural graft tissues and synthetic biomaterials for periodontal and alveolar bone reconstructive applications: a review. Biomater Res. 2017;21:9. [40] MONDSCHEIN RJ, KANITKAR A, WILLIAMS CB, et al. Polymer structure-property requirements for stereolithographic 3D printing of soft tissue engineering scaffolds. Biomaterials. 2017;140: 170-188. [41] COSTA BC, TOKUHARA CK, ROCHA LA, et al. Vanadium ionic species from degradation of Ti-6Al-4V metallic implants: in vitro cytotoxicity and speciation evaluation. Mater Sci Eng C Mater Biol Appl. 2019;96:730-739. [42] FROST HM. A 2003 update of bone physiology and Wolff’s Law for clinicians. Angle Orthod. 2004;74(1):3-15. [43] HIEDA J, NIINOMI M, NAKAI M, et al. Adhesive strength of medical polymer on anodic oxide nanostructures fabricated on biomedical β-type titanium alloy. Mater Sci Eng C Mater Biol Appl. 2014;36:244-251. [44] 杨铁威,刘欣伟,柳云恩,等.钛铌锆钽合金可促进兔肱骨干横骨折的愈合[J].中国组织工程研究,2014,18(52):8382-8386. [45] WU H, DONG H, TANG Z, et al. Electrical stimulation of piezoelectric BaTiO3 coated Ti6Al4V scaffolds promotes anti-inflammatory polarization of macrophages and bone repair via MAPK/JNK inhibition and OXPHOS activation. Biomaterials. 2023;293:121990. [46] XUE W, DU J, LI Q, et al. Preparation, properties, and application of graphene-based materials in tissue engineering scaffolds. Tissue Eng Part B Rev. 2022;28(5):1121-1136. [47] WANG Q, CHU Y, HE J, et al. A graded graphene oxide-hydroxyapatite/silk fibroin biomimetic scaffold for bone tissue engineering. Mater Sci Eng C Mater Biol Appl. 2017;80:232-242. [48] AIDUN A, SAFAEI FA, MOHARRAMI M, et al. Graphene oxide incorporated polycaprolactone/chitosan/collagen electrospun scaffold: enhanced osteogenic properties for bone tissue engineering. Artif Organs. 2019;43(10):E264-E281. [49] BELAID H, NAGARAJAN S, TEYSSIER C, et al. Development of new biocompatible 3D printed graphene oxide-based scaffolds. Mater Sci Eng C Mater Biol Appl. 2020;110:110595. [50] 陈琳.还原氧化石墨烯表面修饰硅酸钙生物陶瓷的制备及骨再生修复性能的研究[D].绵阳:西南科技大学,2019. [51] CHLANDA A, WALEJEWSKA E, KOWIORSKI K, et al. Investigation into morphological and electromechanical surface properties of reduced-graphene-oxide-loaded composite fibers for bone tissue engineering applications: a comprehensive nanoscale study using atomic force microscopy approach. Micron. 2021;146:103072. [52] AAMODT JM, GRAINGER DW. Extracellular matrix-based biomaterial scaffolds and the host response. Biomaterials. 2016;86:68-82. [53] ZHAO C, XIAO Y, LING S, et al. Structure of collagen. Methods Mol Biol. 2021;2347:17-25. [54] ZAREI M, SAMIMI A, KHORRAM M, et al. Fabrication and characterization of conductive polypyrrole/chitosan/collagen electrospun nanofiber scaffold for tissue engineering application. Int J Biol Macromol. 2021;168:175-186. [55] COLLINS MN, BIRKINSHAW C. Hyaluronic acid based scaffolds for tissue engineering--a review. Carbohydr Polym. 2013;92(2):1262-1279. [56] OHBA S, WANG W, ITOH S, et al. Efficacy of platelet-rich plasma gel and hyaluronan hydrogel as carriers of electrically polarized hydroxyapatite microgranules for accelerating bone formation. J Biomed Mater Res A. 2012;100(11):3167-3176. [57] GUO L, LIANG Z, YANG L, et al. The role of natural polymers in bone tissue engineering. J Control Release. 2021;338:571-582. [58] SHAABANI A, SEDGHI R. Preparation of chitosan biguanidine/PANI-containing self-healing semi-conductive waterborne scaffolds for bone tissue engineering. Carbohydr Polym. 2021; 264:118045. [59] MCCULLEN SD, MCQUILLING JP, GROSSFELD RM, et al. Application of low-frequency alternating current electric fields via interdigitated electrodes: effects on cellular viability, cytoplasmic calcium, and osteogenic differentiation of human adipose-derived stem cells. Tissue Eng Part C Methods. 2010;16(6):1377-1386. [60] SUN S, TITUSHKIN I, CHO M. Regulation of mesenchymal stem cell adhesion and orientation in 3D collagen scaffold by electrical stimulus. Bioelectrochemistry. 2006;69(2):133-141. [61] TOPSAKAL A, UZUN M, UGAR G, et al. Development of Amoxicillin-Loaded Electrospun Polyurethane/Chitosan/ $\beta$ -Tricalcium Phosphate Scaffold for Bone Tissue Regeneration. IEEE Trans Nanobioscience. 2018;17(3):321-328. [62] POURJAVADI A, DOROUDIAN M, AHADPOUR A, et al. Injectable chitosan/κ-carrageenan hydrogel designed with au nanoparticles: a conductive scaffold for tissue engineering demands. Int J Biol Macromol. 2019;126:310-317. [63] ZHOU C, YE X, FAN Y, et al. Biomimetic fabrication of a three-level hierarchical calcium phosphate/collagen/hydroxyapatite scaffold for bone tissue engineering. Biofabrication. 2014; 6(3):35013. [64] KIM DY, KWON DY, KWON JS, et al. Stimuli-responsive injectable in situ-forming hydrogels for regenerative medicines. Polym Rev. 2015;55(3):407-452. [65] JING Y, QUAN C, LIU B, et al. A mini review on the functional biomaterials based on poly (lactic acid) stereocomplex. Polym Rev. 2016;56(2):262-286. [66] LIN YJ, HUANG CC, WAN WL, et al. Recent advances in CO(2) bubble-generating carrier systems for localized controlled release. Biomaterials. 2017;133:154-164. [67] CUI L, ZHANG J, ZOU J, et al. Electroactive composite scaffold with locally expressed osteoinductive factor for synergistic bone repair upon electrical stimulation. Biomaterials. 2020;230:119617. [68] ZHANG C, SALICK MR, CORDIE TM, et al. Incorporation of poly(ethylene glycol) grafted cellulose nanocrystals in poly(lactic acid) electrospun nanocomposite fibers as potential scaffolds for bone tissue engineering. Mater Sci Eng C Mater Biol Appl. 2015;49:463-471. [69] PORRELLI D, MARDIROSSIAN M, MUSCIACCHIO L, et al. Antibacterial electrospun polycaprolactone membranes coated with polysaccharides and silver nanoparticles for guided bone and tissue regeneration. ACS Appl Mater Interfaces. 2021;13(15):17255-17267. [70] LIU X, GEORGE MN, LI L, et al. Injectable electrical conductive and phosphate releasing gel with two-dimensional black phosphorus and carbon nanotubes for bone tissue engineering. ACS Biomater Sci Eng. 2020;6(8):4653-4665. [71] PALIERSE E, HÉLARY C, KRAFFT JM, et al. Baicalein-modified hydroxyapatite nanoparticles and coatings with antibacterial and antioxidant properties. Mater Sci Eng C Mater Biol Appl. 2021;118:111537. [72] WANG W, ITOH S, TANAKA Y, et al. Comparison of enhancement of bone ingrowth into hydroxyapatite ceramics with highly and poorly interconnected pores by electrical polarization. Acta Biomater. 2009;5(8):3132-3140. [73] KUMAR VB, KHAJURIA DK, KARASIK D, et al. Silver and gold doped hydroxyapatite nanocomposites for enhanced bone regeneration. Biomed Mater. 2019;14(5):55002. [74] 刘锌,杜斌,孙光权,等.多孔β磷酸三钙-聚吡咯-生物素-淫羊藿素微球复合支架促进骨髓间充质干细胞的募集[J].中国组织工程研究,2020,24(34):5532-5537. [75] HELAEHIL JV, LOURENÇO CB, HUANG B, et al. In vivo investigation of polymer-ceramic PCL/HA and PCL/β-TCP 3D composite scaffolds and electrical stimulation for bone regeneration. Polymers (Basel). 2021;14(1):65. [76] DOROZHKIN SV. Bioceramics of calcium orthophosphates. Biomaterials. 2010;31(7):1465-1485. [77] MATA D, OLIVEIRA FJ, NETO MA, et al. Smart electroconductive bioactive ceramics to promote in situ electrostimulation of bone. J Mater Chem B. 2015;3(9):1831-1845. [78] JIANG N, GUO Z, SUN D, et al. Exploring the mechanism behind improved osteointegration of phosphorylated titanium implants with hierarchically structured topography. Colloids Surf B Biointerfaces. 2019;184:110520. [79] FOROUTAN T, NAZEMI N, TAVANA M, et al. Suspended graphene oxide nanoparticle for accelerated multilayer osteoblast attachment. J Biomed Mater Res A. 2018;106(1):293-303. [80] PAWELEC KM, BEST SM, CAMERON RE. Collagen: a network for regenerative medicine. J Mater Chem B. 2016;4(40):6484-6496. [81] HANSON SE, BENTZ ML, HEMATTI P. Mesenchymal stem cell therapy for nonhealing cutaneous wounds. Plast Reconstr Surg. 2010;125(2):510-516. [82] SHIGEEDA W, SHIBAZAKI M, YASUHIRA S, et al. Hyaluronic acid enhances cell migration and invasion via the YAP1/TAZ-RHAMM axis in malignant pleural mesothelioma. Oncotarget. 2017; 8(55):93729-93740. [83] STELLAVATO A, PIROZZI A, Diana P, et al. Hyaluronic acid and chondroitin sulfate, alone or in combination, efficiently counteract induced bladder cell damage and inflammation. PLoS One. 2019,14(6):e218475. [84] 贺庆,敖强,修波,等.关于壳聚糖材料生物相容性机制的新观点(英文)[J].中国组织工程研究与临床康复,2007,11(35):7110-7112. [85] 李浩宇,张伟,冯凯,等.聚乳酸纤维的制备工艺及应用现状[J].纺织科学与工程学报, 2023,40(3):133-138. [86] VARGAS-BECERRIL N, SÁNCHEZ-TÉLLEZ DA, ZARAZÚA-VILLALOBOS L, et al. Structure of biomimetic apatite grown on hydroxyapatite (HA). Ceramics International. 2020;46(18 Part A): 28806-28813. [87] 单宇华,陈振琦. β-磷酸三钙骨免疫学特性的研究进展[J].口腔医学研究,2021,37(9): 787-790. |
| [1] | Yang Yufang, Yang Zhishan, Duan Mianmian, Liu Yiheng, Tang Zhenglong, Wang Yu. Application and prospects of erythropoietin in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1443-1449. |
| [2] | Wu Jing, Yao Yingce, Yang Xiaowei, Xue Boshi, Zhao Jianbin, Yang Chen, Luan Tianfeng, Zhou Zhipeng. Intervention of muscle strength training combined with neuromuscular electrical stimulation on lower limb function and biomechanical changes in patients with patellofemoral pain [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1365-1371. |
| [3] | Dai Yuexing, Zheng Liqin, Wu Minhui, Li Zhihong, Li Shaobin, Zheng Desheng, Lin Ziling. Effect of vessel number on computational fluid dynamics in vascular networks [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1206-1210. |
| [4] | Wang Shanshan, Shu Qing, Tian Jun. Physical factors promote osteogenic differentiation of stem cells [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1083-1090. |
| [5] | Wang Jianchun, Yang Shuqing, Su Xin, Wang Hongyuan. Different contents of B2O3 affect mechanical properties and bioactivity of bioactive glass scaffolds [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 712-716. |
| [6] | Lan Weiwei, Yu Yaodong, Huang Di, Chen Weiyi. In vitro degradation behavior of Mg-Zn-Ca alloys [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 717-723. |
| [7] | Zhou Xiaowen, Fu Zuchang, Huang Fei, Ai Jianguo, Zhao Feng. Bone defect blocked by bone cement segmental filling in single-plane tibial bone transport [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 736-740. |
| [8] | Zhu Liwei, Wang Jiangyue, Bai Ding. Application value of nanocomposite gelatin methacryloyl hydrogels in different bone defect environments [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 753-758. |
| [9] | Yin Tong, Yang Jilei, Li Yourui, Liu Zhuoran, Jiang Ming. Application of core-shell structured nanofibers in oral tissue regeneration [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 766-770. |
| [10] | Wang Jiani, Chen Junyu. Angiogenesis mechanism of metal ions and their application in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 804-812. |
| [11] | Yang Yuqing, Chen Zhiyu. Role and application of early transient presence of M1 macrophages in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 594-601. |
| [12] | Zhou Shibo, Guan Jianbin, Yu Xing, Zhao He, Yang Yongdong, Liu Tao. Animal models of femoral bone defects: preparation status and characteristics [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 633-638. |
| [13] | Li Yulin, Yu Haipeng, Tang Huajing, Zhang Zitong, Lin Xingnan. The mechanism, safety and application of berberine in promoting bone regeneration [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(35): 5702-5708. |
| [14] | Shang Yonghui, Li Shuai, Liu Yicong, Zhao Qihang, Liu Wen. Three-dimensional finite element study on the effect of posterior tooth forward movement on temporomandibular joint stress in orthodontic reduction patients [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(34): 5516-5520. |
| [15] | Zeng Zhikui, Xiong Wei, Liang Weidong, Qian Guowen, Liang Chaoyi, Pan Bin, Guo Ling, Wei Wenqiang, Qiu Xunxiang, Deng Wenfang, Yuan Lingmei. Bone remodeling in the Masquelet-induced membrane model of rat femur by modulation of H-type vessels by total flavonoids of rhizome drynariae [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(32): 5130-5135. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||