Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (15): 2423-2429.doi: 10.12307/2024.405
Previous Articles Next Articles
Research and application of carbon nanomaterials in peripheral nerve regeneration
Zhai Yunhao, Qian Yun
- Department of Orthopedics, Shanghai Sixth People’s Hospital Affiliated to Shanghai Jiao Tong University School of Medicine, Shanghai 200233, China
-
Received:2023-07-01Accepted:2023-08-02Online:2024-05-28Published:2023-09-23 -
Contact:Qian Yun, MD, Associate researcher, Department of Orthopedics, Shanghai Sixth People’s Hospital Affiliated to Shanghai Jiao Tong University School of Medicine, Shanghai 200233, China -
About author:Zhai Yunhao, Department of Orthopedics, Shanghai Sixth People’s Hospital Affiliated to Shanghai Jiao Tong University School of Medicine, Shanghai 200233, China -
Supported by:National Key Research and Development Program of China, No. 2021YFC2400801 (to QY); Sino-German Mobility Programme of National Natural Science Foundation of China, No. M-0699 (to QY); National Natural Science Foundation of China, No. 82002290 (to QY); Excellent Youth Cultivation Program of Shanghai Sixth People’s Hospital, No. ynyq202201 (to QY)
CLC Number:
Cite this article
Zhai Yunhao, Qian Yun. Research and application of carbon nanomaterials in peripheral nerve regeneration[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(15): 2423-2429.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
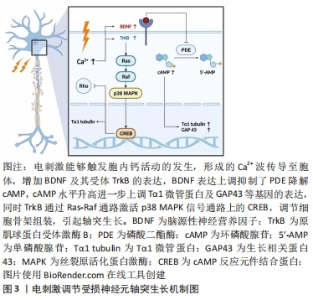
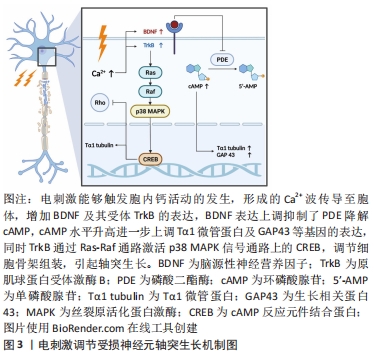
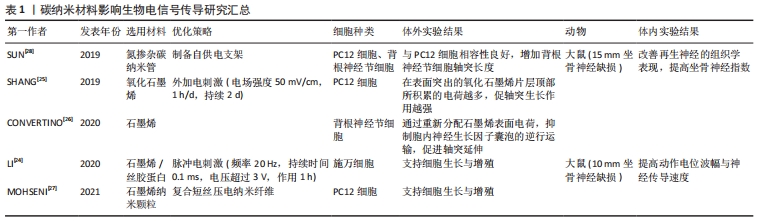
2.1 碳纳米材料作用于微环境生物电信号传导 周围神经损伤造成的电失活主要与胞内离子浓度失调有关,而恢复神经组织电生理活性的重点在于重建生物电信号传导过程中的离子浓度调节机制。周围神经系统中的电压门控钾通道Kv1在生理状态下主要成簇聚集于神经纤维的近结旁区[12],但神经损伤的脱髓鞘信号会使受损神经元细胞膜上的离子通道分布发生改变:Kv1的分散与暴露造成了神经传导速度、动作电位幅度及时长的下降,多种不利因素共同作用最终导致电信号传导阻滞[13]。生物电传导的恢复则与胞内钙活动增加有关,Ca2+作为第二信使负责将损伤信号逆行上传,同时介导了多种重要的轴突再生活动[14],但胞内钙超载的发生可能会诱导细胞凋亡。 改变支架表面形貌的修饰方法能够获得更好的神经再生效果,包括在材料表面添加微/纳米尺寸的微孔、在支架空腔内构建利于细胞黏附及生长的微结构、将支架内表面改性为亲水状态等。通过化学气相沉积在镍泡沫模板上合成的三维石墨烯泡沫能够提高多孔聚己内酯支架的机械强度和导电性,且支持大鼠嗜铬细胞瘤细胞(PC12细胞)的增殖与轴突延伸[15]。此外如醋酸纤维素等亲水材料的表面改性可能为石墨烯支架带来较好的生物相容性[16]。壳聚糖由于具有良好的亲水性及生物相容性而被广泛应用于组织工程领域[17],能够支持神经细胞的黏附与分化,壳聚糖与还原氧化石墨烯纳米片交联后制备的复合支架可能通过增强新生神经网络的电活动强度及同步性来发挥对神经电生理活动的积极作用,但具体的作用机制不明[18]。HU等[19]则发现取向规则的多壁碳纳米管/聚己内酯电纺纳米纤维能够显著促进大鼠骨髓间充质干细胞向施万细胞方向分化,同时伴有神经胶质细胞标志性蛋白的表达上调。体内实验使用种植了骨髓间充质干细胞(向施万细胞方向诱导分化2周)的有序碳纳米管纤维支架修复了大鼠10 mm坐骨神经缺损,支架在提高了复合肌肉动作电位波幅的同时缩短了潜伏期。此外,与联氨交联的双壁碳纳米管神经导管可能通过促进小型神经元簇的形成以实现高强度的同步生物电信号输出[20]。上述研究结果表明,改变碳纳米材料的表面形貌能够帮助恢复受损周围神经的电生理活性,但仍需要进一步的研究提供微结构修饰与改善神经电活动之间的直接证据。 现已明确在神经导管中引入电刺激等物理因素对恢复受损神经的电生理活性至关重要。低频短时电刺激能够在胞内形成Ca2+波,传导至胞体后增加脑源性神经营养因子及其受体原肌球蛋白受体激酶B的表达量,脑源性神经营养因子的过表达抑制了磷酸二酯酶降解cAMP,使胞内cAMP水平持续升高,最终上调一系列神经再生相关基因的表达(如Tα1微管蛋白和生长相关蛋白43等)[21],此外蛋白激酶B通过p38丝裂原活化蛋白激酶信号通路激活cAMP反应元件结合蛋白,调节细胞骨架组装[22],最终导致轴突生长,见图3,而高频电刺激则会引起神经传导阻滞[23]。在脉冲电刺激作用下,多壁碳纳米管/丝胶蛋白神经导管能够修复大鼠坐骨神经10 mm缺损,电生理反应测定中观察到复合肌肉动作电位波幅及神经传导速度的显著改善,达到与自体神经移植组相近的水平[24]。SHANG等[25]发现改变碳纳米材料中的电荷分布可能有助于周围神经再生,在聚吡咯/氧化石墨烯(graphene oxide,GO)导电复合膜表面突出的GO片层顶部所积累的电荷越多,电刺激促进轴突生长的作用也越强。此外,石墨烯能够在神经再生的早期阶段显著抑制小鼠背根神经节细胞中神经生长因子囊泡逆行运输至胞体,使其更多地停滞于轴突生长部位以促进轴突生长,这一作用可能与石墨烯表面电荷的重新分配及静息电位超极化降低细胞兴奋性等机制有关[26]。复合了短丝压电纳米纤维和石墨烯的自电刺激生物活性支架能够支持PC12细胞的体外生长与增殖,且未观察到相关的细胞毒性[27]。SUN等[28]制备了以铂纳米粒子作为阳极、氮杂碳纳米管作为阴极的多段导电支架,能够消耗葡萄糖和氧气以实现自供电,支架产生的电流增加了大鼠背根神经节细胞的轴突长度,在体内实验中修复了大鼠15 mm坐骨神经缺损。将聚乙二醇化的功能碳纳米管作为光声材料制备的复合神经导管在吸收近红外二区脉冲激光后能将光能转化为声能,通过产生光声波促进神经元生长,具体机制可能与短暂的膜破坏及钙离子通道的激活有关[29]。基于上述研究,有理由认为合适条件的物理刺激能够显著促进轴突生长及神经电生理活性重建,但碳纳米材料所对应的最适刺激参数仍有待商榷;此外,复合压电材料及自供电材料的神经导管在临床转化方面有着更大的优势。"

综合应用不同的神经导管设计策略可能会为多方面改善受损神经的电失活提供新的思路。石墨烯表面的大π共轭结构会损伤细胞膜的完整性,而合适的功能化修饰可以增加石墨烯的生物相容性使其更适用于组织工程。QIAN等[30]选择聚多巴胺和精氨酰甘氨天冬氨酸对单层/多层石墨烯进行控释修饰,使用3D打印技术制备神经导管后添加了直径50 μm的微孔,复合神经导管在具备良好机械强度及导电性的基础上能够促进大鼠施万细胞的增殖与黏附,在单层石墨烯支架上培养的施万细胞中神经相关标志物及多种神经营养因子的表达量均为最高水平。HU等[31]利用天然的生物结构,将还原氧化石墨烯纳米片和脑源性神经营养因子修饰在闪蝶蝶翼上,制成了带有特殊微结构的蝶翼支架,观察到PC12细胞和小鼠神经干细胞能够沿蝶翼支架自带的纳米脊方向形成有序的神经元网络;荧光钙成像发现蝶翼支架在缩短胞内钙峰持续时间的同时增加了钙活动频率;体内实验使用由蝶翼支架卷曲形成的神经导管修复了大鼠10 mm坐骨神经缺损。近场静电打印技术结合了静电纺丝和3D打印的特点,能用于在神经导管上添加复杂微结构。WANG等[32]使用近场静电打印获得了具有不同微结构的聚(L-丙交酯-己内酯)支架,将GO逐层涂覆到支架上并原位还原,探究了支架在电刺激作用下诱导轴突生长的能力,证明低电场强度和小直径微纤维是神经元的轴突延伸的正面因素。在新开发的神经导管上综合应用2种及以上的仿生设计已成为主流趋势,随着影响神经电生理活性变量的增加,研究者们也需要注意到由于作用机制的差异,不同修饰方法所对应的最适参数在单独使用和联合应用时可能不同,因此需要更全面的实验用以说明不同神经导管设计策略之间的相互作用。 总之,碳纳米材料在重建受损神经电活性方面能够发挥积极作用,但多数情况下仍然需要配合特定的功能化修饰才能实现周围神经再生。电信号传导的恢复与胞内钙活动密切相关,揭示碳纳米材料与钙活动之间的直接关系将为神经导管的设计及优化提供更确切的指导。同时其他离子通道对周围神经再生产生的影响也不应被忽视,应充分考虑到多离子通道对生物电信号传导的共同作用,从而基于碳纳米材料与离子通道间各异的相互作用来开发全新的功能神经导管。碳纳米材料影响生物电信号传导的研究汇总见表1。"
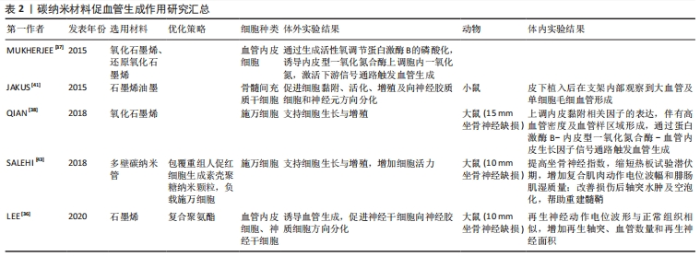
2.2 碳纳米材料作用于微环境神经内血管化 神经内血管化是衔接两侧神经断端的必要前提,损伤形成的神经间隙需要新生血管来填充,近侧轴突的生长延伸也依赖于血管的支持,血管化不足则会严重影响周围神经再生的进程。施万细胞能够改善轴突断端无序生长的混乱情况,同时为再生轴突提供关键的神经突起生长导向因子[33],在施万细胞引导下的轴突再生速度也更快。施万细胞的定向与排列需要血管内皮细胞、成纤维细胞及巨噬细胞等多种细胞的共同作用,其中血管内皮细胞发挥主要作用。在感受到神经间隙中的低氧微环境后,巨噬细胞分泌血管内皮生长因子作用于血管内皮细胞,使其在损伤早期就完全浸润进入神经间隙形成极化血管,新生血管则直接引导施万细胞的迁移,最终导致神经再生[34]。 低浓度(5-10 ng/mL)的石墨烯类碳纳米材料能够促进血管形成,但当浓度增加到较高水平(> 50 ng/mL)时则可能会抑制血管化[35]。含石墨烯质量分数5% 的聚氨酯支架能够上调牛血管内皮细胞中血管内皮生长因子受体和血管内皮钙粘蛋白的表达,在诱导血管生成的同时使神经干细胞向神经胶质细胞方向进行分化[36]。与单独培养相比,血管内皮细胞和神经干细胞在1∶1共培养的条件下细胞增殖更活跃,生长速度也更快,血管内皮细胞表现出了更多的血管相关标志物高表达,神经干细胞同样倾向于向神经胶质细胞方向分化,复合神经导管在修复大鼠10 mm坐骨神经缺损后改善了神经再生面积、再生轴突及血管数量、坐骨神经指数等多方面的表现。碳纳米材料诱导神经内血管化的可能机制是通过生成活性氧调节蛋白激酶B的磷酸化,诱导内皮型一氧化氮合酶增加胞内一氧化氮的含量,激活相关下游信号通路后触发血管生成[37]。QIAN等[38]制备的三维多层多孔GO/聚己内酯复合神经导管能够同时上调CD31和CD34两种内皮细胞黏附相关因子的表达,免疫组化染色也观察到高血管密度及血管样区域的形成,证明复合神经导管促进了再生神经组织的血管化。此外研究验证了复合神经导管能够通过参与蛋白激酶B-内皮型一氧化氮合酶信号通路,最终上调血管内皮生长因子的表达来促进神经内血管化。长期生物安全性的评估结果表明,在复合支架植入大鼠体内18个月后,心、肝等重要器官的组织形态未见明显改变[39]。上述研究充分揭示了碳纳米材料促进神经内血管化的机制,并为开发新型神经导管提供参考。 虽然已经明确碳纳米材料是如何作用于神经内血管生成,研究者们依然需要思考在何种条件下能更进一步发挥碳纳米材料的成血管作用。随着电子印刷及3D打印技术的逐渐成熟,基于生物活性油墨的功能材料也被广泛应用于组织工程。在正弦交流电刺激作用下,在石墨烯纳米片油墨印刷的薄膜上培养的小鼠神经干细胞的树突及轴突明显延长,相互连接形成了发达的神经网络[40]。使用石墨烯油墨3D打印的复合支架还能够诱导人骨髓间充质干细胞的黏附、活化、增殖及分化,显著上调神经胶质细胞和神经元标志性基因的表达,在植入小鼠皮下30 d后支架内部观察到大血管及单细胞毛细血管的形成[41]。促红细胞生成素是一种能促进血管生成、减轻损伤后神经元凋亡的造血因子[42],周围神经损伤发生后在施万细胞中观察到了其表达上调。SALEHI等[43]制备的负载重组人促红细胞生成素的多壁碳纳米管神经导管具备较好的机械强度及导电性,能持续2周可控释放促红细胞生成素,且细胞相容性良好,种植了1.5×104个施万细胞的复合神经导管在植入大鼠10 mm坐骨神经缺损模型后显著改善了损伤后轴突水肿及空泡化的情况,稳定施万细胞并帮助重建髓鞘,最终达到与自体神经移植组相近的功能恢复。综上所述,通过外加电刺激及载药等方法能强化碳纳米材料促血管生成的作用,结合3D打印技术可以制备结构复杂的神经导管,其生物安全性也已得到了部分证实。 上述研究明确了碳纳米材料促进血管形成的具体机制,同时也为寻找增强神经导管促血管化的方法进行了发散探索,但在未来的研究中仍然需要注意到体外实验所提供的环境与实际周围神经损伤微环境之间的差异,即如何创造更贴近人体周围神经损伤的实验条件用以评估血管化的程度,这涉及到体外模拟技术在神经组织工程领域的应用。此外,在实现碳纳米材料成分受控释放的同时更重要的是要明确后续的完整体内转归途径,支架降解产物的生物安全性也必须纳入到研究的考量范围之内。 文章总结了碳纳米材料的促血管生成作用相关研究进展,见表2。"

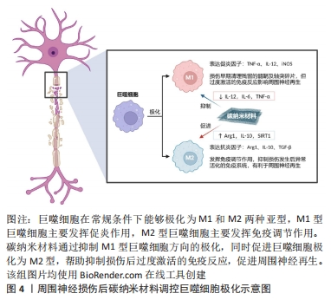
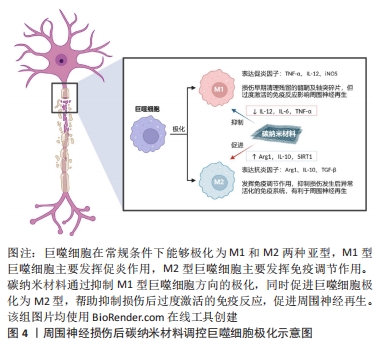
2.3 碳纳米材料作用于微环境免疫应答 神经内血管化的过程依赖于活性氧及其下游信号通路,但过量活性氧带来的强氧化损害却会触发一系列炎症反应,远侧的神经纤维在外部Ca2+大量内流的信号下发生沃勒变性,断裂的髓鞘及轴突残端发生解体,早期的炎症反应表现为巨噬细胞及中性粒细胞向损伤部位聚集,清理残留的髓鞘及轴突碎片,重塑神经再生通道,但随着免疫反应逐渐增强,最终会造成T细胞浸润及抗神经成分的自身抗体生成,免疫复合物大量沉积于神经内膜和束膜,严重损害周围神经再生。巨噬细胞作为周围神经损伤相关免疫反应中数量最多的免疫细胞,能够极化为M1和M2两个亚型,对神经再生产生不同影响:M1型巨噬细胞通过分泌炎症因子发挥促炎作用,而M2型巨噬细胞则具有抗炎及促神经再生的作用,因此,适当增加M2型巨噬细胞的比例有利于周围神经再生,见图4。"

GO是石墨烯的氧化产物,由于连有大量的含氧官能团,GO在损失部分导电性的同时获得了亲水性及高反应活性,更易于进行表面修饰[44]。ZHANG等[45]发现GO可能通过促进巨噬细胞向M2表型极化并抑制M1表型的极化来减轻微环境中的炎症反应,从而促进周围神经再生;通过在聚(L-丙交酯-己内酯)薄膜上制备不同尺寸的线性凹槽,利用静电吸附作用表面锚定GO纳米片后获得的微结构薄膜下调了小鼠巨噬细胞中M1标志性基因白细胞介素12的表达,同时显著上调M2标志性基因精氨酸酶1、白细胞介素10和沉默信息调节因子2同源蛋白1的表达,研究进一步证实GO修饰在巨噬细胞极化过程中发挥了比微结构修饰更重要的作用。桥接大鼠10 mm坐骨神经缺损的体内实验结果表明凹槽宽度为3 μm/3 μm的薄膜支架促神经再生的作用最好,且术后8周测得的预后指标与自体神经移植组相接近。QIAN等[46]发现基于三维交错层的纳米金刚石复合聚己内酯的神经导管具有促髓鞘生成作用,此外能够在下调白细胞介素6和肿瘤坏死因子α的同时上调CD206和白细胞介素10,诱导小鼠单核巨噬细胞向M2型极化,在20 mm坐骨神经缺损大鼠动物模型中也观察到复合神经导管介导了巨噬细胞向M2表型的早期有效极化,减少了成纤维细胞浸润,确保损伤产生的神经组织碎屑被清除,该研究进一步明确Janus激酶-信号转导和转录激活因子信号通路参与了复合神经导管诱导的巨噬细胞极化过程。 上述研究表明,碳纳米材料在诱导巨噬细胞向M2表型极化、减轻损伤相关免疫反应方面具有较为重要的作用,而为神经导管添加微结构可以增强其抗炎作用。碳纳米材料通过调节M1和M2型巨噬细胞的比例来参与机体免疫调节,但研究者们仍不清楚在各时间节点最有利于神经再生的M1/M2比例,引起巨噬细胞表型转变的具体机制也并不完全明确。近年关于碳纳米材料作用于周围神经损伤后免疫应答的相关研究主要集中于巨噬细胞,这可能是由于巨噬细胞作为免疫反应中的主要细胞成分积极参与周围神经再生过程,但目前针对巨噬细胞的单一干预措施仍无法带来足够理想的神经修复效率,因此不应忽视其他免疫细胞在神经再生中发挥的作用,如T细胞和中性粒细胞等[47]。"

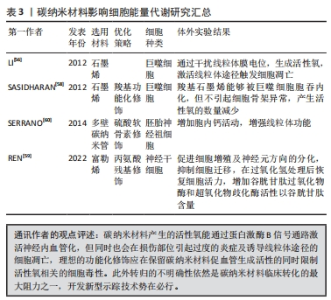
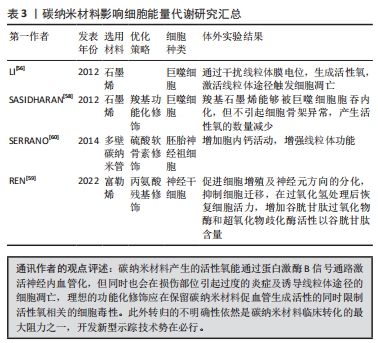
2.4 碳纳米材料作用于微环境生物能量代谢 血管生成和轴突延伸等周围神经再生活动常伴随着巨大的能量消耗,因此保证正常的线粒体功能尤为重要。周围神经损伤发生后,由Armcx1编码的线粒体定位蛋白介导了神经元胞体线粒体在损伤部位的聚集,为神经再生活动合成足量的ATP[48]。然而,施万细胞提供能量的过程并不依赖于线粒体呼吸链,在线粒体细胞色素C氧化酶缺陷的情况下并未观察到施万细胞数量的下降,施万细胞通过代谢重编程发生了糖脂代谢的适应性转变,以有氧糖酵解的方式为轴突提供丙酮酸及乳酸,继而满足轴突的高能量需求[49]。但与此同时,高强度的能量转化过程生成了大量的活性氧,在周围神经损伤早期即观察到轴突活性氧水平的升高[50]。而为了对抗损伤后生成的强氧化微环境,施万细胞在周围神经再生期间高表达血红素氧合酶1,这是一种抗氧化的血红素降解酶,能够减轻氧化应激造成的神经变性[51]。而另一种内源性抗氧化蛋白核因子E2相关因子2 在周围神经损伤发生后迅速失活,这一变化促进了施万细胞的重编程及增殖,同时抑制了施万细胞的再分化及髓鞘形成[52]。伴随周围神经再生发生的一系列细胞能量代谢转变过程的原则在于确保轴突能量供给的同时启动内源性抗氧化途径,以尽可能减少活性氧造成的神经损害。 随着碳材料的尺寸由微米级别到纳米级别的减小,其生物相容性也显著降低,具体原因可能是小尺寸的碳纳米材料具有更多的尖锐边缘,更易于穿透细胞核引起染色体畸变[53],此外碳纳米材料中的过渡元素杂质也会诱导细胞产生过量的活性氧[54],严重影响周围神经再生,这些问题限制了碳纳米材料的临床应用。多项研究表明石墨烯降低了巨噬细胞线粒体膜电位,提高胞内活性氧水平,最终通过线粒体途径诱导细胞凋亡[55-56]。石墨烯的毒性取决于多种生理化学特性之间的复杂相互作用,不同干扰因素所引起的毒性反应也各异[57]。部分研究表明,在对石墨烯进行功能化修饰后显著降低了其细胞毒性,SASIDHARAN等[58]探究了羧基功能化石墨烯的巨噬细胞毒性,强疏水性的原始石墨烯几乎无法被内化而聚集于RAW264.7细胞膜表面,通过阻碍营养物质进入细胞及影响关键离子通道等方式生成了大量活性氧,活性氧进一步干扰微丝肌动蛋白的排列,最终引起细胞骨架功能障碍;与之相反,由于羧基化石墨烯呈亲水性,多数通过胞吞进入细胞内并聚集在核周围区域,但其被内化后并未引起细胞骨架形态的异常,所产生活性氧的数量也明显少于原始石墨烯。有研究发现一种携带了丙氨酸残基的水溶性富勒烯衍生物Ala-C60能够用于恢复过氧化氢处理后的神经干细胞的细胞活力,胞内谷胱甘肽过氧化物酶和超氧化物歧化酶的活性及谷胱甘肽的含量均显著上升,且浓度低于160 μmol/L的Ala-C60对细胞活力并无显著影响[59]。SERRANO等[60]采用冰分离介导的自组装技术合成了基于硫酸软骨素的多壁碳纳米管复合支架用于培养大鼠胚胎神经祖细胞,复合支架能够在神经修复早期暂时降低神经网络中胶质细胞的占比,同时观察到了胞内活跃的钙活动及稳定的线粒体膜电位,研究认为复合支架在增加细胞内钙离子浓度的同时激活了线粒体功能,保证细胞充足的能量供应以支持神经网络的形成。JAKUS等[41]探究了石墨烯/聚乙丙交酯复合支架组分的转归途径,进一步发现石墨烯的降解主要是通过巨噬细胞物理移除单个石墨烯薄片的方式实现,而分解产生的石墨烯薄片无法继续降解,最终嵌顿于植入部位附近的组织中,组织学分析并未在重要脏器中发现石墨烯薄片,聚乙丙交酯则分解为无毒的乳酸和乙醇酸。 总体而言,以石墨烯为代表的碳纳米材料存在由活性氧介导的细胞毒性,生物安全性方面的不确定性限制了基于碳纳米材料开发的神经导管的临床应用。尽管如此,已能够通过功能化改性的方法在一定程度上降低碳纳米材料的毒性,而负载生物活性因子则能使碳纳米材料参与激活细胞内源性抗氧化途径。此外,也需要就碳纳米材料参与机体整体生物代谢的具体方式及其在各组织器官中的完整转归途径做出更全面的阐述,而不是仅局限于神经损伤部位附近的神经导管组分追踪,因此亟待开发一种适用于碳纳米材料的长期稳定示踪技术。 文章总结了碳纳米材料影响细胞能量代谢的相关研究进展,见表3。"
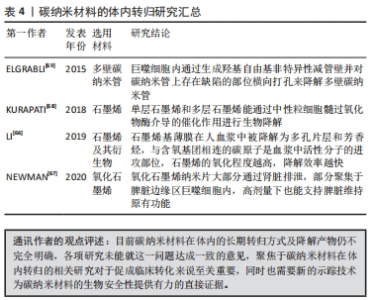
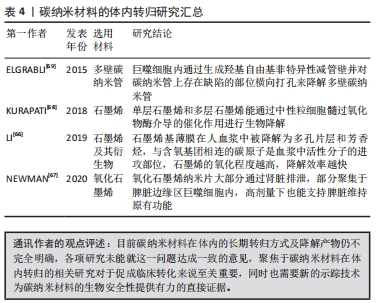
2.5 碳纳米材料的体内转归 传统的示踪方法是使用同位素标记对碳纳米材料的体内转归进行量化与评估,在同位素标记后可通过离心的方法纯化,筛选出被成功标记的碳纳米材料,随后使用γ射线计数器或放射性核素显像技术检测动物模型体内的射线信号[61]。这种方法无法排除放射性同位素的体内作用,同时其有效示踪时间也受到同位素半衰期的影响,无法长期稳定示踪,长期低剂量的放射暴露也不利于人体/实验动物,因此有必要开发一种适用于碳纳米材料的稳定示踪技术。近年来,更多的研究选择合成荧光碳纳米材料用于体内成像,稳定的荧光材料能够规避放射暴露的风险,同时实现长期稳定的实时示踪[62-63]。 在神经导管植入体内后,缓释的碳纳米材料在神经附近的组织间隙中开始向周围扩散,部分嵌顿于附近的组织中,在后续被免疫细胞吞噬,其余则穿透血管内皮进入循环系统,随血流分布到全身各个器官。富含巨噬细胞的网状内皮系统能捕获进入体循环的异物颗粒,入血的多数碳纳米材料通过这一途径被清除,随后聚集于肝、肺等器官中。碳纳米材料聚集的部位与尺寸有关,体循环中直径大于2 μm的碳纳米材料容易嵌顿于肺毛细血管内,更小的碳纳米材料则倾向于聚集在肝和脾中[64]。碳纳米材料在被细胞吞噬后几乎无法进一步代谢降解,其在体内的稳定性良好,但这仅是短期观察的结果,仍有待开展碳纳米材料在体内进一步代谢的长期追踪以评估其生物安全性。在神经导管中引入外源性的微生物或酶类可能会改善碳纳米材料难以降解的问题[65]。此外,经过功能化修饰的碳纳米材料相关功能基团的降解效率及其器官/系统影响也应被单独量化评估。碳纳米材料在体内被清除的速度极慢,因为缺乏有效的清理排泄途径,部分聚集于肺部的碳纳米材料能够在细胞分泌粘液的同时随之一起排出体外,聚集于肝脏的碳纳米材料则难以被清除,对碳纳米材料体内清除过程的观测同样依赖于新型示踪技术的研发。文章归纳了碳纳米材料在体内转归的相关研究成果[66-69],见表4。"
| [1] WATTS G. Jiang Baoguo: one, two, three against trauma in China. Lancet. 2017;390(10104):1729. [2] 孙国平,罗选翔,潘彬.人工神经导管治疗周围神经损伤的材料类型和应用现状[J].中国骨与关节损伤杂志,2021,36(3):334-336. [3] 顾玉东.周围神经损伤治疗的近期进展[C].浙江省医学会手外科学分会成立大会暨2008年学术年会论文汇编,2008,24(2):65-65. [4] 顾玉东.提高周围神经损伤的诊治水平[J].中华创伤骨科杂志,2003,5(1):1-4. [5] BERIS A, GKIATAS I, GELALIS I, et al. Current concepts in peripheral nerve surgery. Eur J Orthop Surg Traumatol. 2019;29(2):263-269. [6] GAO Y, WANG YL, KONG D, et al. Nerve autografts and tissue-engineered materials for the repair of peripheral nerve injuries: a 5-year bibliometric analysis. Neural Regen Res. 2015; 10(6):1003. [7] 钱运,范存义.石墨烯促进周围神经再生的研究进展[J].中华手外科杂志,2019,35(2):158-160. [8] BELLAMKONDA RV. Peripheral nerve regeneration: an opinion on channels, scaffolds and anisotropy. Biomaterials. 2006;27(19):3515-3518. [9] 王乐禹,邱小忠,王璞玥,等.组织工程研究的现状及应关注的重要基础科学问题[J].中国科学基金,2020,34(2):213-220. [10] 李晓强,莫秀梅,范存义.神经导管研究与进展[J].中国生物工程杂志,2007,27(7):112-116. [11] QIAN Y, LIN H, YAN Z, et al. Functional nanomaterials in peripheral nerve regeneration: Scaffold design, chemical principles and microenvironmental remodeling. Mater Today. 2021;51:165-187. [12] WANG H, KUNKEL DD, MARTIN TM, et al. Heteromultimeric K+ channels in terminal and juxtaparanodal regions of neurons. Nature. 1993;365(6441):75-79. [13] KRISHNAN AV, LIN CS, PARK SB, et al. Axonal ion channels from bench to bedside: a translational neuroscience perspective. Prog Neurobiol. 2009;89(3):288-313. [14] BRADKE F, FAWCETT JW, SPIRA ME. Assembly of a new growth cone after axotomy: the precursor to axon regeneration. Nat Rev Neurosci. 2012;13(3):183-193. [15] BAHREMANDI TOLOU N, SALIMIJAZI H, KHARAZIHA M, et al. A three-dimensional nerve guide conduit based on graphene foam/polycaprolactone. Mater Sci Eng C Mater Biol Appl. 2021;126:112110. [16] BAKHTIARY S, CHEGENI A, BABAEIPOUR V, et al. Culture and maintenance of neural progressive cells on cellulose acetate/graphene‑gold nanocomposites. Int J Biol Macromol. 2022;210:63-75. [17] KUMAR MN, MUZZARELLI RA, MUZZARELLI C, et al. Chitosan chemistry and pharmaceutical perspectives. Chem Rev. 2004;104(12):6017-6084. [18] ARANLDI P, DI LISA D, MADDALENA L, et al. A facile approach for the development of high mechanical strength 3D neuronal network scaffold based on chitosan and graphite nanoplatelets. Carbohydr Polym. 2021;271:118420. [19] HU X, WANG X, XU Y, et al. Electric conductivity on aligned nanofibers facilitates the transdifferentiation of mesenchymal stem cells into schwann cells and regeneration of injured peripheral nerve. Adv Healthc Mater. 2020;9(11):1901570. [20] BARREJÓN M, ZUMMO F, MIKHALCHAN A, et al. TEGylated double-walled carbon nanotubes as platforms to engineer neuronal networks. ACS Appl Mater Interfaces. 2022;15(1):77-90. [21] MAENG WY, TSENG WL, LI S, et al. Electroceuticals for peripheral nerve regeneration. Biofabrication. 2022. doi: 10.1088/1758-5090/ac8baa. [22] MCGREGOR CE, ENGLISH AW. The role of BDNF in peripheral nerve regeneration: activity-dependent treatments and Val66Met. Front Cell Neurosci. 2018;12:522. [23] KILGORE KL, BHADRA N. Reversible nerve conduction block using kilohertz frequency alternating current. Neuromodulation. 2014;17(3):242-254. [24] LI X, YANG W, XIE H, et al. CNT/sericin conductive nerve guidance conduit promotes functional recovery of transected peripheral nerve injury in a rat model. ACS Appl Mater Interfaces. 2020;12(33):36860-36872. [25] SHANG L, HUANG Z, PU X, et al. Preparation of graphene oxide-doped polypyrrole composite films with stable conductivity and their effect on the elongation and alignment of neurite. ACS Biomater Sci Eng. 2019;5(3):1268-1278. [26] CONVERTINO D, FABBRI F, MISHRA N, et al. Graphene promotes axon elongation through local stall of nerve growth factor signaling endosomes. Nano Lett. 2020;20(5):3633-3641. [27] MOHSENI M, S A AR, H SHIRAZI F, et al. Preparation and characterization of self-electrical stimuli conductive gellan based nano scaffold for nerve regeneration containing chopped short spun nanofibers of PVDF/MCM41 and polyaniline/graphene nanoparticles: Physical, mechanical and morphological studies. Int J Biol Macromol. 2021;167:881-893. [28] SUN Y, QUAN Q, MENG H, et al. Enhanced neurite outgrowth on a multiblock conductive nerve scaffold with self-powered electrical stimulation. Adv Healthc Mater. 2019;8(10):e1900127. [29] ZHENG N, FITZPATRICK V, CHENG R, et al. Photoacoustic carbon nanotubes embedded silk scaffolds for neural stimulation and regeneration. ACS Nano. 2022;16(2):2292-2305. [30] QIAN Y, ZHAO X, HAN Q, et al. An integrated multi-layer 3D-fabrication of PDA/RGD coated graphene loaded PCL nanoscaffold for peripheral nerve restoration. Nat Commun. 2018;9(1):323. [31] HU Y, CHEN Z, WANG H, et al. Conductive nerve guidance conduits based on morpho butterfly wings for peripheral nerve repair. ACS Nano. 2022;16(2):1868-1879. [32] WANG J, WANG H, MO X, et al. Reduced graphene oxide-encapsulated microfiber patterns enable controllable formation of neuronal-like networks. Adv Mater. 2020;32(40):e2004555. [33] DOMINICI C, MORENO-BRAVO JA, PUIGGROS SR, et al. Floor plate-derived netrin-1 is dispensable for commissural axon guidance. Nature. 2017;545(7654):350-354. [34] CATTIN AL, BURDEN JJ, VAN EMMENIS L, et al. Macrophage-induced blood vessels guide schwann cell-mediated regeneration of peripheral nerves. Cell. 2015;162(5):1127-1139. [35] 张逸,任思聪.支架材料对成血管微环境的影响及作用机制[J].中国组织工程研究,2023, 27(21):3391-3397. [36] LEE TH, YEN CT, HSU SH. Preparation of polyurethane-graphene nanocomposite and evaluation of neurovascular regeneration. ACS Biomater Sci Eng. 2020;6(1):597-609. [37] MUKHERJEE S, SRIRAM P, BARUI AK, et al. Graphene oxides show angiogenic properties. Adv Healthc Mater. 2015;4(11):1722-1732. [38] QIAN Y, SONG J, ZHAO X, et al. 3D Fabrication with integration molding of a graphene oxide/polycaprolactone nanoscaffold for neurite regeneration and angiogenesis. Adv Sci (Weinh). 2018;5(4):1700499. [39] QIAN Y, WANG X, SONG J, et al. Preclinical assessment on neuronal regeneration in the injury-related microenvironment of graphene-based scaffolds. NPJ Regen Med. 2021;6(1):31. [40] DYBOWSKA-SARAPUK L, SOSNOWICZ W, KRZEMINSKI J, et al. Printed graphene layer as a base for cell electrostimulation—preliminary results. Int J Mol Sci. 2020;21(21):7865. [41] JAKUS AE, SECOR EB, RUTZ AL, et al. Three-dimensional printing of high-content graphene scaffolds for electronic and biomedical applications. ACS Nano. 2015;9(4):4636-4648. [42] LU D, MAHMOOD A, QU C, et al. Erythropoietin Enhances Neurogenesis and Restores Spatial Memory in Rats after Traumatic Brain Injury. J Neurotrauma. 2005;22(9):1011-1017. [43] SALEHI M, NASERI-NOSAR M, EBRAHIMI-BAROUGH S, et al. Sciatic nerve regeneration by transplantation of Schwann cells via erythropoietin controlled-releasing polylactic acid/multiwalled carbon nanotubes/gelatin nanofibrils neural guidance conduit. J Biomed Mater Res B Appl Biomater. 2018;106(4):1463-1476. [44] GAIHRE B, POTES MA, SERDIUK V, et al. Two-dimensional nanomaterials-added dynamism in 3D printing and bioprinting of biomedical platforms: unique opportunities and challenges. Biomaterials. 2022;284:121507. [45] ZHANG D, YAO Y, DUAN Y, et al. Surface-anchored graphene oxide nanosheets on cell-scale micropatterned Poly (d, l-lactide-co-caprolactone) conduits promote peripheral nerve regeneration. ACS Appl Mater Interfaces. 2020;12(7):7915-7930. [46] QIAN Y, CHENG Y, OUYANG Y, et al. Multilayered spraying and gradient dotting of nanodiamond-polycaprolactone guidance channels for restoration of immune homeostasis. NPG Asia Mater. 2019;11(1):1-24. [47] ORECCHIONI M, BEDOGNETTI D, SGARRELLA F, et al. Impact of carbon nanotubes and graphene on immune cells. J Transl Med. 2014;12(1):138. [48] CARTONI R, NORSWORTHY MW, BEI F, et al. The mammalian specific protein armcx1 regulates mitochondrial transport during axon regeneration. Neuron. 2016;92(6):1294-1307. [49] FÜNFSCHILLING U, SUPPLIE LM, MAHAD D, et al. Glycolytic oligodendrocytes maintain myelin and long-term axonal integrity. Nature. 2012;485(7399):517-521. [50] HERVERA A, DE VIRGILIIS F, PALMISANO I, et al. Reactive oxygen species regulate axonal regeneration through the release of exosomal NADPH oxidase 2 complexes into injured axons. Nat Cell Biol. 2018;20(3):307-319. [51] KIM M, KIM H, KIM D, et al. Heme oxygenase 1 in schwann cells regulates peripheral nerve degeneration against oxidative stress. ASN Neuro. 2019;11:175909141983894. [52] LV W, DENG B, DUAN W, et al. Schwann cell plasticity is regulated by a weakened intrinsic antioxidant defense system in acute peripheral nerve injury. Neuroscience. 2018;382:1-13. [53] AKHAVAN O, GHADERI E, AKHAVAN A. Size-dependent genotoxicity of graphene nanoplatelets in human stem cells. Biomaterials. 2012;33(32):8017-8025. [54] PULSKAMP K, DIABATÉ S, KRUG HF. Carbon nanotubes show no sign of acute toxicity but induce intracellular reactive oxygen species in dependence on contaminants. Toxicol Lett. 2007;168(1):58-74. [55] YANG K, LI Y, TAN X, et al. Behavior and toxicity of graphene and its functionalized derivatives in biological systems. Small. 2013;9(9-10):1492-1503. [56] LI Y, LIU Y, FU Y, et al. The triggering of apoptosis in macrophages by pristine graphene through the MAPK and TGF-beta signaling pathways. Biomaterials. 2012;33(2):402-411. [57] LALWANI G, D’AGATI M, KHAN AM, et al. Toxicology of graphene-based nanomaterials. Adv Drug Deliv Rev. 2016;105(Pt B):109-144. [58] SASIDHARAN A, PANCHAKARLA LS, SADANANDAN AR, et al. Hemocompatibility and macrophage response of pristine and functionalized graphene. Small. 2012;8(8):1251-1263. [59] REN H, LI J, PENG A, et al. Water-soluble, alanine-modified fullerene c60 promotes the proliferation and neuronal differentiation of neural stem cells. Int J Mol Sci. 2022;23(10):5714. [60] SERRANO MC, NARDECCHIA S, GARCÍA-RAMA C, et al. Chondroitin sulphate-based 3D scaffolds containing MWCNTs for nervous tissue repair. Biomaterials. 2014;35(5):1543-1551. [61] LIU Z, CAI W, HE L, et al. In vivo biodistribution and highly efficient tumour targeting of carbon nanotubes in mice. Nat Nanotechnol. 2007;2(1):47-52. [62] PANWAR N, SOEHARTONO AM, CHAN KK, et al. Nanocarbons for biology and medicine: sensing, imaging, and drug delivery. Chem Rev. 2019;119(16):9559-9656. [63] SONG S, SHEN H, YANG T, et al. Indocyanine green loaded magnetic carbon nanoparticles for near infrared fluorescence/magnetic resonance dual-modal imaging and photothermal therapy of tumor. ACS Appl Mater Interfaces. 2017;9(11):9484-9495. [64] WANG H, YANG ST, CAO A, et al. Quantification of carbon nanomaterials in vivo. Acc Chem Res. 2013;46(3):750-760. [65] LIU L, ZHU C, FAN M, et al. Oxidation and degradation of graphitic materials by naphthalene-degrading bacteria. Nanoscale. 2015;7(32):13619-13628. [66] LI D, HU X, ZHANG S. Biodegradation of graphene-based nanomaterials in blood plasma affects their biocompatibility, drug delivery, targeted organs and antitumor ability. Biomaterials. 2019;202:12-25. [67] NEWMAN L, JASIM DA, PRESTAT E, et al. Splenic capture and in vivo intracellular biodegradation of biological-grade graphene oxide sheets. ACS Nano. 2020;14(8):10168-10186. [68] KURAPATI R, MUKHERJEE SP, MARTÍN C, et al. Degradation of single-layer and few-layer graphene by neutrophil myeloperoxidase. Angew Chem Int Ed Engl. 2018;57(36):11722-11727. [69] ELGRABLI D, DACHRAOUI W, MÉNARD-MOYON C, et al. Carbon nanotube degradation in macrophages: live nanoscale monitoring and understanding of biological pathway. ACS Nano. 2015;9(10):10113-10124. |
| [1] | Yang Yufang, Yang Zhishan, Duan Mianmian, Liu Yiheng, Tang Zhenglong, Wang Yu. Application and prospects of erythropoietin in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1443-1449. |
| [2] | Chen Kaijia, Liu Jingyun, Cao Ning, Sun Jianbo, Zhou Yan, Mei Jianguo, Ren Qiang. Application and prospect of tissue engineering in treatment of osteonecrosis of the femoral head [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1450-1456. |
| [3] | Feng Ruiqin, Han Na, Zhang Meng, Gu Xinyi, Zhang Fengshi. Combination of 1% platelet-rich plasma and bone marrow mesenchymal stem cells improves the recovery of peripheral nerve injury [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 985-992. |
| [4] | Mei Jingyi, Liu Jiang, Xiao Cong, Liu Peng, Zhou Haohao, Lin Zhanyi. Proliferation and metabolic patterns of smooth muscle cells during construction of tissue-engineered blood vessels [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1043-1049. |
| [5] | Wang Shanshan, Shu Qing, Tian Jun. Physical factors promote osteogenic differentiation of stem cells [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1083-1090. |
| [6] | Chen Xiaofang, Zheng Guoshuang, Li Maoyuan, Yu Weiting. Preparation and application of injectable sodium alginate hydrogels [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 789-794. |
| [7] | Wang Jiani, Chen Junyu. Angiogenesis mechanism of metal ions and their application in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 804-812. |
| [8] | Shen Ziqing, Xia Tian, Shan Yibo, Zhu Ruijun, Wan Haoxin, Ding Hao, Pan Shu, Zhao Jun. Vascularized tracheal substitutes constructed by exosome-load hydrogel-modified 3D printed scaffolds [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 697-705. |
| [9] | Zhu Liwei, Wang Jiangyue, Bai Ding. Application value of nanocomposite gelatin methacryloyl hydrogels in different bone defect environments [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 753-758. |
| [10] | Yang Yuqing, Chen Zhiyu. Role and application of early transient presence of M1 macrophages in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 594-601. |
| [11] | Gu Mingxi, Wang Changcheng, Tian Fengde, An Ning, Hao Ruihu, Guo Lin. Preparation and in vitro evaluation of a three-dimensional porous cartilage scaffold made of silk fibroin/gelatin/chitosan [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 366-372. |
| [12] | Wang Xinmin, Yan Wenkai, Song Yahui, Liu Fei. Leukocyte- and platelet-rich fibrin with autologous hamstring tendon for traumatic patella dislocation [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 404-410. |
| [13] | Bi Yujie, Ma Dujun, Peng Liping, Zhou Ziqiong, Zhao Jing, Zhu Houjun, Zhong Qiuhui, Yang Yuxin. Strategy and significance of Chinese medicine combined with medical hydrogel for disease treatment [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 419-425. |
| [14] | Wang Xinyi, Xie Xianrui, Chen Yujie, Wang Xiaoyu, Xu Xiaoqing, Shen Yihong, Mo Xiumei. Electrospun nanofiber scaffolds for soft and hard tissue regeneration [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 426-432. |
| [15] | Gao Xueyu, Zhang Wentao, Sun Tianze, Zhang Jing, Li Zhonghai. Application of metal ions in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 439-444. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||



