Chinese Journal of Tissue Engineering Research ›› 2013, Vol. 17 ›› Issue (32): 5883-5888.doi: 10.3969/j.issn.2095-4344.2013.32.021
Previous Articles Next Articles
Studies on p53 in induced pluripotent stem cells
Lin Tong-xiang1, 2, Lin Yi1
- 1Stem Cell Research Center; 2Department of Developmental Biology, College of Life Science, Fujian Agriculture and Forestry University, Fuzhou 350002, Fujian Province, China
-
Received:2012-11-24Revised:2013-07-18Online:2013-08-06Published:2013-08-06 -
Contact:Lin Tong-xiang☆, Ph.D., Professor, Doctoral supervisor, 1Stem Cell Research Center, 2Department of Developmental Biology, College of Life Science, Fujian Agriculture and Forestry University, Fuzhou 350002, Fujian Province, China Lintx69@yahoo.com Lin Yi, Attending physician, Stem Cell Research Center, Fujian Agriculture and Forestry University, Fuzhou 350002, Fujian Province, China lin_yi_1@yahoo.com -
About author:Lin Tong-xiang☆, Ph.D., Professor, Doctoral supervisor, 1Stem Cell Research Center, 2Department of Developmental Biology, College of Life Science, Fujian Agriculture and Forestry University, Fuzhou 350002, Fujian Province, China Lintx69@yahoo.com -
Supported by:General Project of National Natural Science Foundation of China, No. 31271595*; Project of Fujian Provincial Civil Service Bureau, Office of Human Resources Development in Fujian Province, No. 090700002*
CLC Number:
Cite this article
Lin Tong-xiang, Lin Yi . Studies on p53 in induced pluripotent stem cells[J]. Chinese Journal of Tissue Engineering Research, 2013, 17(32): 5883-5888.
share this article

2.1 动物细胞重编程研究成果获得2012年诺贝尔生理学或医学奖 2012年10月8日,英国研究员John B.Gurdon和日本科学家Shinya Yamanaka,因为在成体细胞重编程成为干细胞的研究中做出了巨大贡献,而获得2012年的诺贝尔生理学或医学奖。诱导多能干细胞具有自我更新且能分化成所有成体细胞的潜能[1-5],有望由此开发医学的新疗法。基于这些技术,科学家可以创建替代的细胞用于治疗一些难以治疗的疾病,如帕金森症等。由于诱导多能干细胞技术可能追溯细胞最早期的状态,因此用于研究这些疾病的机制具有无与伦比的优点。此外,这些细胞还避开了胚胎干细胞而引起的伦理困境。总之,这项发现对于了解动物的发育和医学治疗具有革命性的意义[6]。 在动物细胞重编程中发生了如下标志性事件。1962年,Gurdon[7]研究表明,将某些特定的成体细胞如青蛙的皮肤细胞,经过适当的移植实验,可以产生新的蝌蚪。1996年,Wilmut等[8]领导的科研小组从一只成年绵羊的乳腺细胞克隆出来多利羊。这项研究表明,尽管哺乳动物重编程十分困难,还是可能获得成功的。但是,这些实验十分复杂,难以重复。简单的通过调控1个或者多个基因,技术上是否可行呢?2004年,文章作者研究小鼠胚胎干细胞的遗传稳定性机理,发现p53在小鼠胚胎干细胞(ES细胞)中起干细胞开关作用,可以停止干细胞分化,或者具有某种重编程的作用。2006年,日本Yamanaka改进这些细胞重编程,采用惊人简单的方法,从皮肤细胞诱导产生类似胚胎干细胞的细胞,命名为诱导的多能干细胞[9]。 由于诱导多能干细胞能够绕过胚胎干细胞相关伦理问题,并且由于可能从患者自身提取细胞,具有相同的遗传背景,因此可能避免异体免疫排斥反应[10],这些发现为科研和应用提供了新的选择,引起了巨大的轰动,导致全世界许多科学家参与,现在取得了显著的进展,在包括药品开发等许多领域得到应用。近年来,这样顶级研究的突破,体现了干细胞技术巨大突破,也标志着开启了干细胞技术再生医学的新篇章。诱导多能干细胞研究的国内外大事件,见表1。 2012年4月,日本Chen等[25]用小鼠细胞培育诱导多能干细胞,向培养液中添加肺癌、皮肤癌等癌细胞液体,经过4周左右时间,其中将未分化的诱导多能干细胞移植到小鼠皮下,结果小鼠全部患上癌症,因此,经培养未分化的诱导多能干细胞就是癌症干细胞。2012年7月,日本Kajiwara等[26]发现利用诱导多能干细胞培育肝脏细胞时,由于提供的初始细胞志愿者身体条件不同,培养出的诱导多能干细胞的分化细胞数据和能力也存在很大的差异。2012年12月,Chen等[27]研究发现诱导多能干细胞诱导过程中大量出现一类细胞克隆,外观、生长速度等各方面酷似干细胞,却没有干细胞应有的基因表达和功能。经过深入研究发现,培养诱导多能干细胞所使用的血清中存在“路障”,细胞中的一种蛋白-骨形态发生蛋白对重编程过程起抑制作用。如用维生素C处理,会变成真实的诱导多功能干细胞。"


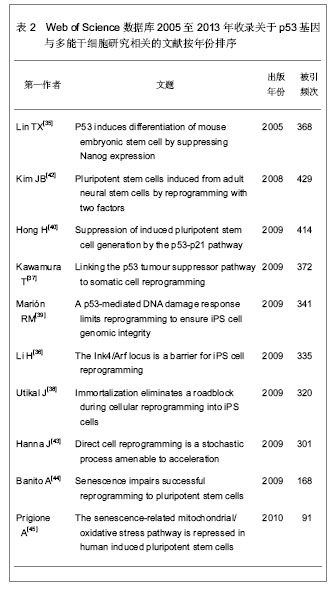
2013年4月,日本京都大学Hikichi等[28]为实验鼠的神经细胞植入诱导多能干细胞4种基因后,研究神经细胞中特有的158个基因功能,发现Pax6等6种基因防碍诱导多能干细胞的培育,如增强这些基因的作用,诱导多能干细胞的培育成功概率可能会降至正常水平的1/5。2013年6月,美国Smith等[29]对诱导多能干细胞进行分化,在试管内制造出了无数的人类红血细胞和血小板,该研究的不同之处在于添加用来调节芳香烃受体通路的化合物。以前的研究表明,这一通路会通过芳香烃受体同环境中的有毒物质相互作用来促进癌细胞发育。然而,在最新研究中,功能性红血细胞和血小板的产量在短时间内呈指数增加,这表明,芳香烃受体在正常的血液细胞的发育过程中也起重要作用。2013年7月,美国Samuel等[30]使用人体诱导多能干细胞制造出能在实验鼠体内存活280 d的人造血管,首先使用诱导多能干细胞造出血管前体细胞,然后将前体细胞移植到实验鼠大脑表面,经过2周左右的时间,前体细胞变成功能性血管,并且持续工作280 d,而且此血管与鼠的正常血管十分相似。 2.2 干细胞库 由于Yamanaka等研究取得了领先的进步,现在日本在生物医学技术领域处于领先地位,Yamanaka和其他科学家正在建立可以用于治疗的干细胞库[31]。 虽然据说距离应用可能还需要至少3年的临床试验时间,Yamanaka科研团队的8个长期项目旨在诱导多能干细胞疗法的临床应用,包括帕金森病的研究项目,其中心设置在京都大学细胞研究和应用中心。人类首次多能干细胞的临床试验预计将在2013年于日本发育生物学研究中心启动,目的是修复视网膜病变,这将是世界上首个利用诱导多能干细胞进行的临床研究,研究对象是老年黄斑变性患者,由于其视网膜后会出现异常血管,这些血管非常脆弱,容易发生出血和液体渗漏,导致视网膜下部的色素上皮细胞受到伤害,视野扭曲,视力急剧降低。通过诱导多能干细胞的研究技术,将患者皮肤组织培育出诱导多能干细胞,将其培育成色素上皮细胞,形成薄片状之后移植到眼部。如果任何多能干细胞工程实验获得成功,诱导多能干细胞的需求将爆炸性增长。Yamanaka计划到2020年,将建立1个标准的干细胞库,含有75种细胞系,足以覆盖日本80%的人口[31]。为了避免发生免疫排斥,3种类型的人类白细胞抗原应该匹配。日本人口的遗传多样性相对较低,遗传匹配容易做到,而其它地方则可能需要更多的细胞系以供匹配选择。 2.3 诱导多能干细胞许多问题有待解决 首先是多能干细胞与癌症细胞相似,最近的一些研究充分说明了这一特点[32]。这对医疗应用提出了严重的安全挑战。其次免疫原性也可能产生。虽然过去推测认为诱导多能干细胞来源于患者自身,其遗传背景可能完全一致,其异体免疫排斥反应将不会产生,然而并不能肯定其它来源的免疫排斥不存在。Zhao等[33]发现的免疫原性也发生于诱导多能干细胞的过程中,可能来自于诱导多能干细胞产生、分化和继代培养过程中的表观遗传学和遗传的变化。 政府的政策制定以及社会问题可能也会限制诱导多能干细胞的医疗用途。这些包括时间、成本、社会接受程度等许多问题。例如,建立1个多能干细胞系费用较高,限制了诱导多能干细胞的广泛应用。干细胞的培养的时间问题也可能是其应用的问题,建立1个细胞系需要花费许多时间,甚至更多的时间来验证和分化这些细胞成为有用的细胞,一般过程长达6个月以上。 2.4 安全问题是普遍关心的课题 其中遗传安全问题可能是许多有待回答问题中的首要问题。事实上,诱导多能干细胞类似于癌细胞。如果注入免疫缺陷小鼠,它将形成畸胎瘤,这是良性肿瘤[10,34],甚至更糟可能产生恶性畸胎癌[35]。 多能干细胞制作过程,类似于创造所谓的“致癌灶”。这是一种实验性研究癌症的方法,用来观察肿瘤。最近的一项研究表明,诱导多能干细胞和癌症细胞是十分相关的,虽然它们是不同类型的细胞[32]。这两种细胞的研究方法采用的基因十分相似,同样也得到十分相似的结论。诱导多能干细胞和癌细胞的诱导过程均涉及如下基因,如cMyc、p53基因突变或者缺失等。这一切都是癌症发生的相关基因,也大大刺激诱导多能干细胞的形成[32]。 p53基因可能是最大的安全问题相关基因:肿瘤抑制蛋白p53在细胞周期停滞和细胞凋亡等过程中被激活。虽然一直被怀疑在干细胞中起主要角色的作用,并且参与细胞分化。但是早期的干细胞研究中不能肯定p53的作用。在2004年底,文章作者首次发现p53基因在小鼠胚胎干细胞中起干细胞与成体细胞转化过程中的开关作用,并且连接干细胞的分化与其细胞的遗传稳定性[35]。当干细胞遇到DNA损伤时,p53蛋白结合干细胞关键转录因子Nanog的启动子,抑制其基因表达。迅速下调Nanog基因表达的结果,在胚胎干细胞中促进细胞分化相关的基因的表达。其转录活性的控制过程是通过p53蛋白的315位点丝氨酸的磷酸化。作者还发现Nanog基因启动子上有2个启动子序列受到p53的控制。控制过程是通过招募共同阻遏msin3a到Nanog基因的启动子上的。因此,激活p53,限制胚胎干细胞核心转录因子Nanog,促进干细胞分化,其功能是掌握干细胞分化和脱分化的“干细胞开关”。 2009年,Yamanaka研究小组和其它4个研究小组[36-40]同时在Nature杂志发表5篇研究论文,再次表明在诱导多能干细胞中p53缺失促进干细胞发生[41],这些研究结果均证明,p53基因功能在诱导多能干细胞中的干细胞开关作用。在成体细胞逆转分化而制成诱导多能干细胞的过程中,消除p53的控制作用是最为重要的,进一步证实了作者在2004年底的发现。在诱导多能干细胞过程中,必须克服p53基因功能;如果在p53基因的缺失下,可以使诱导多能干细胞的诱导效率大大提高,达到20%左右[35],而以前的研究发现在正常p53存在下,一般诱导多能干细胞的效率只有0.01%(人类诱导多能干细胞)[10]或0.1%(小鼠诱导多能干细胞)[9]。更为重要的是,抑制p53基因可以取代原来所需的4个因素中至少2个因子cMyc和Klf4[35]。 检索Web of Science数据库2005至2013年收录关于p53基因与多能干细胞研究相关的文献,总文献数量为57篇。选择引用次数在90次以上的文献,按出版年份排序,见表2。"
| [1] Tateishi K, He J, Taranova O, et al.Generation of insulin-secreting islet-like clusters from human skin fibroblasts.J Biol Chem.2008;283(46):31601-31607.[2] Nelson TJ, Martinez-Fernandez A, Yamada S, et al.Repair of acute myocardial infarction by human stemness factors induced pluripotent stem cells.Circulation.2009; 120(5): 408-416.[3] Nakahata T, Awaya T, Chang H, et al.Derivation of engraftable myogenic precursors from murine ES/iPS cells and generation of disease-specific iPS cells from patients with Duchenne muscular dystrophy (DMD) and other diseases. Rinsho Shinkeigaku.2010;50(11):889.[4] Wernig M, Zhao JP, Pruszak J, et al.Neurons derived from reprogrammed fibroblasts functionally integrate into the fetal brain and improve symptoms of rats with Parkinson's disease.Proc Natl Acad Sci U S A. 2008;105(15):5856-5861.[5] Nishimura K, Nakagawa T, Ono K, et al.Transplantation of mouse induced pluripotent stem cells into the cochlea. Neuroreport.2009;20(14):1250-1254.[6] Coli? M. The 2012 Nobel Prize Laureates in Physiology or Medicine.Vojnosanit Pregl. 2012;69(11):938-939.[7] GURDON JB.The developmental capacity of nuclei taken from intestinal epithelium cells of feeding tadpoles.J Embryol Exp Morphol.1962;10:622-640.[8] Wilmut I, Schnieke AE, McWhir J, et al.Viable offspring derived from fetal and adult mammalian cells.Nature.1997; 385(6619):810-813.[9] Takahashi K, Yamanaka S.Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors.Cell.2006;126(4):663-676.[10] Takahashi K, Tanabe K, Ohnuki M, et al.Induction of pluripotent stem cells from adult human fibroblasts by defined factors.Cell.2007;131(5):861-872.[11] Yu J, Vodyanik MA, Smuga-Otto K, et al.Induced pluripotent stem cell lines derived from human somatic cells.Science. 2007; 318(5858):1917-1920.[12] Nakagawa M, Koyanagi M, Tanabe K, et al.Generation of induced pluripotent stem cells without Myc from mouse and human fibroblasts.Nat Biotechnol.2008;26(1):101-106.[13] Wernig M, Meissner A, Cassady JP, et al.c-Myc is dispensable for direct reprogramming of mouse fibroblasts. Cell Stem Cell.2008;2(1):10-12.[14] Hanna J, Wernig M, Markoulaki S, et al.Treatment of sickle cell anemia mouse model with iPS cells generated from autologous skin.Science.2007;318(5858):1920-1923.[15] Meissner A, Wernig M, Jaenisch R.Direct reprogramming of genetically unmodified fibroblasts into pluripotent stem cells.Nat Biotechnol.2007;25(10):1177-1181. [16] Huangfu D, Maehr R, Guo W, et al.Induction of pluripotent stem cells by defined factors is greatly improved by small- molecule compounds.Nat Biotechnol.2008;26(7):795-797.[17] Huangfu D, Osafune K, Maehr R, et al.Induction of pluripotent stem cells from primary human fibroblasts with only Oct4 and Sox2.Nat Biotechnol.2008;26(11):1269-1275.[18] Zhao Y, Yin X, Qin H, et al.Two supporting factors greatly improve the efficiency of human iPSC generation.Cell Stem Cell.2008;3(5):475-479.[19] Woltjen K, Michael IP, Mohseni P, et al.piggyBac transposition reprograms fibroblasts to induced pluripotent stem cells. Nature. 2009;458(7239):766-770.[20] Kaji K, Norrby K, Paca A, et al.Virus-free induction of pluripotency and subsequent excision of reprogramming factors.Nature.2009;458(7239):771-775.[21] Soldner F, Hockemeyer D, Beard C, et al.Parkinson's disease patient-derived induced pluripotent stem cells free of viral reprogramming factors.Cell.2009;136(5):964-977.[22] Yu J, Hu K, Smuga-Otto K, et al.Human induced pluripotent stem cells free of vector and transgene sequences.Science.2009;324(5928):797-801.[23] Zhao XY, Lv Z, Li W, et al.Production of mice using iPS cells and tetraploid complementation.Nat Protoc.2010; 5(5): 963-971.[24] Kang L, Wang J, Zhang Y, et al.iPS cells can support full-term development of tetraploid blastocyst-complemented embryos.Cell Stem Cell.2009;5(2):135-138.[25] Chen L, Kasai T, Li Y, et al.A model of cancer stem cells derived from mouse induced pluripotent stem cells.PLoS One.2012;7(4):e33544.[26] Kajiwara M, Aoi T, Okita K, et al.Donor-dependent variations in hepatic differentiation from human-induced pluripotent stem cells.Proc Natl Acad Sci U S A. 2012;109 (31):12538-12543.[27] Chen J, Liu H, Liu J, et al.H3K9 methylation is a barrier during somatic cell reprogramming into iPSCs.Nat Genet.2013;45(1): 34-42.[28] Hikichi T, Matoba R, Ikeda T, et al.Transcription factors interfering with dedifferentiation induce cell type-specific transcriptional profiles.Proc Natl Acad Sci U S A.2013;110(16): 6412-6417.[29] Smith BW, Rozelle SS, Leung A, et al.The aryl hydrocarbon receptor directs hematopoietic progenitor cell expansion and differentiation.Blood.2013;30(122):376-385.[30] Samuel R, Daheron L, Liao S, et al.Generation of functionally competent and durable engineered blood vessels from human induced pluripotent stem cells. Proc Natl Acad Sci U S A.2013.http://www.pnas.org/content/early/2013/07/16/1310675110.full.pdf+html[31] Tamaoki N, Takahashi K, Tanaka T, et al. Dental pulp cells for induced pluripotent stem cell banking.J Dent Res.2010; 89(8): 773-778.[32] Riggs JW, Barrilleaux BL, Varlakhanova N, et al.Induced pluripotency and oncogenic transformation are related processes.Stem Cells Dev.2013;22(1):37-50.[33] Zhao T, Zhang ZN, Rong Z, et al. Immunogenicity of induced pluripotent stem cells.Nature.2011;474(7350):212-215.[34] Grad I, Hibaoui Y, Jaconi M, et al. NANOG priming before full reprogramming may generate germ cell tumours. Eur Cell Mater.2011;22:258-274.[35] Lin T, Chao C, Saito S, et al.p53 induces differentiation of mouse embryonic stem cells by suppressing Nanog expression.Nat Cell Biol.2005;7(2):165-171.[36] Li H, Collado M, Villasante A, et al.The Ink4/Arf locus is a barrier for iPS cell reprogramming.Nature.2009;460(7259): 1136-1139.[37] Kawamura T, Suzuki J, Wang YV, et al.Linking the p53 tumour suppressor pathway to somatic cell reprogramming.Nature. 2009; 460(7259):1140-1144.[38] Utikal J, Polo JM, Stadtfeld M, et al. Immortalization eliminates a roadblock during cellular reprogramming into iPS cells.Nature.2009;460(7259):1145-1148.[39] Marión RM, Strati K, Li H, et al.A p53-mediated DNA damage response limits reprogramming to ensure iPS cell genomic integrity.Nature.2009;460(7259):1149-1153.[40] Hong H, Takahashi K, Ichisaka T, et al.Suppression of induced pluripotent stem cell generation by the p53-p21 pathway.Nature.2009;460(7259):1132-1135.[41] Lin Y, Cheng Z, Yang Z, et al.DNp73 improves generation efficiency of human induced pluripotent stem cells.BMC Cell Biol.2012;13:9.[42] Kim JB, Zaehres H, Wu G, et al.Pluripotent stem cells induced from adult neural stem cells by reprogramming with two factors. Nature.2008;454(7204):646-650.[43] Hanna J, Saha K, Pando B, et al.Direct cell reprogramming is a stochastic process amenable to acceleration.Nature.2009; 462(7273):595-601.[44] Banito A, Rashid ST, Acosta JC, et al.Senescence impairs successful reprogramming to pluripotent stem cells.Genes Dev.2009;23(18):2134-2139.[45] Prigione A, Fauler B, Lurz R, et al.The senescence-related mitochondrial/oxidative stress pathway is repressed in human induced pluripotent stem cells.Stem Cells.2010;28(4): 721-733.[46] Levine AJ, Oren M.The first 30 years of p53: growing ever more complex.Nat Rev Cancer.2009;9(10):749-758. |
| [1] | Pu Rui, Chen Ziyang, Yuan Lingyan. Characteristics and effects of exosomes from different cell sources in cardioprotection [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(在线): 1-. |
| [2] | Jiang Yong, Luo Yi, Ding Yongli, Zhou Yong, Min Li, Tang Fan, Zhang Wenli, Duan Hong, Tu Chongqi. Von Mises stress on the influence of pelvic stability by precise sacral resection and clinical validation [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(9): 1318-1323. |
| [3] | Zhang Tongtong, Wang Zhonghua, Wen Jie, Song Yuxin, Liu Lin. Application of three-dimensional printing model in surgical resection and reconstruction of cervical tumor [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(9): 1335-1339. |
| [4] | Gu Xia, Zhao Min, Wang Pingyi, Li Yimei, Li Wenhua. Relationship between hypoxia inducible factor 1 alpha and hypoxia signaling pathway [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1284-1289. |
| [5] | Zhang Xiumei, Zhai Yunkai, Zhao Jie, Zhao Meng. Research hotspots of organoid models in recent 10 years: a search in domestic and foreign databases [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1249-1255. |
| [6] | Wang Zhengdong, Huang Na, Chen Jingxian, Zheng Zuobing, Hu Xinyu, Li Mei, Su Xiao, Su Xuesen, Yan Nan. Inhibitory effects of sodium butyrate on microglial activation and expression of inflammatory factors induced by fluorosis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1075-1080. |
| [7] | Wang Xianyao, Guan Yalin, Liu Zhongshan. Strategies for improving the therapeutic efficacy of mesenchymal stem cells in the treatment of nonhealing wounds [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1081-1087. |
| [8] | Liao Chengcheng, An Jiaxing, Tan Zhangxue, Wang Qian, Liu Jianguo. Therapeutic target and application prospects of oral squamous cell carcinoma stem cells [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1096-1103. |
| [9] | Zhao Min, Feng Liuxiang, Chen Yao, Gu Xia, Wang Pingyi, Li Yimei, Li Wenhua. Exosomes as a disease marker under hypoxic conditions [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1104-1108. |
| [10] | Xie Wenjia, Xia Tianjiao, Zhou Qingyun, Liu Yujia, Gu Xiaoping. Role of microglia-mediated neuronal injury in neurodegenerative diseases [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1109-1115. |
| [11] | Li Shanshan, Guo Xiaoxiao, You Ran, Yang Xiufen, Zhao Lu, Chen Xi, Wang Yanling. Photoreceptor cell replacement therapy for retinal degeneration diseases [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1116-1121. |
| [12] | Jiao Hui, Zhang Yining, Song Yuqing, Lin Yu, Wang Xiuli. Advances in research and application of breast cancer organoids [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1122-1128. |
| [13] | Wang Shiqi, Zhang Jinsheng. Effects of Chinese medicine on proliferation, differentiation and aging of bone marrow mesenchymal stem cells regulating ischemia-hypoxia microenvironment [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1129-1134. |
| [14] | Zeng Yanhua, Hao Yanlei. In vitro culture and purification of Schwann cells: a systematic review [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1135-1141. |
| [15] | Kong Desheng, He Jingjing, Feng Baofeng, Guo Ruiyun, Asiamah Ernest Amponsah, Lü Fei, Zhang Shuhan, Zhang Xiaolin, Ma Jun, Cui Huixian. Efficacy of mesenchymal stem cells in the spinal cord injury of large animal models: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1142-1148. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||