Chinese Journal of Tissue Engineering Research ›› 2020, Vol. 24 ›› Issue (7): 1130-1137.doi: 10.3969/j.issn.2095-4344.2011
Previous Articles Next Articles
Non-coding RNAs in human dental pulp stem cells: regulations and mechanisms
Ren Chunmei1, Liu Yufang1, Xu Nuo2, Shao Miaomiao1, He Jianya1, Li Xiaojie1
- 1Stomatology Medical College, Dalian Medical University, Dalian 116044, Liaoning Province, China; 2Zhongshan College of Dalian Medical University, Dalian 116000, Liaoning Province, China
-
Received:2019-05-30Revised:2019-06-04Accepted:2019-07-06Online:2020-03-08Published:2020-01-20 -
Contact:Li Xiaojie, MD, Associate professor, Master’s supervisor, Stomatology Medical College, Dalian Medical University, Dalian 116044, Liaoning Province, China -
About author:Ren Chunmei, Master candidate, Stomatology Medical College, Dalian Medical University, Dalian 116044, Liaoning Province, China Liu Yufang, Master candidate, Stomatology Medical College, Dalian Medical University, Dalian 116044, Liaoning Province, China Ren Chunmei and Liu Yufang contributed equally to this work. -
Supported by:2018 Teaching Reform Research Project of Chinese Medical Association, No. 2018B-N03024; Liaoning Provincial Science and Technology Department Project, No. 201602230; 2019 Medical Teaching Reform Project of Dalian Medical University, No. DYLX19034; 2018 Central Government Fund for Major Chronic Diseases
CLC Number:
Cite this article
Ren Chunmei, Liu Yufang, Xu Nuo, Shao Miaomiao, He Jianya, Li Xiaojie. Non-coding RNAs in human dental pulp stem cells: regulations and mechanisms[J]. Chinese Journal of Tissue Engineering Research, 2020, 24(7): 1130-1137.
share this article
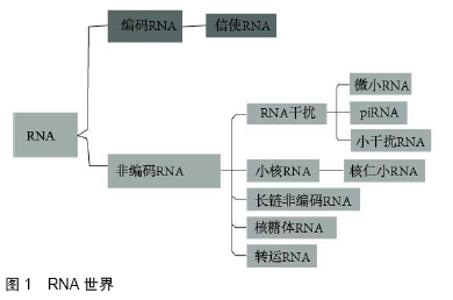
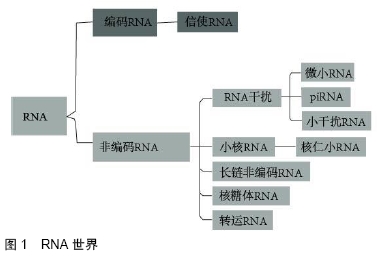
2.1 非编码RNAs的基本介绍 2.1.1 非编码RNAs的起源 人类基因组中超过95%的DNA序列是非蛋白质编码序列,其中许多可以在细胞中转录,并可以进一步加工成大量功能性非编码RNAs,包括转移RNA(transfer RNA,tRNA)、核糖体RNA (ribosomal RNA,rRNA)、microRNA(miRNA或miR)和长链非编码RNAs(long noncoding RNA,lncRNA)等[5]。不涉及与蛋白翻译有关的非编码RNAs,如rRNA和tRNA,最早的非编码RNAs研究可以追溯到20世纪90年代。Liu和Maxwell在哺乳动物组织的内含子中发现U14 snRNA,打开了一个新的“RNA世界”大门,见图1[6]。 "
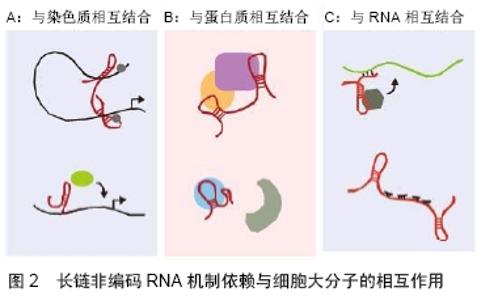
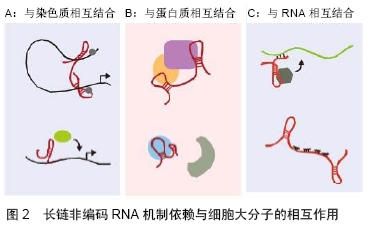
1990年,在小鼠的细胞中鉴别出了一种“非经典”RNA——H19,后来被证明是长链非编码RNAs[7]。在那个非编码RNAs研究的火热时代,大量snoRNA在真核生物及古细菌中被发现,从此之后分子生物研究领域开始刮起了“核仁风暴”[8]。1998年,FIRE等[9]首次在线虫中发现双链RNA分子可诱导产生RNA干扰作用,之后他们又将真正起干扰作用的双链小RNA称为小干扰RNA。RNA干扰是指当细胞中导入与内源性mRNA相似或者完全相同的双链RNA时,会诱发mRNA发生降解并导致转录后基因表达沉默的现象[5]。安德鲁?法尔和克雷格?梅洛也正是因为此项发现荣获了2006年的诺贝尔生理学或医学奖,随后miRNA大量被发现。2003年,人类基因组研究所(NHGRI)启动“DNA元件的百科全书(ENCODE)”计划顺利完成[10],使得基因组测序技术取得了长足的进步。之后,科学界便迎来了新一代测序技术的诞生,在过去的10年中,新一代测序技术不断进 步——测序的数据量增加了100-1 000倍,这些技术上的进展使得人们甚至可以在一条读段(read)上读出整条基因组序列[11],也使非编码基因组能够达到之前所未有的分辨率和规模,随后大量非编码RNAs被鉴定。时至今日,科学家们能用RNA-Seq、染色质免疫沉淀(ChIP)-Seq (转录因子和组蛋白修饰)、ATAC-Seq、DNase-Seq、ChIA-PET和Hi-C等高通量测序方法从人、小鼠、果蝇和线虫中鉴定出非编码RNAs,数量高达 27 394个[10](可用以下位置进行查询:https://www. encodeproject.org/)。非编码RNAs虽然不具有蛋白编码能力,但其具有多样性并能以调控因子等多重身份在生命活动的多个层次中发挥重要作用。 2.1.2 非编码RNAs的定义及分类 随着人类基因组计划研究的不断深入,人们逐渐意识到非编码序列,表观遗传调控等也在各类生命活动中发挥着重要作用。人们将这些可以转录却不能编码蛋白的RNA称为非编码RNAs,非编码RNAs广泛存在于哺乳动物基因组中,是一种没有蛋白编码能力的内源性细胞RNA。各种非编码RNAs已被表明在多种重要生物学过程中扮演关键角色,包括癌症进展、干细胞干性发生等[12]。 非编码RNAs的种类繁多,目前尚无统一的标准,从长度上来划分非编码RNAs可以分为3类:小于50 nt,包括microRNA、siRNA、piRNA;50-500 nt,包括rRNA、tRNA、小核RNA(snRNA), 小核仁RNA(small nucleolar RNA,snoRNA)、启动子相关的RNA等;大于500 nt,包括长链基因间非编码RNAs(long intergenic non-coding RNA,lincRNA)、基因间长链非编码RNAs (T-UCRs)、内源竞争RNA(competing endogenous RNA,ceRNA)等[13]。目前引起广泛关注的长链非编码RNAs是指长度大于200 nt的非编码RNAs,200- 100 000 nt。长链非编码RNA位于细胞核内或胞浆内,没有蛋白质编码能力且保守性差,但具有mRNA 的结构特征—5'的帽式结构和3'端的poly A尾巴,且长链非编码RNA在不同细胞的表达具有特异性,是RNA聚合酶Ⅱ转录的产物[14-15]。 2.1.3 非编码RNAs的作用机制 非编码RNAs的种类很多且相互之间有密切联系。目前,非编码RNAs研究多以miRNAs和长链非编码RNAs为主,文章将以miRNAs、长链非编码RNAs和其他非编码RNAs3个部分来介绍非编码RNAs的作用机制。 (1)miRNAs的作用机制:miRNAs是一类非常重要的非编码RNAs,长度为18-22 nt。在细胞核中,由RNA聚合酶Ⅱ(polII)转录形成初级miRNA(pri-miRNA),然后由RNA结合蛋白DGCR8和RNaseⅢ酶Drosha组成的微处理器切割以形成含有短发夹的前体miRNA (pre-miRNA),RNA-GTP和exportin 5将pre-miRNA输送到细胞质中,最后通过Dicer处理形成成熟的miRNA。成熟的miRNA被整合到RNA诱导的沉默复合物(RNA-induced silencing complex,RISC)中,通过与靶基因mRNA的3'非翻译区(3'UTR)碱基配对,若不完全互补配对(哺乳动物多见),可造成mRNA翻译抑制,若完全互补配对,则造成mRNA降解。最新研究也表明,miRNA可以影响mRNA的稳定性[16]。 miRNAs在诸多生命活动中起着非常重要的作用,可以影响细胞功能的各个方面,包括生长、增殖、分化、发育、代谢、感染、免疫、细胞死亡、细胞器生物发生、信使信号传导、DNA修复和自我更新等。研究表明,miRNA可通过直接靶向多能性因子的3'UTR来调节干细胞的状态。例如,miR-495可通过直接靶向多能干细胞中血管内皮细胞锌指1(vascular endothelial zinc finger 1,Vezf1)抑制内皮细胞或血管生成基因的表达,进而成为治疗心肌梗死的临床靶标[17]。细胞外囊泡由不同的组织分泌,并在细胞-细胞通讯、器官相互作用和组织稳态中发挥重要作用。QIN等[18]通过梯度超速离心和超滤分离出骨髓干细胞衍生的细胞外囊泡,发现细胞外囊泡中含有的miR-196a可以诱导成骨相关基因ALP、OCN、OPN和Runx2的表达,证明了miR-196a部分介导细胞外囊泡依赖性成骨发生作用。 (2)长链非编码RNAs的作用机制:总体来说,功能部分始于长链非编码RNAs细胞定位,若长链非编码RNAs定位于染色质,与染色质相互作用调控顺式和反式基因表达,促进组蛋白修饰。若位于细胞质,可与蛋白质相互作用以调节蛋白质功能,调节蛋白质-蛋白质相互作用,也可以控制RNA的稳定性,影响其翻译,见图2[19]。 "
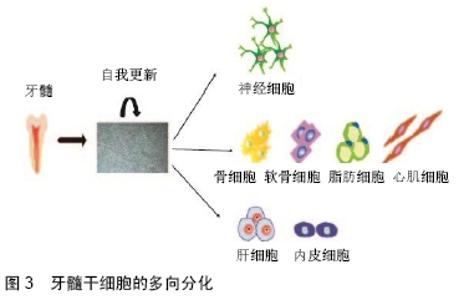
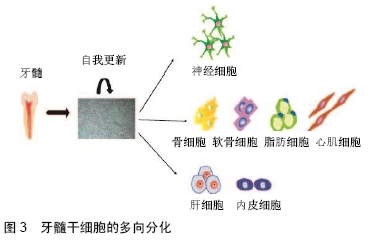
影响染色质结构:①组蛋白修饰:包括乙酰化和去乙酰化;磷酸化和去磷酸化;甲基化和去甲基化。如lncRNA GClnc1结合WDR5(组蛋白甲基化转移酶复合物的关键组分)和KAT2A组蛋白乙酰转移酶,可以通过充当胃癌细胞中潜在的模块化支架来连接WDR5和KAT2A,协调其定位。敲低lncRNA GClnc1,降低了H3K4me3和H3K9Ac(WDR5和KAT2A复合物的相应组蛋白甲基化和乙酰化产物)水平,从而控制其调节组蛋白修饰、基因表达和生物活性的能力。SOD2是WDR5/KAT2A复合物的靶基因之一,敲低lncRNA GClnc1,SOD2表达下调,进而损害了细胞增殖和侵袭能力[20];②DNA甲基化:位于11号染色体上的 LncRNA SNHG1在许多癌组织中高表达,包括肺癌和肝癌。研究发现,新型LncRNA SNHG1在胃癌中上调并促进甲基酶DNMT1表达,促进胃癌增殖,LncRNA SNHG1可以作为胃癌预后的新预测因子和胃癌治疗的潜在靶标[21]。 转录水平调控:①引导转录因子:干扰转录因子与启动子的结合,调控靶基因转录。lncRNA Tug1(牛磺酸上调基因1)在其启动子处与过氧化物酶体增殖物激活受体γ(PPARγ)共激活因子α(PGC-1α)相互作用,正调节Ppargc1a基因转录及其在小鼠足细胞中的靶基因表达,使得线粒体含量增加,线粒体呼吸增强,细胞ATP水平增加,线粒体活性氧降低。PGC-1α可被lncRNA靶向的事实为遗传和药理学干预提供了新的可能性,为改善糖尿病微血管和大血管并发症中的线粒体功能障碍提供了新的治疗方案[22];②作为转录因子和共激活因子:缺氧是快速生长的实体瘤的共同特征,与肿瘤转移和预后不良密切相关,SHIH等[23]研究发现LncHIFCAR (long noncoding HIF-1α co-activating RNA)水平在口腔癌中显著上调,LncHIFCAR/ MIR31HG可充当缺氧诱导因子1α共激活剂,增强缺氧诱导因子1α复合物与靶基因座的结合,使细胞处于缺氧状态,进而促进口腔鳞癌的发生发展;③结合RNA聚合酶Ⅱ(RNAPⅡ):与其相互作用,影响转录;④顺式作用:通过顺式作用直接调控邻近基因表达,干扰相邻基因表达;lncRNA-Six1对编码蛋白质的Six1基因进行顺式作用调节,并编码微肽以激活Six1基因,从而促进细胞增殖并参与肌肉生长[24];⑤通过碱基互补,形成RNA-DNA三螺旋复合物(RNA-DNA hybrids),控制靶基因转录[25]。 转录后水平调控:①调节pre-mRNA选择性剪切:SPRIGHTLYlncRNA可以结合癌症细胞转移相关功能的pre-mRNA分子的内含子区域,然后作为转录后核中枢,使细胞转移到大脑,从而使侵袭性黑色素瘤的死亡率增加[26];②影响mRNA稳定性;③ceRNA调控:LIAO等[27]研究证明,过表达lncRNA CASC2,可以作为内源竞争性RNA(ceRNA)竞争性结合PTEN mRNA上的miRNA-181a,上调PTEN蛋白表达以调节胶质瘤生长和对替莫唑胺(TMZ)的抗性。 (3)其他非编码RNAs的作用机制:miRNAs和长链非编码RNAs在非编码RNAs的研究中占据主导地位,但是其余非编码RNAs也发挥着重要作用。PIWI蛋白首先在果蝇中发现,其中它们在种系干细胞维持和自我更新中发挥作用,一类非编码的24-32个核苷酸的小RNA,可以在哺乳动物睾丸内通过结合到PIWI蛋白形成piRNA复合物,促进生殖干细胞维持和干细胞干性发生,以维持精子数目[28]。 2.2 人牙髓干细胞的研究进展 2.2.1 干细胞的研究进展 干细胞被定义为可以产生一种或多种特定细胞类型的祖细胞。它们的主要功能是提供组织发育、动态平衡和受损组织的修复。随着人类组织工程技术的不断发展,干细胞及其治疗应用已成为全世界快速发展的研究领域,也成为近期研究热点。经过数十年的研究,已经获得了关于干细胞生物学及其实际治疗应用的零碎知识。干细胞是独特的细胞群,具有自我更新和分化的能力,有可能分化为3种胚层中的任何一种,各种各样的成年哺乳动物组织都含有干细胞,在很多组织中干细胞有助于补充正常细胞衰老或损伤而损失的细胞。这些多能干细胞能够自我更新并产生任何谱系的细胞,因此为人类组织工程的发展提供了“种子”细胞[29-30]。NUTI等将干细胞主要分为3类:胚胎干细胞、诱导多能干细胞和成体干细胞。成体干细胞包括神经干细胞、血液干细胞、骨髓间充质干细胞、表皮干细胞等。间充质干细胞是纺锤形的成纤维细胞样细胞,其可以作为未分化细胞复制。脂肪组织和骨髓是最容易获得的间充质干细胞来源,并可在特定条件下形成矿化物质。口腔干细胞具有无损伤性获得、易储存等优点,已成为近年来组织工程研究的热点。牙髓干细胞是研究最多的口腔干细胞之一,高表达CD90,CD73,CD105,CD29,CD13和CD44表面抗原,低表达或不表达CD34,CD45和HLA-DR。除此之外,牙髓干细胞还呈现与矿化组织形成相似的表面标志物和基质蛋白(碱性磷酸盐、骨钙蛋白和骨桥蛋白)[31-33]。 2.2.2 人牙髓干细胞功能介绍 口腔相关的干细胞有牙髓干细胞、牙周膜干细胞、脱落乳牙牙髓干细胞、牙囊干细胞。2000年GRONTHOS等首次从人类牙髓中分离出干细胞,称其为牙髓干细胞,然后进行体外扩增并将其注射到裸鼠体内,人牙髓干细胞在体外与间充质干细胞具有相似的蛋白质表达模式,可以在免疫功能不全的小鼠体内形成钙化沉积物,且在矿物质周围可形成纤维血管组织。牙髓干细胞具备高度的分化增殖能力,与生物材料间存在积极的相互作用,且获取简单高效,对供体损伤小,这些特点也使牙髓干细胞在牙周组织再生方面具有很大的利用潜力[34]。人牙髓干细胞具有多分化潜能,见图3[35-36]。 "

2.2.3 人牙髓干细胞的牙源性分化 GRONTHOS 等[37]提取人牙髓干细胞,注射到裸鼠体内,实验结果证明了人牙髓干细胞可以分化为衬有人成牙本质细胞样细胞的牙本质样结构。人牙髓干细胞已运用各种牙源性组织再生工程中,可以修复受损的牙齿结构并恢复其生物学功能[38]。研究显示,以羟基磷灰石-磷酸三钙作为支架载体,将分离得到的牙髓干细胞移植到8周龄免疫缺陷大鼠体内,在移植部位能够发现类似牙髓-牙本质复合体的组织形成[39]。 2.2.4 人牙髓干细胞的成骨向分化 人牙髓干细胞显示出与骨骼分化过程相似的分化特征,使得研究者将目光转向易提取易保存的人牙髓干细胞。现阶段,体外人工骨再生研究主要困难已不再是形成矿物基质包围的单层细胞,而是如何获得能够形成完整组织具有成骨能力的干细胞。人牙髓干细胞具有高效率成骨能力,而且可以形成完整的血管,在组织形成阶段,足够的血液供应对组织修复和移植是至关重要的。除此之外,有报道称人牙髓干细胞形成的是钙化结节,但不是骨组织碎片。在临床前阶段,这种特性可以评估生物材料的骨传导性[34,40]。 2.2.5 人牙髓干细胞的成脂分化、成软骨分化、成神经分化及其他功能[41] 有许多研究表明牙髓干细胞能够进行成脂肪、软骨和神经源性分化[42-43]。除此之外,牙髓干细胞还具有免疫调节功能[44]。 2.3 非编码RNAs在人牙髓干细胞中的研究进展 冷冻保存儿童的牙齿或成人智齿正在引起全世界的兴趣,尤其是在许多发达国家,大部分组织库已经承认来自神经嵴间充质干细胞的人牙髓干细胞具有多向分化和自我更新的能力[45]。在过去几年中,大量报道已显示人牙髓干细胞的可塑性和增殖能力范围高达30%-50%,与骨髓干细胞相比具有更好的免疫调节行为[31]。对人牙髓干细胞的研究已经成为增长最快的领域之一,它们具有多元分化潜能,是组织工程和再生医学应用的最有前景的工具之一[46]。与此同时,人牙髓干细胞分化是一种严格的协调过程,涉及多种调节途径,可溶性因子如细胞因子、激素和生长因子也可通过复杂网络来调节干细胞的命运。研究人牙髓干细胞的分化机制,对于促进其干性发生显得尤为重要。目前,已经进行了大量研究以探索人牙髓干细胞牙源性分化过程中涉及的机制。研究发现,酒精滥用似乎会导致牙周病、龋齿和口腔溃疡等口腔疾病,将人牙髓干细胞暴露于乙醇中,可导致基因表达谱改变的表观遗传变化[32]。HUANG等[47]研究表明特定剂量(1 mmol/L和2.5 mmol/L)的锶(Sr)通过激活人牙髓干细胞中的钙敏感受体(CaSR)以及下游MAPK/ERK信号通路,在体外显著促进人牙髓干细胞的增殖、牙源性分化和矿化基质形成。还有报道称革兰阴性菌的主要致病因子脂多糖通过Toll样受体4、细胞外调节蛋白激酶(ERK)以及蛋白激酶P38 MAPK信号通路促进人牙髓干细胞的成牙本质细胞分化[48]。ZHANG等[49]通过研究首次揭示了Stathmin蛋白可以激活Wnt/β-连环蛋白通路促进人牙髓干细胞增殖和成牙本质/成骨分化。研究表明p16 INK4a和BMI-1参与氧化应激引发的人牙髓干细胞过早衰老,考虑到这一事实,可以改善外在培养环境培养人牙髓干细胞,以保持其干性,延迟其衰老过程[50]。 最近,许多研究已经证明非编码RNAs的失调,包括长链非编码RNAs(lncRNA)和微小RNA(miRNA),与干细胞干性作用有关,如神经干细胞[51]、造血干细胞[52]、肿瘤干细胞[53]、牙髓干细胞等[54],从非编码基因的角度揭示干细胞的增殖、分化已成为研究的热点之一,GAO等[55]发现lncRNA THOR在鼻咽癌组织中的表达显著增加,并作为YAP的共激活因子,促进了鼻咽癌细胞的干性,减弱其对顺铂的敏感性。研究表明,miR-5100是成骨分化的正调节因子,在成骨细胞分化和矿化过程中明显上调,miR-5100可以靶向抗增殖蛋白家族Tob2进而促进骨相关转录因子osterix的表达,促进成骨细胞分 化[56]。因此有必要探讨与总结非编码RNA在人牙髓干细胞中的作用。 2.3.1 非编码RNAs调控人牙髓干细胞相关基因的转录 非编码RNAs可以通过多种方式,在人牙髓干细胞相关调控基因的转录过程中发挥重要作用。微小RNA (miRNA)是长度为22个核苷酸的非编码RNAs,TAN等[57]发现在诱导多能干细胞中发现了117种具有超过2倍过表达的miRNA,可作为细胞分化中的重要调节转录物。ZENG等[58]发现microRNA-675(miR-675)在患有毛滴 虫-骨质(TDO)综合征的患者中显著下调。毛滴虫-骨质综合征的主要特征之一是牙本质发育不全。他们通过一系列研究发现miR-675通过远端同源框(DLX3)甲基化来调节人牙髓干细胞的牙源性分化。赖氨酸特异性组蛋白去甲基化酶1(KDM1A)是第一个被定义的组蛋白特异性去甲基化酶,可能参与多条信号通路,影响肿瘤发生、生长、增殖、侵袭转移、耐药等多个环节。WANG等[59]研究发现,KDM1A对于口腔干细胞的作用是动态的,KDM1A可以在体外抑制早期骨/牙本质标志碱性磷酸酶的表达,促进牙源性分化移动相关转录因子RUNX2、成骨相关转录因子OSX和同源转录因子DLX2的表达,增强中晚期骨/牙本质分化标志骨诞蛋白、牙本质涎磷蛋白和牙本质基质蛋白1的表达,表明KDM1A在口腔干细胞成骨分化的每个阶段发挥不同作用。他们也发现KDM1A可以通过与人赖氨酸羟化酶2(PLOD2)结合调节口腔干细胞的骨/牙本质分化过程。KDM1A可以受多种非编码RNAs调控而促进干细胞干性发生,如人间充质干细胞[60]、肿瘤干细胞[61]、造血干细胞等[62],非编码RNAs可能通过KDM1A调控人牙髓干细胞相关基因的转录,但具体机制有待进一步探究。 2.3.2 非编码RNAs调控人牙髓干细胞相关基因的翻译 非编码RNAs可以调节mRNA的稳定性,或使mRNA完全降解,从而影响细胞的功能。研究发现lncRNA CCAT1在牙髓干细胞中显著上调。此外,CCAT1通过抑制miR-218的表达促进细胞增殖和分化,miR-218可能是牙髓干细胞的新型标记物[63]。MiR-3099是一种小鼠和啮齿动物特异性miRNA,在神经元分化和中枢神经系统发育过程中表达升高。研究者发现miR-3099过表达时,与神经元标记相关的基因表达上调;相反,与星形胶质细胞标记物相关基因却被抑制,表明miR-3099在调节神经元分化相关标志物的表达中起重要作用。miR-3099的人类同源物mds21在人牙髓干细胞显著高表达,这就提示mds21在调节人牙髓干细胞干性发生方面具有潜在作用。 2.3.3 非编码RNAs调控人牙髓干细胞相关基因的蛋白功能 近年来,很多研究发现LncRNA与miRNA联系密切,常常互为效应因子,通过表观遗传调控发挥作用。有一些其他研究也表明miR-675作为lncRNA H19的下游效应因子可以促进成骨细胞分化。HUANG等[64]发现新途径lncRNA H19/miR-675抑制转化生长因子β1的mRNA水平和蛋白表达,随后抑制转运蛋白(Smad3)。smad3在骨修复中的作用一方面是抑制间充质干细胞向成骨细胞分化,并且减少成骨细胞胞外基质的合成;另一方面是抑制软骨细胞的肥大成熟,使骨修复时间延长。同时,H19/miR-675下调组蛋白去乙酰化酶(HDAC)4/5的mRNA和蛋白水平,从而增加成骨细胞标志物基因表达,调节间充质干细胞的成骨分化,可以作为增强体内骨形成的潜在靶标。过表达lncRNA H19可以通过降低S-腺苷高半胱氨酸水解酶(SAHH)活性,进而使得DNMT3B活性降低,DLX3甲基化水平降低而促进DLX3表达,最终促进人牙髓干细胞的牙源性分化。与此同时,人牙髓干细胞的衰老使得其在细胞疗法中的应用受到其复制和分化潜能的限制。因此,阐明非编码RNAs在人牙髓干细胞衰老中的机制对于人牙髓干细胞在组织工程中的应用也是重要的。miR-152属于miR-148/152家族,其成员具有相同的种子序列并且在许多癌症中充当肿瘤抑制剂。GU等[65]研究表明miR-152通过抑制SIRT7表达诱导人牙髓干细胞衰老。IGF-1可以促进间充质干细胞的骨/牙源性分化,通过IGF-1R介导的IGF-1信号传导在干细胞的分化和形态发生中起重要作用。丝裂原活化蛋白激酶(mitogen- activated protein kinases,MAPKs)是细胞内的一类丝氨酸/苏氨酸蛋白激酶,是细胞内重要的信号传导通路,主要参与凋亡调控、细胞代谢、细胞分化和肿瘤发生等生命过程,MAPKs包括3个主要成员,分别是细胞外信号调节蛋白激酶(extracellularsignal regulated protein kinase,ERK)、c-Jun氨基末端激酶(c-Jun amino-t erminal kinase,JNK)和P38 MAPK[66]。IGF-1可以通过激活MAPKs信号上调间充质干细胞的骨/牙源性分化。miRNA let-7在调节细胞增殖和分化方面有着重要作用,并参与维持干细胞干性发生。LIU等[67]发现IGF-1R是let-7c的靶标,Let-7c可以抑制牙髓干细胞中的IGF-1R表达,过表达Let-7c也可以使得P38 MAPK信号传导途径下调,随后导致IGF-1处理的牙髓干细胞的骨/牙源性分化能力减弱。 "

| [1] MEDDENS CA, VAN DER LIST ACJ, NIEUWENHUIS EES, et al. Non-coding DNA in IBD: from sequence variation in DNA regulatory elements to novel therapeutic potential. Gut. 2019; 68(5):928-941. [2] HEINZ S, ROMANOSKI CE, BENNER C, et al. The selection and function of cell type-specific enhancers. Nat Rev Mol Cell Biol. 2015;16(3):144-154. [3] KIM SS, LEE SV. Non-Coding RNAs in Caenorhabditis elegans Aging. Mol Cells. 2019;42(5):379-385. [4] VALTIERI M, SORRENTINO A. The mesenchymal stromal cell contribution to homeostasis. J Cell Physiol. 2008;217(2): 296-300. [5] YU AM, JIAN C, YU AH, et al. RNA therapy: Are we using the right molecules. Pharmacol Ther. 2019;196:91-104. [6] LIU J, MAXWELL ES. Mouse U14 snRNA is encoded in an intron of the mouse cognate hsc70 heat shock gene. Nucleic Acids Res. 1990;18(22):6565-6571. [7] BRANNAN CI, DEES EC, INGRAM RS, et al. The product of the H19 gene may function as an RNA. Mol Cell Biol.1990; 10(1): 28-36. [8] KISS T. Small nucleolar RNAs: an abundant group of noncoding RNAs with diverse cellular functions. Cell. 2002; 109(2):145-148. [9] FIRE A, XU S, MONTGOMERY MK, et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 1998;391(6669):806-811. [10] DAVIS CA, HITZ BC, SLOAN CA, et al. The Encyclopedia of DNA elements (ENCODE): data portal update. Nucleic Acids Res. 2018;46(D1):D794-D801. [11] GOODWIN S, MCPHERSON JD, MCCOMBIE WR. Coming of age: ten years of next-generation sequencing technologies. Nat Rev Genet. 2016;17(6):333-351. [12] CHAN JJ, TAY Y. Noncoding RNA:RNA Regulatory Networks in Cancer. Int J Mol Sci. 2018;19(5): E1310. [13] NICOLAS FE. Role of ncRNAs in Development, Diagnosis and Treatment of Human Cancer. Recent Pat Anticancer Drug Discov. 2017;12(2):128-135. [14] PONTING CP, OLIVER PL, REIK W. Evolution and functions of long noncoding RNAs. Cell. 2009;136(4):629-641. [15] VANCE KW, PONTING CP. Transcriptional regulatory functions of nuclear long noncoding RNAs.Trends Genet. 2014;30(8): 348-355. [16] KABEKKODU SP, SHUKLA V, VARGHESE VK, et al. Clustered miRNAs and their role in biological functions and diseases. Biol Rev Camb Philos Soc. 2018;93(4):1955-1986. [17] LIANG J, HUANG W, CAI W, et al. Inhibition of microRNA-495 Enhances Therapeutic Angiogenesis of Human Induced Pluripotent Stem Cells. Stem Cells. 2017;35(2):337-350. [18] QIN Y, WANG L, GAO Z, et al. Bone marrow stromal/stem cell-derived extracellular vesicles regulate osteoblast activity and differentiation in vitro and promote bone regeneration in vivo. Sci Rep. 2016;6:21961. [19] SCHMITT AM, CHANG HY. Long Noncoding RNAs in Cancer Pathways. Cancer Cell. 2016;29(4):452-463. [20] SUN TT, HE J, LIANG Q, et al. LncRNA GClnc1 Promotes Gastric Carcinogenesis and May Act as a Modular Scaffold of WDR5 and KAT2A Complexes to Specify the Histone Modification Pattern.Cancer Discov. 2016;6(7):784-801. [21] HU Y, MA Z, HE Y, et al. LncRNA-SNHG1 contributes to gastric cancer cell proliferation by regulating DNMT1. Biochem Biophys Res Commun. 2017;491(4):926-931. [22] LONG J, BADAL SS, YE Z, et al. Long noncoding RNA Tug1 regulates mitochondrial bioenergetics in diabetic nephropathy. J Clin Invest. 2016;126(11):4205-4218. [23] SHIH JW, CHIANG WF, WU ATH, et al. Long noncoding RNA LncHIFCAR/MIR31HG is a HIF-1α co-activator driving oral cancer progression. Nat Commun. 2017;8:15874. [24] CAI B, LI Z, MA M, et al. LncRNA-Six1 Encodes a Micropeptide to Activate Six1 in Cis and Is Involved in Cell Proliferation and Muscle Growth. Front Physiol. 2017;8:230. [25] WILUSZ JE, SUNWOO H, SPECTOR DL. Long noncoding RNAs: functional surprises from the RNA world. Genes Dev. 2009;23(13):1494-1504. [26] LEE B, SAHOO A, MARCHICA J, et al. The long noncoding RNA SPRIGHTLY acts as an intranuclear organizing hub for pre-mRNA molecules. Sci Adv. 2017;3(5):e1602505. [27] LIAO Y, SHEN L, ZHAO H, et al. LncRNA CASC2 Interacts With miR-181a to Modulate Glioma Growth and Resistance to TMZ Through PTEN Pathway.J Cell Biochem. 2017;118(7): 1889-1899. [28] HAN YN, LI Y, XIA SQ, et al. PIWI Proteins and PIWI-Interacting RNA: Emerging Roles in Cancer. Cell Physiol Biochem. 2017;44(1):1-20. [29] GHOSAL S, DAS S, CHAKRABARTI J. Long noncoding RNAs: new players in the molecular mechanism for maintenance and differentiation of pluripotent stem cells. Stem Cells Dev. 2013;22(16):2240-2253. [30] ODORICO JS, KAUFMAN DS, THOMSON JA. Multilineage differentiation from human embryonic stem cell lines. Stem Cells. 2001;19(3):193-204. [31] TATULLO M, CODISPOTI B, PADUANO F, et al. Strategic Tools in Regenerative and Translational Dentistry. Int J Mol Sci. 2019;20(8):E1879. [32] KHALID O, KIM JJ, DUAN L, et al. Genome-wide transcriptomic alterations induced by ethanol treatment in human dental pulp stem cells (DPSCs). Genom Data. 2014;2:127-131. [33] KAWASHIMA N. Characterisation of dental pulp stem cells: a new horizon for tissue regeneration. Arch Oral Biol. 2012; 57(11):1439-1458. [34] GRAZIANO A, D'AQUINO R, LAINO G, et al. Dental pulp stem cells: a promising tool for bone regeneration. Stem Cell Rev. 2008;4(1):21-26. [35] YAMADA Y, NAKAMURA-YAMADA S, KUSANO K, et al. Clinical Potential and Current Progress of Dental Pulp Stem Cells for Various Systemic Diseases in Regenerative Medicine: A Concise Review. Int J Mol Sci. 2019;20(5):E1132. [36] POURGONABADI S, GHORBANI A, TAYARANI NAJARN Z, et al. In vitro assessment of alendronate toxic and apoptotic effects on human dental pulp stem cells. Iran J Basic Med Sci. 2018;21(9):905-910. [37] GRONTHOS S, MANKANI M, BRAHIM J, et al. Postnatal human dental pulp stem cells (DPSCs) in vitro and in vivo. Proc Natl Acad Sci U S A. 2000;97(25):13625-13630. [38] NUTI N, CORALLO C, CHAN BM, et al. Multipotent Differentiation of Human Dental Pulp Stem Cells: a Literature Review. Stem Cell Rev. 2016;12(5):511-523. [39] SONG Y, YANG L. Transgenerational impaired spermatogenesis with sperm H19 and Gtl2 hypomethylation induced by the endocrine disruptor p,p'-DDE. Toxicol Lett. 2018;297:34-41. [40] CARINCI F, PAPACCIO G, LAINO G, et al. Comparison between genetic portraits of osteoblasts derived from primary cultures and osteoblasts obtained from human pulpar stem cells. J Craniofac Surg. 2008;19(3):616-625. [41] AYDIN S, ŞAHIN F. Stem Cells Derived from Dental Tissues. Adv Exp Med Biol. 2019;1144:123-132. [42] ARMIÑÁN A, GANDÍA C, BARTUAL M, et al. Cardiac differentiation is driven by NKX2.5 and GATA4 nuclear translocation in tissue-specific mesenchymal stem cells. Stem Cells Dev. 2009;18(6):907-918. [43] MARÍ-BEFFA M, SEGURA-EGEA JJ, DÍAZ-CUENCA A. Regenerative Endodontic Procedures: A Perspective from Stem Cell Niche Biology. J Endod. 2017;43(1):52-62. [44] TOMASELLO L, MAUCERI R, COPPOLA A, et al. Mesenchymal stem cells derived from inflamed dental pulpal and gingival tissue: a potential application for bone formation. Stem Cell Res Ther. 2017;8(1):179. [45] ZHANG D, LI Q, RAO L, et al. Effect of 5-Aza-2'-deoxycytidine on odontogenic differentiation of human dental pulp cells. J Endod. 2015;41(5):640-645. [46] YEN AH, YELICK PC. Dental tissue regeneration - a mini-review. Gerontology. 2011;57(1):85-94. [47] HUANG M, HILL RG, RAWLINSON SC. Strontium (Sr) elicits odontogenic differentiation of human dental pulp stem cells (hDPSCs): A therapeutic role for Sr in dentine repair. Acta Biomater. 2016;38:201-211. [48] HE W, WANG Z, LUO Z, et al. LPS promote the odontoblastic differentiation of human dental pulp stem cells via MAPK signaling pathway. J Cell Physiol. 2015;230(3):554-561. [49] ZHANG X, NING T, WANG H, et al. Stathmin regulates the proliferation and odontoblastic/osteogenic differentiation of human dental pulp stem cells through Wnt/β-catenin signaling pathway. J Proteomics. 2019;202:103364. [50] MAS-BARGUES C, VIÑA-ALMUNIA J, INGLÉS M, et al. Role of p16INK4a and BMI-1 in oxidative stress-induced premature senescence in human dental pulp stem cells. Redox Biol. 2017;12:690-698. [51] 傅愉,张敬.非编码RNA在神经系统发育和损伤修复中的研究进展[J].同济大学学报(医学版),2018,39(5):128-138. [52] 何云燕,贾思远,于善娟.红细胞生成相关MiRNA和LncRNA研究进展[J].实用临床医学,2017,18(9):91-97. [53] 刘子鑫,刘善荣.非编码RNA调控肿瘤干细胞的研究进展[J].生命科学,2018,30(2):196-203. [54] 张鑫,汪成林,杨静,等.牙髓干细胞的表观遗传调控[J].国际口腔医学杂志,2018,45(3):261-266. [55] GAO L, CHENG XL, CAO H. LncRNA THOR attenuates cisplatin sensitivity of nasopharyngeal carcinoma cells via enhancing cells stemness. Biochimie. 2018;152:63-72. [56] WANG H, CUI Y, LUAN J, et al. MiR-5100 promotes osteogenic differentiation by targeting Tob2. J Bone Miner Metab. 2017;35(6):608-615. [57] TAN X, DAI Q. Characterization of microRNAs expression profiles in human dental-derived pluripotent stem cells. PLoS One. 2017;12(5):e0177832. [58] ZENG L, ZHAO N, LI F, et al. miR-675 promotes odontogenic differentiation of human dental pulp cells by epigenetic regulation of DLX3. Exp Cell Res. 2018;367(1):104-111. [59] WANG L, YANG H, LIN X, et al. KDM1A regulated the osteo/dentinogenic differentiation process of the stem cells of the apical papilla via binding with PLOD2. Cell Prolif. 2018; 51(4):e12459. [60] ZHAO X, HUANG Q, JIN Y. Gold nanorod delivery of LSD1 siRNA induces human mesenchymal stem cell differentiation. Mater Sci Eng C Mater Biol Appl. 2015;54:142-149. [61] HUANG Y, ZOU Y, LIN L, et al. miR-101 regulates cell proliferation and apoptosis by targeting KDM1A in diffuse large B cell lymphoma. Cancer Manag Res. 2019;11: 2739-2746. [62] WANG J, SAIJO K, SKOLA D, et al. Histone demethylase LSD1 regulates hematopoietic stem cells homeostasis and protects from death by endotoxic shock. Proc Natl Acad Sci U S A. 2018;115(2):E244-E252. [63] ZHONG YX, LI WS, LIAO LS, et al. LncRNA CCAT1 promotes cell proliferation and differentiation via negative modulation of miRNA-218 in human DPSCs. Eur Rev Med Pharmacol Sci. 2019;23(9):3575-3583. [64] HUANG Y, ZHENG Y, JIA L, et al. Long Noncoding RNA H19 Promotes Osteoblast Differentiation Via TGF-β1/Smad3/ HDAC Signaling Pathway by Deriving miR-675. Stem Cells. 2015;33(12):3481-3492. [65] GU S, RAN S, LIU B, et al. miR-152 induces human dental pulp stem cell senescence by inhibiting SIRT7 expression. FEBS Lett. 2016;590(8):1123-1131. [66] WEI X, PENG W, JIANG Q, et al. Chrysin promotes SMMC-7721 cell apoptosis by regulating MAPKs signaling pathway. Nan Fang Yi Ke Da Xue Xue Bao. 2018;38(10): 1187-1194. [67] LIU GX, MA S, LI Y, et al. Hsa-let-7c controls the committed differentiation of IGF-1-treated mesenchymal stem cells derived from dental pulps by targeting IGF-1R via the MAPK pathways. Exp Mol Med. 2018;50(4):25. [68] VOLAREVIC V, MARKOVIC BS, GAZDIC M, et al. Ethical and Safety Issues of Stem Cell-Based Therapy. Int J Med Sci. 2018;15(1): 36-45. [69] HUANG CC, NARAYANAN R, ALAPATI S, et al. Exosomes as biomimetic tools for stem cell differentiation: Applications in dental pulp tissue regeneration. Biomaterials. 2016;111: 103-115. [70] YAN P, LUO S, LU JY, et al. Cis- and trans-acting lncRNAs in pluripotency and reprogramming. Curr Opin Genet Dev. 2017; 46:170-178. [71] VICTOR AK, REITER LT. Dental pulp stem cells for the study of neurogenetic disorders. Hum Mol Genet. 2017;26(R2): R166-R171. |
| [1] | Qin Yanchun, Rong Zhen, Jiang Ruiyuan, Fu Bin, Hong Xiaohua, Mo Chunmei. Chinese medicine compound preparation inhibits proliferation of CD133+ liver cancer stem cells and the expression of stemness transcription factors [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(19): 3016-3023. |
| [2] | Zhang Shuang, Tan Rui, Wang Chunxiao, Wu Fengyu, Guo Hongyu. MicroRNAs for assessing the motion control of human skeletal muscles [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(17): 2755-2760. |
| [3] | Fan Siqi, Zeng Ping, Nong Jiao, Liu Jinfu, Qian Xiaofen. Effect of Tongluo Shenggu Capsule-containing serum on osteoclasts and Toll-like receptor 4/nuclear factor-kappa B signaling pathway [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(14): 2155-2160. |
| [4] | Fan Xuemin, Fang Shanbao, Chen Zhixing, Mo Shuixue. Status and application prospects of nano-clay Laponite [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(10): 1622-1627. |
| [5] | Wang Hongshu, Han Shen, Liu Zu, Li Xiaofang, Zhong Chongbin, Li Lifeng, Li Yaxiong, Jiang Lihong. Transcription factor NKX2-5: molecular structure and biological function in regulating cardiovascular precursor cells [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(1): 108-115. |
| [6] | Huang Hui, Dai Yao, Li Yongsheng, Chen Wei, Tang Fang, Huang Yuting, Zhou Zheng, Liu Hairong. Application and research of non-coding RNA in bone tissue engineering with cells and scaffold [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(4): 596-605. |
| [7] | Zhang Yanan, Yan Xia, Meng Zengdong. Zn and Mg increase the bioactivity and osteogenic induction of hydroxyapatite biomaterial in bone repair: clinical application and mechanism [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(4): 606-611. |
| [8] | Yang Wenxiao, Yang Ning, Liu Yao. Immunomodulation of extracellular matrix and its role in tissue regeneration [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(35): 5701-5707. |
| [9] | Zhou Pengfei, Lin Jing, Chen Yuying, Lin Minkui. Canine dental pulp stem cells-polyglycolic acid scaffold complex for canine periodontal tissue defect [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(34): 5526-5531. |
| [10] | Chen Qianqian, Shen Mengjie, Yang Kun, Liu Qi. Immunoregulation of dental tissue-derived mesenchymal stem cells and its significance in oral diseases and tissue regeneration [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(19): 3101-3107. |
| [11] | Hu Kaiwei, Nie Ling, Zhang He, Li Yuzhou, Yang Sheng. Application of α-n-butyl 2-cyanoacrylate medical adhesive for repair of oral mucosal wound of rats [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(16): 2526-2530. |
| [12] | Yin Ying, Wang Jiaqi, Dai Xiaohan, Li Yiping, Zhang Xuehui. A comparative study on the bone repair effects of two kinds of tissue regeneration membranes [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(10): 1515-1520. |
| [13] | Han Mingli, Lü Pengwei, Qian Xueke, Yang Xue, Yang Yunqing, Gu Yuanting. MicroRNA-10b regulates aldehyde dehydrogenase 1 mRNA and protein expression in breast cancer MCF-7 cell line [J]. Chinese Journal of Tissue Engineering Research, 2019, 23(9): 1349-1353. |
| [14] | Wang Canli1, 2, Jiao Zhili2, Sun Yong1, 2, Sun Song3 . Comparison of the effects of two kinds of platelet-rich fibrins on the proliferation activity of human gingival fibroblasts [J]. Chinese Journal of Tissue Engineering Research, 2019, 23(7): 1007-1012. |
| [15] | Chen Qingui, Zeng Mian, He Wanmei, Zhang Lishan, Zheng Haichong. Knockdown of foxM1 strengthens osteogenic differentiation ability of bone marrow mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2019, 23(5): 673-679. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||