Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (24): 3915-3921.doi: 10.12307/2024.089
Previous Articles Next Articles
Regulating oxidative stress with natural products for treating osteoporosis
Yan Binghan1, Li Zhichao1, Su Hui1, Xue Haipeng2, Xu Zhanwang2, Tan Guoqing2
- 1Shandong University of Traditional Chinese Medicine, Jinan 250014, Shandong Province, China; 2Affiliated Hospital of Shandong University of Traditional Chinese Medicine, Jinan 250014, Shandong Province, China
-
Received:2023-05-13Accepted:2023-07-04Online:2024-08-28Published:2023-11-22 -
Contact:Tan Guoqing, MD, Associate chief physician, Affiliated Hospital of Shandong University of Traditional Chinese Medicine, Jinan 250014, Shandong Province, China -
About author:Yan Binghan, Master candidate, Shandong University of Traditional Chinese Medicine, Jinan 250014, Shandong Province, China -
Supported by:General Project of National Natural Science Foundation of China, No. 82174410 (to XZW); Shandong Natural Science Foundation Project, No. ZR2020KH011 (to XZW); Shandong Natural Science Foundation (General Project), No. ZR2020MH362 (to TGQ); National Famous Traditional Chinese Medicine Expert Inheritance Studio Construction Project, No. [2022]75 (to XZW)
CLC Number:
Cite this article
Yan Binghan, Li Zhichao, Su Hui, Xue Haipeng, Xu Zhanwang, Tan Guoqing. Regulating oxidative stress with natural products for treating osteoporosis[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(24): 3915-3921.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks

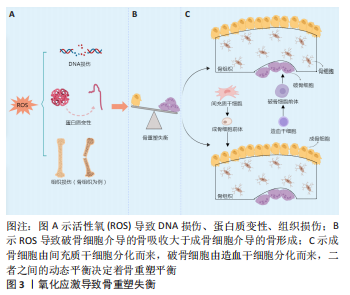
2.1 氧化应激与骨重塑 骨骼具有标准化的结构和功能,通常处于单一的恒定状态,其中成骨细胞和破骨细胞的动态平衡对于骨代谢的平衡至关重要[5]。氧化应激是指细胞内氧化还原平衡失调,导致细胞代谢产生过多的自由基和其他氧化活性物质,羟基自由基和超氧化物等自由基分子的损伤会引发连锁反应,诱发氧化应激,导致氧化损伤,如DNA损伤、蛋白质变性和组织损伤等[6]。氧化应激过程主要涉及的自由基包括活性氧和活性氮,以及其他氧化物的产生和清除两个方面,当细胞的抗氧化防御机制不能及时抵消氧化应激导致的氧化损伤时,一些细胞因子如肿瘤坏死因子α、白细胞介素6等可能被激活[7],此时,单细胞受到影响,随着氧化损伤的加重,整个生理系统都会受到影响。诸多信号通路如核因子红细胞2相关因子2(Nuclear factor-erythroid 2-related factor 2,Nrf2)/抗氧化反应元件、核转录因子κB、有丝分裂原活化蛋白激酶、腺苷酸活化蛋白激酶、细胞外信号调节激酶等也参与调控氧化应激相关基因的表达,从而参与氧化应激反应[8],另外,细胞的自噬能力也被认为可以对抗氧化应激[9]。氧化应激导致的细胞变化可以通过抑制或激活多种细胞途径来改变细胞功能,包括诱导炎症反应、干扰细胞分化、抑制重要的细胞功能以及引发线粒体启动的细胞死亡和凋亡等[10],最终导致疾病的发生,如心血管疾病、肿瘤、神经系统疾病、代谢性疾病等,其中骨质疏松症就是骨代谢疾病的一种,因此,防治氧化应激对于维护和促进人体健康具有重要意义。氧化应激对于成骨细胞和破骨细胞的生理功能具有重要的影响,在成骨细胞前体中,高水平的活性氧会激活属于叉头蛋白家族的FOXO(Forkhead box O)转录因子,使其与β-连环蛋白结合,从而增强抗氧化酶的转录,β-连环蛋白对于促进成骨细胞分化是必需的,这种作用会降低β-连环蛋白的可用性,从而抑制成骨细胞的生成,此外高水平的活性氧也会对成骨细胞的活性、活力以及增殖产生负面影响,引起成骨细胞数量减少以及功能的丧失,导致骨形成的减少[11-13]。活性氧诱导的成骨细胞和骨细胞的凋亡,有利于破骨细胞的生成并抑制矿化和成骨,此外,在破骨细胞前体细胞中,活性氧水平的升高可以通过激活核因子κB信号通路来促进破骨细胞的分化和活性,活性氧还会诱导炎症反应,增加破骨细胞的形成和活性,导致组织破坏和骨质流失[14-15]。氧化应激影响骨重塑的具体机制见图3。"

2.2 天然产物改善氧化应激状态治疗骨质疏松症 不断出现的证据将氧化应激与骨代谢过程相联系,这为通过改善氧化应激状态治疗骨质疏松症指明了道路。来源于自然界的动植物、矿物及其加工产品的天然产物具有结构新颖多样、活性良好且不良反应小的优点[16],除此之外,它们在抗氧化和抗炎作用方面作用显著[17],能够减轻氧化应激的损害,改善骨质疏松症的症状及预防骨折发生,随着天然产物的应用越来越广泛,多种天然化合物已经被筛选为改善氧化应激状态的有效调节剂,为骨质疏松症的治疗提供新思路和新途径。所以,此文介绍了天然产物在改善氧化应激状态方面的多种药理作用,并进一步总结了天然产物通过改善氧化应激在骨质疏松症中调控成骨细胞骨基质矿化、调控破骨细胞介导的骨吸收、调控骨相关细胞的增殖、分化、活性和凋亡方面所发挥的作用。 2.2.1 天然产物改善氧化应激调控成骨分化 间充质干细胞是一种多能细胞,能够自我更新和分化,是脂肪细胞和成骨细胞的共同祖细胞[18],骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是骨髓来源的间充质干细胞,在一定环境刺激下可以通过调控一系列基因表达、信号通路等相关分子机制转化为成骨细胞,参与骨组织再生和修复[19]。目前,一些天然产物的调节效应已经在体外和体内实验中被证实,HUANG等[20]通过建立氧化细胞损伤模型和小鼠卵巢切除骨质疏松症模型,报道了天然中草药天麻提取物天麻素的抗氧化和抗骨质疏松作用,他们通过体外细胞分子生物学实验发现天麻素可以促进氧化损伤状态下BMSCs的细胞增殖,并增加了成骨标志物,除此之外,天麻素还抑制了脂质的生成并减少了破骨细胞的数量;在体外实验中,他们发现卵巢切除小鼠的骨微结构在天麻素的干预下有所改善。这些结果表明天麻素对骨质疏松症具有保护作用,并与活性氧的减少有关。人脂肪来源的间充质干细胞同样具有成骨分化的潜能,柚皮苷是一种天然的抗氧化和抗炎化合物,可以有效保护人脂肪来源的间充质干细胞免受氧化损伤导致的成骨分化抑制。WANG等[21]发现,柚皮苷恢复了碱性磷酸酶活性以及钙含量,并提高Runt相关转录因子2和成骨细胞特异基因osterix的基因表达水平,其机制可能与Wnt信号通路有关。部分天然产物通过改善氧化应激有效促进了BMSCs成骨分化,从而使骨重塑的天平向成骨细胞介导的骨形成倾斜。 2.2.2 天然产物改善氧化应激调控成骨细胞骨基质矿化 成骨细胞在骨基质矿化中起着至关重要的作用,其产生骨基质蛋白,其中以Ⅰ型胶原蛋白为主,这些蛋白形成了骨基质,成骨细胞也可以通过在生成和分泌碱性磷酸酶的过程中调节骨基质钙和磷的水平来影响骨基质的矿化[22]。研究已经发现氧化应激对成骨细胞谱系的发育和功能有一定的负面影响,氧化应激可能通过抑制成骨细胞的胶原蛋白合成和骨基质矿化来影响成骨细胞功能。最近的研究发现了几种天然产物小分子多酚可以改善氧化应激状态,调控成骨细胞的骨基质矿化。银杏内酯B是银杏叶提取物的独特成分,通过抑制活性氧和炎症,对包括骨质疏松症在内的许多与衰老相关的退行性疾病发挥治疗作用[23]。LEE等[24]报道了银杏内酯B与衰老、卵巢切除以及糖皮质激素诱导的骨质疏松小鼠的相关性,其通过让3种小鼠模型口服银杏内酯B的方式证实了银杏内酯B可以改善骨质量和骨微结构,此外他们还通过体外实验的方式发现银杏内酯B处理的老年小鼠血清蛋白谱存在“返老还童”的现象,从细胞分子生物学角度发现了银杏内酯B通过降低活性氧促进衰老间充质干细胞的成骨,抑制衰老巨噬细胞的破骨分化,他们通过体内外实验最终证实了银杏内酯B的骨保护作用基于直接促进成骨细胞矿化。除此之外,银杏内酯B在抑制破骨细胞的骨吸收方面也有一定的作用。同样,阿魏酸是一种广泛存在于许多植物组织中的天然多酚,许多研究表明阿魏酸可以抑制磷脂酰肌醇3-激酶/蛋白激酶B通路以及活性氧的产生,具有抗氧化、抗炎等多种生物活性[25]。ZHOU等[26]通过建立细胞和糖皮质激素(地塞米松)引起的骨质疏松大鼠模型(地塞米松大鼠),在体内外探讨了阿魏酸的骨保护作用,骨保护素/核因子κB受体激活剂配体(receptor activator of nuclear factor κB ligand,RANKL)比值对于骨吸收和骨形成配对至关重要,并被用于骨重塑评价,他们的体内外实验均证实了阿魏酸可以增加骨保护素/RANKL比值,除此之外,他们还在体外实验发现阿魏酸可以促进成骨细胞增殖、提高碱性磷酸酶水平并促进矿化结节形成。同时,他们在体内实验观察阿魏酸对于地塞米松大鼠血清Runt相关转录因子2、Ⅰ型胶原蛋白、成骨细胞特异基因osterix、骨桥蛋白和骨钙素基因表达水平的改善以及骨微结构的变化,证实了阿魏酸具有骨保护作用。阿魏酸的这些骨保护作用的机制是通过脂蛋白受体相关蛋白5/糖原合酶激酶3B/细胞外信号调节激酶途径降低活性氧产生以此来预防氧化应激损伤,最终可以促进成骨细胞增殖,改善成骨细胞活性以保持骨量。异补骨脂素是中药补骨脂中提取的成分,与阿魏酸类似,异补骨脂素也可以改善Ⅰ型胶原蛋白、成骨细胞特异基因osterix、骨桥蛋白基因表达水平,但其抑制氧化应激的途径是通过靶向调节过氧化物酶增殖物激活受体γ/Wnt信号通路完成的[27]。CHEN等[28]也通过地塞米松大鼠模型研究了花青素的抗氧化应激作用,并发现花青素可以恢复成骨细胞的分化和矿化,这种骨保护作用是通过激活Nrf2通路完成的。石榴皮具有较好的抗氧化作用[29],SPILMONT等[30]通过建立卵巢切除大鼠模型,探讨了石榴皮提取物对骨质疏松症的影响机制,他们研究发现石榴皮提取物可以减轻氧化应激损伤,提高碱性磷酸酶活性和成骨标志物的转录水平,促进成骨细胞矿化。与之类似的,TAO等[31]通过铁超载卵巢切除大鼠模型研究发现水飞蓟宾同样可以增加成骨细胞的碱性磷酸酶分泌和矿化能力。 在衰老过程中,个体的整体代谢水平和骨组织的微循环系统都会下降,使得骨髓变得缺血,骨髓质血液供应减少,靠血液输送的氧气和营养物质的供应也随之减少,缺氧或低氧分压通过线粒体中的氧化磷酸化妨碍ATP的产生,但可以通过无氧糖酵解刺激ATP的产生;然而,这会导致活性氧产生增加。此外,缺氧环境还可以刺激细胞内的氧感受器,促进缺氧诱导因子1α的稳定和核转运,从而进一步促进活性氧的生成,导致成骨功能减弱[32]。淫羊藿苷是天然产物中药淫羊藿中提取的有效生物活性成分,由于其植物雌激素的特性,其抗骨质疏松的作用已被证实。MA等[33]从缺氧、氧化应激与骨质疏松症之间的关系着手,报道了淫羊藿苷在缺氧条件下对成骨细胞的影响,他们发现淫羊藿苷能降低体外缺氧条件下成骨细胞的氧化应激和凋亡,保持成骨细胞的生存能力和成骨潜能,使得Runt相关转录因子2、osterix基因表达水平升高,碱性磷酸酶活性增加,矿化结节形成。可以看到,一些天然产物能够调节成骨细胞的基质矿化,促进骨形成,这种调节作用具有重要的治疗意义,可以加快骨组织再生和修复的过程。 2.2.3 天然产物改善氧化应激调控破骨细胞介导的骨吸收 氧化应激是引起骨质疏松症的主要原因之一,过量的自由基和氧化物有利于破骨细胞的生成,导致骨吸收的增加。活性氧通过RANKL介导的RANKL激活NADPH氧化酶、肿瘤坏死因子受体相关因子6和Ras相关的C3肉毒杆菌毒素底物1,在破骨细胞发生和骨吸收中发挥重要作用。因此,寻找具有抗氧化作用的天然产物是一种改善骨吸收的治疗途径。 红景天苷,一种从传统中药红景天中提取的有效生物成分,被证实具有抗氧化的作用,ZHANG等[34]报道了红景天苷的抗氧化作用以及其对骨质疏松症的骨保护作用,他们从体外实验证实了红景天苷可以增加骨小梁,改善骨微结构;同时,又通过体内实验证实了在红景天苷的作用下,RANKL、白细胞介素6以及活性氧的产生被抑制,血清氧化应激标志物表达降低,这些结果表明了红景天苷骨保护作用的具体机制是通过抑制骨吸收介质的释放和骨形成细胞的氧化损伤来实现的。异荭草苷是中药荜茇、山楂中的有效活性成分,具有抗氧化、抗炎、抗肿瘤等多种生物活性[35-36],研究表明异荭草苷通过调节骨保护素/RANKL的比率来实现其抗骨吸收作用,具体地说,异荭草苷可以增加骨保护素的表达,同时抑制RANKL的表达,从而抑制破骨细胞的分化和骨吸收活性。Nrf2/抗氧化反应元件通路是一种重要的抗氧化途径,可以抵抗氧化应激过程中产生的自由基和氧化物,保护细胞免受氧化应激的损伤,研究发现,异荭草苷可以激活Nrf2/抗氧化反应元件通路,从而抑制氧化应激反应的发生[37]。天然橄榄油中的提取物橄榄苦苷,也是中国传统药材女贞子中的有效活性成分,动物实验发现同样可以通过提高骨保护素/RANKL的比率来缓解骨吸收[38]。GARCíA-VILLALBA等[39]在临床研究中也证实了橄榄苦苷调节氧化应激抗骨质疏松的作用。 Nrf2/Kelch样ECH相关蛋白1信号通路是一种重要的抗氧化途径,可以抵抗氧化应激引起的细胞损伤和减缓炎症反应[40]。中药仙茅提取物苔黑酚葡萄糖苷可以提高Nrf2的表达量并抑制Keap1的活性,从而激活Nrf2/Keap1信号通路,保护细胞免受氧化应激的损伤。自噬是一种重要的细胞代谢途径,可以通过降解细胞内的蛋白质和细胞器来获得营养物质和能量,然而,破骨细胞自噬的过程会导致活性氧生成和细胞凋亡,从而加速骨吸收过程[41]。研究发现,苔黑酚葡萄糖苷可以抑制破骨细胞的形成、分化和骨吸收活性来减轻骨丢失,其具体机制是通过激活Nrf2/Keap1和哺乳动物雷帕霉素靶蛋白信号通路,减轻氧化应激和破骨细胞自噬,从而起到改善骨质疏松症的作用[42]。除此之外,其他与氧化应激相关的信号通路也可以被天然产物改善,甘草酸是中药甘草中的有效生物活性成分。LI等[43]通过体外实验探讨了甘草酸对骨吸收的保护作用,他们发现甘草酸可以抑制RANKL诱导的破骨细胞形成,并可以通过抑制有丝分裂原活化蛋白激酶和核转录因子κB信号通路,激活腺苷酸活化蛋白激酶/Nrf2信号通路来上调抗氧化酶的活性,降低氧化应激。 除了天然植物药中的活性成分之外,天然植物源性的生物活性肽也被证实具有抗氧化作用。研究发现,小麦芽肽可以调控氧化应激水平,改善骨微结构,同时小麦芽肽可以调控骨保护素/RANKL/RANK/肿瘤坏死因子受体相关因子6通路,抑制成骨细胞分化特异性基因表达,从而抑制骨吸收,有效延缓氧化应激引起的骨质疏松症[44],可降低成骨细胞的活性,抑制骨吸收,并通过降低骨钙素水平,改善骨质疏松症。此外,来自水生动物的一种类胡萝卜素——虾青素作为一种天然的抗氧化剂,具有很大的潜力用于预防和治疗与氧化应激相关的疾病,包括骨质疏松症,GENG等[45]证实了虾青素可以通过抑制氧化应激,进而促进骨形成,抑制破骨细胞介导的骨吸收。由此可见,天然产物中的某些化合物和海洋生物中的某些成分都具有改善氧化应激及调节破骨细胞介导骨吸收的作用,这为探索和寻找抗氧化剂来治疗骨质疏松症提供了思路和方向。 2.2.4 天然产物改善氧化应激调控骨相关细胞的增殖、分化和活性 氧化应激可以通过多种途径对骨相关细胞的增殖、分化和活性产生负面影响,导致骨代谢异常和骨质流失。氧化应激可以抑制成骨细胞的增殖,导致成骨细胞的数量减少并降低骨基质的合成,从而影响骨强度和骨质量。此外,氧化应激还可以抑制BMSCs向成骨细胞分化的过程,同样可以导致成骨细胞数量减少和骨形成能力下降。活性氧诱导了成骨细胞的形成减少,这使得骨重塑失衡,促使破骨细胞生成并抑制矿化和成骨。白藜芦醇是一种非黄酮类的天然植物多酚,从中药藜芦根部分离而来,可以改善氧化应激调控骨成骨细胞以及破骨细胞的活性和增殖分化水平。FENG等[46]报道了白藜芦醇可以调控骨保护素/RANKL的比率,抑制破骨细胞的活性和形成,FoxO1是成骨细胞增殖和氧化还原平衡所需的唯一因子,他们还发现RES通过抑制磷脂酰肌醇3-激酶/蛋白激酶B信号通路靶向调节FoxO1转录活性,从而减轻氧化应激损伤并抑制破骨细胞生成。无独有偶,JIANG等[47]也报道了白藜芦醇对于改善氧化应激影响骨重塑平衡的相关作用,他们发现白藜芦醇可以通过激活沉默信息调节因子sirtuin1/FoxO1信号通路,增强机体对氧化损伤的抵抗能力,并促进成骨细胞的增殖、分化,抑制了氧化应激引起的细胞凋亡。除了白藜芦醇之外,鼠尾草酸以及女贞子也可以抑制破骨细胞的生成,鼠尾草酸是一种天然化合物,被广泛应用于中草药治疗中,研究表明,鼠尾草酸可以抑制破骨细胞前体产生的氧化应激,从而降低 RANKL 的信号通路。此外鼠尾草酸还可以通过激活Nrf2信号通路和抑制核转录因子κB、有丝分裂原活化蛋白激酶的活化来下调活化T细胞胞质核因子1和c-Fos,从而抑制破骨细胞的发生[48]。女贞子是一种传统中药材,其中含有多种有效成分,如橄榄苦苷酸和熊果酸等,研究表明,FLL水提取物可以通过调节沉默信息调节因子sirtuin6/核因子κB /组织蛋白酶 K信号通路抑制衰老小鼠的氧化应激损伤并抑制破骨细胞的生成[49]。 成骨细胞分化过程中的异常可能导致骨质疏松症,活性氧可以激活FoxO3a转录因子,拮抗Wnt信号,这是成骨细胞生成的重要刺激,同时,β-连环蛋白不仅是 FoxO3a 抗氧化应激的基本共激活因子,还是经典Wnt通路下游效应子T细胞因子的必要介质,有助于调节骨量[50]。麦冬素D是从中草药麦冬中分离得到的一种强效抗氧化药物,也被发现具有保护成骨细胞分化的作用,其机制是通过FoxO3a-β-连环蛋白信号通路降低氧化应激[51]。同样,中药丹参有效成分丹参酚被报道可以通过Wnt/FoxO3a 信号通路消除氧化应激对成骨细胞分化的抑制作用[52]。c-Jun 氨基末端激酶是3个特征明显的有丝分裂原活化蛋白激酶通路之一,它转导细胞外信号并调节细胞增殖、分化、迁移、凋亡等细胞活动,三七皂苷R1提取自传统中药三七。LI等[53]研究发现三七皂苷R1可以通过阻断c-Jun 氨基末端激酶信号通路减轻氧化应激损伤并恢复成骨细胞的成骨分化。 成骨细胞是骨生成过程中的关键细胞,其活性的改变会影响到骨形成的过程,成骨细胞活性增加可以促进骨基质的分泌和矿化,从而增加骨密度,对于预防和治疗骨质疏松症具有重要的作用。与此相反,成骨细胞活性下降,会导致骨基质的减少和骨微结构破坏,因此,成骨细胞活性的调节是骨质疏松症预防和治疗的必经之路。天然产物被广泛研究用于骨质疏松症的治疗,其中包括对成骨细胞活性的调节,人参皂苷Rb1是中草药人参中的生物活性成分,ZHU等[54]研究发现人参皂苷Rb1可以抑制氧化应激,逆转氧化应激环境下的成骨细胞活力和成骨细胞生长调节因子,但并未阐述其具体的抗氧化机制以及成骨细胞活性的保护机制。丹参酮ⅡA是一种从丹参中提取的中药,ZHU等[55]研究发现丹参酮ⅡA可以改善成骨细胞的活性,其具体机制是通过核转录因子κB信号通路减轻氧化应激来提高成骨细胞的活性。此外,一些食物也具有天然的抗氧化成分,能保护骨免受活性氧的侵害,番茄红素在细胞分子生物学、动物实验以及临床实验中被发现可以改善氧化应激,促进成骨细胞的功能活性[56],此外葡萄籽原花青素、石榴同样也被发现可以改善成骨细胞的活性[57-58],芒果中的天然多酚芒果苷也可以通过调节细胞外信号调节激酶5/Nrf2信号通路,保护成骨细胞免受氧化损伤[59]。许多天然产物被证明可通过调节氧化应激途径来保护成骨细胞的增殖、分化和活性,同时,也有部分天然产物可以抑制破骨细胞的增殖分化,这样使得骨形成的比例增加,起到抗骨质疏松的作用。 2.2.5 天然产物改善氧化应激调控骨相关细胞的凋亡 氧化应激是影响骨相关细胞生长与分化的重要因素,无论是成骨细胞、破骨细胞还是骨细胞,长期的氧化损伤都会导致它们的凋亡并导致骨重塑的失衡,天然产物具有多种药理活性,其中许多分子具有改善氧化应激、抗氧化和抗凋亡的潜力。在氧化应激下,自噬被认为对细胞死亡具有保护作用,WANG等[60]发现中药知母中的生物多酚知母皂苷可以抑制哺乳动物雷帕霉素靶蛋白/核因子κB信号通路激活自噬来减轻氧化应激和成骨细胞凋亡,起到改善骨代谢平衡以及抗骨质疏松的作用。与之类似的,白藜芦醇也是通过调节自噬来抑制细胞的凋亡,但白藜芦醇是通过激活腺苷酸活化蛋白激酶/c-Jun氨基末端激酶1通路以解离Beclin-1/Bcl-2复合物,是自噬恢复并抑制骨细胞的凋亡[61],与知母皂苷抑制自噬有所不同,白藜芦醇促进自噬,无疑的是,无论是自噬的促进还是抑制,其最终目的都是为了达到最佳的自噬水平,进而调节氧化应激、抑制细胞凋亡。这种相反的调节自噬机制提示适度的自噬水平是天然产物抗氧化应激的关键,但究竟何种水平的自噬才是最佳的自噬水平还值得进一步的研究。姜黄素是从姜黄中分离出来的天然抗氧化剂,DAI等[62]发现姜黄素显著提高蛋白激酶B和磷酸化糖原合成酶激酶3β的水平,并通过激活相关信号通路,改善氧化应激诱导的成骨细胞凋亡。 与大多数有抗氧化作用的天然产物一样,金银花、杜仲的主要活性成分绿原酸的抗氧化作用也与Nrf2相关通路密不可分,HAN等[63]发现了绿原酸可以通过Nrf2/血红素加氧酶1通路的激活来抵抗激素诱导的氧化损伤并保护成骨细胞防止其凋亡。此外,川芎乙醇提取物被发现可以通过抑制磷脂酰肌醇3-激酶/蛋白激酶B通路信号通路降低细胞活性氧水平,抑制成骨细胞凋亡,从而改善骨质疏松[64]。无论是抑制成骨细胞的凋亡亦或是抑制骨细胞的凋亡,这些天然产物都是通过某种途径改善氧化应激和抑制骨细胞的凋亡,促进骨相关细胞的生长和分化,从而恢复骨的代谢平衡。天然产物通过调节氧化应激治疗骨质疏松症的作用机制和调控关系以及天然小分子化合物的分子结构汇总见表1。"

| [1] CHANDRA A, RAJAWAT J. Skeletal Aging and Osteoporosis: Mechanisms and Therapeutics. Int J Mol Sci. 2021;22(7):3553. [2] SŁUPSKI W, JAWIEŃ P, NOWAK B. Botanicals in Postmenopausal Osteoporosis. Nutrients. 2021;13(5):1609. [3] THANGAVEL P, PUGA-OLGUÍN A, RODRÍGUEZ-LANDA JF, et al. Genistein as Potential Therapeutic Candidate for Menopausal Symptoms and Other Related Diseases. Molecules. 2019;24(21):3892. [4] MARTINIAKOVA M, BABIKOVA M, MONDOCKOVA V, et al. The Role of Macronutrients, Micronutrients and Flavonoid Polyphenols in the Prevention and Treatment of Osteoporosis. Nutrients. 2022;14(3):523. [5] SCHRÖDER K. NADPH oxidases in bone homeostasis and osteoporosis. Free Radic Biol Med. 2019;132:67-72. [6] RAHAL A, KUMAR A, SINGH V, et al. Oxidative stress, prooxidants, and antioxidants: the interplay. Biomed Res Int. 2014;2014:761264. [7] KIMBALL JS, JOHNSON JP, CARLSON DA. Oxidative Stress and Osteoporosis. J Bone Joint Surg Am. 2021;103(15):1451-1461. [8] LIANG Y, LI J, LIN Q, et al. Research Progress on Signaling Pathway-Associated Oxidative Stress in Endothelial Cells. Oxid Med Cell Longev. 2017;2017:7156941. [9] GALATI S, BONI C, GERRA MC, et al. Autophagy: A Player in response to Oxidative Stress and DNA Damage. Oxid Med Cell Longev. 2019;2019: 5692958. [10] BHATTI JS, BHATTI GK, REDDY PH. Mitochondrial dysfunction and oxidative stress in metabolic disorders - A step towards mitochondria based therapeutic strategies. Biochim Biophys Acta Mol Basis Dis. 2017; 1863(5):1066-1077. [11] AGIDIGBI TS, KIM C. Reactive Oxygen Species in Osteoclast Differentiation and Possible Pharmaceutical Targets of ROS-Mediated Osteoclast Diseases. Int J Mol Sci. 2019;20(14):3576. [12] IANTOMASI T, ROMAGNOLI C, PALMINI G, et al. Oxidative Stress and Inflammation in Osteoporosis: Molecular Mechanisms Involved and the Relationship with microRNAs. Int J Mol Sci. 2023;24(4):3772. [13] HUANG L, SU W, WU Z, et al. Glucosamine suppresses oxidative stress and induces protective autophagy in osteoblasts by blocking the ROS/Akt/mTOR signaling pathway. Cell Biol Int. 2022;46(5):829-839. [14] WANG X, CHEN B, SUN J, et al. Iron-induced oxidative stress stimulates osteoclast differentiation via NF-κB signaling pathway in mouse model. Metabolism. 2018;83:167-176. [15] MARCUCCI G, DOMAZETOVIC V, NEDIANI C, et al. Oxidative Stress and Natural Antioxidants in Osteoporosis: Novel Preventive and Therapeutic Approaches. Antioxidants(Basel). 2023;12(2):373. [16] LI YQ, ZHANG F, YU LP, et al. Targeting PINK1 Using Natural Products for the Treatment of Human Diseases. Biomed Res Int. 2021;2021:4045819. [17] BAGHERNIYA M, MAHDAVI A, SHOKRI-MASHHADI N, et al. The beneficial therapeutic effects of plant-derived natural products for the treatment of sarcopenia. J Cachexia Sarcopenia Muscle. 2022;13(6):2772-2790. [18] CHEN Q, SHOU P, ZHENG C, et al. Fate decision of mesenchymal stem cells: adipocytes or osteoblasts? Cell Death Differ. 2016;23(7):1128-1139. [19] RUDIANSYAH M, EL-SEHRAWY AA, AHMAD I, et al. Osteoporosis treatment by mesenchymal stromal/stem cells and their exosomes: Emphasis on signaling pathways and mechanisms. Life Sci. 2022;306:120717. [20] HUANG Q, SHI J, GAO B, et al. Gastrodin: an ancient Chinese herbal medicine as a source for anti-osteoporosis agents via reducing reactive oxygen species. Bone. 2015;73:132-144 [21] WANG L, ZHANG YG, WANG XM, et al. Naringin protects human adipose-derived mesenchymal stem cells against hydrogen peroxide-induced inhibition of osteogenic differentiation. Chem Biol Interact. 2015;242: 255-261. [22] VIMALRAJ S. Alkaline phosphatase: Structure, expression and its function in bone mineralization. Gene. 2020;754:144855. [23] ZUO W, YAN F, ZHANG B, et al. Advances in the Studies of Ginkgo Biloba Leaves Extract on Aging-Related Diseases. Aging Dis. 2017;8(6):812-826. [24] LEE CW, LIN HC, WANG BY, et al. Ginkgolide B monotherapy reverses osteoporosis by regulating oxidative stress-mediated bone homeostasis. Free Radic Biol Med. 2021;168:234-246. [25] LI D, RUI YX, GUO SD, et al. Ferulic acid: A review of its pharmacology, pharmacokinetics and derivatives. Life Sci. 2021;284:119921. [26] ZHOU W, CHEN B, SHANG J, et al. Ferulic acid attenuates osteoporosis induced by glucocorticoid through regulating the GSK-3β/Lrp-5/ERK signalling pathways. Physiol Int. 2021;108(3):317-341. [27] WANG J, WANG G, GONG L, et al. Isopsoralen regulates PPARγ/WNT to inhibit oxidative stress in osteoporosis. Mol Med Rep. 2018;17(1):1125-1131. [28] CHEN L, HU SL, XIE J, et al. Proanthocyanidins-Mediated Nrf2 Activation Ameliorates Glucocorticoid-Induced Oxidative Stress and Mitochondrial Dysfunction in Osteoblasts. Oxid Med Cell Longev. 2020;2020:9102012. [29] 郭璐,夏道宗,张晓熙,等.石榴皮多组分提取工艺优化及多体系抗氧化活性评价[J].中华中医药杂志,2019,34(9):4008-4012. [30] SPILMONT M, LÉOTOING L, DAVICCO MJ, et al. Pomegranate Peel Extract Prevents Bone Loss in a Preclinical Model of Osteoporosis and Stimulates Osteoblastic Differentiation in Vitro. Nutrients. 2015;7(11):9265-9284. [31] TAO ZS, LI TL, WEI S. Silymarin prevents iron overload induced bone loss by inhibiting oxidative stress in an ovariectomized animal model. Chem Biol Interact. 2022;366:110168. [32] MA Y, QIU S, ZHOU R. Osteoporosis in Patients With Respiratory Diseases. Front Physiol. 2022;13:939253. [33] MA HP, MA XN, GE BF, et al. Icariin attenuates hypoxia-induced oxidative stress and apoptosis in osteoblasts and preserves their osteogenic differentiation potential in vitro. Cell Prolif. 2014;47(6):527-539. [34] ZHANG JK, YANG L, MENG GL, et al. Protection by salidroside against bone loss via inhibition of oxidative stress and bone-resorbing mediators. PLoS One. 2013;8(2):e57251. [35] AN MF, WANG MY, SHEN C, et al. Isoorientin exerts a urate-lowering effect through inhibition of xanthine oxidase and regulation of the TLR4-NLRP3 inflammasome signaling pathway. J Nat Med. 2021;75(1):129-141. [36] FAN X, WEI W, HUANG J, et al. Isoorientin Attenuates Cisplatin-Induced Nephrotoxicity Through the Inhibition of Oxidative Stress and Apoptosis via Activating the SIRT1/SIRT6/Nrf-2 Pathway. Front Pharmacol. 2020; 11:264. [37] CAO Z, LIU W, BI B, et al. Isoorientin ameliorates osteoporosis and oxidative stress in postmenopausal rats. Pharm Biol. 2022;60(1):2219-2228. [38] LIU H, ZHAO A, HUANG Y, et al. Efficacy and Mechanisms of Oleuropein in Postmenopausal Osteoporosis. Comput Math Methods Med. 2022; 2022:9767113. [39] GARCÍA-VILLALBA R, LARROSA M, POSSEMIERS S, et al. Bioavailability of phenolics from an oleuropein-rich olive (Olea europaea) leaf extract and its acute effect on plasma antioxidant status: comparison between pre- and postmenopausal women. Eur J Nutr. 2014;53(4):1015-1027. [40] BELLEZZA I, GIAMBANCO I, MINELLI A, et al. Nrf2-Keap1 signaling in oxidative and reductive stress. Biochim Biophys Acta Mol Cell Res. 2018; 1865(5):721-733. [41] GUO YF, SU T, YANG M, et al. The role of autophagy in bone homeostasis. J Cell Physiol. 2021;236(6):4152-4173. [42] GONG W, LIU M, ZHANG Q, et al. Orcinol Glucoside Improves Senile Osteoporosis through Attenuating Oxidative Stress and Autophagy of Osteoclast via Activating Nrf2/Keap1 and mTOR Signaling Pathway. Oxid Med Cell Longev. 2022;2022:5410377. [43] LI Z, CHEN C, ZHU X, et al. Glycyrrhizin Suppresses RANKL-Induced Osteoclastogenesis and Oxidative Stress Through Inhibiting NF-κB and MAPK and Activating AMPK/Nrf2. Calcif Tissue Int. 2018;103(3):324-337. [44] WANG F, YANG G, LI Y, et al. A peptide from wheat germ abolishes the senile osteoporosis by regulating OPG/RANKL/RANK/TRAF6 signaling pathway. Phytomedicine. 2022;104:154304. [45] GENG Q, WANG S, HENG K, et al. Astaxanthin attenuates irradiation-induced osteoporosis in mice by inhibiting oxidative stress, osteocyte senescence, and SASP. Food Funct. 2022;13(22):11770-11779. [46] FENG YL, JIANG XT, MA FF, et al. Resveratrol prevents osteoporosis by upregulating FoxO1 transcriptional activity. Int J Mol Med. 2018;41(1): 202-212. [47] JIANG Y, LUO W, WANG B, et al. Resveratrol promotes osteogenesis via activating SIRT1/FoxO1 pathway in osteoporosis mice. Life Sci. 2020;246: 117422. [48] THUMMURI D, NAIDU VGM, CHAUDHARI P. Carnosic acid attenuates RANKL-induced oxidative stress and osteoclastogenesis via induction of Nrf2 and suppression of NF-κB and MAPK signalling. J Mol Med (Berl). 2017;95(10):1065-1076. [49] LI L, CHEN B, ZHU R, et al. Fructus Ligustri Lucidi preserves bone quality through the regulation of gut microbiota diversity, oxidative stress, TMAO and Sirt6 levels in aging mice. Aging (Albany NY). 2019;11(21):9348-9368. [50] IYER S, AMBROGINI E, BARTELL SM, et al. FOXOs attenuate bone formation by suppressing Wnt signaling. J Clin Invest. 2013;123(8):3409-3419. [51] HUANG Q, GAO B, WANG L, et al. Ophiopogonin D: A new herbal agent against osteoporosis. Bone. 2015;74:18-28. [52] YANG Y, SU Y, WANG D, et al. Tanshinol attenuates the deleterious effects of oxidative stress on osteoblastic differentiation via Wnt/FoxO3a signaling. Oxid Med Cell Longev. 2013;2013:351895. [53] LI X, LIN H, ZHANG X, et al. Notoginsenoside R1 attenuates oxidative stress-induced osteoblast dysfunction through JNK signalling pathway. J Cell Mol Med. 2021;25(24):11278-11289. [54] ZHU Y, HU C, ZHENG P, et al. Ginsenoside Rb1 alleviates aluminum chloride-induced rat osteoblasts dysfunction. Toxicology. 2016;368-369: 183-188. [55] ZHU S, WEI W, LIU Z, et al. TanshinoneIIA attenuates the deleterious effects of oxidative stress in osteoporosis through the NFκB signaling pathway. Mol Med Rep. 2018;17(5):6969-6976. [56] OLIVEIRA GR, VARGAS-SANCHEZ PK, FERNANDES RR, et al. Lycopene influences osteoblast functional activity and prevents femur bone loss in female rats submitted to an experimental model of osteoporosis. J Bone Miner Metab. 2019;37(4):658-667. [57] ZHANG Z, ZHENG L, ZHAO Z, et al. Grape seed proanthocyanidins inhibit H2O2-induced osteoblastic MC3T3-E1 cell apoptosis via ameliorating H2O2-induced mitochondrial dysfunction. J Toxicol Sci. 2014;39(5):803-813. [58] SPILMONT M, LÉOTOING L, DAVICCO MJ, et al. Pomegranate and its derivatives can improve bone health through decreased inflammation and oxidative stress in an animal model of postmenopausal osteoporosis. Eur J Nutr. 2014;53(5):1155-1164. [59] XIA G, LI X, ZHU X, et al. Mangiferin protects osteoblast against oxidative damage by modulation of ERK5/Nrf2 signaling. Biochem Biophys Res Commun. 2017;491(3):807-813. [60] WANG N, XU P, WU R, et al. Timosaponin BII improved osteoporosis caused by hyperglycemia through promoting autophagy of osteoblasts via suppressing the mTOR/NFκB signaling pathway. Free Radic Biol Med. 2021;171:112-123. [61] WEI L, CHAI S, YUE C, et al. Resveratrol protects osteocytes against oxidative stress in ovariectomized rats through AMPK/JNK1-dependent pathway leading to promotion of autophagy and inhibition of apoptosis. Cell Death Discov. 2023;9(1):16. [62] DAI P, MAO Y, SUN X, et al. Attenuation of Oxidative Stress-Induced Osteoblast Apoptosis by Curcumin is Associated with Preservation of Mitochondrial Functions and Increased Akt-GSK3β Signaling. Cell Physiol Biochem. 2017;41(2):661-677. [63] HAN D, GU X, GAO J, et al. Chlorogenic acid promotes the Nrf2/HO-1 anti-oxidative pathway by activating p21Waf1/Cip1 to resist dexamethasone-induced apoptosis in osteoblastic cells. Free Radic Biol Med. 2019;137:1-12. [64] DONG XL, YU WX, LI CM, et al. Chuanxiong (Rhizome of Ligusticum chuanxiong) Protects Ovariectomized Hyperlipidemic Rats from Bone Loss. Am J Chin Med. 2020;48(2):463-485. |
| [1] | Yang Yifeng, Ye Nan, Wang Lin, Guo Shuaicheng, Huang Jian. Signaling pathway of dexmedetomidine against ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1464-1469. |
| [2] | Guo Sutong, Feng Dehong, Guo Yu, Wang Ling, Ding Yujian, Liu Yi, Qian Zhengying, Li Mingyang. Construction and finite element analysis of normal and osteoporotic hip models [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1342-1346. |
| [3] | Yu Weijie, Liu Aifeng, Chen Jixin, Guo Tianci, Jia Yizhen, Feng Huichuan, Yang Jialin. Advantages and application strategies of machine learning in diagnosis and treatment of lumbar disc herniation [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1426-1435. |
| [4] | Lou Guo, Zhang Yan, Fu Changxi. Role of endothelial nitric oxide synthase in exercise preconditioning-induced improvement of myocardial ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1283-1288. |
| [5] | Lin Zeyu, Xu Lin. Research progress in gout-induced bone destruction mechanism [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1295-1300. |
| [6] | Zhang Xiaoyun, Liu Hua, Chai Yuan, Chen Feng, Zeng Hao, Gao Zhengang, Huang Yourong. Effect of Yishen Gushu Formula on bone metabolic markers and clinical efficacyn in patients with osteoporosis of kidney deficiency and blood stasis type [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1155-1160. |
| [7] | Dai Yuexing, Zheng Liqin, Wu Minhui, Li Zhihong, Li Shaobin, Zheng Desheng, Lin Ziling. Effect of vessel number on computational fluid dynamics in vascular networks [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1206-1210. |
| [8] | Pan Xiaolong, Fan Feiyan, Ying Chunmiao, Liu Feixiang, Zhang Yunke. Effect and mechanism of traditional Chinese medicine on inhibiting the aging of mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1091-1098. |
| [9] | Ma Shuwei, He Sheng, Han Bing, Zhang Liaoyun. Exosomes derived from mesenchymal stem cells in treatment of animals with acute liver failure: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1137-1142. |
| [10] | Zhang Min, Peng Jing, Zhang Qiang, Chen Dewang. Mechanical properties of L3/4 laminar decompression and intervertebral fusion in elderly osteoporosis patients analyzed by finite element method [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(6): 847-851. |
| [11] | Xue Xiaofeng, Wei Yongkang, Qiao Xiaohong, Du Yuyong, Niu Jianjun, Ren Lixin, Yang Huifeng, Zhang Zhimin, Guo Yuan, Chen Weiyi. Finite element analysis of osteoporosis in proximal femur after cannulated screw fixation for femoral neck fracture [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(6): 862-867. |
| [12] | Kaiyisaier•Abudukelimu, Maimaitimin•Abulimiti, Li Lei, Yang Xiaokai, Zhang Yukun, Liu Shuai. Effect of lumbar CT values in the diagnosis of osteoporosis in women patients with lumbar degenerative diseases [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(6): 945-949. |
| [13] | Wang Liping, Lian Tianxing, Hu Yongrong, Yang Hongsheng, Zeng Zhimou, Liu Hao, Qu Bo. HU value of chest CT vertebral body in the opportunistic screening of type 2 diabetes mellitus osteoporosis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(6): 950-954. |
| [14] | Zhang Kefan, Shi Hui. Research status and application prospect of cytokine therapy for osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(6): 961-967. |
| [15] | Li Jiaqi, Huang Yuanli, Li Yan, Wang Chunren, Han Qianqian. Mechanism and influencing factors in molecular weight degradation of non-cross-linked hyaluronic acid [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 747-752. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||