其他干细胞
-
图1|未损伤Nestin-tdT小鼠的鉴定
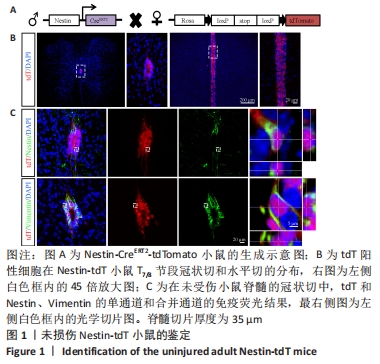
结果:为靶向室管膜细胞,使用Nestin-CreERT2小鼠与Rosa26-tdTomato(tdT)报告小鼠杂交,获得Nestin-CreERT2-tdTomato小鼠。在他莫昔芬诱导下,Nestin阳性细胞被红色荧光特异性标记。他莫昔芬不注射,红色荧光不表达(数据未显示)。为了确认室管膜细胞表达报告基因,观察了连续注射4 d他莫昔芬,清除7 d后小鼠tdT的表达情况,见图1。脊髓T8节段的冠状切与水平切显示,tdT阳性细胞主要分布在脊髓中央管的室管膜区域,染色结果显示tdT阳性细胞与室管膜相关的标记物中间丝Nestin和波形蛋白(Vimentin,Vim)共标,与以前的文献结果相似[14]。
图2|Nestin-tdT小鼠中tdT阳性细胞在脊髓损伤后的增殖情况

结果:为了研究Nestin-tdT小鼠在脊髓损伤后室管膜细胞对损伤的反应,首先观察了未损伤状态下的室管膜细胞,见图2。未损伤时tdT/BrdU双阳性的室管膜细胞只占tdT阳性细胞的(1.2±0.5)%。在脊髓损伤后,tdT阳性细胞在脊髓损伤后3 d内大量增殖,tdT/BrdU双阳性的细胞占tdT阳性细胞总数的(58.1±2.4)%,第3天比第1天,P < 0.05,7-14 d时增殖的室管膜细胞呈下降趋势,7 d时,tdT/BrdU双阳性细胞占tdT阳性细胞总数的百分比为(57.9±5.17)%,14 d时,tdT/BrdU双阳性细胞占比为(48.5±3.4)%,第7天比第3天,P > 0.05;第14天比第7天,P > 0.05。
图3|Nestin-tdT小鼠脊髓损伤后tdT阳性细胞向星形胶质细胞分化
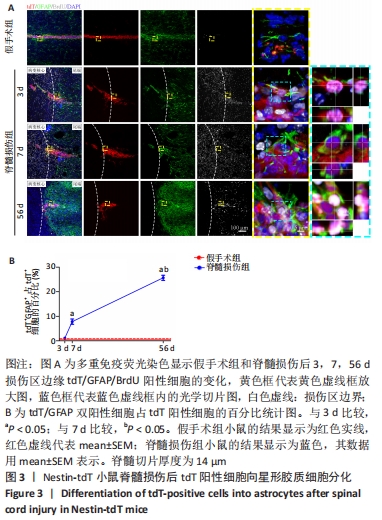
结果:为了观察脊髓损伤后室管膜细胞是否可以分化为星形胶质细胞以及它们的时空动态过程,利用免疫荧光染色的方式,GFAP/BrdU标记增殖的星形胶质细胞。未损伤时,靠近室管膜层的星形胶质细胞呈双极形态[15]。损伤边缘附近tdT/GFAP双阳性细胞最早在第3天出现,占比为(1.1±0.1)%,此时室管膜细胞开始离开中央管区域并向损伤部位增殖迁移,第7天时,星形胶质瘢痕边缘有许多长的GFAP阳性星形胶质细胞突起,这些突起相互交织和重叠成致密的网状结构[16],见图3,tdT/GFAP双阳性细胞占tdT阳性细胞总数的百分比为(7.8±1.1)%(第7天比第3天,P < 0.05)。在第56天时,有(25.7±1.0)%的室管膜细胞分化为了星形胶质细胞(第56天与第7天相比,P < 0.05)。
图4|Nestin-tdT小鼠脊髓损伤后28 d tdT阳性细胞向幼稚神经元分化
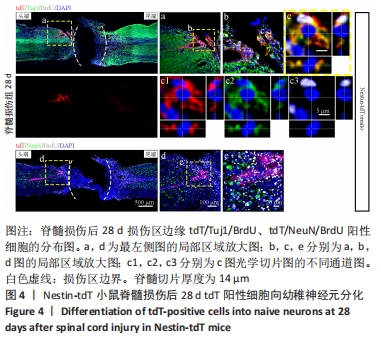
结果:观察Nestin阳性室管膜细胞在完全横断脊髓损伤后是否可以分化为神经元,借助未成熟神经元的标记物Tuj1和增殖细胞的标记物BrdU免疫荧光双标,判断新生神经元的形成。在未受伤的脊髓中,tdT阳性细胞不表达Tuj1。在脊髓损伤后第28天,病变区边缘出现tdT/Tuj1双阳性细胞,显示部分室管膜细胞分化为未成熟的神经元,见图4。
图6|Nestin-tdT和Foxj1-tdT小鼠脊髓损伤后56 d tdT阳性细胞的分化情况
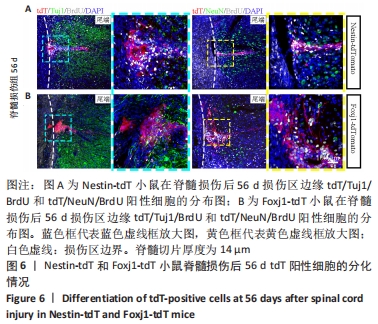
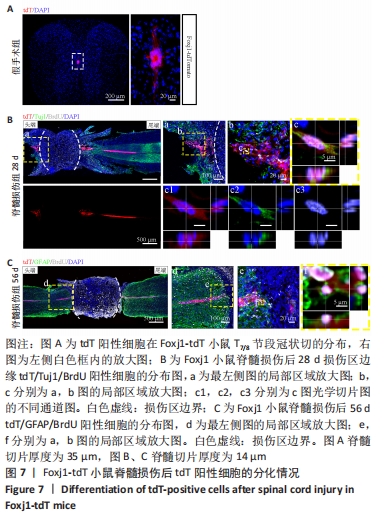
图7|Foxj1-tdT小鼠脊髓损伤后tdT阳性细胞的分化情况
在同一时间点,通过成熟神经元标记物NeuN的免疫荧光染色,判断室管膜细胞向成熟神经元的分化情况,结果显示:在脊髓损伤区及损伤周围并未观察到tdT阳性的室管膜细胞分化为成熟的神经元。在56 d时,在脊髓损伤区及损伤周围并未发现tdT阳性细胞与Tuj1或NeuN共表达,见图6A。
Nestin在室管膜细胞的背侧和腹侧表达,Foxj1可以标记几乎所有的室管膜细胞,所以使用了Foxj1-CreERT2-tdT小鼠。启动子Foxj1在室管膜细胞中特异性控制CreER表达,因此更适用于追踪成年小鼠脊髓损伤后室管膜细胞的分化命运[17]。Foxj1-tdT小鼠在手术前连续注射他莫昔芬4 d,以激活可诱导的Cre重组酶并启动报告基因的转录。在脊髓损伤后第28天,观察到在tdT阳性细胞中只有(3.2±0.3)%表达未成熟神经元的标记物Tuj1,见图5,图7(与Nestin-tdT小鼠脊髓损伤后28 d相比,P > 0.05)。在第56天时tdT/GFAP双阳性的星形胶质细胞占tdT阳性室管膜细胞的(12.3±1.0)%。免疫荧光结果显示:在脊髓损伤第56天时,tdT没有与Tuj1或NeuN共表达,见图6B。