1.1 设计 体外细胞功能检测及分子机制观察实验,多组间比较采用单因素方差分析,两组间比较采用非配对t检验。
1.2 时间及地点 实验于2019年11月至2020年12月在遵义医科大学医学基础药理教育部重点实验室完成。
1.3 材料
1.3.1 组织样本来源 收集遵义医科大学附属口腔医院就诊需拔除的废弃牙齿。所有供者对实验知情同意并签署知情同意书。
健康牙周膜组织来源来自年龄30-50岁健康牙周患者,无吸烟史,无家族疾病史,无感染及严重系统性疾病,口内余留牙齿20颗及以上。
炎症牙周膜组织来自年龄30-50岁牙周炎患者,牙周袋> 4 mm,附着丧失3.0-4.0 mm以上,无严重系统性疾病的患者。
实验方法已通过遵义医科大学附属口腔医院伦理委员会相关伦理审查(伦审[2021]1-244号)。
1.3.2 主要实验试剂 α-MEM培养基、DMEM培养基、胎牛血清(Gbico,美国);PBS、Ⅰ型胶原酶、青霉素链霉素混合液、0.25%胰蛋白酶、细胞冻存液、高效RIPA裂解液、1%甲苯胺蓝染液、BCA试剂盒、3%磷钨酸负染色液、地塞米松、β-甘油磷酸钠、维生素C、SDS-PAGE 凝胶快速制备试剂盒、40 g/L多聚甲醛组织细胞固定液、1%茜素红S染色液(Solarbio,中国);PKH26(Sigma,美国);CCK-8试剂盒(DOJINDO,日本);反转录试剂盒(Takara,日本);Ⅰ型胶原抗体、RUNX2抗体、碱性磷酸酶抗体、CD44抗体、CD73抗体、CD90抗体、CD105抗体、CD9、CD63、CD81、TSG101(Abcam,美国);外泌体-FBS(SBI,美国);ECL化学发光试剂盒、DiO (细胞膜绿色荧光探针)、DAPI染色液、碱性磷酸酶检测试剂盒(Beyotime,中国);碱性磷酸酶、Ⅰ型胶原、RUNX2引物(上海生工,中国)。
1.3.3 主要实验仪器 超净工作台(金净,中国);CO2恒温培养箱、高速冷冻离心机、全波长酶标仪、超微量分光光度计(Thermo Scientific,美国);超声清洗仪(易净,中国);制冰机(SANYO,日本);高压灭菌锅(HIRAYAMA,日本);水浴锅(力辰,中国);水浴恒温振荡器(智城,中国);倒置荧光显微镜(Olympus,日本);低速离心机(中佳,中国);透射电镜(Hitachi,日本);超低温冰箱(Haier,中国);凝胶成像系统、实时荧光定量PCR仪、PCR反转录仪(BIO-RAD,美国);纳米颗粒跟踪分析仪(Particle Metrix,德国);细胞计数仪(Count star,中国);流式细胞仪、高速低温离心机、超速冷冻离心机(Beckman,美国);电子分析天平(Sartorius,德国);纯水机(Millipore,法国)。
1.3.4 主要实验器材 6孔板、24孔板、96孔板、15 mL离心管、50 mL离心管、10 cm细胞培养皿、一次性移液管、EP管(Nest,美国);超速离心管(Beckman,美国);封口膜(PARAFILM,美国);T25细胞培养瓶、T75细胞培养瓶、细胞冻存管(CORNING,美国);移液器(Eppendorf,德国);移液器吸头(BKMAM,中国) ;细胞计数板(Count star,中国);PVDF膜(Solarbio,中国)。
1.4 实验方法
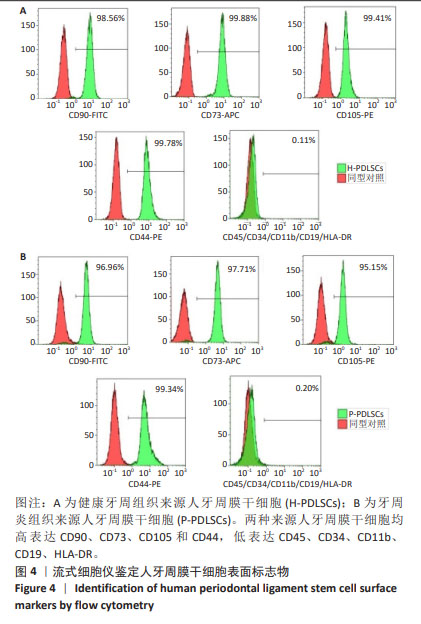
1.4.1 人牙周膜干细胞的分离培养与表型鉴定 收集到拔出牙齿后,冷冻保存于含3%双抗的α-MEM 培养基中,转运至实验室。用PBS反复冲洗至牙根表面洁净且无血液,在6孔板中使用手术刀片在牙根的中1/3区域刮取牙周膜组织,再次使用PBS冲洗致组织脱离牙根,转移至15 mL离心管中,37 ℃水浴摇床中使用Ⅰ型胶原酶消化1 h。完全培养基(含体积分数10%胎牛血清、3%双抗的α-MEM 培养基)终止消化,800 r/min离心5 min,弃上清,使用完全培养基重悬细胞,接种至T25培养瓶中,十字摇匀,得到健康牙周组织与牙周炎组织来源的人牙周膜干细胞,分别记为H-PDLSCs、P-PDLSCs。5 d后进行首次换液,此后每3 d常规换液1次。倒置荧光显微镜下见细胞融合至80%-85%进行 1∶2 传代。
流式细胞仪行细胞表面标志物鉴定:取第3代生长良好的人牙周膜干细胞,消化后800 r/min离心5 min,弃上清,用含体积分数3%胎牛血清的PBS重悬计数,调整细胞浓度至2.5×109 L-1。取200 µL细胞悬液加入EP管,分别加入荧光标记抗体CD44、CD73、CD90、CD105、CD45/CD34/CD11b/CD19/HLA-DR,4℃避光孵育30 min,用PBS清洗重悬,上流式细胞仪检测。

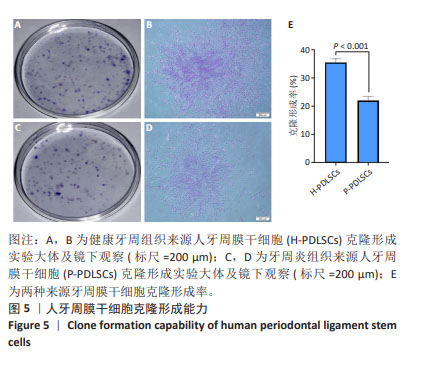
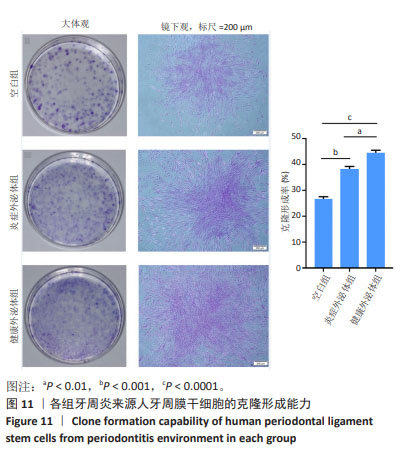
1.4.2 人牙周膜干细胞的克隆培养 当原代细胞融合达瓶底80%-85%时消化传代,使用完全培养基重悬细胞,采用有限稀释法进行培养:调整细胞数至5-10个/mL,96孔板每孔接种200 µL单细胞悬液。第2天挑选仅存在1个细胞的孔,每3 d换液1次。当细胞融合达孔底1/2-2/3时消化传代。选取生长状态良好的第2代细胞,调整细胞密度至800个/皿,接种于10 cm培养皿。每3 d常规换1次液,12 d后弃培养基,用PBS清洗2次,0.1%甲苯胺蓝染色1.0-2.0 h,显微镜下观察染色结果,室温干燥后计算克隆形成率。
1.4.3 人牙周膜干细胞来源外泌体的提取及鉴定
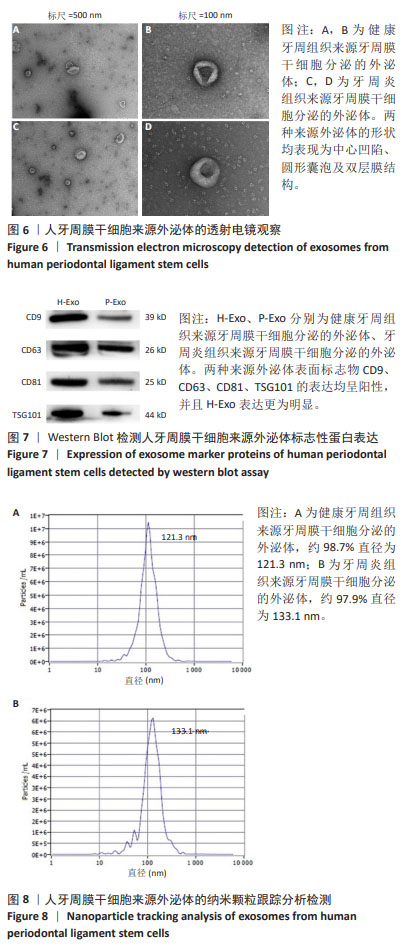
外泌体的提取:选取生长状态良好的第3代H-PDLSCs、P-PDLSCs,分别接种于T75培养瓶。当细胞融合达瓶底80%-90%时用PBS冲洗3次,使用无外泌体培养基继续培养48 h,收集上清液,在4 ℃环境下300×g离心5 min、2 000×g离心5 min,收集上清液,104×g离心30 min,收集上清液,用0.22 μm滤器过滤后置入专用超速离心管,105×g离心90 min,弃上清液,保留沉淀;将过滤后的PBS装满离心管,105×g离心90 min,去上清液,取100 μL过滤后的PBS加至外泌体中,于-80 ℃冰箱冻存,得到H-PDLSCs、P-PDLSCs分泌的外泌体,分别记为H-Exo、P-Exo。
外泌体浓度测定:按照BCA试剂盒说明书,将标准品10 μL加入96孔板中,设置3个复孔,制作标准曲线;同时将外泌体样品10 μL加入96孔板中,设置3个复孔,再加入200 μL显色工作液,37 ℃孵育30 min。选择波长562 nm,使用酶标仪检测各孔吸光度值,绘制曲线计算外泌体质量浓度。后续实验外泌体质量浓度为50 μg/mL。
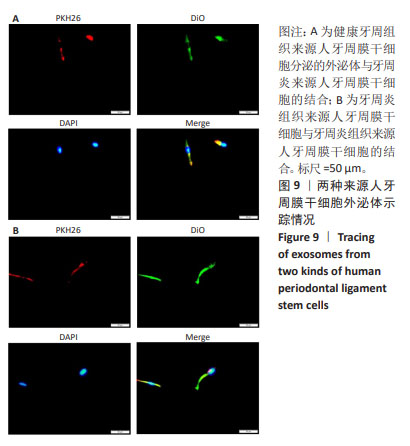
外泌体的鉴定:①透射电镜观察:将样品充分混匀,吸取20 μL样品滴至铜网上沉淀3 min,吸干多余液体,滴20 μL磷钨酸于铜网上负染3 min,吸干多余液体,常温干燥,透射电镜检测成像。②特异性蛋白鉴定:在样品中加入RIPA缓冲液充分混匀,冰上裂解30 min;在4 ℃环境下12 000 r/min离心10 min,收集上清液,进行10%SDS聚丙烯酰胺凝胶电泳,转移至聚偏二氟乙烯膜上,室温下用5%脱脂乳封闭2 h,用TBST清洗3次,加入稀释后的一抗(CD9,稀释比1∶1 000;CD63,稀释比1∶2000;CD81,稀释比1∶1 000;TSG101,稀释比1∶1 000)4 ℃孵育过夜,用TBST清洗3次,在室温下与稀释后的二抗(1∶5 000)孵育1 h,用TBST清洗3次,吸干水分后进行Western Blot检测。③纳米颗粒追踪分析:用超纯水将外泌体混悬液稀释1 000倍,用标准品进行仪器性能测试合格后,再取200 μL外泌体,用Particle Metrix纳米颗粒跟踪分析仪测量外泌体的粒径。
1.4.4 人牙周膜干细胞来源外泌体示踪实验 首先取200 μL的P-Exo及H-Exo分别加入2 mL稀释液C中;另将16 μL PKH26加入4 mL稀释液C中混匀,配置PKH26染色工作液;然后将等量的外泌体分别加入染色工作液中避光孵育5 min;转移至超速离心管中,4 ℃环境下105×g离心1 h,去上清,使用无外泌体α-MEM重悬外泌体后分别与第3代P-PDLSCs共培养24 h;用PBS冲洗2次,加入DiO染液染色15 min,用PBS冲洗2次;加入DAPI染液染色5 min,用PBS冲洗2次,显微镜下观察。
1.4.5 人牙周膜干细胞来源外泌体对P-PDLSCs生物学特性的影响
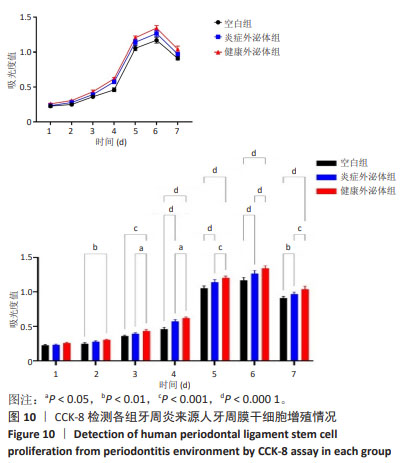
(1)对P-PDLSCs增殖的影响:选取生长状态良好的第3代P-PDLSCs接种于96孔板内,细胞密度为1×104/孔,分3组培养,空白组正常培养(不加入外泌体),健康外泌体组与炎症外泌体组分别加入50 μg/mL的H-Exo、P-Exo,每组5个重复孔。于设定的培养时间点取出孔板,用PBS冲洗2次,每孔加入100 μL CCK-8试剂反应2.5 h,使用酶标仪选择波长450 nm检测吸光度值。
(2)对P-PDLSCs克隆形成的影响:选取生长状态良好的第2代P-PDLSCs接种于10 cm培养皿,细胞密度为1 000个/皿,实验分组与处理同(1)。培养12 d后,观察细胞集落形成。
(3)对P-PDLSCs成骨能力的影响:
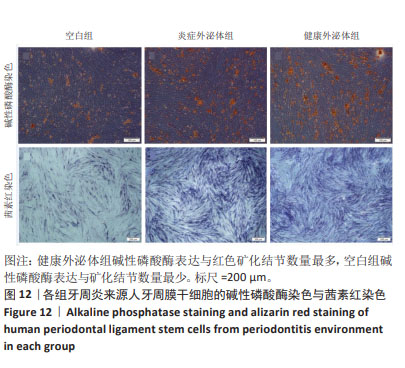
碱性磷酸酶染色:选取生长状态良好的第3代P-PDLSCs接种于24孔板内,细胞密度为1×105/孔,当细胞融合达80%左右时分3组培养,空白组更换为500 µL成骨诱导液(含体积分数5%无外泌体胎牛血清、1%双抗+100 nmol/L地塞米松+10 mmol/L β-甘油磷酸钠+0.05 mmol/L维生素C的DMEM培养基),健康外泌体组与炎症外泌体组分别更换为含50 μg/mL H-Exo、P-Exo的成骨诱导液。诱导培养7 d后,取出孔板,用PBS冲洗3次,多聚甲醛固定30 min,用PBS冲洗3次;加入碱性磷酸酶染色试剂染色30 min,用PBS冲洗3次,显微镜下观察细胞染色情况。
茜素红染色:选取生长状态良好的第3代P-PDLSCs接种于24孔板内,细胞密度为1×105/孔,实验分组及处理同“碱性磷酸酶染色”。诱导培养21 d后,取出孔板,用PBS冲洗3次,多聚甲醛固定30 min,用PBS冲洗3次,吸干水分,加入茜素红染液染色5 min,用PBS冲洗3次,显微镜下分析红色矿化结节形成。
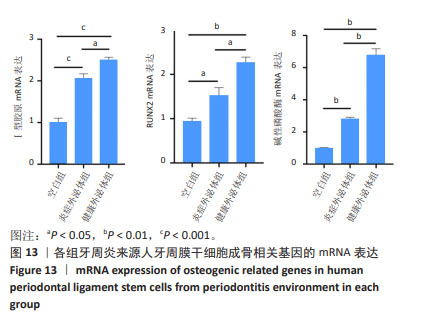
成骨相关基因mRNA表达检测:选取生长状态良好的第3代P-PDLSCs接种于6孔板内,细胞密度为2×105/孔,当细胞融合达80%左右时分3组培养,分组处理同“碱性磷酸酶染色”,成骨诱导液的体积为2 mL。诱导培养7 d后,用Trizol法提取细胞总 RNA,测定RNA浓度和纯度,合成为cDNA,进行RT-PCR反应。引物序列信息见表1。

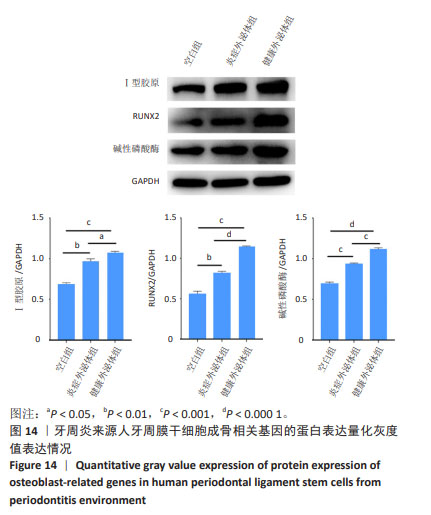
成骨相关基因蛋白表达检测:选取生长状态良好的第3代P-PDLSCs接种于T25培养瓶内,细胞密度为2×105/瓶,当细胞融合达80%左右时3组培养,分组处理同“碱性磷酸酶染色”,成骨诱导液的体积为4 mL。诱导培养7 d后,检测Ⅰ型胶原、RUNX2、碱性磷酸酶蛋白的表达,其中一抗稀释比例为1∶1 000,二抗稀释比例为1∶5 000,检测方法同1.4.3。
1.5 主要观察指标 两种来源外泌体对P-PDLSCs增殖、克隆形成及成骨分化的影响。
1.6 统计学分析 使用SPSS 18.0软件进行统计分析,所有实验均进行3次或3次以上的独立重复实验,每次最少设置3组平行实验。实验数据结果采用x±s表示,两两比较采用非配对t检验,两者以上比较采用单因素方差分析,当P < 0.05时差异有显著性意义。该文统计学方法已经遵义医科大学生物统计学专家审核。
中国组织工程研究杂志出版内容重点:干细胞;骨髓干细胞;造血干细胞;脂肪干细胞;肿瘤干细胞;胚胎干细胞;脐带脐血干细胞;干细胞诱导;干细胞分化;组织工程