Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (22): 4813-4822.doi: 10.12307/2025.450
Previous Articles Next Articles
Relationship between biological mechanism of selenium and selenium nanoparticles and common oral diseases
Peng Luyao1, Gu Yu1, 2
- 1Zhuhai Campus of Zunyi Medical University, Zhuhai 519041, Guangdong Province, China; 2Guizhou Provincial University Key Laboratory of Oral Disease Research, Zunyi 563000, Guizhou Province, China
-
Received:2024-04-07Accepted:2024-06-11Online:2025-08-08Published:2024-12-06 -
Contact:Gu Yu, Master, Associate professor, Zhuhai Campus of Zunyi Medical University, Zhuhai 519041, Guangdong Province, China; Guizhou Provincial University Key Laboratory of Oral Disease Research, Zunyi 563000, Guizhou Province, China -
About author:Peng Luyao, Zhuhai Campus of Zunyi Medical University, Zhuhai 519041, Guangdong Province, China -
Supported by:Local Universties, Provincial University Students Innovation and Entrepreneurship Training Program, No. S202310661302X (to PLY)
CLC Number:
Cite this article
Peng Luyao, Gu Yu. Relationship between biological mechanism of selenium and selenium nanoparticles and common oral diseases[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(22): 4813-4822.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
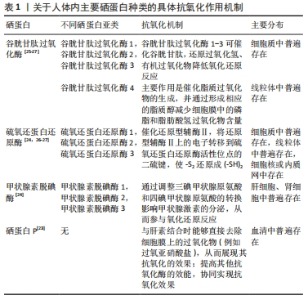
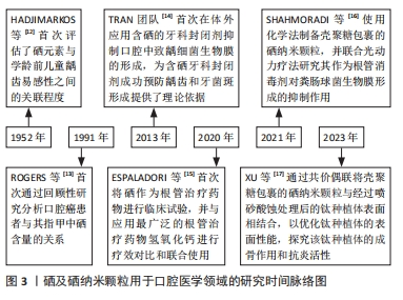
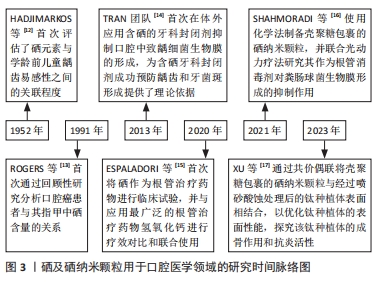
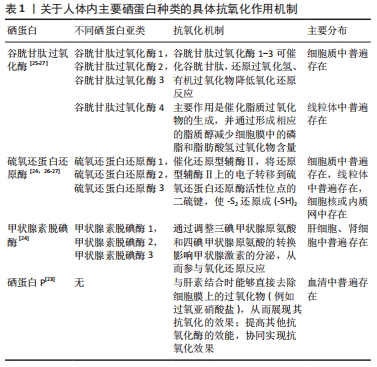
2.2 硒纳米颗粒的合成制备方法 目前工业、生物医学等领域合成硒纳米颗粒的方法主要通过化学法、物理法和生物法3种方法进行制备。根据合成方法及制备过程中所使用原料和/或引发条件的不同,合成的硒纳米颗粒大小也有一定差异,范围可从1-1 000 nm不等(通常为5- 350 nm)。 2.2.1 化学合成法 化学还原是制备硒纳米颗粒使用最多、最广泛的一种方法[18],一般使用亚硒酸钠与还原剂发生氧化还原反应进行制备,常用的还原剂有抗坏血酸、维生素C、谷胱甘肽等,但生成的橙红色硒纳米物质极不稳定,需要使用高分子聚合物、糖类、蛋白质等物质对其进行表面修饰[19]。壳聚糖具备多种活性基团、良好的生物相容性、生物易降解性等特点且不产生免疫原性和毒性,因此被常规用作修饰硒纳米颗粒表面的稳定剂[20]。提高硒纳米颗粒稳定性的方法一般主要有2种途径:首先,尽可能选择合适的还原剂分散纳米硒,避免其聚集成团簇;其次,使用性能较好的稳定剂对纳米硒进行表面修饰。TANG等[21]使用硒多糖作为稳定剂,构建亚硒酸钠和抗坏血酸的氧化还原体系,成功合成了直径为92.5 nm的球形硒多糖-硒纳米颗粒,该纳米粒子能在各种离子强度、酸碱度及低温下保持良好的稳定性。 2.2.2 物理合成法 激光烧蚀、微波照射、γ射线辐射、超声场等是制备硒纳米颗粒常用的物理合成技术[22]。其中脉冲激光烧蚀法是最常使用的方法[20],可通过激光照射硒结晶体沉淀一段时间后,经过烧蚀后的结晶体可直接形成硒胶体溶液[1]。物理合成法制备硒纳米颗粒较为简单,并且硒纳米颗粒的稳定性即便在不加入稳定剂的情况下也能够得到保证,同时粒子直径大小可通过调节波长、频率、温度、pH值、时间等方式来决定[18]。此外,为了加快硒纳米颗粒的制备速度、效率并提高其数量和质量,物理合成法常用作加快化学合成法和生物合成法制备硒纳米颗粒的辅助方法,如使用γ射线照射制备硒纳米颗粒的真菌,可诱导真菌发生基因突变,从而使硒纳米颗粒的产量增加[19]。但由于物理法制备硒纳米颗粒的设备参数设置较为困难、费用高等原因,不适用于大规模生产,以至于在实际生产中尚未得到广泛应用。 2.2.3 生物合成法 随着绿色环保意识和可持续发展理念的不断提高,人们对化学合成法和物理合成法所带来的环境污染及生物安全性等问题日渐重视,因此越来越多的研究人员开始关注使用生物合成法制备硒纳米颗粒。生物合成以细菌、真菌、植物等自然生物为载体,降低了制备成本和生物毒性,简化了制备工艺的复杂性,并且提高了硒纳米颗粒的合成效率和生物相容性。ZAMBONINO等[22]使用耐甲氧西林金黄色葡萄球菌、铜绿假单胞菌等细菌合成了直径为90-150 nm的球形硒纳米颗粒,并对其进行抗菌能力测试,发现由某种特定细菌制备的硒纳米颗粒能够对同一种类的细菌发挥更强的抑菌作用。 2.3 硒及纳米硒的生物学活性机制 2.3.1 抗炎、抗氧化机制 炎症反应是机体在遭受外部机械、化学或生物等有害刺激时所展现的一种保护性反应,但在防御过程中产生的大量氧自由基及过氧化物等活性氧物质会造成核酸、蛋白质、脂质等大分子物质损伤,并不断刺激组织细胞的氧化应激状态,从而形成循环加重的炎症反应,最终出现临床症状。机体清除活性氧物质的途径有2条:一是非酶促抗氧化系统,包括各种水溶性和脂溶性的抗氧化剂;二是酶促抗氧化系统,包括超氧化物歧化酶、谷胱甘肽过氧化酶、硫氧还蛋白还原酶等[19]。硒参与人体中的抗氧化机制主要是:①以硒蛋白的方式参与抗氧化酶系统的生成过程。目前发现,至少存在25种硒蛋白与氧化还原反应、炎症抑制有 关[23-24],其中以谷胱甘肽过氧化酶、硫氧还蛋白还原酶、甲状腺素脱碘酶、硒蛋白P的研究最多。各型硒蛋白存在不同亚类,不同亚类硒蛋白的抗氧化机制也有所差异,具体机制见表1。特别是硒代半胱氨酸是谷胱甘肽过氧化酶的活性中心,即硒代半胱氨酸的含量和活性即可反映谷胱甘肽过氧化酶活性氧的清除能力[28]。②调控与炎症有关的信号传递途径,例如核因子κB通路、促分裂素原活化蛋白激酶通路等。研究发现机体内硒的含量能够直接影响核因子κB通路的激活。有学者在探究亚硒酸钠对肺癌细胞影响的实验中发现,经过亚硒酸钠处理后的细胞核因子κB的磷酸化水平降低,与之相关的通路蛋白p-核因子κB、p-IkB-α的水平明显下降[29]。同时,硒的补充能够有效减少丙二醛、肿瘤坏死因子α和白细胞介素1β等促炎因子的表达[30]。郭咏梅及其团队[31]在利用脂多糖诱导的奶牛乳腺上皮细胞模型中发现,硒保护组的谷胱甘肽过氧化酶1和硫氧还蛋白还原酶1等抗氧化酶表达均有所增加,细胞凋亡信号激酶1、白细胞介素1、白细胞介素6、肿瘤坏死因子α等炎症相关因子以及诱导型一氧化氮合酶基因、p38丝裂原活化蛋白激酶等与丝裂原活化蛋白激酶通路有关的上游激动剂、下游细胞因子的表达和活化都呈现下降趋势,证明硒能够通过调整丝裂原活化蛋白激酶通路来影响炎症反应。③有助于调节单核细胞与内皮细胞之间的黏附,并推动巨噬细胞的移动和转移。L-选择素具有调控单核细胞附着血管内皮细胞并进一步转化为巨噬细胞的能力,而硒则能触发L-选择素脱落酶的生成,进而促进可溶性L-选择素的形成,这有助于减少大量白细胞在炎症区域的聚集,从而降低炎症区域的应激反应[25]。有学者分离健康供者的单核细胞,观察这些细胞在补充硒前后L-选择素和可溶性L-选择素的表达[32],并模拟血液流动的环境进行体外细胞黏附测定,结果表明:硒处理后的单核细胞可溶性L-选择素增加,向炎症区域移动的单核细胞数量平均值及黏附性均显著降低。该团队在随后的实验中进一步证实,硒以膜结合方式诱导L-选择素脱落酶金属蛋白酶17/肿瘤坏死因子α转换酶活性增加,以此减少白细胞的大量堆集。④通过调控基因的表观遗传,即抑制巨噬细胞组蛋白和炎症敏感因子的乙酰化来控制炎症。NARAYAN等[33]构建脂多糖诱导的RAW246.7细胞模型,探究亚硒酸盐通过影响表观遗传在炎症调节中的作用,结果发现:补充亚硒酸盐后可降低原代RAW246.7细胞和永生RAW246.7细胞中环氧化酶2、肿瘤坏死因子启动子K12和K16位点处组蛋白H4乙酰化水平以及核因子(κB因子) p65亚基的乙酰化水平,以上结果表明,硒可通过抑制巨噬细胞组蛋白和氧化还原敏感转录因子的乙酰化来控制炎症。"

2.3.2 抗菌机制 硒及硒纳米颗粒在抗菌方面的优越性使其成为近十年最热门的新型抗菌材料之一。研究发现硒纳米颗粒的抗菌作用与纳米颗粒的直径有直接联系,但纳米颗粒直径又受合成方法和制备环境等各种因素的影响,一般直径范围为5-350 nm。有报道指出纳米颗粒的直径越小其相对表面积越大,易于与周围环境发生物质交换,同时更利于渗透细菌细胞膜。因此,可认为当硒纳米颗粒的形态、化学成分、Zeta电位等因素相同时,其直径越小抗菌性能越好,并且具有浓度依赖性[3,34-36]。硒纳米颗粒主要通过4种机制产生抗菌作用(图4),具体为:①减少细菌生物膜的形成。细菌存在的方式主要有浮游形态和生物膜2类。目前常用的抗菌药物主要为广谱抗菌药和酶抑制剂,这些药物在杀灭革兰阳性菌方面仍具有一定疗效,但对于革兰阴性菌及耐甲氧西林金黄色葡萄球菌等超级细菌却难以奏效。当细菌以生物膜的形式存在时,它们对抗生素的抵抗力和耐药性都会得到增强。硒纳米颗粒具有显著的抑菌作用,能够阻止金黄色葡萄球菌、铜绿假单胞菌、粪肠球菌、大肠杆菌、伤寒沙门氏菌和肠炎链球菌等多种细菌生物膜的生成[35]。当使用硒纳米颗粒与抗生素三联ATB(包括氨苄西林、苯唑西林和青霉素)治疗时,其对耐甲氧西林金黄色葡萄球菌形成生物膜的抑制效果可高达(94±4)%[35]。另一项研究表明,尽管硒纳米颗粒在Se-NEMO-S6和Bio Se-NEMO-S24(Bio Se-NEMO-S是微生物合成的嵌入有机材料 Bio Se-NEMO-S中的球形硒纳米结构)抑制细菌生物膜形成的最小浓度下,也能够完全阻止金黄色葡萄球菌生物膜和铜绿假单胞菌生物膜的生长[37] 。②介导抗菌光动力疗法,释放大量活性氧物质导致细菌进入氧化应激状态。硒纳米颗粒具有光敏性,在特定波长和氧气存在下会发生一系列光化学反应,导致大量活性氧的产生杀灭细菌,以起到抗菌作用[16],同时硒纳米颗粒可释放硒氧离子进入细菌内部,与蛋白质和酶的-SH、-NH或-COOH等官能团相互作用使其失活,以此阻断细菌ATP形成、DNA复制、蛋白质及脂质合成等过程,最后使细菌丧失活性[36]。③形成静电排斥压力,直接作用并破坏细胞膜。硒纳米颗粒表面高纯度的Zeta电位对表面带有同样负电荷的革兰阴性菌有着极强的排斥力,这种强烈的压力能直接损害细菌细胞膜,使其破裂致内容物流出,从而引发细菌死亡。鉴于革兰阳性菌的肽聚糖层是革兰阴性菌的2-8倍,所以硒纳米颗粒对革兰阳性菌的抑制能力相对较弱[34-36]。④减少细菌的黏附、定植。有学者在体外利用羟基磷灰石制备获得性薄膜,以模拟口腔内牙齿表面环境,探究不同浓度硒对变异链球菌黏附功能的影响,发现硒能够影响黏附素表面蛋白P1(非蔗糖依赖性途径)和合成水不溶性葡聚糖的关键酶——葡萄糖基转移酶(蔗糖依赖性黏附途径)以及抗氧化相关酶类的活性,从而降低变异链球菌对羟基磷灰石的黏附能力[38]。 2.3.3 免疫调节机制 硒对免疫调节的作用在非特异性免疫和特异性免疫两方面均有所体现,其中对非特异性免疫的调控主要通过介导氧化炎症反应进行,在非特异免疫方面主要包括:①通过硒酶影响细胞趋化因子,减少对下游细胞的趋化作用,以阻止炎症的进一步发展。例如:谷胱甘肽过氧化酶和硫氧还蛋白还原酶能够抑制催化花生四烯酸合成白三烯B4的前体物质5-脂肪氧化酶和15-脂肪氧化酶的活性[24],以降低白三烯B4引发的中性粒细胞进入炎症区域的可能性。②通过谷胱甘肽氧化酶控制吞噬细胞的氧化应激状态,调节免疫。当机体发生全身炎症反应综合征时,会出现不断放大、持续并具有自我破坏且不受控制的炎症反应,此时会产生大量活性氧刺激谷胱甘肽过氧化酶4的过表达。研究发现,过度表达的过氧化酶4能够影响IκB 与核因子κB 复合物的解离,从而抑制核因子的激活以及核易位,降低促炎信号的转录并下调环氧化酶2及白三烯B4等炎性物质的表达[27,39]。③通过诱导巨噬细胞促炎表型(M1)向抗炎表型(M2)进行转化。NELSON等[40]以小鼠骨髓源性巨噬细胞为原料,研究硒水平对白细胞介素4 诱导的骨髓源性巨噬细胞标志物表达的影响,结果显示:与未补充硒的对照组比较,补充硒的实验组小鼠巨噬细胞抗炎表型标志物精氨酸酶1、抵抗素样分子α和甘露糖受体1 的表达均增加,同时巨噬细胞促炎表型标记物肿瘤坏死因子α和白细胞介素1β的表达量明显下降,并且硒与白细胞介素4还具有促进巨噬细胞向抗炎表型转化的协同作用,表明硒可以通过诱导巨噬细胞表型的转变降低炎症反应。此外,硒对免疫细胞表型的调控能力与硒的有效浓度密切相关。超生理浓度补充硒不一定能刺激巨噬细胞向促炎表型转化。根据以上实验结果推测,硒对免疫细胞表型的调控能力具有浓度依赖性,并且该有效浓度范围可能在100-250 nmol/L之间。 硒在特异性免疫方面的作用主要包括:①细胞免疫:硒蛋白与T细胞受体结合能够诱导钙离子通道的增量并刺激T细胞的增殖、分化、代谢等过程,以调节细胞免疫。硒蛋白K作为免疫细胞最具特征性的硒蛋白,其表达量与硒的摄入量呈正比,硒蛋白K能与内质网膜上的DHHC6酶结合进行棕榈酰化[41],避免被酰化水解,还可促进内质网钙通道蛋白肌醇1,4,5三磷酸受体的表达,从而提高钙通道的开放以及T细胞在细胞免疫调节中的表达。②体液免疫:在特异性免疫系统中,硒的添加能够增强T细胞的增殖分化能力,产生更多的 CD4+ T细胞,CD4+ T细胞分泌白细胞介素2等细胞因子又可以进一步增强B淋巴细胞的活性[41-42]。此外有相关研究证实,无论是以无机硒(如:亚硒酸钠)还是以有机硒(如:硒化党参多糖)的形式补充硒元素,均能够显著增加血清中免疫球蛋白IgA、IgG和IgM的含量[43-44]。 2.3.4 抗肿瘤机制 硒对肿瘤的治疗作用在20世纪60年代一经报道后就迅速成为各界学者们的研究热点之一。目前已有研究指出,由于硒的半衰期较短,硒在高代谢的癌细胞中吸收得更多,对癌细胞的毒性作用更强。因此,常规治疗癌细胞剂量的硒元素既不会对机体的健康细胞及组织有明显毒副影响,又能表现出对癌细胞的显著抑制作用[45],这一独特的优势使硒在治疗肿瘤疾病方面具有无限潜力。硒的抗肿瘤机制是以氧化反应为核心,影响肿瘤细胞的复制增殖、凋亡、裂解死亡及转移等过程,具体表现为:①释放大量活性氧物质损伤癌细胞的DNA:甲基硒代半胱氨酸在体内代谢生成的甲基硒醇和甲基硒酸以及亚硒酸盐代谢产生的硒化氢等物质,可与谷胱甘肽或-SH基团相互作用产生?O?—、过氧化氢等活性氧产物损伤癌细胞DNA,有效抑制癌细胞的生长[46]。②线粒体功能障碍:线粒体作为癌细胞产生ATP维持自身能量需求的主要场所,其膜电位的稳定维持是ATP持续产生的重要前提[47]。大量活性氧物质导致癌细胞释放细胞色素C,并触发细胞凋亡因子caspase-3的激活,从而干扰膜电位的稳定性,导致线粒体功能出现障碍。此外,线粒体途径还可影响癌细胞有丝分裂期及DNA合成后期[46,48]。 ③影响各种炎症信号通路:应激活化蛋白激酶又被称为c-Jun氨基末端激酶,是丝裂原活化蛋白激酶信号通路的一个亚类,它作为活性氧下游的正调节分子在细胞自噬和凋亡诱导中起作用;同时,哺乳动物雷帕霉素靶蛋白的磷酸化可阻止线粒体膜通透性,降低释放细胞色素C阻断癌细胞的内源性凋亡,而硒的补充可减少磷酸化蛋白激酶B和磷酸化哺乳动物雷帕霉素靶蛋白,增加c-Jun氨基末端激酶的磷酸化。因此,硒能够激活c-Jun氨基末端激酶以影响丝裂原活化蛋白激酶通路并抑制蛋白激酶B哺乳动物雷帕霉素靶蛋白信号通路,从而诱导癌细胞(例如:骨肉瘤细胞)凋亡的自噬过程[49]。王皓等[48]指出,硒还可以通过激活与丝裂原活化蛋白激酶通路相联系的核因子κB、Wnt/β-catenin、丝裂原活化蛋白激酶/细胞外调节蛋白激酶等其他炎症相关信号途径去破坏癌细胞的内环境稳态以及信号传递过程。④抑制肿瘤细胞新生血管的生成,降低肿瘤细胞转移的风险:金属基质蛋白酶1、金属基质蛋白酶2在细胞外基质降解中扮演重要角色。硒甲烷的前体物质能够抑制金属基质蛋白酶2、金属基质蛋白酶9的表达,同时上调金属基质蛋白酶组织抑制剂1和金属基质蛋白酶组织抑制剂2的表达,这样可以有效降低肿瘤细胞对细胞外胶原基质的黏附和迁移能力。甲基硒酸作为癌症预防中抗肿瘤血管生成的关键因子,能够诱导人大血管内皮细胞内DNA合成前期至DNA合成阶段处于停滞状态,并抑制血管内皮生长因子及内皮细胞中金属基质蛋白酶2的分泌[45,50]。此外,近年来越来越多的研究开始关注硒纳米颗粒对肿瘤的影响,硒纳米颗粒的抗肿瘤机制也是通过活性氧的产生介导癌细胞的一系列氧化应激状态,阻止DNA复制,造成DNA与蛋白质交联,扰乱细胞代谢等。有学者通过化学法制备葡聚糖70000-硒纳米颗粒和泊洛沙姆188-硒纳米颗粒,体外培养HepG2细胞,经荧光测定,硒纳米颗粒在孵育60 min后即可被HepG2细胞完全吸收;检测HepG2细胞中的活性氧水平及细胞凋亡结果发现,葡聚糖70000-硒纳米颗粒和泊洛沙姆188-硒纳米颗粒处理后的细胞活性氧水平及细胞凋亡率明显升高[49]。该研究结果表明相较于常规治疗的硒元素,硒纳米颗粒对于肿瘤细胞的治疗具有更佳的靶向性、稳定性、生物活性及安全性。 2.4 硒及纳米硒在口腔常见疾病的研究现状 2.4.1 口腔癌 口腔癌的发病在早期无明显特殊症状,患者不易觉察,一经确诊往往已发展到晚期阶段,即Ⅲ期或Ⅳ期,因此,口腔癌的早期检测和确诊对实现有效治疗至关重要。有报道指出,若能在早期及时发现并干预口腔癌,不仅能够提高患者的生活质量,并且治愈率可高达77%以上[51]。癌前病变作为口腔癌发生发展的一个重要环节,约有85%的口腔白斑患者和7%-13%的口腔黏膜纤维化患者会发展成为口腔癌[52-53]。在一项口腔白斑患者的横断面研究中,研究人员使用番茄红素、硒和维生素E联合治疗口腔白斑,3个月后治疗组患者病灶缩小了7.72 cm2,而对照组(给予安慰剂)患者病灶仅缩小了1.7 cm2 (P < 0.05)[54],该项研究结果表明,番茄红素、硒和维生素E的联合使用能够有效治疗口腔白斑 。KUMAR等[52]通过分析口腔黏膜纤维化与口腔鳞状细胞癌患者血清和唾液中的硒含量情况发现,与健康对照组比较,所有的口腔黏膜纤维化及口腔鳞状细胞癌患者血清中硒含量降低,但唾液中硒含量无明显变化,该团队研究人员认为由于受到饮食、心理、自主神经系统等口腔局部原因影响,与血清硒含量测定相比,唾液硒含量测定值参考意义不大,测定血清硒含量对口腔癌及癌前病变的早期预测或辅助诊断具有一定临床指导意义。除此之外,硒还可以作为抗氧化剂和放射性治疗保护剂在口腔癌治疗过程中发挥双重作用。有临床研究发现,放射治疗后的Ⅲ期口腔癌患者连续6个月补充硒(硒胶囊,400 μg/粒)后癌细胞中的DNA和RNA含量显著下降(P < 0.001),并且与只经过放射治疗组相比,硒补充组患者的不溶性胶原蛋白增多(成熟性胶原蛋白),可溶性胶原蛋白(酸溶性胶原蛋白和盐溶性胶原蛋白)减少(P < 0.05),证明硒不仅能够抑制癌细胞增殖,同时还能减少放疗过程中因电离辐射产生的多种活性氧物质对组织中成熟胶原蛋白的攻击[55]。表2为硒在口腔癌中的应用总结。"

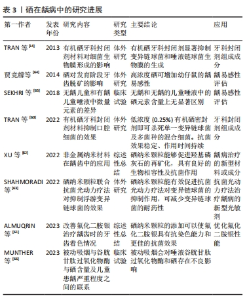
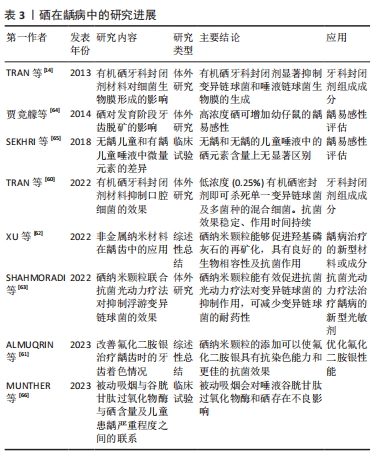
2.4.2 龋病 龋病是当牙齿硬组织被细菌侵染后出现的一种慢性且逐渐恶化的破坏性疾病,其中变异链球菌被普遍认为是导致龋病的主要细菌[59]。在龋病发生的四联因素理论中,牙菌斑生物膜为诱发的始动因素,因此控制菌斑在龋病的预防和治疗中就显得尤为重要。有研究发现,有机硒共价附着的牙科封闭剂材料能阻断变异链球菌和唾液链球菌发育形成生物膜,使用含有1%,0.5%,0.25%和0.1%含硒牙科封闭剂作用于变异链球菌、唾液链球菌、血链球菌后,与无硒牙科封闭剂的对照组相比,0.25%以上浓度的含硒牙科封闭剂已经能够完全杀死单种细菌或几种细菌的混合,同时可以抑制已进入封闭剂中的细菌生长繁殖,以规避传统充填材料因发生微渗漏而引起的继发龋[14,60];将含硒牙科封闭剂在PBS中浸泡1年后仍能保持杀菌的稳定性,相较于抗菌能力会随时间逐渐削弱的普通氟化物牙科封闭剂材料相比,含硒牙科封闭剂很好地解决了这一问题。尽管在实际临床应用中氟化物对于龋病预防和治疗的成效已得到充分认可,但在氟化物长期临床应用中也逐渐发现了一些问题,例如用于治疗低龄儿童龋的氟化二胺银在治疗龋齿后会使牙齿发生不可逆地染色变化,从而影响美观。针对这一现象,ALMUQRIN等[61]提出可以通过在氟化二胺银中添加具有抗氧化作用的硒纳米颗粒,这种方法不仅确保了持续的抗菌效果,还能防止氟化二胺银对牙齿造成染色。硒纳米颗粒可通过抑制致龋菌(如变异链球菌)的生长来减少牙齿脱矿,还能够诱导和促进羟基磷灰石等矿物质的沉积来增强牙体组织的再矿化能力,避免牙釉质脱矿的同时也减少了细菌的耐药性,而且相比于金属纳米材料的生物相容性更好,不会引起牙齿颜色的变化,也不会影响材料的性能[62]。硒纳米颗粒还可作为光敏剂介导抗菌光动力疗法。SHAHMORADI等[63]在体外比较亚甲基蓝及硒纳米颗粒诱导的抗菌光动力疗法对浮游变异链球菌的抑制作用,结果显示硒纳米颗粒诱导的抗菌光动力疗法具有最高的抗菌活性(P < 0.001),硒纳米颗粒能与抗菌光动力疗法产生更多的协同效应,并且较亚甲基蓝有更低的细胞毒性及细菌耐药性。在硒与龋齿易感性关系方面,有学者探究了不同硒水平(低硒组:0.015 mg/kg、中硒组:0.15 mg/kg、高硒组:1.5 mg/kg)作用下的乳仔鼠牙齿脱矿情况,推测可能因为硒进入了正处于发育中牙的釉基质蛋白,使得牙齿对酸的敏感性增高,导致高硒组乳仔鼠牙齿脱矿程度最严重,而低硒组乳仔鼠牙齿的脱矿程度低于不给予硒的对照组[64]。提示高浓度硒可能增加牙齿的龋易感性,而较低浓度的硒则有助于减少这种易感性。然而,另外一些研究则指出,有龋儿童和无龋儿童的血清中微量元素硒无明显差异[65-66]。因此,硒能否作为龋齿早期诊断、治疗、预后的监测指标仍有待更多深入的探讨。现将上述硒在龋病中的研究进展总结如表3。"

2.4.3 牙髓根尖周病 细菌感染是影响牙髓根尖周病进展、治疗、预后、复发等环节的一个关键性因素。其中粪肠球菌常被检出于难治性根尖周炎,与根管持续性感染及治疗后再感染有直接关系。粪肠球菌在持续性根管感染中的检出率为原发性根管感染检出率的9.1倍[67]。于是有学者利用硒纳米颗粒能够介导抗菌光动力疗法抑制细菌生物膜形成的特点,研究壳聚糖包裹硒纳米颗粒联合抗菌光动力疗法对粪肠球菌生物膜的影响,以琼脂扩散法测定抑菌效果,结果显示:与单独照射的空白对照组以及亚甲基蓝作光敏剂引发的抗菌光动力疗法组比较,硒纳米颗粒引发的抗菌光动力疗法以及硒纳米颗粒+亚甲基蓝引发的抗菌光动力疗法对粪肠球菌生物膜具有显著抑制作用(P < 0.05),并且硒纳米颗粒联合抗菌光动力疗法能抑制进入牙本质小管深层(深度为200-400 μm)的粪肠球菌,而单纯的抗菌光动力疗法能到达牙本质小管的深度仅为200 μm[16]。根管治疗作为牙髓根尖周病的核心治疗手段,其首要步骤就是彻底清除根管系统中的感染源,这意味着需要进行高质量的根管预备工作。除了单纯的机械预备,化学预备作为根管预备中必不可少的一部分,选择具有高效抗菌的根管消毒剂至关重要。硒可通过影响根尖周炎症相关的趋化因子和细胞因子,从而控制根尖周炎症的进展及牙槽骨的破坏。ESPALADORI等[15]将硒用作牙髓敷料治疗根尖周炎,15 d后收集患者的标本进行检测,结果显示硒(10 μmol/L亚硒酸钠)敷料组与硒(10 μmol/L亚硒酸钠)和氢氧化钙共同处理组根管中干扰素γ mRNA表达明显降低,肿瘤坏死因子α mRNA及白细胞介素10表达水平明显提升,提示硒能够增强氢氧化钙对根尖周的抗炎反应。另外,无论硒是在单独使用或者联合其他根管用药使用都能加强对根管系统的化学预备,促进根尖周组织的修复。现将硒作为根管消毒剂的实验研究总结如表4。"


2.4.4 口腔种植 随着口腔材料学的不断发展和种植技术的进步,口腔种植技术的应用领域范围也在不断扩大。评估患者是否适合进行口腔种植以及种植体植入牙槽骨后患者的预后情况是否理想仍然受到2个最关键因素的制约:一是患者是否有足够的种植骨量;二是种植体植入后能否很好地实现骨结合,最终稳定地存在于患者口腔内并行使功能。前者大都可通过引导骨再生解决骨量不足的问题,后者的发生常常是由于创口发生感染导致迁延不愈使种植体脱落。基于以上2方面的问题,许多学者开始在引导骨再生膜及种植体材料上进行研究。REDDY等[70]使用硒掺杂的生物玻璃、胶原蛋白和明胶开发了一种新型复合可降解的引导骨再生膜,并对其进行扫描电镜、X射线能谱、抗菌及生物毒性等检测,证明该膜表面的层状结构和纤维状排列特征有利于成骨细胞的附着和分化,硒的加入也几乎完全抑制了金黄色葡萄球菌和大肠杆菌的生长,同时玻璃离子和明胶的添加更好地促进了引导骨再生膜的骨诱导性及机械性能,以上特性使得该膜具有良好的生物活性及应用价值。钛及钛合金作为应用最广泛的口腔种植体材料,具有耐高温、抗腐蚀、质量轻、机械性能好等特点。钛层的表面容易生成TiO2氧化层薄膜,有助于加强种植体与骨骼的紧密结合,但种植体本身的生物惰性易导致种植体表面形成菌斑生物膜,从而影响植体与骨的结合效果,导致种植失败[59]。在钛的表面沉积硒和透明质酸涂层可减少植体表面菌斑生物膜的形成[71]。此外,有研究人员制备壳聚糖包裹的硒纳米颗粒并通过共价偶联将其固定于喷砂酸蚀处理后的钛基底上,分析其植入后的骨整合和抗炎作用,结果显示:与钛-喷砂酸蚀组相比,钛-硒组的p65和IκB-α磷酸化水平、p-p65/p65和p-IκBα/IκBα比值显著降低,成骨标志物(Runt-相关转录因子2、成骨细胞特异性转录因子Osterix和骨钙素)的表达显著增加,证明壳聚糖包裹的硒纳米颗粒的钛种植体能够抑制核因子κB信号通路,减少由细菌刺激的炎症反应,以促进骨结合[17]。现将硒在口腔种植材料中的主要应用优势总结于图5[69-71]。"


目前硒及硒纳米颗粒在口腔疾病的预防、诊断、治疗等方面的研究中还存在一定空白,所能参考借鉴的报道和研究有限,文章所描述的硒和硒纳米颗粒在口腔癌、龋病、牙髓根尖周病、口腔种植等方面的应用大都还处于体外实验阶段,缺乏临床可靠数据的支撑。在未来,硒及硒纳米颗粒在口腔疾病中的应用仍然需要大量的、更深层次的研究去进一步推进。 2.5 硒及硒纳米颗粒的生物安全性 硒虽然是人体必须的微量元素之一,但它的营养治疗剂量与中毒剂量范围非常接近,WHO规定硒的最大安全剂量为400 μg/d,中毒剂量为750 μg/d [72],中国营养协会与国际粮农组织建议人体硒的摄入量为50 μg/d [73]。有报道指出亚硒酸钠的半数致死量为21.17 mg/kg,生物合成的酵母硒半数致死量至少为亚硒酸钠的37倍[74]。此外,纳米硒作为3种形式中毒性最小、安全范围最大的硒形式,有研究发现当硒纳米颗粒剂量为1 600 μg/d时不会出现明显的中毒症状 [9],而当剂量增加到3 200 μg/d时才会出现硒中毒症状,即纳米硒致死剂量可能是其他有机和无机硒制剂的4-6倍[16,61]。 由此可见,硒的浓度及存在形式对硒应用时的生物安全性影响非常大。因此临床实践应用时,还需结合给药途径、药物剂型、药物代谢动力学、细菌病毒及细胞的敏感性等多种因素综合考虑硒的使用剂量及形式。"

| [1] SHAHMORADI S, SHARIATI A, ZARGAR N, et al. Antimicrobial effects of selenium nanoparticles in combination with photodynamic therapy against Enterococcus faecalis biofilm. Photodiagnosis Photodyn Ther. 2021;35:102398. [2] XIAO X, DENG H, LIN X, et al. Selenium nanoparticles: Properties, preparation methods, and therapeutic applications. Chem Biol Interact. 2023;378:110483. [3] 樊婷玥,任煜,蒋文雯,等.纳米硒在生物医用材料领域的应用研究进展[J].纺织导报,2020(6):44-48. [4] 贺栋,祁珊珊,郑红星,等.硒的生理功能及富硒产品研究进展[J].食品研究与开发,2023,44(1):191-196. [5] 张淑娟,邵明丽,陈旭阳,等.硒对水产养殖动物的生物学功能和毒性作用及其机理研究进展[J].动物营养学报,2023,35(5):2815-2827. [6] RAZAGHI A, POOREBRAHIM M, SARHAN D, et al. Selenium stimulates the antitumour immunity: Insights to future research. Eur J Cancer. 2021;155:256-267. [7] 张菁怡,曾庆节,殷超,等.硒的生理功能及其在动物生产中的应用研究进展[J].黑龙江畜牧兽医,2024(4):17-23+28. [8] 樊军.富硒食品的研究进展[J].中国食品工业,2023(22):86-89. [9] 王碧莹,王亮亮.硒的生理功能及纳米硒在动物营养中的应用研究进展[J].中国畜牧杂志:1-9. [2023-12-22]. doi:10.19556/j.0258-7033.20230905-04 [10] 郗慧娟,陈晗玉,骆莹,等.酵母菌源纳米硒的制备、安全性评价及纳米硒奶片研发[J/OL].食品工业科技:1-15.[2024-03-13]. doi: 10.13386/j.issn1002-0306.2023110079 [11] MARTÍNEZ-ESQUIVIAS F, GUTIÉRREZ-ANGULO M, PÉREZ-LARIOS A, et al. Anticancer Activity of Selenium Nanoparticles In Vitro Studies. Anticancer Agents Med Chem. 2022;22(9):1658-1673. [12] HADJIMARKOS DM, STORVICK CA, REMMERT LF. Selenium and dental caries; an investigation among school children of Oregon. J Pediatr. 1952;40(4):451-455. [13] ROGERS MA, THOMAS DB, DAVIS S, et al. A case-control study of oral cancer and pre-diagnostic concentrations of selenium and zinc in nail tissue. Int J Cancer. 1991;48(2):182-188. [14] TRAN P, HAMOOD A, MOSLEY T, et al. Organo-selenium-containing dental sealant inhibits bacterial biofilm. J Dent Res. 2013;92(5):461-466. [15] ESPALADORI MC, DINIZ JMB, DE BRITO LCN, et al. Selenium intracanal dressing: effects on the periapical immune response. Clin Oral Investig. 2021;25(5):2951-2958. [16] SHAHMORADI S, SHARIATI A, ZARGAR N, et al. Antimicrobial effects of selenium nanoparticles in combination with photodynamic therapy against Enterococcus faecalis biofilm. Photodiagnosis Photodyn Ther. 2021;35:102398. [17] XU Y, SHEN Z, ZHOU Y, et al. Osteogenic and anti-inflammatory effects of SLA titanium substrates doped with chitosan-stabilized selenium nanoparticles via a covalent coupling strategy. Colloids Surf B Biointerfaces. 2023;224:113217. [18] XIAO X, DENG H, LIN X, et al. Selenium nanoparticles: Properties, preparation methods, and therapeutic applications. Chem Biol Interact. 2023;378:110483. [19] 黄轶驰,田红旗.纳米硒制备方法、抗氧化作用机制及临床应用研究进展[J].山东医药,2021,61(6):103-108. [20] 石廷玉,何彩林,黄胜,等.硒纳米颗粒的合成、安全性、作用及其机制的研究进展[J].中国药理学通报,2023,39(3):406-413. [21] TANG L, LUO X, WANG M, et al. Synthesis, characterization, in vitro antioxidant and hypoglycemic activities of selenium nanoparticles decorated with polysaccharides of Gracilaria lemaneiformis. Int J Biol Macromol. 2021;193(Pt A):923-932. [22] ZAMBONINO MC, QUIZHPE EM, MOUHEB L, et al. Biogenic Selenium Nanoparticles in Biomedical Sciences: Properties, Current Trends, Novel Opportunities and Emerging Challenges in Theranostic Nanomedicine. Nanomaterials (Basel). 2023;13(3):424. [23] 覃新云,农可懿,吕其壮,等.微量元素硒的抗氧化作用研究进展[J].中国食品添加剂,2022,33(10):272-278. [24] 方热军,杨凯丽.硒的抗氧化和免疫作用及其代谢调控途径[J].饲料工业,2018,39(23):1-7. [25] RAZA A, JOHNSON H, SINGH A, et al. Impact of selenium nanoparticles in the regulation of inflammation. Arch Biochem Biophys. 2022;732: 109466. [26] ZAHIA TH, YONA L, ANNE-LAURE B, et al. Selective up-regulation of human selenoproteins in response to oxidative stress. Free Radic Biol Med. 2014;75 Suppl 1:S25. [27] QIAN F, MISRA S, PRABHU KS. Selenium and selenoproteins in prostanoid metabolism and immunity. Crit Rev Biochem Mol Biol. 2019;54(6):484-516. [28] 李春燕,孙传政,宋鑫.肿瘤细胞死亡的一种新形式——铁死亡[J].中国生物化学与分子生物学报,2019,35(11):1208-1214. [29] 许晓,李明,范理宏.亚硒酸钠对肺癌细胞生物学行为的影响及其相关机制研究[J].安徽医科大学学报,2021,56(7):1117-1122. [30] 陈栩然,丁周莹,顿小玲,等.微量元素硒的抗炎效应研究进展[J].中国食物与营养:1-6[2024-05-23].doi:10.19870/j.cnki.11-3716/ts.20230420.002 [31] 郭咏梅,张博綦,闫素梅,等. 硒对脂多糖诱导的奶牛乳腺上皮细胞氧化损伤的保护作用[J].动物营养学报,2017,29(9):3375-3384. [32] AHRENS I, ELLWANGER C, SMITH BK, et al. Selenium supplementation induces metalloproteinase-dependent L-selectin shedding from monocytes. J Leukoc Biol. 2008;83(6):1388-1395. [33] NARAYAN V, RAVINDRA KC, LIAO C, et al. Epigenetic regulation of inflammatory gene expression in macrophages by selenium. J Nutr Biochem. 2015;26(2):138-145. [34] SEROV DA, KHABATOVA VV, VODENEEV V, et al. A Review of the Antibacterial, Fungicidal and Antiviral Properties of Selenium Nanoparticles. Materials (Basel). 2023;16(15):5363. [35] ALMATAR M, MAKKY EA, VAR I, et al. The Role of Nanoparticles in the Inhibition of Multidrug-Resistant Bacteria and Biofilms. Curr Drug Deliv. 2018;15(4):470-484. [36] SAHOO B, LEENA PANIGRAHI L, JENA S, et al. Oxidative stress generated due to photocatalytic activity of biosynthesized selenium nanoparticles triggers cytoplasmic leakage leading to bacterial cell death. RSC Adv. 2023;13(17):11406-11414. [37] PIACENZA E, PRESENTATO A, ZONARO E, et al. Antimicrobial activity of biogenically produced spherical Se-nanomaterials embedded in organic material against Pseudomonas aeruginosa and Staphylococcus aureus strains on hydroxyapatite-coated surfaces. Microb Biotechnol. 2017;10(4):804-818. [38] 黄瑞哲,田剑刚,种燕,等.不同浓度硒对变形链球菌的粘附功能的影响[J].临床口腔医学杂志,2011,27(3):136-138 [39] HOFFMANN PR. Mechanisms by which selenium influences immune responses. Arch Immunol Ther Exp (Warsz). 2007;55(5):289-297. [40] NELSON SM, LEI X, PRABHU KS. Selenium levels affect the IL-4-induced expression of alternative activation markers in murine macrophages. J Nutr. 2011;141(9):1754-1761 [41] AVERY JC, HOFFMANN PR. Selenium, Selenoproteins, and Immunity. Nutrients. 2018;10(9):1203. [42] MA C, HOFFMANN PR. Selenoproteins as regulators of T cell proliferation, differentiation, and metabolism. Semin Cell Dev Biol. 2021;115:54-61. [43] ZHANG K, ZHAO Q, ZHAN T, et al. Effect of Different Selenium Sources on Growth Performance, Tissue Selenium Content, Meat Quality, and Selenoprotein Gene Expression in Finishing Pigs. Biol Trace Elem Res. 2020;196(2):463-471. [44] 高珍珍,张超,景丽荣,等.7种硒化多糖在小鼠体内外免疫活性的比较[J].南京农业大学学报,2020,43(4):705-713. [45] KIM SJ, CHOI MC, PARK JM, et al. Antitumor Effects of Selenium. Int J Mol Sci. 2021;22(21):11844. [46] SHORT SP, WILLIAMS CS. Selenoproteins in Tumorigenesis and Cancer Progression. Adv Cancer Res. 2017;136:49-83. [47] WANG Z, JI L, REN Y, et al. Preparation and Anti-tumor Study of Dextran 70,000-Selenium Nanoparticles and Poloxamer 188-Selenium Nanoparticles. AAPS PharmSciTech. 2021;23(1):29. [48] 王皓,王玉丽,孙洁洁,等.纳米硒在医药领域中的应用研究进展[J].国际药学研究杂志,2020,47(5):337-341+346. [49] LI X, WANG Y, CHEN Y, et al. Hierarchically constructed selenium-doped bone-mimetic nanoparticles promote ROS-mediated autophagy and apoptosis for bone tumor inhibition. Biomaterials. 2020;257:120253. [50] ZENG H, COMBS GF JR. Selenium as an anticancer nutrient: roles in cell proliferation and tumor cell invasion. J Nutr Biochem. 2008;19(1):1-7. [51] 方起程.癌症光动力治疗和新抗癌光敏剂华卟啉钠[J].中国新药杂志,2014,23(13):1540-1545. [52] KUMAR V, KUMARI N, EALLA KKR, et al. Comparative analysis of trace elements in the saliva and serum of patients with oral submucous fibrosis and squamous cell carcinoma. Mol Clin Oncol. 2024;20(3):18. [53] KHANNA S. Immunological and biochemical markers in oral carcinogenesis: the public health perspective. Int J Environ Res Public Health. 2008;5(5):418-422. [54] MANAS A, VENKATESWARARAO CH, VAID S, et al. Assessment of Utility of Lycopene, Selenium, and Vitamin E in Management of Oral Leukoplakia. J Pharm Bioallied Sci. 2022;14(Suppl 1):S233-S235. [55] ELANGO N, SAMUEL S, CHINNAKKANNU P. Enzymatic and non-enzymatic antioxidant status in stage (III) human oral squamous cell carcinoma and treated with radical radio therapy: influence of selenium supplementation. Clin Chim Acta. 2006;373(1-2):92-98. [56] GHOSE A, FLEMING J, HARRISON PR. Selenium and signal transduction: roads to cell death and anti-tumour activity. Biofactors. 2001;14(1-4): 127-133. [57] MADIYAL A, SHETTY SR, BABU GS. Micronutrients and Their Role in Oral Cancer: A Review. West Indian Med J. 2016;65(2):383-388. [58] MAMPILLY MO, RAVINDRAN N, PARAMBIL MS, et al. Assessment of Serum Selenium and Ceruloplasmin in Potentially Malignant Disorders and Oral Cancer. J Pharm Bioallied Sci. 2021;13(Suppl 2):S989-S992. [59] 罗廷炎,顾瑜,秦晓飞.纳米材料的抗菌机制及在口腔感染性疾病中的作用[J].中国组织工程研究,2023,27(21):3407-3414. [60] TRAN P, KOPEL J, RAY C, et al. Organo-selenium containing dental sealant inhibits biofilm formation by oral bacteria. Dent Mater. 2022; 38(5):848-857. [61] ALMUQRIN A, KAUR IP, WALSH LJ, et al. Amelioration Strategies for Silver Diamine Fluoride: Moving from Black to White. Antibiotics (Basel). 2023;12(2):298. [62] XU VW, NIZAMI MZI, YIN IX, et al. Caries Management with Non-Metallic Nanomaterials: A Systematic Review. Int J Nanomedicine. 2022;17:5809-5824. [63] SHAHMORADI S, SHARIATI A, AMINI SM, et al. The application of selenium nanoparticles for enhancing the efficacy of photodynamic inactivation of planktonic communities and the biofilm of Streptococcus mutans. BMC Res Notes. 2022;15(1):84. [64] 贾竟艨,程敏,李文娟,等.硒对大鼠牙龋易感性影响体外研究[J].中国实用口腔科杂志,2014,7(5):271-273+278. [65] SEKHRI P, SANDHU M, SACHDEV V, et al. Estimation of Trace Elements in Mixed Saliva of Caries Free and Caries Active Children. J Clin Pediatr Dent. 2018;42(2):135-139. [66] MUNTHER S, AWN BH, YASSIN HN. The Impact of Passive Smoking on Salivary Glutathione Peroxidase and Selenium in Relation to Dental Caries Severity among Five Years Old Children. Indian J Dent Res. 2023;34(3):270-273. [67] 李莹雪,王雨霏,张凌琳.粪肠球菌在牙髓根尖周病中致病机制及抗菌治疗的研究进展[J].口腔疾病防治,2019,27(8):535-540. [68] MIGLANI S, TANI-ISHII N. Biosynthesized selenium nanoparticles: characterization, antimicrobial, and antibiofilm activity against Enterococcus faecalis. PeerJ. 2021;9:e11653. [69] BOLAT N, ERZURUMLU Y, AŞCI H, et al. Selenium ameliorates inflammation by decreasing autophagic flux and mitogen-activated protein kinase signalling on experimentally induced rat periapical lesions. Int Endod J. 2023;56(2):227-244. [70] REDDY SB, ARUMUGAM P, KISHORE OG, et al. Development, Characterization, and Antibacterial Analysis of the Selenium-Doped Bio-Glass-Collagen-Gelatin Composite Scaffold for Guided Bone Regeneration. Cureus. 2023;15(11):e48838. [71] GANESH S, S G, MADHU K. Commercially Pure Titanium Implants With Selenium and Hyaluronic Acid Coating for Dental Applications. Cureus. 2024;16(1):e52984. [72] RAYMAN MP. Selenium intake, status, and health: a complex relationship. Hormones (Athens). 2020;19(1):9-14. [73] 昌晓宇,卢坚雯,汤小明,等.我国主要富硒地区富硒大米硒含量和品质调查分析[J].江西农业学报,2023,35(9):102-106. [74] 郑泽洋,李绮敏,杨安源.纳米硒毒性与营养研究进展[J].食品安全导刊,2021(22):109-111. |
| [1] | Xu Hao, Ding Lu, Li Xiao. Investigating the effect of the mechanical wear on abutment screw in Morse taper connection implant implant system by using finite element analysis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(在线): 1-9. |
| [2] | Zhang Yuhang, Zeng Yuning, Zeng Jindi, Lu Yixuan, Ye Hui, Ji Jianxin. Accuracy of modified implant template of assisted implantation in missing second molars [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 738-744. |
| [3] | Wang Huan, Lu Jing, Li Ying, Meng Maohua, Shu Jiayu, Luo Yuncai, Li Wenjie, Dong Qiang. Manufacture and mechanical property on zirconia abutments with a titanium base in dental implant restoration [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(10): 2171-2177. |
| [4] | Xu Yinghua, Liu Jing, You Quan, Wen Zhihao, Gao Lu. Effect of neodymium-doped:yttrium aluminum perovskite laser combined with two kinds of remineralizers on remineralization of early enamel caries [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 360-365. |
| [5] | Zhang Binjing, Wang Jian. Cerium and cerium-based materials in dental applications [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(15): 2445-2451. |
| [6] | Lang Yaoling, Wang Qian, Chen Bin, Bai Guohui, Guan Xiaoyan, Liu Jianguo. Removal of the selective marker gene in the fusion gene expression vector of plant anti-caries vaccine [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(1): 7-11. |
| [7] | Xu Xingxing, Wen Chaoju, Meng Maohua, Wang Qinying, Chen Jingqiao, Dong Qiang. Carbon nanomaterials in oral implant [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(7): 1062-1070. |
| [8] | Chen Jingqiao, Li Ying, Meng Maohua, Xu Xingxing, Wang Qinying, Wang Huan, Lu Jing, Shu Jiayu, Dong Qiang. Research progress in platelet-rich fibrin in stomatology [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(3): 441-446. |
| [9] | Xu Dapeng, Jing Jie, Ma Lu, Qu Aili. Biomechanical analysis of implant selection for maxillary posterior teeth based on healing process simulation [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(25): 3942-3948. |
| [10] | Luo Tingyan, Gu Yu, Qin Xiaofei. Antibacterial mechanism and application of nanomaterials in oral infectious diseases [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(21): 3407-3414. |
| [11] | Qi Yuhan, Shi Qianhui, An Zheqing, Liao Jian. Bone ring technique for restoration of dentition defects with bone deficiency [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(17): 2738-2744. |
| [12] | Wang Yuesheng, Gao Wei, Peng Cheng. Surface treatment of dental implant materials and their antibacterial and osteoinductive ability [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(12): 1961-1968. |
| [13] | Zhang Jianguo, Chen Chen, Hu Fengling, Huang Daoyu, Song Liang. Design and biomechanical properties of dental implant pore structure based on three-dimensional finite element analysis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 585-590. |
| [14] | Yang Qiongqiong, Li Ping, Wang Qian. Role and regulatory mechanism of microRNA in bone tissue repair around dental implants [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(28): 4539-4545. |
| [15] | Li Hu, Guan Xiaoyan, Li Min, Dong Jingnan, Xiao Qianwen, Bai Guohui, Wang Mingwei, Liu Jianguo. Hydrogel loaded anti-caries DNA vaccine pVAX1-SpaP/P produces immune effects in four ways [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(27): 4340-4345. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||