Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (22): 4804-4812.doi: 10.12307/2025.451
Previous Articles Next Articles
Tissue engineering technology for repairing temporomandibular joint: problems and challenges
Lai Pengyu, Liang Ran, Shen Shan
- School of Stomatology, Jinan University, Guangzhou 510632, Guangdong Province, China
-
Received:2024-04-09Accepted:2024-06-13Online:2025-08-08Published:2024-12-06 -
Contact:Shen Shan, MD, Chief physician, Master’s supervisor, School of Stomatology, Jinan University, Guangzhou 510632, Guangdong Province, China -
About author:Lai Pengyu, School of Stomatology, Jinan University, Guangzhou 510632, Guangdong Province, China -
Supported by:Municipality-University (Institute) Joint Funding Scheme of Guangzhou Science and Technology Program, No. 202201020031 (to SS)
CLC Number:
Cite this article
Lai Pengyu, Liang Ran, Shen Shan. Tissue engineering technology for repairing temporomandibular joint: problems and challenges[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(22): 4804-4812.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
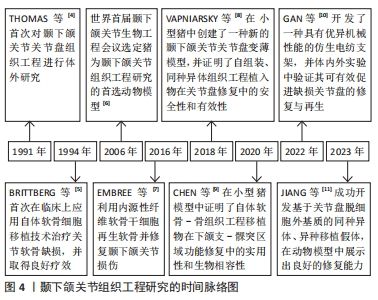
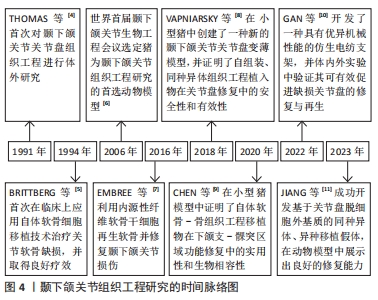
2.1 颞下颌关节组织工程的研究时间脉络 截至目前,颞下颌关节组织工程已经发展了30多年。1991年,THOMAS等[4]首次对颞下颌关节关节盘组织工程进行体外研究,揭开了颞下颌关节组织工程研究的序幕。1994年,BRITTBERG等[5]首次在临床上应用自体软骨细胞移植技术治疗关节软骨缺损,并取得了良好疗效。2006年,世界首届颞下颌关节生物工程会议选定猪为颞下颌关节组织工程研究的首选动物模型[6]。2016年,EMBREE等[7]利用内源性纤维软骨干细胞再生软骨并修复颞下颌关节损伤。2018年,VAPNIARSKY等[8]在小型猪中创建了一种新的颞下颌关节关节盘变薄模型,证明了自组装、同种异体组织工程植入物在关节盘修复中的安全性和有效性。2020年,CHEN等[9]在小型猪模型中证明了自体软骨-骨组织工程移植物在下颌支-髁突区域功能修复中的实用性和生物相容性。2022年,GAN等[10]开发了一种具有优异机械性能的仿生电纺支架,并在体内外实验中验证其可有效促进缺损关节盘的修复与再生。2023年,JIANG等[11]成功开发了基于关节盘脱细胞外基质的同种异体、异种移植假体,在动物模型中展示出良好的修复能力。颞下颌关节组织工程的研究时间脉络见图4。"

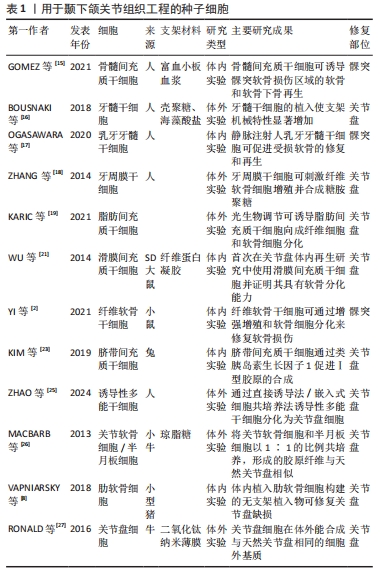
2.2 用于颞下颌关节组织工程的种子细胞 2.2.1 干细胞 种子细胞是组织工程的重要组成部分,需要具备良好的细胞特性和基质合成能力,因此其类型和来源十分重要。间充质干细胞由于具有多向分化和易于提取等特性,是组织工程中最广泛使用的干细胞。间充质干细胞可来源于骨髓、牙髓、脂肪、滑膜等组织[12],其中骨髓是最常见的间充质干细胞来源。骨髓间充质干细胞在细胞增殖和软骨分化方面具有优越性,并且因其免疫逃逸能力较强,在临床应用中不会引起明显的炎症反应。研究表明,骨髓间充质干细胞关节内注射可以延缓颞下颌关节骨关节炎软骨和软骨下骨病变[13],体外与特定生长因子共培养可产生具有各向异性的软骨基质,与天然关节盘相似[14]。GOMEZ等[15]将骨髓间充质干细胞植入富血小板血浆支架,并放置在小鼠髁突软骨缺损区域表面,6周后缺损完全修复。与骨髓间充质干细胞相比,牙源性间充质干细胞因与颞下颌关节组织具有相同的胚胎起源和相似的基因表达模式,对其再生表现出高亲和力。BOUSNAKI等[16]发现牙髓干细胞在壳聚糖/海藻酸盐混合支架中可向成纤维细胞和软骨细胞分化,同时与无细胞支架相比机械特性显著增加。OGASAWARA等[17]通过静脉注射人乳牙牙髓干细胞的无血清培养基,减轻了颞下颌关节骨关节炎造成的软骨退化,并促进新软骨生成。ZHANG等[18]证明牙周膜干细胞通过刺激颞下颌关节纤维软骨细胞增殖和细胞外基质生成来实现纤维软骨的再生。脂肪间充质干细胞同样具有软骨分化能力,并因取材方便、获取量大、传代稳定性好等优势在各类组织工程中应用广泛。近期有研究通过激光诱导脂肪间充质干细胞向成纤维细胞和软骨细胞分化,展现了光生物调节疗法在颞下颌关节组织工程中的应用前景[19]。与骨髓、骨膜和脂肪组织来源的间充质干细胞相比,滑膜间充质干细胞具有更强的软骨形成能力[20]。WU等[21]证明滑膜间充质干细胞具有软骨分化能力,同时纤维蛋白凝胶的添加可增强关节盘穿孔的修复效果。目前已知软骨形成能力最强的间充质干细胞是存在于髁突浅层区域的纤维软骨干细胞,单个纤维软骨干细胞即可自发生成软骨原基,并通过膜内/软骨内骨化产生骨[7]。YI等[2]证明颞下颌关节骨关节炎髁突软骨和软骨下骨的退化与纤维软骨干细胞有关。在疾病早期,纤维软骨干细胞可通过增强增殖分化来修复损伤,但在晚期失去正常功能后,软骨破坏进程加快。除成人组织外,间充质干细胞还来源于胎儿组织、脐带和脐血等[22]。与其他间充质干细胞相比,脐带间充质干细胞是一种相对年轻的细胞类型,增殖分化能力强,无供体部位发病率,免疫原性低且易于获得,同时被证明具有产生纤维软骨的强大潜力,因此成为颞下颌关节组织工程种子细胞的理想选择[23]。除间充质干细胞外,诱导性多能干细胞也在软骨再生领域展现出巨大潜力。诱导性多能干细胞来源广泛,可通过多种组织的体细胞编程获得,具有无限增殖和分化能力[24]。ZHAO等[25]证明诱导性多能干细胞具有分化为关节盘细胞的能力,直接诱导第14天分化程度最高,而嵌入式细胞共培养在不同时间均表现出显著分化,并能促进细胞生长和增殖。因具有广阔的临床应用前景,诱导性多能干细胞成为当前组织工程领域的热门研究对象。 2.2.2 体细胞 部分体细胞也能作为颞下颌关节组织工程的种子细胞,如关节软骨细胞、半月板细胞、肋软骨细胞和关节盘细胞等。MACBARB等[26]将关节软骨细胞和半月板细胞在关节盘形琼脂糖支架中以1∶1的比例共培养,并施以外源压力及生长因子刺激,成功设计出第一个自组装、形态特定的人工关节盘。VAPNIARSKY等[8]使用同种异体传代的肋软骨细胞构建出机械性能与天然关节盘相似的无支架植入物,在体内植入后成功修复关节盘缺损,该组织工程植入物在植入后稳定维持在原位,2周时与周围天然组织部分融合,8周时完全融合,同时保持其原有的形状和尺寸,术后8周取出发现其机械性能和完整性与植入时无异;此外,组织学和免疫组织化学评估显示植入物周围存仅存在轻度炎症反应,表明该植入物具有良好的免疫耐受性和生物相容性。除肋软骨细胞外,关节盘细胞也被证明在体外能够合成与天然关节盘相同的细胞外基质[27]。尽管这些体细胞在组织工程中表现良好,但与干细胞相比在来源、去分化和扩增方面仍存在较多限制,并且其代谢和再生速度较慢,因此在组织工程中的应用较少[22,28]。 文章列举了用于颞下颌关节组织工程的种子细胞种类,见表1。自1994年BRITTBERG等[5]首次在临床上应用自体软骨细胞移植技术治疗关节软骨缺损以来,越来越多学者开始探索细胞疗法在颞下颌关节修复中的应用。尽管骨髓间充质干细胞、牙髓干细胞等干细胞在颞下颌关节组织工程研究中展现出强大的分化能力和软骨形成潜力,但出于安全考虑,目前大多数研究仍然是在体外进行,缺乏体内治疗效果及预后的相关数据。因此,未来需要更多的基础研究、临床前研究和临床试验来验证干细胞的治疗效果,并全面评估细胞疗法修复颞下颌关节损伤的潜力。"
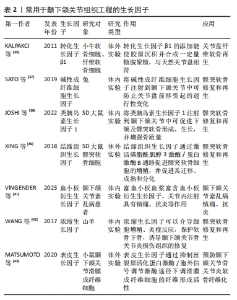
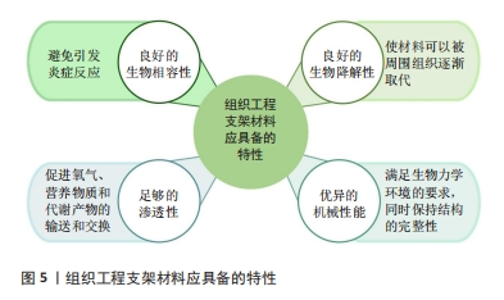
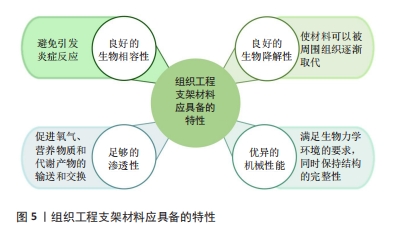
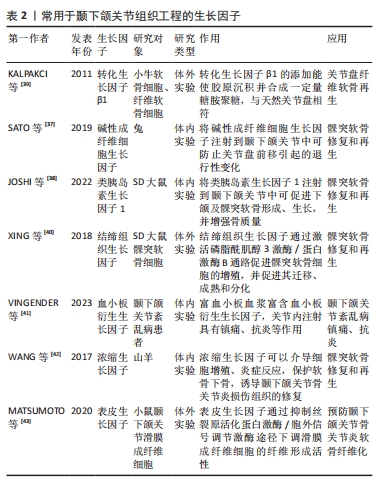
2.3.1 水凝胶 水凝胶具有优异的机械性能和生物特性,能够促进细胞的增殖、均匀封装和相互作用,以及营养物质和代谢废物的运输。水凝胶可在关节镜下输送,解决了开放性植入手术创伤过大的问题。目前,水凝胶支架的主要制备方法包括冷冻干燥、静电纺丝、3D打印等[2]。根据材料成分,水凝胶可分为天然水凝胶、合成水凝胶和复合水凝胶。天然水凝胶具有低免疫原性、高生物兼容性等优点,可由藻酸盐、壳聚糖、透明质酸、明胶、胶原蛋白等合成,然而,由于天然水凝胶机械性能较低、稳定性差等缺陷,其实际应用效果不理想[29]。相比之下,合成或复合水凝胶具有较高的重复性和结构完整性,并且能根据需求调节理化性质和力学性能,因此成为当前研究的热门方向。JIANG等[30]利用3D打印技术设计了一种可用作人工关节盘的聚己内酯增强水凝胶,该水凝胶具有类似于天然关节盘的机械强度,同时具有更好的抗疲劳性、黏弹性和亲水性,并且具有蠕变小、摩擦小、细胞毒性低等优点。HOU等[31]采用冻融和退火联合处理方法成功制备了一种新型仿生水凝胶,由聚乙烯醇和氧化石墨烯纳米片改性阴离子聚氨酯组成,其中前者形成缠结网络以提供机械支撑,后者发挥保水和润滑作用,该水凝胶在注入颞下颌关节后能长期保持结构稳定性,有效保护软骨免受磨损。此外,有研究将药物、生长因子等活性分子封装到水凝胶中,以促进组织修复和再生。TARAFDER等[32]将结缔组织生长因子、转化生长因子β3封装到水凝胶中,动物模型实验结果显示生长因子的掺入显著改善了颞下颌关节骨关节炎,并促进穿孔关节盘的愈合。综上所述,水凝胶在颞下颌关节组织工程中展现出显著优势,能够有效促进颞下颌关节组织再生。同时,将药物、生长因子等掺入水凝胶中用于局部递送,可减轻炎症、缓解疼痛。未来的研究应继续探索药物、生长因子等的关节内传递系统,以实现活性分子的释放与颞下颌关节组织修复和再生的速度相匹配;并进一步探索水凝胶的二级、三级甚至更高级结构的构建方法,深入研究其形态、功能以及在颞下颌关节内的生物学和生物力学表现。此外,目前大多数研究仍停留在体外实验阶段,需要进一步在动物模型和临床试验中验证其可行性,以探索出最适合临床应用的治疗方案。 2.3.2 脱细胞外基质支架 脱细胞外基质能为细胞增殖、分化提供天然生化环境,具有免疫耐受性高、生物相容性好等优点。目前,脱细胞外基质支架的主要制备方法有3D打印、水凝胶交联等[33]。BROWN等[34]将小肠黏膜下层衍生的脱细胞外基质支架植入已进行关节盘切除的猪模型中,1个月后发现细胞已填充支架并形成致密、排列整齐的纤维软骨,生化成分、压缩模量等接近天然关节盘。JIANG等[11]通过激光治疗和聚己内酯输注恢复关节盘脱细胞引起的机械损伤,该构建体模仿了天然关节盘的结构形态、生物力学等特性,在体外和大鼠皮下模型中均表现出良好的生物相容性、安全性和免疫耐受性。为避免手术植入造成的创伤,脱细胞外基质和水凝胶的结合成为目前研究的热门方向。LIANG等[35]用胃蛋白酶对猪的关节盘进行脱细胞并将得到的脱细胞外基质进行处理,成功开发了一种可注射的水凝胶,该水凝胶在体外可促进软骨细胞增殖,在体内可促进局部干细胞迁移,具有修复和再生关节盘的潜力。YI等[2]将3D打印聚合物支架与关节盘脱细胞外基质水凝胶相结合开发了一种仿生复合支架,该支架表现出优异的生物力学、结构和功能特性,为细胞存活、增殖、细胞外基质产生和组织再生创造了有利的微环境。 综上所述,脱细胞外基质在颞下颌关节组织工程中拥有广阔应用前景,然而,当前研究阶段仍面临许多挑战,例如:多数情况下细胞外基质脱细胞后会出现机械性能下降等问题,并且现有脱细胞方法难以去除所有细胞及核酸,存在免疫排斥反应的隐患,亟待进一步优化。未来的研究工作应致力于探索最有效的脱细胞方法,开发力学性能更强、稳定性更好、安全性更高的脱细胞外基质支架,推动其在颞下颌关节组织工程及未来临床实践中的应用。 2.4 用于颞下颌关节组织工程的生长因子 2.4.1 常用生长因子 生长因子被广泛应用于促进细胞分化和生物合成、增强细胞对信号的应答等方面。目前,应用于颞下颌关节组织工程的生长因子主要有转化生长因子β1、碱性成纤维细胞生长因子、类胰岛素生长因子1、结缔组织生长因子、血小板衍生生长因子、浓缩生长因子、表皮生长因子等。大量研究表明,转化生长因子β1、碱性成纤维细胞生长因子、类胰岛素生长因子1是颞下颌关节组织工程的3个关键生长因子,不仅能够诱导间充质干细胞分化,合成与天然关节盘相似的Ⅰ型胶原和糖胺聚糖,还能够修复髁突等部位的软骨缺损[36-39]。近年来,其他生长因子在颞下颌关节组织工程中的作用也得到了研究。XING等[40]首次证明结缔组织生长因子在整个髁突软骨层中广泛表达,通过激活磷脂酰肌醇3激酶/蛋白激酶B通路促进髁突软骨细胞的增殖,能够促进软骨细胞迁移、成熟和分化。血小板衍生生长因子可以增强细胞分化和细胞外基质合成。富血小板血浆富含血小板衍生生长因子,关节内注射具有镇痛、抗炎等作用[41]。WANG等[42]发现浓缩生长因子可以介导细胞增殖、炎症反应,保护软骨下骨,诱导颞下颌关节骨关节炎损伤组织的修复。MATSUMOTO等[43]发现表皮生长因子可通过抑制丝裂原活化蛋白激酶/胞外信号调节激酶途径下调滑膜成纤维细胞的纤维形成活性,临床上可用于预防颞下颌关节骨关节炎软骨纤维化。上述各种生长因子在颞下颌关节组织工程中的应用潜力巨大,但其具体作用机制和最佳使用方案仍需进一步研究。未来的研究应注重生长因子的协同作用及其在体内环境中的长期效果,以优化生长因子的组合和使用方式,提升颞下颌关节组织工程的治疗效果。生长因子在颞下颌关节组织工程中的应用,见表2。"
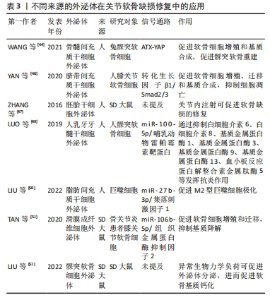
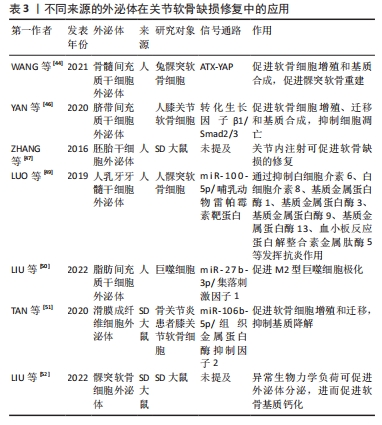
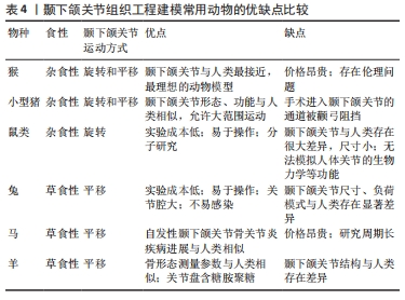
2.4.2 外泌体 外泌体是一类具有脂质双层膜结构的细胞外囊泡,直径30-150 nm。不同细胞来源的外泌体携带不同类型蛋白质、核酸、脂质等,通过传递这些生物活性分子来诱导受体细胞的生物反应,充当细胞间的通讯载体[3,24]。大量研究表明,外泌体广泛参与软骨细胞之间的信息传递,调节软骨细胞的生理功能[24]。如前所述,颞下颌关节疾病的主要病理表现之一是软骨缺损,近年来外泌体已成为关节软骨缺损修复的研究前沿。骨髓间充质干细胞外泌体可通过ATX-YAP轴促进颞下颌关节骨关节炎髁突软骨重建[44]。脂肪间充质干细胞外泌体通过上调miR-145和miR-221通路促进软骨形成[45]。脐带间充质干细胞外泌体通过激活转化生长因子β1/Smad2/3通路促进软骨细胞增殖、迁移和基质合成,抑制细胞凋亡[46]。关节内注射胚胎干细胞外泌体可促进软骨及软骨下骨的有序再生,修复软骨缺损[47]。此外,部分学者对外泌体调节免疫反应的机制进行了研究。CASADO等[48]发现向滑膜炎猪模型关节内注射的骨髓间充质干细胞外泌体可发挥免疫调节作用,减少滑膜淋巴细胞和肿瘤坏死因子α水平。LUO等[49]证明人乳牙牙髓干细胞外泌体通过调节miR-100-5p/哺乳动物雷帕霉素靶蛋白通路抑制白细胞介素6、白细胞介素8、基质金属蛋白酶1、基质金属蛋白酶3、基质金属蛋白酶9、基质金属蛋白酶13及血小板反应蛋白解整合素金属肽酶5等的表达,对颞下颌关节骨关节炎发挥抗炎作用。LIU等[50]证明脂肪间充质干细胞外泌体可通过调节miR-27b-3p/集落刺激因子1通路促进M2型巨噬细胞极化,从而减轻炎症反应。除来源于间充质干细胞外,外泌体还可以由体细胞分泌。滑膜成纤维细胞外泌体通过调节miR-106b-5p/组织金属蛋白酶抑制因子2通路来促进软骨细胞增殖和迁移,并抑制基质降解[51]。LIU等[52]发现异常的生物力学负荷会导致髁突软骨细胞外泌体形成和分泌增加,促进软骨基质钙化,进而导致颞下颌关节骨关节炎软骨异常钙化加速。因此,抑制退行性病变软骨细胞外泌体的分泌有望成为预防和治疗颞下颌关节骨关节炎的新途径。 基于现有研究,外泌体主要通过以下途径修复关节软骨缺损:促进软骨细胞增殖、迁移并抑制其凋亡;促进软骨基质合成并抑制其分解,恢复基质代谢的动态平衡;调节免疫反应,发挥抗炎作用;修复线粒体损伤,恢复能量稳态等[3,24]。表3总结了不同来源的外泌体在关节软骨缺损修复中的应用。该新兴疗法提供了一种“无细胞”的策略,克服了当前细胞疗法的局限性。尽管外泌体疗法显示出巨大的潜力,但由于目前研究仍处于初步阶段,不同来源外泌体的治疗潜力、最佳治疗浓度、具体治疗方案以及可能存在的不良反应仍需进一步研究来确定。此前大多数实验是在膝关节等部位进行,将来应致力于研究外泌体在颞下颌关节组织工程中的应用。"
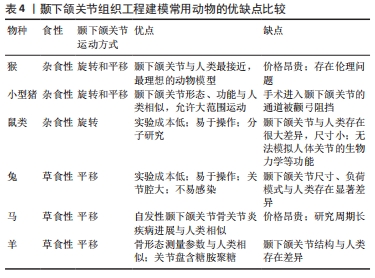
2.5 颞下颌关节组织工程动物模型 在人体临床试验之前,需在相关动物模型中对组织工程植入物进行检查,以初步验证其安全性和有效性。颞下颌关节组织工程现处于早期阶段,大多数研究仍在体外进行[53],阻碍相关技术从实验室推进到临床的主要原因之一是缺乏对不同实验动物模型特征的比较评估[54]。由于不同物种的颞下颌关节形态和功能差异显著,没有任何一种动物可以完全模拟人类颞下颌关节病理生理的各个方面。因此,选择合适的实验动物是成功建立相关疾病模型的基础。颞下颌关节结构与下颌运动方式相关,而后者又与食性相关,因此,在选择实验动物时应优先考虑与人类食性相似的杂食性哺乳动物。猴作为与人类最接近的灵长类动物,是颞下颌关节组织工程研究的理想动物模型,但由于价格昂贵以及存在伦理问题,使用猴的研究较少。小型猪的颞下颌关节在解剖形态、生物化学及生物力学等方面与人类相似,并且能够进行大范围运动,是颞下颌关节模型研究的黄金标准[8,20,54]。早在2006年世界首届颞下颌关节生物工程会议上,猪便被选为颞下颌关节组织工程研究的首选动物模型[6]。鼠类由于性价比高,成为大多数研究的首选实验动物,但鼠的颞下颌关节结构与人类差异较大,无法模拟人体关节生物力学等功能,并且由于尺寸较小很多研究受到了限制[28,55]。此外,一些草食性动物也用于颞下颌关节组织工程研究,如兔、马、羊等[56-57]。兔的颞下颌关节解剖形态与人类相似,而且关节腔较大,可接受手术并佩戴机械装置;兔自身抵抗力强,建模过程中不易感染且价格低廉、易于操作,使其成为颞下颌关节组织工程体内研究最常用的动物模型[22,55]。在大型动物模型中,只有马表现出自发性颞下颌关节骨关节炎的缓慢进展,其软骨厚度、临床症状、放射学体征及年龄进展等方面与人类相似[57]。羊的颞下颌关节虽整体形状与人类不同,但可以作为评估骨矿物质密度等骨形态测量参数的良好模型[54]。文章比较了颞下颌关节组织工程建模常用动物的优缺点,见表4。"
| [1] TRINDADE D, CORDEIRO R, JOSÉ HC, et al. Biological treatments for temporomandibular joint disc disorders: strategies in tissue engineering. Biomolecules. 2021;11(7):933. [2] YI P, LIANG J, HUANG F, et al. Composite system of 3D-printed polymer and acellular matrix hydrogel to repair temporomandibular joint disc. Front Mater. 2021;8621416. [3] LEE YH, PARK HK, AUH QS, et al. Emerging potential of exosomes in regenerative medicine for temporomandibular joint osteoarthritis. Int J Mol Sci. 2020;21(4):1541. [4] THOMAS M, GRANDE D, HAUG RH. Development of an in vitro temporomandibular joint cartilage analog. J Oral Maxil Surg. 1991; 49(8):854-856. [5] BRITTBERG M, LINDAHL A, NILSSON A, et al. Treatment of deep cartilage defects in the knee with autologous chondrocyte transplantation. N Engl J Med. 1994;331(14):889-895. [6] DETAMORE MS, ATHANASIOU KA, MAO J. A call to action for bioengineers and dental professionals: directives for the future of TMJ bioengineering. Ann Biomed Eng. 2007;35(8):1301-1311. [7] EMBREE MC, CHEN M, PYLAWKA S, et al. Exploiting endogenous fibrocartilage stem cells to regenerate cartilage and repair joint injury. Nat Commun. 2016;7(1):13073. [8] VAPNIARSKY N, HUWE LW, ARZI B, et al. Tissue engineering toward temporomandibular joint disc regeneration. Sci Transl Med. 2018; 10(446):eaaq1802. [9] CHEN D, WU JY, KENNEDY KM, et al. Tissue engineered autologous cartilage-bone grafts for temporomandibular joint regeneration. Sci Transl Med. 2020;12(565):eabb6683. [10] GAN Z, ZHAO Y, WU Y, et al. Three-dimensional, biomimetic electrospun scaffolds reinforced with carbon nanotubes for temporomandibular joint disc regeneration. Acta Biomater. 2022; 147:221-234. [11] JIANG N, CHEN H, ZHANG J, et al. Decellularized-disc based allograft and xenograft prosthesis for the long-term precise reconstruction of temporomandibular joint disc. Acta Biomater. 2023;159173-159187. [12] 陈凯佳,刘景云,曹宁.组织工程技术在股骨头坏死治疗中的应用及前景[J].中国组织工程研究,2024,28(9):1450-1456. [13] CHEN K, MAN C, ZHANG B, et al. Effect of in vitro chondrogenic differentiation of autologous mesenchymal stem cells on cartilage and subchondral cancellous bone repair in osteoarthritis of temporomandibular joint. Int J Oral Max Surg. 2013;42(2):240-248. [14] LEGEMATE K, TARAFDER S, JUN Y, et al. Engineering human TMJ discs with protein-releasing 3D-printed scaffolds. J Dent Res. 2016;95(7): 800-807. [15] GOMEZ M, WITTIG O, DIAZ-SOLANO D, et al. Mesenchymal stromal cell transplantation induces regeneration of large and full-thickness cartilage defect of the temporomandibular joint. Cartilage. 2021;13(1_suppl):1814S-1821S. [16] BOUSNAKI M, BAKOPOULOU A, PAPADOGIANNI D, et al. Fibro/chondrogenic differentiation of dental stem cells into chitosan/alginate scaffolds towards temporomandibular joint disc regeneration. J Mater Sci: Mater Med. 2018;291-217. [17] OGASAWARA N, KANO F, HASHIMOTO N, et al. Factors secreted from dental pulp stem cells show multifaceted benefits for treating experimental temporomandibular joint osteoarthritis. Osteoarthr Cartilage. 2020;28(6):831-841. [18] ZHANG J, GUO F, MI J, et al. Periodontal ligament mesenchymal stromal cells increase proliferation and glycosaminoglycans formation of temporomandibular joint derived fibrochondrocytes. BioMed Res Int. 2014;2014:410167. [19] KARIC V, CHANDRAN R, ABRAHAMSE H. Laser-induced differentiation of human adipose-derived stem cells to temporomandibular joint disc cells. Lasers Surg Med. 2021;53(4):567-577. [20] MIN Z, LI Y, XIONG Y, et al. Specific tissue engineering for temporomandibular joint disc perforation. Cytotherapy. 2024;26(3): 231-241. [21] WU Y, GONG Z, LI J, et al. The pilot study of fibrin with temporomandibular joint derived synovial stem cells in repairing TMJ disc perforation. BioMed Res Int. 2014;2014:454021. [22] ACRI TM, SHIN K, SEOL D, et al. Tissue engineering for the temporomandibular joint. Adv Healthcare Mater. 2019;8(2): 1801236. [23] KIM H, YANG G, PARK J, et al. Therapeutic effect of mesenchymal stem cells derived from human umbilical cord in rabbit temporomandibular joint model of osteoarthritis. Sci Rep. 2019; 9(1):13854. [24] YUAN W, WU Y, HUANG M, et al. A new frontier in temporomandibular joint osteoarthritis treatment: Exosome-based therapeutic strategy. Front Bioeng Biotech. 2022;101074536. [25] ZHAO Y, LI C, HU S, et al. In vitro differentiation of human induced pluripotent stem cells into temporomandibular joint disc like cells. Heliyon. 2024;10(1):e23937. [26] MACBARB RF, CHEN AL, HU JC, et al. Engineering functional anisotropy in fibrocartilage neotissues. Biomaterials. 2013;34(38): 9980-9989. [27] RONALD S, MILLS DK. Fibrochondrocyte growth and functionality on TiO2 nanothin films. J Funct Biomater. 2016;7(2):15. [28] DONAHUE RP, HU JC, ATHANASIOU KA. Remaining hurdles for tissue-engineering the temporomandibular joint disc. Trends Mol Med. 2019;25(3):241-256. [29] 侯钰熙,张然,武秀萍.仿生水凝胶在软骨组织工程应用中的优势与潜力[J].中国组织工程研究,2022,26(34): 5569-5576. [30] JIANG N, YANG Y, ZHANG L, et al. 3D-printed polycaprolactone reinforced hydrogel as an artificial TMJ disc. J Dent Res. 2021;100(8): 839-846. [31] HOU Y, JIN M, LIU Y, et al. Biomimetic construction of a lubricious hydrogel with robust mechanics via polymer chains interpenetration and entanglement for TMJ disc replacement. Chem Eng J. 2023;460: 141731. [32] TARAFDER S, KOCH A, JUN Y, et al. Micro-precise spatiotemporal delivery system embedded in 3D printing for complex tissue regeneration. Biofabrication. 2016;8(2):025003. [33] MOURA C, TRINDADE D, VIEIRA M, et al. Multi-material implants for temporomandibular joint disc repair: tailored additive manufacturing production. Front Bioeng Biotech. 2020;8:342. [34] BROWN BN, CHUNG WL, LOWE J, et al. Inductive remodeling of extracellular matrix scaffolds in the temporomandibular joint of pigs. Tissue Eng Part A. 2022;28(9-10):447-457. [35] LIANG J, YI P, WANG X, et al. Acellular matrix hydrogel for repair of the temporomandibular joint disc. J Biomed Mater Res Part B. 2020;108(7):2995-3007. [36] VAN BELLINGHEN X, IDOUX-GILLET Y, PUGLIANO M, et al. Temporomandibular joint regenerative medicine. Int J Mol Sci. 2018; 19(2):446. [37] SATO M, TSUTSUI T, MOROI A, et al. Adaptive change in temporomandibular joint tissue and mandibular morphology following surgically induced anterior disc displacement by bFGF injection in a rabbit model. J Cranio Maxill Surg. 2019;47(2):320-327. [38] JOSHI AS, HATCH NE, HAYAMI T, et al. IGF‐1 TMJ injections enhance mandibular growth and bone quality in juvenile rats. Orthod Craniofac Res. 2022;25(2):183-191. [39] KALPAKCI KN, KIM EJ, ATHANASIOU KA. Assessment of growth factor treatment on fibrochondrocyte and chondrocyte co-cultures for TMJ fibrocartilage engineering. Acta Biomater. 2011;7(4):1710-1718. [40] XING X, LI Z, YU Z, et al. Effects of connective tissue growth factor (CTGF/CCN2) on condylar chondrocyte proliferation, migration, maturation, differentiation and signalling pathway. Biochem Biophys Res Commun. 2018;495(1):1447-1453. [41] VINGENDER S, DŐRI F, SCHMIDT P, et al. Evaluation of the efficiency of hyaluronic acid, PRP and I-PRF intra-articular injections in the treatment of internal derangement of the temporomandibular joint: a prospective study. J Cranio Maxill Surg. 2023;51(1):1-6. [42] WANG F, SUN Y, HE D, et al. Effect of concentrated growth factors on the repair of the goat temporomandibular joint. J Oral Max Surg. 2017;75(3):498-507. [43] MATSUMOTO S, YOKOTA S, CHOSA N, et al. Receptor tyrosine kinase ligands and inflammatory cytokines cooperatively suppress the fibrogenic activity in temporomandibular-joint-derived fibroblast-like synoviocytes via mitogen-activated protein kinase kinase/extracellular signal-regulated kinase. Exp Ther Med. 2020;20(3):1967-1974. [44] WANG Y, ZHAO M, LI W, et al. BMSC-derived small extracellular vesicles induce cartilage reconstruction of temporomandibular joint osteoarthritis via autotaxin–YAP signaling Axis. Front Cell Dev Biol. 2021;9:656153. [45] ZHAO C, CHEN JY, PENG WM, et al. Exosomes from adipose-derived stem cells promote chondrogenesis and suppress inflammation by upregulating miR-145 and miR-221. Mol Med Rep. 2020;21(4):1881-1889. [46] YAN L, WU X. Exosomes produced from 3D cultures of umbilical cord mesenchymal stem cells in a hollow-fiber bioreactor show improved osteochondral regeneration activity. Cell Biol Toxicol. 2020;36:165-178. [47] ZHANG S, CHU W, LAI R, et al. Exosomes derived from human embryonic mesenchymal stem cells promote osteochondral regeneration. Osteoarthr Cartilage. 2016;24(12):2135-2140. [48] CASADO JG, BLáZQUEZ R, VELA FJ, et al. Mesenchymal stem cell-derived exosomes: immunomodulatory evaluation in an antigen-induced synovitis porcine model. Front Vet Sci. 2017;4:39. [49] LUO P, JIANG C, JI P, et al. Exosomes of stem cells from human exfoliated deciduous teeth as an anti-inflammatory agent in temporomandibular joint chondrocytes via miR-100-5p/mTOR. Stem Cell Res Ther. 2019;10(1):216. [50] LIU Y, ZHANG Z, WANG B, et al. Inflammation‐Stimulated MSC‐Derived Small Extracellular Vesicle miR‐27b‐3p Regulates Macrophages by Targeting CSF‐1 to Promote Temporomandibular Joint Condylar Regeneration. Small. 2022;18(16):2107354. [51] TAN F, WANG D, YUAN Z. The fibroblast-like synoviocyte derived exosomal long non-coding RNA H19 alleviates osteoarthritis progression through the miR-106b-5p/TIMP2 axis. Inflammation. 2020;43(4):1498-1509. [52] LIU Q, WANG R, HOU S, et al. Chondrocyte-derived exosomes promote cartilage calcification in temporomandibular joint osteoarthritis. Arthritis Res Ther. 2022;24(1):44. [53] GONG S, EMPERUMAL CP, AL‐ERYANI K, et al. Regeneration of temporomandibular joint using in vitro human stem cells: a review. J Tissue Eng Regener Med. 2022;16(7):591-604. [54] LEE JD, BECKER JI, LARKIN LM, et al. Morphologic and histologic characterization of sheep and porcine TMJ as large animal models for tissue engineering applications. Clin Oral Invest. 2022;26(7): 5019-5027. [55] ZHAO Y, AN Y, ZHOU L, et al. Animal models of temporomandibular joint osteoarthritis: Classification and selection. Front Physiol. 2022; 13:859517. [56] 王悦,高文莫,耿威.颞下颌关节骨关节炎的实验动物建模研究进展[J].口腔颌面修复学杂志,2023,24(1):70-75. [57] JASIŃSKI T, TUREK B, KACZOROWSKI M, et al. Equine Models of Temporomandibular Joint Osteoarthritis: A Review of Feasibility, Biomarkers, and Molecular Signaling. Biomedicines. 2024;12(3):542. |
| [1] | Lai Pengyu, Liang Ran, Shen Shan. Tissue engineering technology for repairing temporomandibular joint: problems and challenges [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(在线): 1-9. |
| [2] | Han Haihui, Ran Lei, Meng Xiaohui, Xin Pengfei, Xiang Zheng, Bian Yanqin, Shi Qi, Xiao Lianbo. Targeting fibroblast growth factor receptor 1 signaling to improve bone destruction in rheumatoid arthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1905-1912. |
| [3] | Yuan Weibo, Liu Chan, Yu Limei. Potential application of liver organoids in liver disease models and transplantation therapy [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1684-1692. |
| [4] | Yang Zhihang, Sun Zuyan, Huang Wenliang, Wan Yu, Chen Shida, Deng Jiang. Nerve growth factor promotes chondrogenic differentiation and inhibits hypertrophic differentiation of rabbit bone marrow mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1336-1342. |
| [5] | Jin Kai, Tang Ting, Li Meile, Xie Yuan. Effects of conditioned medium and exosomes of human umbilical cord mesenchymal stem cells on proliferation, migration, invasion, and apoptosis of hepatocellular carcinoma cells [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1350-1355. |
| [6] | Aikepaer · Aierken, Chen Xiaotao, Wufanbieke · Baheti. Osteogenesis-induced exosomes derived from human periodontal ligament stem cells promote osteogenic differentiation of human periodontal ligament stem cells in an inflammatory microenvironment [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1388-1394. |
| [7] | De Ji, Suo Langda, Wei Yuchen, Wang Bin, Awangcuoji, Renqingcuomu, Cui Jiuzeng, Zhang Lei, Ba Gui. Comprehensive analysis of genes related to endometrial receptivity and alternative splicing events in northwest Tibetan cashmere goats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1429-1436. |
| [8] | Lyu Liting, Yu Xia, Zhang Jinmei, Gao Qiaojing, Liu Renfan, Li Meng, Wang Lu. Bibliometric analysis of research process and current situation of brain aging and exosomes [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1457-1465. |
| [9] | Peng Hongcheng, Peng Guoxuan, Lei Anyi, Lin Yuan, Sun Hong, Ning Xu, Shang Xianwen, Deng Jin, Huang Mingzhi . Role and mechanism of platelet-derived growth factor BB in repair of growth plate injury [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1497-1503. |
| [10] | Li Jialin, Zhang Yaodong, Lou Yanru, Yu Yang, Yang Rui. Molecular mechanisms underlying role of mesenchymal stem cell secretome [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1512-1522. |
| [11] | Cao Yue, Ye Xinjian, Li Biyao, Zhang Yining, Feng Jianying. Effect of extracellular vesicles for diagnosis and therapy of oral squamous cell carcinoma [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1523-1530. |
| [12] | Sun Yuting, Wu Jiayuan, Zhang Jian. Physical factors and action mechanisms affecting osteogenic/odontogenic differentiation of dental pulp stem cells [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1531-1540. |
| [13] | Chen Yuning, Jiang Ying, Liao Xiangyu, Chen Qiongjun, Xiong Liang, Liu Yue, Liu Tong. Buqi Huoxue Compounds intervene with the expression of related factors and autophagy related proteins in a rat model of cerebral ischemia/reperfusion [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1152-1158. |
| [14] | Li Shuai, Liu Hua, Shang Yonghui, Liu Yicong, Zhao Qihang, Liu Wen. Stress distribution on the maxilla when wearing the Twin-block appliance for Class II malocclusion [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 881-887. |
| [15] | Han Haihui, Meng Xiaohu, Xu Bo, Ran Le, Shi Qi, Xiao Lianbo. Effect of fibroblast growth factor receptor 1 inhibitor on bone destruction in rats with collagen-induced arthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 968-977. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||