Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (29): 4685-4690.doi: 10.12307/2024.581
Previous Articles Next Articles
3D-printed scaffolds repair infected bone defects
Dong Bo, Li Xiaoyu, Li Birong, Li Zhen, Wang Zixuan, Yin Zhaoyi, Meng Weiyan
- Department of Oral Implantology, Hospital of Stomatology, Jilin University, Changchun 130012, Jilin Province, China
-
Received:2023-09-06Accepted:2023-12-14Online:2024-10-18Published:2024-03-23 -
Contact:Meng Weiyan, Chief physician, Department of Oral Implantology, Hospital of Stomatology, Jilin University, Changchun 130012, Jilin Province, China -
About author:Dong Bo, Physician, Department of Oral Implantology, Hospital of Stomatology, Jilin University, Changchun 130012, Jilin Province, China
CLC Number:
Cite this article
Dong Bo, Li Xiaoyu, Li Birong, Li Zhen, Wang Zixuan, Yin Zhaoyi, Meng Weiyan. 3D-printed scaffolds repair infected bone defects[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(29): 4685-4690.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
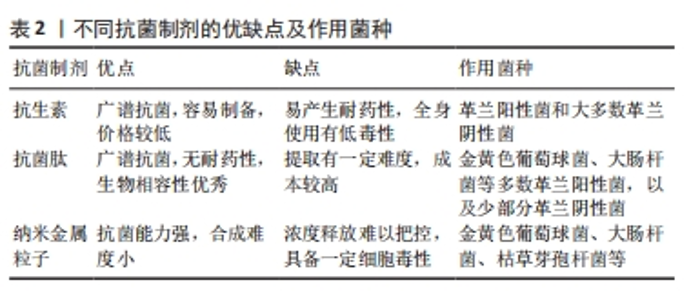
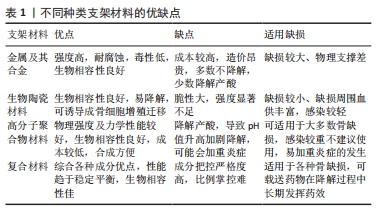
2.1.1 金属及其合金 金属因具有良好的力学性能被广泛应用到骨组织工程学中,目前常见的金属支架材料包括钛及其合金、镁、钽等。钛作为目前应用最广泛的金属支架材料,具有强度高、耐腐蚀、低毒性及生物相容性良好等特点。通过动态超分子组装方法将银纳米颗粒与纯钛复合作为植入支架,该材料的孔径约为350 μm、孔隙率约64%,在体内外实验中均表现出优异的促骨再生能力,并且增加支架的表面积和孔隙率可以增强植入物的初始稳定性,提高骨与支架之间的摩擦系数、减少微动、诱导骨内长、促进体内植入后的骨整合[8]。3D打印钛支架有利于骨长入,但其微孔结构也有利于细菌繁殖,并且纯钛支架无法降解,在临床应用中受到限制。钽是一种延展性较好的金属,具有较好的耐腐蚀性和低毒性,同时出色的骨诱导性及骨传导性使钽在骨组织工程中具有良好的应用前景[5]。通过选择性激光熔化技术制备具有相同结构钽和钛支架的平均孔径分别为406 μm和459 μm,孔隙率分别为58.5%和60.6%,均呈现了一定的成骨性能[9]。但由于熔点较高、无法降解及加工成本等问题,钽、铌的相关研究较少。近年来,镁及其合金由于可降解性成为被广泛关注的骨移植材料,但纯镁的耐腐蚀性差、降解速度太快,并且分解产生的H2使局部pH值升高,高浓度的Mg2+会对细胞产生毒性作用[10]。所以目前多数研究是构建镁合金支架或者构建磷酸镁等材料,具备一定成骨能力,但存在性能不够稳定等问题。 由此可见,作为3D打印支架材料时,金属材料主要起到提高物理强度和生物相容性的作用,但因为很多金属熔点过高需要高温打印,无法在支架打印过程中进行表面涂层,需后续结合药物或生物因子才能起到抗菌作用达到治疗感染性骨缺损的目的,故该方法适用于缺损较大、感染程度较轻的骨缺损。 2.1.2 生物陶瓷材料 生物陶瓷材料多数为无机物,具有良好的生物相容性、骨传导性能 [5]。常用的生物陶瓷材料主要包括羟基磷灰石、β-磷酸三钙、生物活性玻璃等。由于羟基磷灰石与人体骨矿物成分相似,具有良好的生物相容性和诱导成骨性能,成为骨组织工程和药物加载系统应用的热门研究课题[11]。通过常温气动打印再高温烧结去除有机成分的羟基磷灰石支架孔径为150-200 μm,具备更多吸附和生长位点[12],提供有利成骨的环境。但羟基磷灰石纯度提高时降解速度快,支架强度呈下降趋势。β-磷酸三钙是磷酸钙的一种高温相,其溶解速率和吸收降解速率显著快于羟基磷灰石[13]。3D打印个性化β-磷酸三钙仿生骨支架释放的钙磷离子随着时间延续不断沉积,材料表面钙磷离子浓度达到临界过饱和度而形成磷灰石颗粒有机物,促进成骨[14];支架孔径约为223 μm,孔隙率约为65%,平均最大压缩强度为3.83 MPa。β-磷酸三钙的性能与人体骨成分较接近,但依旧存在强度不足的缺点。生物活性玻璃作为3D打印支架材料用于骨组织工程中时受控溶解,成分中的Ca、P以及人为添加的其他离子可释放至临界浓度,供细胞增殖和分化需要,这构成了生物活性玻璃的一个独特特征[15]。BAINO等[16]利用海绵模板法烧结制备了硅酸盐基玻璃陶瓷支架,支架孔隙率为56%,弹性模量为380 MPa,抗压强度为18 MPa。生物活性玻璃有着良好的生物相容性及可调控性,但修改生物活性玻璃的成分也会影响支架的降解和生物活性。 因此,生物陶瓷材料虽具有良好的生物相容性以及较好的成骨相关结果,但作为人体硬组织的替代品,在合适的孔径以及孔隙率下明显存在强度不足、脆性高的缺点,因此很难以单独材料的形式应用于骨植入物。 2.1.3 高分子聚合物材料 高分子聚合材料具有良好的生物相容性和降解性,其物理强度及力学性能较生物陶瓷材料高很多,可分为人工合成聚合材料和天然聚合材料[5]。人工合成聚合材料主要有聚己内酯、聚乳酸羟基乙酸共聚物、聚乙二醇等,具有生物相容性良好、支架强度高等优点。聚己内酯作为生物降解材料已被广泛应用于3D打印支架的制备,与其他聚酯相比,聚己内酯的优点包括良好的生物相容性、相对较慢的降解速率以及较少的酸分解产物[17]。 采用高温3D打印技术制作掺杂碳化羟基磷灰石的仿生聚己内酯复合支架,打印温度为180 ℃,支架孔径为250-350 μm,具有更好的弹性模量、抗压强度及成骨性能[18]。然而,聚己内酯的疏水性和缺乏表面细胞识别位点限制了其在骨组织工程中的应用[19]。聚乳酸羟基乙酸共聚物是聚乳酸和聚乙醇酸的合成共聚物,可以溶解在广泛的溶剂中,并且可以很容易地操控制作所需的大小和形状,具有良好的生物相容性和力学强度[20]。在熔化温度197 ℃的条件下,通过熔融沉积法制作的3D打印聚乳酸羟基乙酸共聚物支架孔径为400 μm,孔隙率约为59%,应力测试显示该支架具有接近骨组织工程的最大应力 [21],但在研究过程中发现聚乳酸羟基乙酸共聚物存在降解性差、降解产酸及缺少细胞结合位点等缺点,需结合其他材料进行改性研究。天然聚合物常取自于壳聚糖、丝素蛋白等,有着良好的延展性、生物相容性和生物降解性。天然聚合物表面通常含有生物功能分子,可以帮助细胞在支架上附着、整合和分化[22]。壳聚糖是一种多糖,通常存在于甲壳类动物的壳中,作为一种用途广泛的半合成聚合物,除了抗菌和生物黏附特性外还具有良好的生物相容性和生物降解性[23],并且易被修饰,能结合多种基团或分子。HERMENEAN等[24]制备的富含氧化石墨烯的3D打印壳聚糖支架孔径在450-500 μm、孔隙率为63%,在小鼠颅骨缺损中展示了成骨分化和骨修复能力,但抗压强度为19 MPa,可见壳聚糖支架强度不足,在大面积骨缺损中的应用受限。 高分子聚合材料相对于陶瓷材料具有较好的力学性能,相对于金属材料又具备可降解的生物活性且成本低廉,被广泛研究,然而多数人工合成聚合材料降解产酸,有加重局部炎症的风险,常与生物陶瓷等材料结合使用。 2.1.4 复合材料 目前,由多种材料构成的复合材料在3D打印支架研究中被广泛应用,各种材料取长补短,可以更大程度满足多孔支架在组织工程中的需求。其中,聚合物与生物陶瓷的结合类似骨组织中有机成分与无机成分的结合,更接近真实的骨基质环境,被广泛用于骨组织工程研究[5]。人工合成高分子材料降解后会产酸,导致局部pH值降低、材料降解速度加剧[25],与羟基磷灰石联合应用可以中和局部pH值,进而调控支架降解速度。将聚乳酸羟基乙酸共聚物与羟基磷灰石结合可增强羟基磷灰石的机械强度,羟基磷灰石中含有的羟基可平衡pH值,进而改善局部环境[26]。通过高温3D打印技术构建了胺化壳聚糖与聚乳酸羟基乙酸共聚物/羟基磷灰石复合支架,纯聚乳酸羟基乙酸共聚物支架在270 ℃左右开始降解,在370 ℃左右降解完成,而聚乳酸羟基乙酸共聚物/羟基磷灰石支架和聚乳酸羟基乙酸共聚物/胺化壳聚糖/羟基磷灰石支架的起始降解温度在220 ℃左右,说明羟基磷灰石的加入调节了聚乳酸羟基乙酸共聚物难降解的特性 [27];动物成骨实验显示,聚乳酸羟基乙酸共聚物/胺化壳聚糖/羟基磷灰石组在整个实验过程中骨形态相对完整、新骨形成逐渐增多,感兴趣区域形态学分析显示聚乳酸羟基乙酸共聚物/胺化壳聚糖/羟基磷灰石组不同时间点的骨体积分数显著高于其他各组,可见羟基磷灰石改善了聚乳酸羟基乙酸共聚物的降解性,并且解决了降解产酸的问题。采用基于熔融沉积建模的3D打印技术制备不同纳米羟基磷灰石质量比(0%-30%)的圆柱形聚己内酯支架,支架具有规则的相互连接、有序多孔结构,孔径为300 μm,随着复合材料中纳米羟基磷灰石含量的增加,拉伸模量和压缩模量逐渐增大,含30%纳米羟基磷灰石的聚己内酯支架具有最高的拉伸模量和压缩模量,其力学性能与原生骨相近,聚己内酯明显改善了纳米羟基磷灰石脆性大的缺点[28]。 除了支架材料的选择,3D打印支架的孔隙率、孔径和分布也与骨整合能力密切相关。在骨组织工程中,直径为200-500 μm 的微孔具有更高的成骨细胞渗透性和血管形成的潜力,从而促进成骨[11]。如果支架的孔隙率为55%-70%,在结构和力学上与人体小梁骨相似,可加快成骨速度[22]。因此,3D打印支架无论选择何种材料都需要综合考虑上述因素,以获得最终良好的成骨效果。 2.2 治疗感染性骨缺损的3D打印抗菌制剂的应用 由于开放性骨缺损常伴有细菌感染,而感染会严重损害骨再生过程,临床治疗感染性骨缺损时除了对缺损处的局部重建,控制感染也是主要解决手段。感染性骨缺损的主要致病菌包括金黄色葡萄球菌、表皮葡萄球菌、铜绿假单胞菌及大肠杆菌等 [29]。对于临床不规则的开放骨缺损,需要在传统3D打印骨支架上进一步负载抗菌制剂促进骨重建,其中抗菌制剂的选择对感染愈合和骨重建质量具有重要影响。不同抗菌制剂的优缺点及作用菌种见表2。"
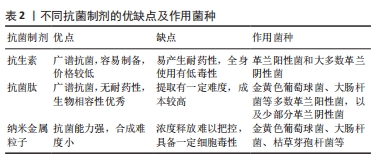
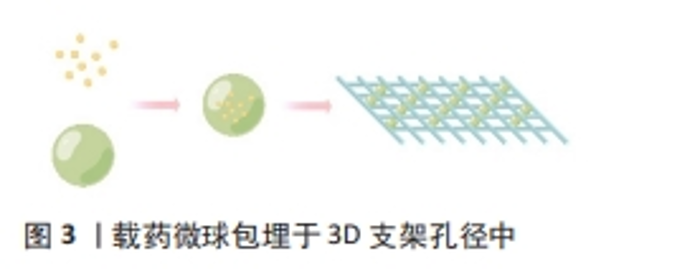
2.2.1 抗生素 抗生素作为最经典、应用最广泛的抗菌药物在传统骨感染治疗过程中使用广泛。抗生素产生杀菌作用主要有4种机制:抑制细菌细胞壁的合成、与细胞膜相互作用、干扰蛋白质的合成及抑制核酸的复制和转录[30]。3D打印支架递送抗菌药物时常将抗生素包裹于水凝胶或微球中,之后再负载到支架当中,较常用的抗生素有罗红霉素、万古霉素、多西环素以及左氧氟沙星等。采用熔融电流体力学3D打印技术制备含不同量罗红霉素的聚己内酯/聚乙二醇复合支架,在前6 h内,所有支架的罗红霉素释放量均达到70%以上,说明将药物包封在静电纺纤维中是提高低溶性药物溶出率和生物利用度的有效方法;另外,装载罗红霉素的支架周围出现了对大肠杆菌和金黄色葡萄球菌的明显抑制区[19]。应用低温快速3D打印技术制备含不同量万古霉素的聚乳酸羟基乙酸共聚物/磷酸三钙复合支架,3种复合支架材料前10 d的万古霉素缓释能力相当,均维持在50 g/L;另外,抑菌环实验也表明在20 d后抑菌带未见明显缩小,说明抗生素在支架上的释放速度相对稳定,能持续发挥抗菌作用[31]。通过 3D墨水打印技术构建含有多西环素的复合支架,可持续释放多西环素3周,并且在第1周释放浓度较高,该负载多西环素的支架能积极分泌骨形态发生蛋白2促进前期成骨,同时具有广谱抗菌能力,提高细胞生存性,显示出其修复感染性骨缺损的潜力[32]。CICUéNDEZ等[33]制备了3D打印纤维素/左氧氟沙星支架,该支架能够抑制金黄色葡萄球菌生长、破坏细菌生物膜,但不会对成骨细胞产生细胞毒性作用,同时允许前成骨细胞在其表面定植和分化;此外在生理条件(pH=7.4)下,药物释放缓慢而持续,在酸性pH值下药物释放明显更高。 抗生素可供选择的种类繁多,然而在3D打印支架中抗生素的释放情况与支架材料、孔隙率、局部pH值环境等因素息息相关,有待深入研究;并且抗生素本身细菌耐药性增加的缺点依旧存在,在一定程度上限制了临床应用[34]。 2.2.2 抗菌肽 抗菌肽是来源于自然的两亲性小分子多肽,具有广谱的抗菌、抗病毒、抗肿瘤活性,所有的生命形式中都有抗菌肽的存在[35]。膜渗透是抗菌肽对抗病原体的主要作用机制,抗菌肽与带负电荷的细菌表面结构进行静电作用,然后进入细胞膜与脂质双层膜相互作用,形成跨膜孔,导致细胞膜破坏[36]。通过改良W/O/W复乳溶剂挥发法制备负载抗菌肽KSL-W(KKVVFWVKFK-NH2)的聚乳酸羟基乙酸共聚物缓释微球,可以稳定释放抗菌肽达2周左右,继续通过低温3D打印技术制备负载缓释微球的3D复合支架,该支架对革兰阳性菌及革兰阴性菌都有良好的抑制作用,也能有效抑制生物膜的形成[37]。KARAMAT-ULLAH等[38]将抗菌肽改性的丝素与二氧化硅纳米结构联合构建3D打印仿生凝胶基复合支架,将含有精氨酸-甘氨酸-天冬氨酸(RGD)序列的抗菌肽(RGDKWKLFKKIGAVL KVLC)结合到缺乏序列的丝素当中,培养早期就可以显示出对革兰阴性菌较好的抗菌活性,有效地抑制生物膜的形成。可以看出抗菌肽具有良好生物相容性及诸多理想的性能,但抗菌肽的提取、用量以及如何在材料中保证稳定的生物活性仍需进一步探究。 2.2.3 纳米粒子 纳米粒子是指直径小于100 nm的纳米颗粒,当某些材料尺寸达到纳米级别时比表面能增加、吸附细菌的能力增强,使细菌细胞膜遭到破坏[39]。目前,有关纳米粒子的研究中以金属材料居多,其中银纳米粒子由于优良的抗菌性能被广泛研究,有研究发现,纳米银颗粒在吸附细菌的同时大量产生活性氧来干扰细菌DNA的复制,使抗菌特性得到增强[40]。同时,纳米银颗粒的黏附使膜由有序状态变为无序状态,并且在杀死过程中分解膜成分如脂肪酸、蛋白质和碳水化合物。纳米银颗粒能够与膜蛋白结合,显著干扰膜通透性、呼吸链、细胞分裂和离子运输[41]。在一定的还原条件下,氧化石墨烯可以诱导Ag离子直接在其表面生长,形成氧化石墨烯纳米银颗粒复合材料。WENG等[42]设计纳米银颗粒负载纳米羟基磷灰石还原氧化石墨烯3D打印支架,扫描电镜图像观察显示纳米银颗粒附着在支架表面,抗菌实验显示当复合支架中纳米银颗粒含量达到4%时,支架抗菌活性最强,抑制生物膜形成,表现出修复感染性骨缺损的潜能。除此之外,纳米银颗粒具有提高药物递送效率、改善光动力的治疗效果,可进一步加强杀菌作用[43]。然而由于纳米银颗粒表面能大,密度增加时极易自发团聚,导致抗菌活性大量丧失,并且纳米银颗粒不能被人体降解或排出,临床使用受限。因价格低廉且为人体微量元素之一,铜纳米颗粒也进入到学者们的研究视野当中,铜离子在不同氧化还原状态之间交替而具有抗菌功能[44]。铜离子会破坏细菌外膜的通透性导致细胞内容物泄漏,通过产生的高水平活性氧抑制细胞呼吸。在阴离子羧甲基壳聚糖和海藻酸盐混合物中加入纳米铜,进一步冷冻干燥形成复合支架,添加纳米铜的支架具有良好的生物相容性,可通过释放铜离子促进细胞黏附和成骨,并且对金黄色葡萄球菌及大肠杆菌都具有良好的抗菌作用,但抗生物膜表现不佳[45]。另外,有研究在TiO2纳米粒子中掺入2%的纳米铜,增强了在可见光照射下纳米粒子的抗菌性能[46]。就目前而言,纳米铜的抗菌作用远不如纳米银,并且存在高浓度的细胞毒性。 纳米粒子由于优良的抗菌性能成为近些年的研究热点,尤其在尺寸、表面化学、光学和热力学方面改进参数后抗菌性能会进一步提高。但是,金属纳米粒子本身可能在高浓度时存在细胞毒性以及代谢排出的问题,所以临床应用受限。其余无机纳米粒子如壳聚糖、脂质体等虽生物相容性较好,但抗菌能力较弱,常作为其他抗菌药物的纳米递送载体应用于骨组织工程中。 2.3 3D打印支架负载抗菌制剂方式 根据抗菌制剂自身的理化性质、大小、形态以及相应抗菌性能等差异,3D打印支架负载抗菌制剂的方式也有相应变化[47]。此外,也应考虑支架材料成分的特性,协同支架材料和抗菌制剂之间的关系,相互促进。目前常见的结合方法有以下3种:支架负载载药微球、支架表面制备抗菌涂层、抗菌制剂与支架材料混合打印,下面将进行详细阐述。 2.3.1 支架负载载药微球 将制备好的载药微球负载于多孔支架当中,根据支架孔径制备不同的微球(图3),此种方法适用于纳米粒子,可通过载体结合其他抗菌制剂,协同发挥功能。"

有学者采用乳化法制备异烟肼载药微球后,将携带微球的混合药物粉末与羟基磷灰石/β-磷酸三钙均匀混合加入水凝胶中,按照质量比5∶8均匀搅拌,制作不同微球含量的3D打印芯材,有效减少了药物突释的现象[48]。采用双乳化法制备万古霉素/聚乳酸羟基乙酸共聚物微球后,通过聚多巴胺涂层吸附到3D打印聚己内酯支架上,体外对金黄色葡萄球菌产生抑制作用达5 d。研究表明在支架内快速有效地构建结构良好的血管网络,对于移植后的骨修复至关重要[49]。采用微流控技术制备包封去铁胺脂质体的水凝胶微球,然后包埋于3D打印生物陶瓷支架的孔隙内,在这种复合支架中去铁胺在前6 h内有效释放36%,有利于促进支架内血管的快速生长;在随后的7 d内去铁胺的释放率达到69%,这构成了支架内血管形成及骨髓间充质干细胞成骨分化的前提[50]。这种负载方式药物释放平缓,极大减少了药物突释,但载药率低。药物释放速率受微球基质材料以及支架材料降解能力的影响,微球负载过多也会影响支架的强度[51]。 2.3.2 支架表面制备抗菌涂层 支架打印完成后,将抗菌制剂或载药微球通过化学键或者静电吸附结合在支架表面(图4),这种方式可最大限度保证支架形态和力学性能,支架的降解速度完全由支架材料决定,基本不受抗菌制剂的影响,适用于有吸附作用的抗菌制剂。"

通过化学键结合的共价接枝方法,在40 ℃反应持续12 h得到接枝抗菌剂壳聚糖季铵盐的聚乳酸羟基乙酸共聚物/羟基磷灰石复合支架[52],该支架能减少细菌黏附和生物膜的形成,促进成骨分化和血管形成。ZHANG等[53]将3D打印聚氨酯支架浸泡在2%盐酸多巴胺中24 h,支架表面形成聚多巴胺,然后放入氧化石墨烯悬浮液中24 h,使氧化石墨烯吸附在聚氨酯表面,结果显示氧化石墨烯的锋利边缘可以有效切割大肠杆菌,发挥良好的抗菌效果。BUYUKSUNGUR等[54]将3D打印的聚己内酯支架浸入纳米羟基磷灰石悬浮液中以涂覆羟基磷灰石,之后置于聚富马酸丙烯溶液中,最后制得聚己内酯/羟基磷灰石/聚富马酸丙烯复合支架。羟基磷灰石的加入提高了支架表面的亲水性,在酶和水的作用下聚己内酯/羟基磷灰石/聚富马酸丙烯支架表现出理想的降解率,呈现一定抗菌性能及较好的组织再生能力,但载药率较低、释放周期短,并且抗菌涂层会导致支架孔径以及孔隙率的减小。 2.3.3 抗菌制剂与支架材料混合打印 将抗菌制剂与支架材料按照一定比例预先混合后,再共同进行3D打印制备支架(图5),由于药物直接与材料进行物理混合,此种打印方式载药率较高且实验方法相对简单,抗菌制剂可随支架降解持续释放,适用于抗生素的负载。"

BAI等[19]将具有不同质量比(95∶0∶5、90∶5∶5、85∶10∶5、80∶15∶5)的聚己内酯、聚乙二醇和罗红霉素同时添加到30 mL四氢呋喃中,冷却后切割聚己内酯/聚乙二醇/罗红霉素复合物,将其放置在熔融3D打印设备上的注射器中,95 ℃熔融30 min,成功得到聚己内酯/聚乙二醇/罗红霉素复合支架,该支架可有效抑制生物膜形成、加快成骨。用磷酸银和利多卡因药物混合聚己内酯,采用气动挤压3D 打印技术制备多孔抑菌成骨支架,可通过调节打印口径的材料粗细来控制利多卡因药物的释放速率,但稳定性不足,前期出现了药物突释[55]。可见与支架材料共同打印时,抗菌制剂的释放速度也在一定程度上受支架材料孔径和孔隙率的影响,当与降解速度过快的材料混合使用时,前期容易出现药物突释。另外,在选取支架材料时需注意打印时温度、压强、光照等因素是否会影响抗菌制剂的性能。 2.4 成骨微环境相关调节 骨组织的修复和再生是一个复杂的过程,涉及多种细胞的参与,受多种因素的调控。免疫细胞和细胞因子在调节骨形成和骨吸收平衡中起着至关重要的作用[56]。3D打印支架能够驱动巨噬细胞向M2(抗炎/促修复)表型发展,并且增加M2型细胞中血管内皮生长因子和骨形态发生蛋白2的表达,进而刺激加快成骨[57]。此外,局部免疫环境促进M2型巨噬细胞通过凝血级联、PI3K/AKT信号通路、玻璃体蛋白和纤连蛋白交叉功能作用于细胞极化,发挥辅助杀菌作用[58]。研究表明,巨噬细胞数量的减少影响损伤组织的血管生成和延迟伤口愈合,而血管化和成骨诱导是骨再生的两个重要过程[59]。新骨组织的生长依赖于其内部的血液供应和周围的毛细血管化,如何选择正确的免疫因子和成血管相关因子作为骨再生治疗的靶点,建立有效的免疫微环境和血管化,以及如何使免疫调控、血供调节与骨组织工程相结合,仍是研究者面临的诸多问题[60]。"

| [1] SCHWARZ EM, PARVIZI J, GEHRKE T, et al. 2018 International consensus meeting on musculoskeletal infection: research priorities from the general assembly questions. J Orthop Res. 2019;37(5):997-1006. [2] YANO MH, KLAUTAU GB, DA SILVA CB, et al. Improved diagnosis of infection associated with osteosynthesis by use of sonication of fracture fixation implants. J Clin Microbiol. 2014;52:4176-4182. [3] IIKURA T, LEE SY, SAKAI Y, et al. Causative factors of fracture nonunion: the proportions of mechanical, biological, patient- dependent , and patient- independent factors. Orthop Sci. 2014;19(1):120-124. [4] METSEMAKERS WJ, KUEHL R, MORIARTY TF, et al. Infection after fracture fixation: Current surgical and microbiological concepts. Injury. 2018;49(3): 511-522. [5] 王进,葛建飞,郭开今,等.3D打印多孔材料应用于骨缺损修复的研究进展[J].中华骨与关节外科杂志,2019,12(7):556-560. [6] ZHU W, MA X, GOU M, et al. 3D printing of functional biomaterials for tissue engineering. Curr Opin Biotechnol. 2016;40:103-112. [7] 贺超,王磊,李国远,等.3D打印在骨科的应用[J].中华骨科杂志,2017, 37(19):1235-1241. [8] QIAO S, WU D, LI Z, et al. The combination of multi-functional ingredients-loaded hydrogels and three-dimensional printed porous titanium alloys for infective bone defect treatment. J Tissue Eng. 2020;11:2041731420965797. [9] ZHOU W, YAN J, LI Y, et al. Based on the synergistic effect of Mg2+ and antibacterial peptides to improve the corrosion resistance, antibacterial ability and osteogenic activity of magnesium-based degradable metals. Biomater Sci. 2021; 9(3): 807-825. [10] WANG H, SU K, SU L, et al. Comparison of 3D-printed porous tantalum and titanium scaffolds on osteointegration and osteogenesis. Mater Sci Eng C Mater Biol Appl. 2019;104:109908. [11] ABDUL HALIM NA, HUSSEIN MZ, KANDAR MK. Nanomaterials-Upconverted Hydroxyapatite for Bone Tissue Engineering and a Platform for Drug Delivery. Int J Nanomedicine. 2021;16:6477-6496. [12] KASTEN P, BEYEN I, BORMANN D, et al. The effect of two point mutations in GDF-5 on ectopic bone formation in a beta-tricalciumphosphate scaffold. Biomaterials. 2010;31(14):3878-3884. [13] 吴重草,郇志广,朱钰方,等.3D打印HA微球支架的制备与表征[J].无机材料学报,2021,36(6):601-607. [14] 段钢,陈宏亮,郭开今,等.3D打印β-磷酸三钙仿生骨支架修复兔股骨髁骨缺损[J].骨科临床与研究杂志,2020,5(4):243-250. [15] EL-RASHIDY AA, ROETHER JA, HARHAUS L, et al. Regenerating bone with bioactive glass scaffolds: A review of in vivo studies in bone defect models. Acta Biomater. 2017;62:1-28. [16] BAINO F, VITALE-BROVARONE C. Mechanical properties and reliability of glass-eceramic foam scaffolds for bone repair. Mater Lett. 2014;(118):27-30. [17] SEDDIGHIAN A, GANJI F, BAGHABAN-ESLAMINEJAD M, et al. Electrospun PCL scaffold modified with chitosan nanoparticles for enhanced bone regeneration. Prog Biomater. 2021;10(1):65-76. [18] MOGHADDASZADEH A, SEDDIQI H, NAJMODDIN N, et al. Biomimetic 3D-printed PCL scaffold containing a high concentration carbonated-nanohydroxyapatite with immobilized-collagen for bone tissue engineering: enhanced bioactivity and physicomechanical characteristics. Biomed Mater. 2021;16(6). doi: 10.1088/1748-605X/ac3147. [19] BAI J, WANG H, GAO W, et al. Melt electrohydrodynamic 3D printed poly (ε-caprolactone)/polyethylene glycol/roxithromycin scaffold as a potential anti-infective implant in bone repair. Int J Pharm. 2020;576:118941. [20] JIN S, XIA X, HUANG J, et al. Recent advances in PLGA-based biomaterials for bone tissue regeneration. Acta Biomater. 2021;127:56-79. [21] SONG X, LI X, WANG F, et al. Bioinspired Protein/Peptide Loaded 3D Printed PLGA Scaffold Promotes Bone Regeneration. Front Bioeng Biotechnol. 2022;10:832727. [22] TURNBULL G, CLARKE J, PICARD F, et al. 3D bioactive composite scaffolds for bone tissue engineering. Bioact Mater. 2017;3(3):278-314. [23] RAJABI M, MCCONNELL M, CABRAL J, et al. Chitosan hydrogels in 3D printing for biomedical applications. Carbohydr Polym. 2021;260:117768. [24] HERMENEAN A, CODREANU A, HERMAN H, et al. Chitosan-Graphene Oxide 3D scaffolds as Promising Tools for Bone Regeneration in Critical-Size Mouse Calvarial Defects. Sci Rep. 2017;7(1):16641-16612. [25] 郑扬,李危石,刘忠军.骨组织3D打印: 骨再生的未来[J].北京大学学报( 医学版),2015,47(2):203-206. [26] BABILOTTE J, MARTIN B, GUDURIC V, et al. Development and characterization of a PLGA-HA composite material to fabricate 3D-printed scaffolds for bone tissue engineering. Mater Sci Eng C Mater Biol Appl. 2021;118:111334. [27] YANG Y, CHU L, YANG S, et al. Dual-functional 3D-printed composite scaffold for inhibiting bacterial infection and promoting bone regeneration in infected bone defect models. Acta Biomater. 2018;79:265-275. [28] WANG Y, WANG J, GAO R, et al. Biomimetic glycopeptide hydrogel coated PCL/nHA scaffold for enhanced cranial bone regeneration via macrophage M2 polarization-induced osteo-immunomodulation. Biomaterials. 2022; 285:121538. [29] TRAMPUZ A, ZIMMERLI W. Diagnosis and treatment of infections associated with fracture-fixation devices. Injury. 2006;37: 59-66. [30] WRIGHT GD. Antibiotic Adjuvants: Rescuing Antibiotics from Resistance. Trends Microbiol. 2016;24(11):862-871. [31] 许刚,何纯青,张飞,等.低温3D打印复合万古霉素/PLGA/TCP骨修复材料的制备与性能评估[J].中国美容医学,2021,30(5):59-62. [32] WANG M, LI H, YANG Y, et al. A 3D-bioprinted scaffold with doxycycline-controlled BMP2-expressing cells for inducing bone regeneration and inhibiting bacterial infection. Bioact Mater. 2020;6(5):1318-1329. [33] CICUÉNDEZ M, DOADRIO JC, HERNÁNDEZ A, et al. Multifunctional pH sensitive 3D scaffolds for treatment and prevention of bone infection. Acta Biomater. 2018;65:450-461. [34] 李善龙,从凯,尚剑,等.抗生素缓释载体在慢性骨髓炎治疗中的应用进展[J].临床与病理杂志,2021,41(4):934-941. [35] 辛本凯,王会岩.抗菌肽在抗菌材料中的研究进展[J].吉林医药学院学报,2021,42(1):53-55. [36] YAN Y, LI Y, ZHANG Z, et al. Advances of peptides for antibacterial applications. Colloids Surf B Biointerfaces. 2021;202:111682. [37] LI C, XU X, GAO J, et al. 3D printed scaffold for repairing bone defects in apical periodontitis. BMC Oral Health. 2022;22(1):327. [38] KARAMAT-ULLAH N, DEMIDOV Y, SCHRAMM M, et al. 3D Printing of Antibacterial, Biocompatible, and Biomimetic Hybrid Aerogel-Based Scaffolds with Hierarchical Porosities via Integrating Antibacterial Peptide-Modified Silk Fibroin with Silica Nanostructure. ACS Biomater Sci Eng. 2021; 7(9):4545-4556. [39] WANG L, HU C, SHAO L. The antimicrobial activity of nanoparticles:present situation and prospects for the future. Int J Nanomed. 2017;12:1227-1249. [40] JANCZAK K, KOSMALSKA D, KACZOR D, et al. Bactericidal and Fungistatic Properties of LDPE Modified with a Biocide Containing Metal Nanoparticles. Materials (Basel). 2021;14(15):4228. [41] TANG S, ZHENG J. Antibacterial Activity of Silver Nanoparticles: Structural Effects. Adv Healthc Mater. 2018;7(13):e1701503. [42] WENG W, LI X, NIE W, et al. One-Step Preparation of an AgNP-nHA@RGO Three-Dimensional Porous Scaffold and Its Application in Infected Bone Defect Treatment. Int J Nanomedicine. 2020;15:5027-5042. [43] 张昌,任恩,庞鑫,等.光动力抗菌纳米制剂研究进展[J].中国激光, 2020,47(2):163-170. [44] LI M, MA Z, ZHU Y, et al. Toward a Molecular Understanding of the Antibacterial Mechanism of Copper-Bearing Titanium Alloys against Staphylococcus aureus. Adv Healthc Mater. 2016;5(5):557-566. [45] LU Y, LI L, ZHU Y, et al. Multifunctional Copper-Containing Carboxymethyl Chitosan/Alginate Scaffolds for Eradicating Clinical Bacterial Infection and Promoting Bone Formation. ACS Appl Mater Interfaces. 2018;10(1): 127-138. [46] LEYLAND NS, PODPORSKA-CARROLL J, BROWNE J, et al. Cu doped TiO2 anti-bacterial visible light active photocatalytic coatings to combat hospital-acquired infections. Sci Rep. 2016;6:24770. [47] 李仕明,李永亮,毛傲飞,等.支架载药微纳结构的加工进展[J].激光杂志,2018,39(3):1-4. [48] 谭浩,周建平,许燕,等.3D打印异烟肼载药微球支架及体外释药研究[J].燕山大学学报,2022,46(1):38-45. [49] ZHOU Z, YAO Q, LI L, et al. Antimicrobial Activity of 3D-Printed Poly(ε-Caprolactone) (PCL) Composite Scaffolds Presenting Vancomycin-Loaded Polylactic Acid-Glycolic Acid (PLGA) Microspheres. Med Sci Monit. 2018;24: 6934-6945. [50] HAN X, SUN M, CHEN B, et al. Lotus seedpod-inspired internal vascularized 3D printed scaffold for bone tissue repair. Bioact Mater. 2020;6(6):1639-1652. [51] HESS U, SHAHABI S, TRECCANI L, et al. Co-delivery of cisplatin and doxorubicin from calcium phosphate beads/matrix scaffolds for osteosarcoma therapy. Mater Sci Eng C Mater Biol Appl. 2017;77:427-435. [52] YANG Y, YANG S, WANG Y, et al. Anti-infective efficacy, cytocompatibility and biocompatibility of a 3D-printed osteoconductive composite scaffold functionalized with quaternized chitosan. Acta Biomater. 2016;46:112-128. [53] ZHANG S, SHI X, MIAO Z, et al. 3D-Printed Polyurethane Tissue‐Engineering Scaffold with Hierarchical Microcellular Foam Structure and Antibacterial Properties. Adv Eng Mater. 2022;24(3):2101134. [54] BUYUKSUNGUR S, ENDOGAN TANIR T, BUYUKSUNGUR A, et al. 3D printed poly(ε-caprolactone) scaffolds modified with hydroxyapatite and poly(propylene fumarate) and their effects on the healing of rabbit femur defects. Biomater Sci. 2017;5(10):2144-2158. [55] SHAO J, MA J, LIN L, et al. Three-Dimensional Printing of Drug-Loaded Scaffolds for Antibacterial and Analgesic Applications. Tissue Eng Part C Methods. 2019;25(4):222-231. [56] YANG N, LIU Y. The Role of the Immune Microenvironment in Bone Regeneration. Int J Med Sci. 2021;18(16):3697-3707. [57] LIU X, CHEN M, LUO J, et al. Immunopolarization-regulated 3D printed-electrospun fibrous scaffolds for bone regeneration. Biomaterials. 2021; 276:121037. [58] HU W, CHEN Y, DOU C, et al. Microenvironment in subchondral bone: predominant regulator for the treatment of osteoarthritis. Ann Rheum Dis. 2021;80(4):413-422. [59] ERIKSEN EF. Cellular mechanisms of bone remodeling. Rev Endocr Metab Disord. 2010,11(4):219-227. [60] SALHOTRA A, SHAH HN, LEVI B, et al. Mechanisms of bone development and repair. Nat Rev Mol Cell Biol. 2020;21(11):696-711. |
| [1] | Chen Kaijia, Liu Jingyun, Cao Ning, Sun Jianbo, Zhou Yan, Mei Jianguo, Ren Qiang. Application and prospect of tissue engineering in treatment of osteonecrosis of the femoral head [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1450-1456. |
| [2] | Bai Chen, Yang Wenqian, Meng Zhichao, Wang Yuze. Strategies for repairing injured anterior cruciate ligament and promoting graft healing [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1457-1463. |
| [3] | Wang Menghan, Qi Han, Zhang Yuan, Chen Yanzhi. Three kinds of 3D printed models assisted in treatment of Robinson type II B2 clavicle fracture [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1403-1408. |
| [4] | Yu Weijie, Liu Aifeng, Chen Jixin, Guo Tianci, Jia Yizhen, Feng Huichuan, Yang Jialin. Advantages and application strategies of machine learning in diagnosis and treatment of lumbar disc herniation [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1426-1435. |
| [5] | Lin Zeyu, Xu Lin. Research progress in gout-induced bone destruction mechanism [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1295-1300. |
| [6] | Ma Shuwei, He Sheng, Han Bing, Zhang Liaoyun. Exosomes derived from mesenchymal stem cells in treatment of animals with acute liver failure: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1137-1142. |
| [7] | Ning Tianliang, Wang Kun, Wang Lingbiao, Han Pengfei. Finite element analysis on correction effect of varus foot orthosis based on the three-point force principle [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(6): 891-899. |
| [8] | Zhang Kefan, Shi Hui. Research status and application prospect of cytokine therapy for osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(6): 961-967. |
| [9] | Xu Rong, Wang Haojie, Geng Mengxiang, Meng Kai, Wang Hui, Zhang Keqin, Zhao Huijing. Research advance in preparation and functional modification of porous polytetrafluoroethylene artificial blood vessels [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 759-765. |
| [10] | Chen Xiaofang, Zheng Guoshuang, Li Maoyuan, Yu Weiting. Preparation and application of injectable sodium alginate hydrogels [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 789-794. |
| [11] | Liu Chuang, Shan Shuo, Yu Tengbo, Zhou Huan, Yang Lei. Advantages, discomfort and challenges of clinical application of orthopedic hemostatic materials [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 795-803. |
| [12] | Shen Ziqing, Xia Tian, Shan Yibo, Zhu Ruijun, Wan Haoxin, Ding Hao, Pan Shu, Zhao Jun. Vascularized tracheal substitutes constructed by exosome-load hydrogel-modified 3D printed scaffolds [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 697-705. |
| [13] | Wang Jianchun, Yang Shuqing, Su Xin, Wang Hongyuan. Different contents of B2O3 affect mechanical properties and bioactivity of bioactive glass scaffolds [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 712-716. |
| [14] | Zhang Yihai, Shang Peng, Ma Benyuan, Hou Guanghui, Cui Lunxu, Song Wanzhen, Qi Dexuan, Liu Yancheng. Structural design and mechanical property analysis of trabecular scaffold of triply periodic minimal surface with a radial gradient [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 741-746. |
| [15] | Li Jiaqi, Huang Yuanli, Li Yan, Wang Chunren, Han Qianqian. Mechanism and influencing factors in molecular weight degradation of non-cross-linked hyaluronic acid [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(5): 747-752. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||