Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (25): 4087-4093.doi: 10.12307/2024.146
Previous Articles Next Articles
Action mechanism of traditional Chinese medicine and mesenchymal stem cells regulating immune response in treatment of amyotrophic lateral sclerosis
Wang Shaona1, Gao Chen1, Fan Feiyan1, Liu Feixiang2, Zhang Yunke1, 2
- 1Henan University of Chinese Medicine, Zhengzhou 450046, Henan Province, China; 2The First Affiliated Hospital of Henan University of Chinese Medicine, Zhengzhou 450046, Henan Province, China
-
Received:2023-03-08Accepted:2023-04-24Online:2024-09-08Published:2023-11-24 -
Contact:Zhang Yunke, Chief physician, MD, Professor, Doctoral supervisor, Post-doctoral cooperative supervisor, Henan University of Chinese Medicine, Zhengzhou 450046, Henan Province, China; The First Affiliated Hospital of Henan University of Chinese Medicine, Zhengzhou 450046, Henan Province, China -
About author:Wang Shaona, Master candidate, Henan University of Chinese Medicine, Zhengzhou 450046, Henan Province, China -
Supported by:National Natural Science Foundation of China, No. 81974564 (to ZYK); National Natural Science Foundation of China, No. 82104730 (to LFX); Central Plains Talent Program - Leading Talents in Science and Technology Innovation, No. 224200510027 (to ZYK)
CLC Number:
Cite this article
Wang Shaona, Gao Chen, Fan Feiyan, Liu Feixiang, Zhang Yunke. Action mechanism of traditional Chinese medicine and mesenchymal stem cells regulating immune response in treatment of amyotrophic lateral sclerosis[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(25): 4087-4093.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks

2.1 肌萎缩侧索硬化的免疫炎症机制 免疫系统是人体抵抗内外传染源的中间防御环节,先天免疫反应和适应性免疫反应作为宿主整体免疫系统的主要成分,两者截然不同但动态相辅以抵御病原体入侵维持宿主细胞稳态。在肌萎缩侧索硬化的病程中,小胶质细胞活化一方面启动先天免疫反应并以抗原呈递方式激活T细胞亚群(适应性免疫反应)释放额外因子放大炎症反应,T细胞(包括CD4+T及CD8+T细胞)在肌萎缩侧索硬化炎症环境中进入脊髓,其中CD4+T细胞反向分泌抗炎因子白细胞介素10调控小胶质细胞表型减弱对运动神经元毒性;而多数毒性CD8+T细胞浸润并损害人体组织;另一方面释放的反应性神经胶质因子可破坏血脊髓屏障紧密性,而其屏障损伤又加速适应性免疫细胞浸润[12];此外补体系统扩散为非细胞自主损伤的炎症驱动力。可见先天免疫和适应性免疫反应间常互相影响构成恶性循环,两者持续且突出的激活加大了对运动神经元的破坏力。"


2.2 中药治疗肌萎缩侧索硬化的免疫机制研究 目前,在治疗肌萎缩侧索硬化这种免疫相关性运动神经元病中,常需要一种药物或多种药物协同配合以改变其病理变化,而具有免疫调节的中药在其中发挥着不可或缺的优势作用。因此,中药单体及其复方可通过保护血脑屏障(肌萎缩侧索硬化免疫屏障)、抗神经炎症、抑制补体系统激活、抑制自然杀伤细胞毒性和调节T细胞等免疫途径治疗肌萎缩侧索硬化。 2.2.1 中药单体 冰片、黄芪甲苷均能上调闭锁小带蛋白1、闭合蛋白5表达,两者配伍和三七总甲苷协同抑制闭锁小带蛋白1和咬合蛋白下调,从而保护血脑屏障[13-14],而人参皂苷 Rg1也可显著上调闭锁小带蛋白1和咬合蛋白水平,并下调基质金属蛋白酶2、基质金属蛋白酶9表达恢复血脑屏障完整性[15],故表明中药有效成分可能间接调控影响血脑屏障通透性的因子来重建肌萎缩侧索硬化免疫屏障完整性;半枝莲提取物[16]、广藿香提取成分槲皮素7,3’,4’-三甲醚[17]、虎杖提取到的迷人醇成分和紫花地丁提取成分均可介导补体经典通路来抑制补体系统活性[18-19],尤其以广藿香有效成分抑制作用最强,但它们各自发挥抗补体活性作用靶点不全一致。 半枝莲提取物以C1r,C1s,C3,C4作为其主要作用靶点,广藿香提取成分以 C1q,C2,C5,C9为其主要作用靶点;不同的是后两者亦可经旁通路途径发挥抗补体活性,其中虎杖提取物以C1q,C2,C4 及C9作为其主要作用靶点,紫花地丁成分可通过不同补体靶点或多靶点发挥抗补体活性作用。雷公藤提取物(雷公藤红素)可通过阻断细胞外信号调节激酶1 /2和核因子kB磷酸化以减少促炎因子和一氧化氮产生,从而抑制自身免疫发挥抗炎效果[20]。蜂毒中提取的有效成分蜂毒肽广泛被认定为具有较大抗炎活性,可直接降低小胶质细胞活性或间接减少炎症因子分泌、脑干和脊髓中P38丝裂原活化蛋白激酶磷酸化水平,明显调整肌萎缩侧索硬化小鼠神经炎症,延缓疾病发展[21]。紫河车提取物可抑制c-Jun氨基末端激酶信号通路传导,减少小胶质细胞诱导型一氧化氮合酶和环氧合酶2表达,发挥抗炎作用[22]。从中药栝蒌根提取的天花粉蛋白以剂量依赖性方式可直接上调调节性T细胞数量、免疫指标白细胞介素10水平和诱导叉状头螺旋转录因子3更高表达而增强调节性T细胞免疫调节能力,发挥更稳定的免疫抑制功能[23]。瞿麦可溶性组分二氯甲胺可改变AKT磷酸化信号传导(与调节性T细胞分化相关)并降低辅助性T细胞17分化,诱导调节性T细胞增殖维持平衡改变免疫环境[24]。中药单体调控免疫反应治疗肌萎缩侧索硬化的作用机制见表1。"

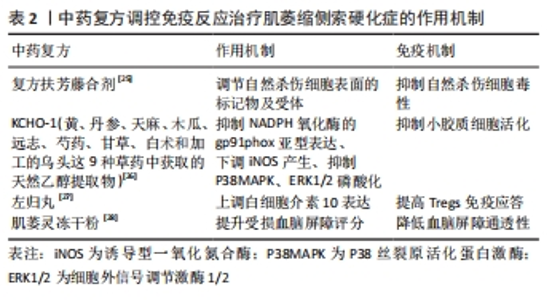
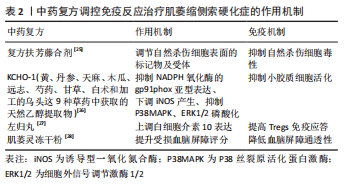
2.2.2 中药复方 扶芳藤、黄芪和红参三味中药组成的复方扶芳藤合剂具有益气健脾、养血补心和活血通络功效,可上调自然杀伤细胞表面CD2、CD95、PD-1受体和活化分子,被认为是自然杀伤细胞最好的免疫调节剂[25];KCHO-1主要是从姜黄、丹参、天麻、木瓜、远志、芍药、甘草、白术和加工的乌头9种草药中获取的天然乙醇提取物,研究发现将其给药后通过降低NADPH氧化酶的gp91phox亚型表达、下调诱导型一氧化氮合酶水平和减轻P38丝裂原活化蛋白激酶磷酸化和细胞外信号调节激酶1/2的激活减少氧化应激反应,抑制小胶质细胞增殖活化,从而发挥免疫调节作用改善运动活性从而延缓肌萎缩侧索硬化小鼠模型疾病进展[26]。左归丸能上调免疫指标白细胞介素10,但发现免疫抑制能力与左归丸的使用剂量有关,尤以中剂量使用时显著提高调节性T细胞的免疫应答功能[27]。肌萎灵相关制剂独有扶元起萎、养荣生肌及益气通络之效,主要组成包括人参、鹿茸及何首乌等,其中肌萎灵冻干粉可显著提高受损小鼠血脑屏障评分,延缓神经元水肿,降低血脑屏障通透性进而延缓病情进展[28],而其他类型制剂在临床亦或是基础实验研究中均对肌萎缩侧索硬化治疗起到意想不到的疗效。 以上研究表明,中药单体和中药复方可不同程度地调节闭锁小带蛋白1及闭合蛋白5等相关蛋白、细胞外信号调节激酶1/2信号传导、C4C9补体因子及诱导型一氧化氮合酶、环氧合酶2等炎症因子的表达,进而恢复血脑屏障稳定性、减弱自然杀伤细胞毒性、抑制小胶质细胞和补体系统激活、调节T细胞功能,发挥特有的免疫特性来调控先天免疫和适应性免疫靶向治疗肌萎缩侧索硬化。中药复方调控免疫反应治疗肌萎缩侧索硬化的作用机制见表2。"

2.3 间充质干细胞治疗肌萎缩侧索硬化的免疫机制 因肌萎缩侧索硬化疾病治疗需求不断增加,而间充质干细胞被公认为具有可塑性和免疫调节特性,促其成为治疗肌萎缩侧索硬化最有力的候选者。另外间充质干细胞衍生的外泌体具有最小免疫原性特点,既能调节炎症反应又能刺激内源性神经发生,也为肌萎缩侧索硬化疾病免疫治疗提供巨大潜力。因此,免疫调节已成为间充质干细胞或外泌体治疗肌萎缩侧索硬化的潜在治疗方法。 2.3.1 重建血液中枢神经系统屏障完整性 血液中枢神经系统屏障包含血脑屏障和血脊髓屏障,是肌萎缩侧索硬化重要的免疫屏障,可高效阻碍有毒物质从血液渗入中枢神经系统并向外泵出毒素。 间充质干细胞可改善血管末梢星形胶质细胞完整性,降低破坏肌萎缩侧索硬化血脑屏障的水通道蛋白4表达,维持细胞内外离子和水通道平衡阻止内源性免疫介质进入运动神经元微环境[29];间充质干细胞治疗时促进Wnt转录并增强其自身治疗潜力[30],而其中Wnt5a转录通过激活平面细胞极性(Par/aPKC PCP)途径来稳定脑内皮细胞紧密连接,保持血脑屏障完整性[31];间充质干细胞可减少与血管内皮生长因子A相关的内皮型一氧化氮合酶信号传导,稳定紧密连接蛋白表达,降低血脑屏障通透性[32]。间充质干细胞或是间充质干细胞源性外泌体(mesenchymal stem cells exosomes,MSCs-Exo)均可直接改善内皮细胞增殖、上调紧密连接蛋白(闭锁小带蛋白1、闭合蛋白5、咬合蛋白)水平[33-34],其中外泌体可穿过血脑屏障直接作用于运动神经元并稳定血脑屏障;间充质干细胞可提升周细胞覆盖率使其辅助星形胶质细胞,同内皮细胞重新塑造微血管系统[35]。人骨髓间充质干细胞移植后观察到层黏连蛋白显著表达(尤其是肌萎缩侧索硬化中表达较少的层黏连蛋白α2、α5[36]),且数据显示高剂量细胞移植增强了基底膜的完整性,证明人骨髓间充质干细胞可促进血管生成阻碍基底膜破裂进而恢复血脊髓毛细血管通透性[37]。此外研究证实,间充质干细胞来源的细胞外囊泡及脂肪间充质干细胞分泌的外泌体(adipose- derived stem cells exosomes,ADSCs-exo)均能改善病理条件下线粒体功能障碍[38-39],前者亦能平衡线粒体动力学、极大限度减少线粒体损伤、加速线粒体功能恢复,从而保持血液中枢神经系统屏障完整。 2.3.2 抑制自然杀伤细胞毒性 自然杀伤细胞是肌萎缩侧索硬化发病机制中发挥核心作用的先天免疫细胞,同时也是适应性免疫关键组成部分,是具有显著毒性的活性细胞。免疫细胞在稳态环境下不会攻击人体自身组织细胞,而自然杀伤细胞可以裂解自身细胞,使其受损。间充质干细胞主要削弱自然杀伤细胞活化和增殖,两者形成稳定的炎症-修复系统抵御外界侵害,主要机制为:①刺激γ干扰素产生;②介导可溶性因子修饰;③以直接接触方式调控。 影响γ干扰素释放:一方面间充质干细胞以剂量、单核细胞趋化因子1依赖方式增加白细胞介素12和白细胞介素18含量(正常情况下,两者刺激自然杀伤细胞分泌γ干扰素)进一步诱导γ干扰素分泌;另一方面间充质干细胞增强自然杀伤细胞中参与γ干扰素重要转录因子的白细胞介素12受体表达和转录激活因子4信号磷酸化诱导γ干扰素合成[40]。正常细胞表达主要组织相容性复合体Ⅰ类分子并保护其免受自然杀伤细胞介导裂解,间充质干细胞对自然杀伤细胞的易感性同其主要组织相容性复合体Ⅰ类分子表达水平呈负相关,表达较高水平主要组织相容性复合体Ⅰ类分子的间充质干细胞在体内存活时间更长且逃避自然杀伤细胞毒性,进而在体内表现更高的免疫抑制活性[41]。而γ干扰素分泌增加刺激主要组织相容性复合体Ⅰ类分子上调,升高间充质干细胞在体内外的存活率,从而削弱自然杀伤细胞介导的细胞毒性发挥更强免疫调节能力。 合成可溶性因子:间充质干细胞可合成调节细胞外信号调节激酶1/2信号传导或降低CD56和γc链表达的前列腺素E2来抑制自然杀伤细胞毒性[42]。自然杀伤细胞自身释放的白细胞介素1β常为环加氧酶2途径激活物,当间充质干细胞同自然杀伤细胞密切接触时,刺激更大量前列腺素E2从而产生更有效抑制作用[43],可见其可能首先经负反馈机制将信号传至间充质干细胞以抑制其自身活性,间充质干细胞存在加强抑制效果。转化生长因子β、吲哚胺2,3-双加氧酶是间充质干细胞分泌的另外两种因子常同前列腺素E2相互协同,减少刺激受体NKp30,NKp44在自然杀伤细胞上的表达[44],降低CD132表达改变自然杀伤细胞亚型[45],使其活性完全受损。 直接接触方式:间充质干细胞同细胞直接接触时对自然杀伤细胞影响更大,一方面两者共培养后CD73表达增多,而新CD73自然杀伤细胞可将5-磷酸腺苷转化为具备免疫调节作用的腺苷并通过自分泌或旁分泌调节自然杀伤细胞免疫功能[46];另一方面两者直接接触后显著下调自然杀伤细胞上介导其细胞毒性功能的两个关键激活受体CD244和自然杀伤2成员D(NKG2D)水平[47]。 2.3.3 抑制补体系统异常激活 补体系统是先天免疫系统的核心分支,由受体和调节蛋白构成并以级联反应方式增强免疫反应,一方面可清除由细胞应激反应或死亡所产生的外来有害威胁,另一方面可借助补体受体具备调节炎症的能力,监测调节免疫功能。间充质干细胞具备强大且广泛的抗补体活性作用,对抑制补体系统介导损伤的机制主要为分泌因子H抑制补体活化:因子H是天然的补体调节剂,既可抑制C3、C5转化酶形成并减缓神经元衰变进程;又可作为辅助因子促使C3b、C4b失去活性。因子H缺乏将导致补体活化增强,而间充质干细胞可产生因子H抑制补体失调[48],从而恢复运动神经元直接损伤。现有研究发现,间充质干细胞因其免于宿主细胞监视,对先天性免疫亦是适应性免疫均可经多种机制表现出巨大的免疫调节活性,但间充质干细胞输注后奇怪消失且自身活性与功能降低,所以目前寻找不仅能抑制补体而且提高间充质干细胞活性与输注后功能的新方法。然而最近体外实验研究结果显 示,给予有效补体抑制剂肝素(抑制经典和替代补体途径)后可保护间充质干细胞免受补体介导损伤更好地发挥其功能[49],其次招募因子H至间充质干细胞表面局部抑制补体活化。 2.3.4 抑制小胶质细胞活化 小胶质细胞是中枢神经系统常驻的巨噬细胞,具有监测细胞外环境和免疫防御作用。小胶质细胞激活是神经炎症重要组成部分,但持续性神经炎症刺激常导致神经退行性病变。在肌萎缩侧索硬化中,运动神经元与小胶质细胞可相互作用,疾病早期对运动神经元发挥保护性源于分化出促进修复及再生的M2型小胶质细胞,而在疾病进展过程中,受损的运动神经元里含有数量较多的M1型小胶质细胞,表明M1型小胶质细胞参与运动神经元变性并促进疾病进展。 间充质干细胞抑制小胶质细胞活化,延缓运动神经损伤机制主要包括:①直接抑制增殖:肖昆太等[50]研究发现人羊膜间充质干细胞同小胶质细胞共培养时,明显抑制小胶质细胞增殖和迁移,但具体通路尚不清晰;周葳[51]研究发现,人脐带间充质干细胞来源的外泌体(human umbilical cord mesenchymal stem cell exosomes,hUC-MSC-Exo)可明显降低小胶质细胞增殖活性进行免疫调节,且抑制程度同外泌体浓度呈正相关。②调控小胶质细胞表型:间充质干细胞可释放能够激活M2型、消退M1型并将促炎毒性环境转为抗炎神经保护的转化生长因子β来改善免疫微环境,改变小胶质细胞表型[52]。也有研究认为,这些可溶性因子是由间充质干细胞外泌体作用,但具体是哪种类型需进一步深入研究[53]。郝磊等[54]研究发现骨髓间充质干细胞外泌体(bone marrow mesenchymal stem cells exosomes,BMSCs-Exo)可携带miR-124-1基因明显降低肿瘤坏死因子α、白细胞介素6水平和升高CD206、白细胞介素10表达,从而调控小胶质细胞向其M2型转化,抑制炎症反应;此外间充质干细胞不仅可直接分泌趋化因子CX3CL1,也能刺激星形胶质细胞分泌或促进小胶质细胞趋化因子受体 CX3CR1表达,调控CX3CL1 /CX3CR1系统轴实现运动神经元与小胶质细胞之间正向对话,调控保护型小胶质细胞发生[55]。 2.3.5 调控T细胞 促进CD4+T细胞增殖、抑制CD8+T细胞扩增:T细胞是适应性免疫核心参与者,CD4+T细胞和CD8+T细胞为T细胞常见的两个亚型。其中CD4+T细胞于肌萎缩侧索硬化期间可调节M2型小胶质细胞表达来支持对运动神经元保护,其缺失易引起运动神经元丧失并加速疾病进展;CD8+T细胞被认为具有双向作用,在外周发挥神经保护而在中枢神经系统浸润时触发运动神经元死亡[56]。 间充质干细胞在体内体外均具有调节免疫能力,其对T细胞及T细胞亚型的调控机制为:①间充质干细胞自身比例高低主要决定T细胞数量,低水平的间充质干细胞促进T细胞扩增,相反高水平的间充质干细胞抑制T细胞增殖,为肌萎缩侧索硬化患者T细胞重建提供方向;有研究发现间充质干细胞衍生的外泌体含有众多蛋白质,其通过下调Cdk2蛋白和上调p27kip蛋白表达,来阻碍细胞周期进行有效抑制T细胞增殖[57];另外间充质干细胞衍生的外泌体可表达细胞程序性死亡配体1(PD-L1)和转化生长因子β,其中前者与T细胞表面受体结合阻断细胞间负信号传导通路,抑制T细胞活化,后者经内在配体受体相互作用发挥更强大的抗增殖效果[58]。②间充质干细胞中含有高水平的CC趋化因子配体2,当使用CC趋化因子配体2阻断剂治疗后CD4+T细胞水平明显下降,CC趋化因子配体2高水平产生使得间充质干细胞获取较高免疫刺激并介导其刺激CD4+T细胞增殖[59]。③间充质干细胞可明显抑制CD8+T细胞扩增、分化和活化为细胞毒性细胞[60]。 增强调节性T细胞功能:调节性T细胞(Tregs)是免疫反应基本调节剂,可抑制对宿主有害的先天免疫和适应性免疫反应,因发现其在肌萎缩侧索硬化早期缓慢进展阶段水平升高(发挥中枢神经系统抗炎作用)和在晚期快速进展阶段水平降低(神经炎症恶化),且发挥比CD4+T细胞更大的神经保护作用,被认定为特定保护亚群[61]。目前间充质干细胞可能是增强调节性T细胞功能改善免疫环境最理想治疗方法,主要机制为提高调节性T细胞含量并增强其免疫抑制功能。 调节性T细胞的百分比受叉状头螺旋转录因子3(影响调节性T细胞发育及调控)表达和抗炎性细胞因子分泌的影响,间充质干细胞可介导可溶性因子和非可溶性因子稳定辅助性T细胞17和调节性T细胞比例。①细胞接触:间充质干细胞可抑制介导神经炎症的辅助性T细胞17分化并诱导调节性T细胞表型表达,表明间充质干细胞即使在炎症背景下仍具备调控调节性T细胞数量的能力[62]。此外,间充质干细胞及调节性T细胞均被认为有免疫抑制作用,在探求间充质干细胞对调节性T细胞影响实验中显示,两者共培养后比未与间充质干细胞培养的单独调节性T细胞发挥更强大免疫抑制作用[63]。人羊膜间充质干细胞亦可提高淋巴细胞中调节性T细胞数量,调节中晚期肌萎缩侧索硬化小鼠发挥免疫抑制作用[50]。②分泌因子作为中间介质:脂肪间充质干细胞分泌白细胞介素6诱导调节性T细胞分化发挥免疫调节双重性,亦可表达高水平细胞间黏附分子1,与辅助性T细胞17配体结合升高调节性T细胞相关因子,促进辅助性T细胞17向调节性T细胞转化维持其比例平衡[64]。有研究表明间充质干细胞同CD4+T细胞共培养时可激活Toll样受体,释放白细胞介素10等其他免疫调节分子或激活Notch信号轴,增强间充质干细胞诱导调节性T细胞能力[65]。间充质干细胞源性外泌体一方面携带特定RNA可增加白细胞介素10产生使其通过抗原提呈细胞(APC)发挥免疫抑制作用[66],另外激活维持STATS磷酸化通路,抑制辅助性T细胞17分化同时显著提高调节性T细胞和叉状头螺旋转录因子3含量,保护运动神经元[67]。间充质干细胞调控免疫反应治疗肌萎缩侧索硬化症的作用机制见表3。"


2.4 中药联合间充质干细胞治疗肌萎缩侧索硬化的免疫机制 中药联合间充质干细胞治疗神经系统疾病已有较多论述,且部分也进入临床试验。该课题组也曾探讨过中药联合间充质干细胞治疗如多发性硬化、阿尔茨海默病、帕金森等神经退行性疾病,除此之外还研究了益气活血类方药如补阳还五汤联合骨髓间充质干细胞对血脑屏障通透性的影响,结果发现补阳还五汤组、骨髓间充质干细胞组、联合组均能改善水通道蛋白4水平,但以联合组效果更显著[68]。而肌萎缩侧索硬化疾病的发生也同血脑屏障被破坏有关,但目前对于中药联合间充质干细胞改善肌萎缩侧索硬化血脑屏障通透性报道较少,有待进一步证实。肌萎灵注射液是治疗肌萎缩侧索硬化疾病的中药新制剂,临床疗效明确;在研究其对骨髓基质细胞的增殖分化影响发现,肌萎灵注射液不仅避免了常规诱导剂的不良反应,还能促进骨髓基质细胞增殖和分化为更高水平的神经元,可见为中药与干细胞联合应用为促进肌萎缩侧索硬化临床提供较高研究价值[69]。目前对于两者联合应用调控免疫反应治疗肌萎缩侧索硬化报道较少,但上述研究打开了新思路,未来需学者进一步深入研究。"

| [1] LONGINETTI E, FANG F. Epidemiology of amyotrophic lateral sclerosis: an update of recent literature. Curr Opin Neurol. 2019;32(5):771-776. [2] 贺韵涵,王强,孙嫘,等.肌萎缩侧索硬化症治疗的研究进展[J].现代中西医结合杂志,2020,29(6):679-684. [3] HULISZ D. Amyotrophic lateral sclerosis: disease state overview. Am J Manag Care. 2018;24(15 Suppl):S320-S326. [4] ZHAO W, BEERS DR, APPEL SH. Immune-mediated mechanisms in the pathoprogression of amyotrophic lateral sclerosis. J Neuroimmune Pharmacol. 2013;8(4):888-899. [5] PARKER SE, HANTON AM, STEFANOU SN, et al. Revisiting the role of the innate immune complement system in ALS. Neurobiol Dis. 2019;127:223-232. [6] 眭淑彦.肌萎缩侧索硬化症的中医病因病机探究[J].神经病学与神经康复学杂志,2014,11(3):130-132. [7] 董阿茹汗,李竹庭,段建华.清热解毒类中药对免疫功能的影响研究进展[J].山西中医,2023,39(4):66-67,70. [8] WU X, JIANG J, GU Z, et al. Mesenchymal stromal cell therapies: immunomodulatory properties and clinical progress. Stem Cell Res Ther. 2020;11(1):345. [9] ABDUL WAHID SF, LAW ZK, ISMAIL NA, et al. Cell-based therapies for amyotrophic lateral sclerosis/motor neuron disease. Cochrane Database Syst Rev. 2019;12(12):CD011742. [10] KWON MS, NOH MY, OH KW, et al. The immunomodulatory effects of human mesenchymal stem cells on peripheral blood mononuclear cells in ALS patients. J Neurochem. 2014;131(2):206-218. [11] WANG Y, CHEN X, CAO W, et al. Plasticity of mesenchymal stem cells in immunomodulation: pathological and therapeutic implications. Nat Immunol. 2014;15(11):1009-1016. [12] BARBEITO AG, MESCI P, BOILLÉE S. Motor neuron-immune interactions: the vicious circle of ALS. J Neural Transm (Vienna). 2010;117(8):981-1000. [13] 徐露,张太君.冰片联合灯盏花素对缺氧/复氧损伤血脑屏障通透性的影响[J].中国中医药信息杂志,2016,23(2):76-78. [14] 丁煌,唐三,杨筱倩,等.冰片配伍黄芪甲苷与三七总皂苷对脑缺血/再灌注后血脑屏障通透性的影响[J].中国药理学通报,2019,35(11):1516-1523. [15] 刘杨波,谌浩东,冯聚玲,等.人参皂苷Rg1对脑缺血再灌注损伤大鼠血脑屏障的保护作用[J].中国药学杂志,58(10):908-914. [16] 司昕蕾,辛二旦,边甜甜,等.中药抗补体活性研究进展[J].中国中医药信息杂志,2019,26(6):136-139. [17] 阮姝楠,卢燕,陈道峰.广藿香的抗补体活性成分[J].中国中药杂志,2013, 38(13):2129-2135. [18] 沈路路,卢燕,程志红,等.虎杖的抗补体活性蒽醌类成分及其作用靶点[J].中草药,2013,44(18):2502-2507. [19] 杜冬生,程志红,陈道峰.紫花地丁中的抗补体生物碱类成分研究[J].中国中药志,2017,42(24):4794-4800. [20] LI YH, LIU SB, ZHANG HY, et al. Antioxidant effects of celastrol against hydrogen peroxide-induced oxidative stress in the cell model of amyotrophic lateral sclerosis. Sheng Li Xue Bao. 2017;69(6):751-758. [21] YANG EJ, KIM SH, YANG SC, et al. Melittin restores proteasome function in an animal model of ALS. J Neuroinflammation. 2011;8:69. [22] LEE KW, JI HM, KIM DW, et al. Effects of Hominis placenta on LPS-induced cell toxicity in BV2 microglial cells. J Ethnopharmacol. 2013;147(2):286-292. [23] 丁旭苹,王雪,路丽明.中药天花粉蛋白增强诱导CD4+CD25+Foxp3+调节性T细胞数量和功能的初探[J].世界科学技术-中医药现代化,2021,23(11): 4097-4108. [24] 裘冯卓,金庆文.T细胞调控及中药瞿麦在肌萎缩侧索硬化症治疗中的应用[J].中国临床神经科学,2021,29(2):224-231. [25] 李建明,彭丽珊,刘显,等.复方扶芳藤合剂对免疫抑制小鼠NK细胞的调节作用研究[J/OL].沈阳药科大学学报:1-18[2023-04-10]. [26] GEUN KM, WON CS, YOOJIN S, et al. KCHO-1, a novel herbal anti-inflammatory compound, attenuates oxidative stress in an animal model of amyotrophic lateral sclerosis. J Veter Sci. 2017;18(4):487-497. [27] 张建,唐巍然.调节性T细胞与中草药的免疫调节[J].中国药业,2015,24(B12): 448-450. [28] 张秋艳,王玲玲,张东蛟,等.肌萎灵冻干粉对运动神经元的保护作用[J]. 疑难病杂志,2011,10(3):197-200,247. [29] GARBUZOVA-DAVIS S, KURIEN C, THOMSON A, et al. Endothelial and astrocytic support by human bone marrow stem cell grafts into symptomatic ALS mice towards blood-spinal cord barrier repair. Sci Rep. 2017;7(1):884. [30] MONSOUR M, GARBUZOVA-DAVIS S, BORLONGAN CV. Patching up the permeability: the role of stem cells in lessening neurovascular damage in amyotrophic lateral sclerosis. Stem Cells Transl Med. 2022;11(12):1196-1209. [31] ARTUS C, GLACIAL F, GANESHAMOORTHY K, et al. Couraud PO. The Wnt/planar cell polarity signaling pathway contributes to the integrity of tight junctions in brain endothelial cells. J Cereb Blood Flow Metab. 2014;34(3):433-440. [32] PARK HJ, SHIN JY, KIM HN, et al. Mesenchymal stem cells stabilize the blood-brain barrier through regulation of astrocytes. Stem Cell Res Ther. 2015;6:187. [33] ODENWALD MA, CHOI W, BUCKLEY A, et al. ZO-1 interactions with F-actin and occludin direct epithelial polarization and single lumen specification in 3D culture. J Cell Sci. 2017;130(1):243-259. [34] YARI H, MIKHAILOVA MV, MARDASI M, et al. Emerging role of mesenchymal stromal cells (MSCs)-derived exosome in neurodegeneration-associated conditions: a groundbreaking cell-free approach. Stem Cell Res Ther. 2022; 13(1):423. [35] DÍAZ-FLORES L, GUTIÉRREZ R, MADRID JF, et al. Morphofunction, interactions and pathology in a quiescent and activated mesenchymal cell niche. Histol Histopathol. 2009;24(7):909-969. [36] ROPPER AE, THAKOR DK, HAN I, et al. Defining recovery neurobiology of injured spinal cord by synthetic matrix-assisted hMSCs implantation. Proc Natl Acad Sci U S A. 2017;114(5):E820-E829. [37] GARBUZOVA-DAVIS S, HALLER E, NAVARRO S, et al. Transplantation of human bone marrow stem cells into symptomatic ALS mice enhances structural and functional blood-spinal cord barrier repair. Exp Neurol. 2018;310:33-47. [38] LOUSSOUARN C, PERS YM, BONY C, et al. Mesenchymal stromal cell-derived extracellular vesicles regulate the mitochondrial metabolism via transfer of miRNAs. Front Immunol. 2021;12:623973. [39] 何锴琳,张航,王俊岭.外泌体在肌萎缩侧索硬化中的研究进展[J].临床与病理杂志,2019,39(8):1783-1789. [40] THOMAS H, JÄGER M, MAUEL K, et al. Interaction with mesenchymal stem cells provokes natural killer cells for enhanced IL-12/IL-18-induced interferon-gamma secretion. Mediators Inflamm. 2014;2014:143463. [41] OH JY, KIM H, LEE HJ, et al. MHC Class I enables MSCs to evade NK-Cell-mediated cytotoxicity and exert immunosuppressive activity. Stem Cells. 2022;40(9):870-882. [42] ABBASI B, SHAMSASENJAN K, AHMADI M, et al. Mesenchymal stem cells and natural killer cells interaction mechanisms and potential clinical applications. Stem Cell Res Ther. 2022;13(1):97. [43] CHATTERJEE D, MARQUARDT N, TUFA DM, et al. Role of gamma-secretase in human umbilical-cord derived mesenchymal stem cell mediated suppression of NK cell cytotoxicity. Cell Commun Signal. 2014;12:63. [44] SOTIROPOULOU PA, PEREZ SA, GRITZAPIS AD, et al. Interactions between human mesenchymal stem cells and natural killer cells. Stem Cells. 2006;24(1):74-85. [45] SHI Y, WANG Y, LI Q, et al. Immunoregulatory mechanisms of mesenchymal stem and stromal cells in inflammatory diseases. Nat Rev Nephrol. 2018;14(8):493-507. [46] LEE DK, SONG SU. Immunomodulatory mechanisms of mesenchymal stem cells and their therapeutic applications. Cell Immunol. 2018;326:68-76. [47] PEDROSO JF, DE SOUZA VALIM V, PEZZI A, et al. An experimental study comparing the expansion of peripheral blood natural killer (NK) cells cultured with artificial antigen-presenting cells, in the presence or absence of bone marrow mesenchymal stem cells (MSCs). Mol Biotechnol. 2020;62(5):306-315. [48] TU Z, LI Q, BU H, et al. Mesenchymal stem cells inhibit complement activation by secreting factor H. Stem Cells Dev. 2010;19(11):1803-1809. [49] LI Y, FUNG J, LIN F. Local inhibition of complement improves mesenchymal stem cell viability and function after administration. Mol Ther. 2016;24(9):1665-1674. [50] 肖昆太.人羊膜间充质干细胞静脉移植对ALS转基因小鼠免疫炎症调节作用研究[D].广州:南方医科大学,2018. [51] 周葳. hUC-MSCs-exo对小胶质细胞增殖及炎性反应的调节作用[D].唐山:华北理工大学,2019. [52] KIM SH, OH KW, JIN HK, et al. Immune inflammatory modulation as a potential therapeutic strategy of stem cell therapy for ALS and neurodegenerative diseases. BMB Rep. 2018;51(11):545-546. [53] ZHANG Q, FU L, LIANG Y, et al. Exosomes originating from MSCs stimulated with TGF-β and IFN-γ promote Treg differentiation. J Cell Physiol. 2018;233(9):6832-6840. [54] 郝磊,金戈,杨涌涛,等.骨髓间充质干细胞外泌体介导miR-124-1对小胶质细胞M2型极化调控的影响[J].上海交通大学学报(医学版),2022,42(3): 323-330. [55] SUN H, BÉNARDAIS K, STANSLOWSKY N, et al. Therapeutic potential of mesenchymal stromal cells and MSC conditioned medium in Amyotrophic Lateral Sclerosis (ALS)--in vitro evidence from primary motor neuron cultures, NSC-34 cells, astrocytes and microglia. PLoS One. 2013;8(9):e72926. [56] COQUE E, SALSAC C, ESPINOSA-CARRASCO G, et al. Cytotoxic CD8+ T lymphocytes expressing ALS-causing SOD1 mutant selectively trigger death of spinal motoneurons. Proc Natl Acad Sci U S A. 2019;116(6):2312-2317. [57] LEE S, KIM S, CHUNG H, et al. Mesenchymal stem cell-derived exosomes suppress proliferation of T cells by inducing cell cycle arrest through p27kip1/Cdk2 signaling. Immunol Lett. 2020;225:16-22. [58] MOKARIZADEH A, DELIREZH N, MORSHEDI A,et al. Dalir-Naghadeh B. Phenotypic modulation of auto-reactive cells by insertion of tolerogenic molecules via MSC-derived exosomes. Vet Res Forum. 2012 Fall;3(4):257-261. [59] ZHOU Y, DAY A, HAYKAL S, et al. Mesenchymal stromal cells augment CD4+ and CD8+ T-cell proliferation through a CCL2 pathway. Cytotherapy. 2013;15(10): 1195-1207. [60] WANG LT, JIANG SS, TING CH, et al. Differentiation of mesenchymal stem cells from human induced pluripotent stem cells results in downregulation of c-Myc and DNA replication pathways with immunomodulation toward CD4 and CD8 Cells. Stem Cells. 2018;36(6):903-914. [61] BEERS DR, ZHAO W, WANG J, et al. ALS patients’ regulatory T lymphocytes are dysfunctional, and correlate with disease progression rate and severity. JCI Insight. 2017;2(5):e89530. [62] GHANNAM S, PÈNE J, MOQUET-TORCY G, et al. Mesenchymal stem cells inhibit human Th17 cell differentiation and function and induce a T regulatory cell phenotype. J Immunol. 2010;185(1):302-312. [63] YAN Z, ZHUANSUN Y, CHEN R, et al. Immunomodulation of mesenchymal stromal cells on regulatory T cells and its possible mechanism. Exp Cell Res. 2014;324(1): 65-74. [64] ENGELA AU, BAAN CC, PEETERS AM, et al. Interaction between adipose tissue-derived mesenchymal stem cells and regulatory T-cells. Cell Transplant. 2013; 22(1):41-54. [65] ABDI J, RASHEDI I, KEATING A. Concise review: TLR pathway-miRNA interplay in mesenchymal stromal cells: regulatory roles and therapeutic directions. Stem Cells. 2018;36(11):1655-1662. [66] NEGI N, GRIFFIN MD. Effects of mesenchymal stromal cells on regulatory T cells: Current understanding and clinical relevance. Stem Cells. 2020;38(5):596-605. [67] ZHANG J, MA X, CAO L, et al. Enhancing and stabilization of cord blood regulatory T-cell suppressive function by human mesenchymal stem cell (MSCs)-derived exosomes. Clin Exp Immunol. 2022;208(3):255-267. [68] 张运克,车志英,李可.补阳还五汤联合骨髓间充质干细胞对脑缺血大鼠血脑屏障通透性的影响[J].中华中医药学刊,2019,37(7):1548-1553. [69] 王继明,吴以岭,陈金亮,等.肌萎灵注射液对人骨髓基质细胞增殖和向神经细胞分化的影响[J].中国中医基础医学杂志,2007,13(10):768-770. |
| [1] | Chen Kaijia, Liu Jingyun, Cao Ning, Sun Jianbo, Zhou Yan, Mei Jianguo, Ren Qiang. Application and prospect of tissue engineering in treatment of osteonecrosis of the femoral head [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1450-1456. |
| [2] | Yang Yifeng, Ye Nan, Wang Lin, Guo Shuaicheng, Huang Jian. Signaling pathway of dexmedetomidine against ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1464-1469. |
| [3] | Zhang Xiaoyun, Liu Hua, Chai Yuan, Chen Feng, Zeng Hao, Gao Zhengang, Huang Yourong. Effect of Yishen Gushu Formula on bone metabolic markers and clinical efficacyn in patients with osteoporosis of kidney deficiency and blood stasis type [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1155-1160. |
| [4] | Yue Yun, Wang Peipei, Yuan Zhaohe, He Shengcun, Jia Xusheng, Liu Qian, Li Zhantao, Fu Huiling, Song Fei, Jia Menghui. Effects of croton cream on JNK/p38 MAPK signaling pathway and neuronal apoptosis in cerebral ischemia-reperfusion injury rats [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1186-1192. |
| [5] | Liu Xin, Hu Man, Zhao Wenjie, Zhang Yu, Meng Bo, Yang Sheng, Peng Qing, Zhang Liang, Wang Jingcheng. Cadmium promotes senescence of annulus fibrosus cells via activation of PI3K/Akt signaling pathway [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1217-1222. |
| [6] | Wei Juan, Li Ting, Huan Mengting, Xie Ying, Xie Zhouyu, Wei Qingbo, Wu Yunchuan. Mechanism by which static exercise improves insulin resistance in skeletal muscle of type 2 diabetes [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1271-1276. |
| [7] | Wang Weiqing, Zhou Yue. Chronic inflammation regulates adipose tissue fibrosis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1307-1312. |
| [8] | Feng Ruiqin, Han Na, Zhang Meng, Gu Xinyi, Zhang Fengshi. Combination of 1% platelet-rich plasma and bone marrow mesenchymal stem cells improves the recovery of peripheral nerve injury [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 985-992. |
| [9] | Qiu Xiaoyan, Li Bixin, Li Jingdi, Fan Chuiqin, Ma Lian, Wang Hongwu. Differentiation of insulin-producing cells from human umbilical cord mesenchymal stem cells infected by MAFA-PDX1 overexpressed lentivirus [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1000-1006. |
| [10] | Liu Qiwei, Zhang Junhui, Yang Yuan, Wang Jinjuan. Role and mechanism of umbilical cord mesenchymal stem cells on polycystic ovary syndrome [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1015-1020. |
| [11] | Pan Xiaolong, Fan Feiyan, Ying Chunmiao, Liu Feixiang, Zhang Yunke. Effect and mechanism of traditional Chinese medicine on inhibiting the aging of mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1091-1098. |
| [12] | Ma Shuwei, He Sheng, Han Bing, Zhang Liaoyun. Exosomes derived from mesenchymal stem cells in treatment of animals with acute liver failure: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1137-1142. |
| [13] | Zhang Kefan, Shi Hui. Research status and application prospect of cytokine therapy for osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(6): 961-967. |
| [14] | Wei Yuanxun, Chen Feng, Lin Zonghan, Zhang Chi, Pan Chengzhen, Wei Zongbo. The mechanism of Notch signaling pathway in osteoporosis and its prevention and treatment with traditional Chinese medicine [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 587-593. |
| [15] | Liu Luxing, Di Mingyuan, Yang Qiang. Signaling pathways in the mechanism underlying active ingredients of Chinese medicine in the treatment of osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 609-614. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||



