Chinese Journal of Tissue Engineering Research ›› 2023, Vol. 27 ›› Issue (26): 4239-4245.doi: 10.12307/2023.565
Previous Articles Next Articles
Metabolomics evaluation of periodontitis: biomarkers, pathological mechanism and systemic relationship
Zhao Zirui, Hu Qiaoyu, Qi Xia, Liu Qing
- Hebei Clinical Research Center for Oral Diseases, Hebei Key Laboratory of Stomatology, School and Hospital of Stomatology, Hebei Medical University, Shijiazhuang 050017, Hebei Province, China
-
Received:2022-09-05Accepted:2022-10-18Online:2023-09-18Published:2023-01-28 -
Contact:Liu Qing, Master, Chief physician, Associate professor, Hebei Clinical Research Center for Oral Diseases, Hebei Key Laboratory of Stomatology, School and Hospital of Stomatology, Hebei Medical University, Shijiazhuang 050017, Hebei Province, China -
About author:Zhao Zirui, Master candidate, Hebei Clinical Research Center for Oral Diseases, Hebei Key Laboratory of Stomatology, School and Hospital of Stomatology, Hebei Medical University, Shijiazhuang 050017, Hebei Province, China -
Supported by:Clinical Medicine Talents Training Program of Hebei Provincial Government in 2022, No. 361029 (to LQ)
CLC Number:
Cite this article
Zhao Zirui, Hu Qiaoyu, Qi Xia, Liu Qing. Metabolomics evaluation of periodontitis: biomarkers, pathological mechanism and systemic relationship[J]. Chinese Journal of Tissue Engineering Research, 2023, 27(26): 4239-4245.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks

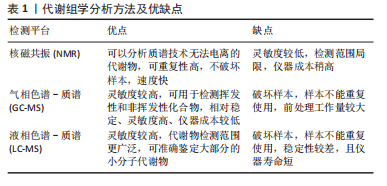
2.1 代谢组学技术概述 代谢组学(Metabolomics or Metabonomics)是在基因组学、转录组学和蛋白组学之后新发展的组学技术,可以通过代谢产物的变化,进一步推导机体的生理或病理状态及机制。代谢组学比基因组学和蛋白质组学更接近表型,因此代谢组学分子标志物会更敏感。代谢物是反映生物过程的小分子,通常在临床医学中作为诊断、预后或治疗反应生物标志物。 目前代谢组学分析最常用行的3个检测方法是核磁共振(nuclear magnetic resonance,NMR)、气相色谱-质谱(gas chromatography- mass spectrometry,GC-MS)和液相色谱-质谱(liquid chromatography-mass spectrometry,LC-MS),见表1。核磁共振可以分析质谱技术无法电离的代谢物,可重复性高、速度快,但其灵敏度较低,检测范围局限,仪器成本稍高。质谱技术的灵敏度较高,气相色谱-质谱用于挥发性和非挥发性化合物,相对稳定、灵敏度高、仪器成本较低,但样品前处理工作量较大。液相色谱-质谱的灵敏度更高,代谢物检测范围更广泛,可准确鉴定大部分的小分子代谢物,但其稳定性较差,且仪器寿命短。"

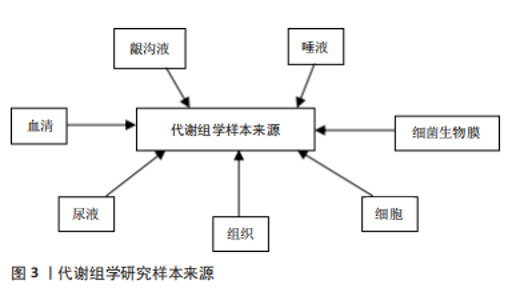
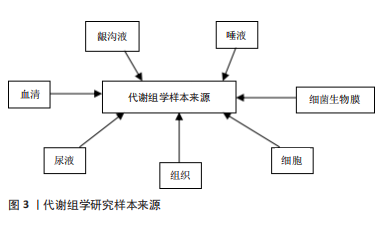
2.2.1 唾液 唾液是一种多成分的口腔液体,可以反映口腔和全身健康状况。唾液由口腔的大、小唾液腺分泌,90%的唾液由腮腺、下颌下和舌下腺分泌,其余部分由小唾液腺分泌。与血清类似,唾液中含有电解质、酶、激素、抗体、生长因子、龈沟液等不同的机体分泌产物[6-7],其中许多成分可以通过被动扩散、主动转运等方式由血液进入唾液中。因此,唾液在一定情况下可被视为身体生理功能的反应。 唾液检测具有独特的优势,它是一种非侵入性的检测手段,而且采集方法十分的简单、快速且价格低廉,比血清更安全,不需要高级的仪器设备或者独特的采集技术,同时其对检测的地点也没有特殊要求,无论是社区门诊、医院还是家里都可以很方便地进行采集。唾液代谢组学是对唾液中所有小分子代谢物的检测,目前已经发现了许多与牙周相关的重要标志物[8-9],已被用于牙周炎的早期诊断、病理过程分析及预后的观察。然而,目前仍存在许多挑战,比如尚未了解不同口腔疾病的复杂代谢途径,且唾液样品收集方案、储存、制备方法的不统一的会造成不同研究的差异。未来有待于建立统一的标准化的采样适应证和指南,从而解决这一问题。 2.2.2 龈沟液 龈沟液可被用于牙周炎的病理分析和诊断。龈沟液是指存在于牙龈沟内的液体,主要来源于牙周组织中的血管丛,为机体的生理性或炎性渗出液,由血清和局部组织的产物组成[10],包括炎症递质、炎细胞、上皮细胞、局部组织分解物和抗体,以及与生物膜相关的口腔微生物,因此它能反映机体的生理状态,可以体现细胞和牙周组织促进恢复体内稳态的能力,在炎性状态下其流量增加并且伴随着大量的炎细胞和炎症因子[11]。与唾液类似,龈沟液易于采集,是一种非损伤性的取样方法,包括毛细管吸取法、滤纸法及龈沟冲洗法[12],目前最常用的是滤纸法。龈沟液可以准确反映牙周局部的生理状态,特异性和准确性高,被视为是研究牙周炎最理想的基质[13]。 2.2.3 血清与尿液 口腔代谢组学研究的样本还可以来自血清或尿液。血清在体内营养物质、激素、离子、气体和代谢物中起着关键作用,组织器官功能障碍和病理状态都可以改变血清的化学状态和分子组成[14]。血清代谢组学分析反映了生物体的当前状态,可以更直观地了解疾病,血清中内源性代谢产物水平的变化更能直接反映疾病的发病机制。尿液中代谢物可以反映体内所有生化途径的状态,而且其分子浓度常高于血清中的分子浓度,能为研究提供更加丰富的基质[15]。与组织细胞的采样方法相比,从血清、尿液收集代谢组学数据在临床上更为常用,其采集更加简单方便,破坏性较小,更有利于患者遵守实验要求。而且过去的研究表明,口腔的多种疾病包括牙周炎都与全身状态密切相关,也可以通过口服药物来治疗疾病,因此血液或尿液样本也适合于牙周炎的研究。 2.2.4 组织与细胞 组织和细胞的代谢组学研究对于理解口腔疾病的病理生理过程和潜在机制很有价值。组织分析是将切取的器官组织提取成液体形式,再从中分析代谢物的变化。组织器官代谢组学分析是研究局部和机体发病机制的有效方法,有利于了解与该组织相关的生理和代谢过程[16-17],因此许多代谢组学研究都集中在组织、器官或其提取物上。但是由于器官和组织提取具有侵入性,仅限于组织活检样本和动物模型的研究。 与动物模型和临床样本的研究相比,细胞实验研究更容易实施,价格更便宜。细胞的代谢组学分析可以解释细胞代谢对生物效应和机制的影响[18],与细胞信号通路机制互补,还可以进一步了解结构与功能之间的关系,用于鉴定特定的代谢物生物标志物[19],以及对药物的反应,是探索牙周细胞生理病理学过程的理想方法。 2.2.5 细菌生物膜 细菌可产生各种代谢物,这些代谢产物可能直接或间接导致口腔疾病[20],细菌代谢组学已被大量应用于口腔代谢组学研究[21-23]。由于技术限制,传统的细菌代谢组学研究需要相当大的样本,需要基于体外细菌培养技术进行研究,而临床口腔生物膜样本则由于体积过小而无法分析。2010年,TAKAHASHI等[24]通过毛细管电泳质谱法(capillary electrophoresis,CE-MS)从没有明显口腔状况的年轻捐赠者身上采集的少量牙龈上菌斑测出了代谢产物,这种毛细管电泳质谱使数量较少的临床样本的研究成为了可能。在牙周炎治疗中,也从代谢组学角度研究了微生物组的变化,CALIFF等[25]使用Grace刮匙进行牙周袋中龈下菌斑的取样,用有机溶剂提取菌斑,同时测量最大袋深,发现牙周炎与20种最丰富的代谢物相关,且使用0.25%次氯酸钠漱口治疗后,最大袋深有改善者代谢物也发生了显著变化,袋深没有改善的患者代谢谱也较为恒定。 2.3 代谢组学技术在牙周炎中的应用 目前,代谢组学在牙周病学领域的研究尚处于早期阶段,相关研究结果集中在蛋白质、脂肪、碳水化合物和核苷酸等代谢通路,主要涉及牙周炎的生物标志物的鉴定、病理机制研究、治疗及预后研究等方面,然而相关研究仍面对许多的困难和挑战。 2.3.1 代谢组学在牙周炎早期诊断中的应用 临床上大多根据临床检查和影像学检查的结果来诊断牙周炎,但这是在疾病发生之后的诊断,此时已经有较重的临床破坏,在早期预测方面存在局限性,因此需要一种手段来早期预测和诊断牙周炎,在各种体液样本中发现代谢的变化,用于检测牙周炎。代谢组学技术可根据体液或组织中特征性的生物标志物,可用于预测牙周炎,提高早期诊断率,从而做到早期诊断和早期治疗,在疾病早期阻断组织破坏[26-27]。见表3。"
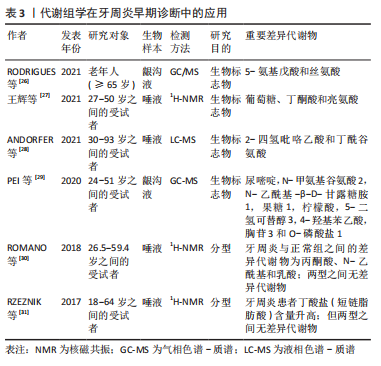
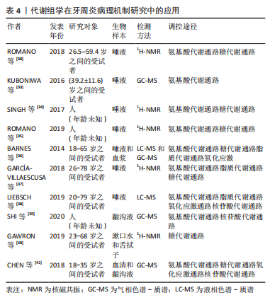
AND?RFER等[28]的一项大样本横断面研究确定了与牙齿脱落相关的唾液代谢物的特征,2-吡咯烷乙酸和丁酰腐胺与5年牙齿脱落密切相关,因此最可能成为筛查目的的生物标志物,以确定牙周炎的受试者的诊断,同时也能识别预测到更多有牙齿脱落风险的患者。一项最近的研究对慢性牙周炎患者和健康对照者的174个龈沟液样品进行非靶向代谢组学分析,共获得了147种不同的代谢物,慢性牙周炎组中最显著富集的代谢物是尿嘧啶、N-氨基甲酰谷氨酸2、N乙酰-β-D-甘露糖胺1、果糖1、柠檬酸、5-二氢皮质醇3和4-羟基苯乙酸,而胸苷3、O-磷酸丝氨酸 1、甲基丙二酸和1-单棕榈胺则与牙周炎的严重程度呈负相关[29]。这些代谢物与探诊深度(probing depth,PD)、出血指数(bleeding on probing,BOP)和临床附着水平(clinical attachment Level,CAL)的预测具有很强的正或负相关性,可能被用作牙周炎症严重程度的指标,如果龈沟液中这些代谢物与先前相比大幅增加或降低,则表明有患牙周炎的风险或已经患有牙周炎,从而在早期提醒医生和患者采取相关防治措施。 传统分类将牙周炎分为慢性牙周炎(chronic periodontitis,CP)和侵袭性牙周炎(agressive periodontitis,AgP),它们在进展速度、预后和对特定治疗方法的需求方面存在差异,目前两者的诊断主要基于临床检查和影像学指标。一些代谢组学研究比较了来自口腔健康人群和两种牙周炎分型(慢性和侵袭性牙周炎)患者的唾液样本,发现代谢组学能够以令人满意的可预测性区分健康和牙周炎样本,慢性牙周炎患者的丁酸显著增加,乳酸水平显著降低,脯氨酸、苯丙氨酸、异亮氨酸、缬氨酸和酪氨酸水平较高,脂肪酶、蛋白酶和糖苷酶活性的平行上调,能为牙周诊断提供可靠的分子生物标志物[30-31]。但代谢组学结果显示慢性牙周炎和侵袭性牙周炎中观察到的代谢组差异并不明显,并不能检测出明确的生化信号来区分两种不同类型的牙周炎,因此代谢组学的改变取决于疾病的严重程度而不是牙周炎的类型,在没有明确表征情况下,不能轻易诊断侵袭性牙周炎,并且慢性牙周炎和侵袭性牙周炎之间的区别并没有足够明显的组织学、微生物学、免疫学或遗传学基础支持[32]。因此,代谢组学分析虽然不能用于区分两种不同类型的牙周炎,但可能成为临床上辅助早期牙周炎鉴定和分期的有效方法。 2.3.2 代谢组学在牙周炎病理机制研究中的应用 代谢组学可同时分析氨基酸、脂质、糖类、核苷酸等几千种小分子代谢物,利用R语言等大数据分析软件筛选出差异代谢物,差异代谢物的富集分析利用京都基因与基因组百科全书(KEGG)数据库实现,从而找到与疾病发病有关的异常代谢通路。代谢组学能显现出牙周炎病理过程中的小分子改变,有助于研究牙周疾病的分子机制。代谢组学研究证实了牙周炎的发生与氨基酸、糖、脂质、核苷等代谢异常有关,为牙周炎的病理与生理机制的探究提供了新思路。见表4。"
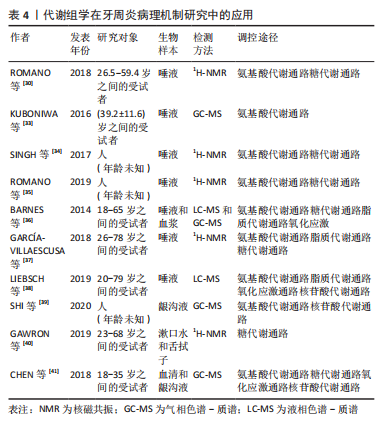

(1)牙周炎的氨基酸代谢:与牙周健康个体相比,多项研究发现牙周炎患者及动物模型的多种氨基酸水平发生改变,包括缬氨酸、苯丙氨酸、异亮氨酸、酪氨酸、丁酸盐、尸胺和亚精胺上调;而丙酮酸和N-乙酰基在健康人中的表达最多,这主要涉及谷氨酸代谢、组氨酸代谢和酪氨酸代谢[30,33-39]。牙周组织富含蛋白质,牙周炎患者蛋白质的降解增加,是由于牙周微生物和宿主来源的炎症蛋白酶(例如基质金属蛋白酶)的活性上调[42],蛋白酶将宿主牙周蛋白降解为肽和氨基酸,这些肽和氨基酸将作为微生物的丰富能量库和营养资源,最终影响微生物和宿主功能结构。尸胺是组织腐烂时产生的一种物质,与牙菌斑生物膜的增加呈正相关。缬氨酸和异亮氨酸是支链必需氨基酸,参与细胞中许多代谢途径。丙酮酸是三羧酸循环的起点,在牙周炎时会增加,缬氨酸也由细菌从丙酮酸合成[43],缬氨酸含量增高可能也与丙酮酸分解代谢增强有关。 (2)牙周炎的脂质代谢:游离脂肪酸和与脂肪酸氧化相关的代谢在牙周炎患者中经常发生改变。有研究报道了牙周炎患者的亚油酸、二十二碳五烯酸、二高亚油酸、花生四烯酸、2-羟基棕榈酸酯、丙酸、异戊酸、己酸和异己酸的含量增加,肉毒碱的两种副产物3-脱氢肉碱和乙酰肉碱的含量也增加,表明脂质大分子的炎症降解更高[36]。有研究表明牙周炎患者的丁酸盐含量上升,丁酸盐是一种由口腔细菌代谢的短链脂肪酸[31,37-38],有助于细菌生物膜的生长,同时可以降低细胞间黏附分子1的表达,从而抑制免疫细胞的招募和迁移。此外还能抑制中性粒细胞的产生和吞噬能力,从而促进疾病的发展。 (3)牙周炎的糖代谢:糖酵解、三羧酸循环和无氧呼吸中的许多代谢变化与牙周炎有关。N-乙酰基、丙酮酸的含量降低,但琥珀酸、葡萄糖水平增高[31,34-36]。丙酮酸是糖酵解途径的终产物,是贯穿原核细胞和真核细胞的几种代谢途径的中间体,起着重要的枢纽作用。然而,乳酸在不同的研究中显示出相反的变化,在两项研究中,牙周炎患者的乳酸含量升高[34,40],而在有的研究中则呈现相反的趋势[30-31,35,37]。综上,牙周炎糖代谢变化的机制与体内糖无氧氧化和有氧氧化的失衡有关。 (4)牙周炎与氧化应激:大量证据表明牙周炎症与氧化应激密切相关,氧化还原的不平衡指的是活性氧的过量和抗氧化剂的缺乏,活性氧在牙周炎症中参与牙周破坏。牙周疾病中活性氧含量增加,谷胱甘肽的含量减少[38,41],谷胱甘肽是主要的抗氧化剂和细胞内氧化还原介质,可以中和自由基和活性氧。有学者认为活性氧产生的主要来源是通过黄嘌呤氧化酶的嘌呤降解途径[38],氧化应激与嘌呤降解代谢呈正相关,嘌呤降解增加代表着炎症反应增加,牙周炎患者氧化应激增加,且嘌呤降解代谢物水平较高[36]。 (5)牙周炎的核苷酸代谢:病原体侵入宿主细胞时可以改变机体的核苷酸代谢,释放出牙周细胞的核酸,核苷和碱基是细菌的重要营养来源,核酸代谢分解成碳和能源,从而为细菌增殖创造有利条件。有研究表明牙周炎患者尿嘧啶、黄嘌呤和尿素的水平升高,胸腺嘧啶的水平降低[29,38-39,41]。嘌呤降解途径中,在活性氧的作用下黄嘌呤氧化酶被激活,在黄嘌呤氧化酶的催化作用下,次黄嘌呤转化为黄嘌呤,然后转化为尿素;但嘧啶代谢的具体机制目前尚不明确。综上,与慢性牙周炎相关的病原体可能通过核苷酸改变受感染宿主的新陈代谢。 2.3.3 代谢组学在牙周炎治疗及预后研究中的应用 牙周炎的治疗效果通常根据患者临床检查结果的改善来确定,但是临床指标改变与内在分子水平的改变往往并不同步,应该通过分析机体分子水平的改变,来提高预后和疗效判断的准确性。代谢组学目前已被用于比较牙周炎治疗前后的代谢变化。见表5。"
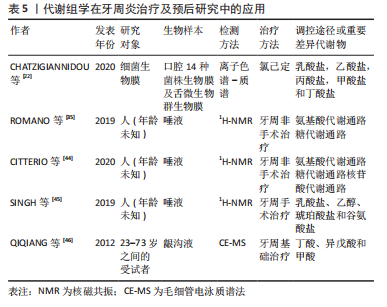

一项体外研究构建了模拟口腔多种微生物群的生物膜,研究结果表明氯己定作用于生物膜后菌群组成及代谢产物发生了变化,不能使菌群转变到健康状态,而且它们还会进一步扰乱口腔共生微生物群[22],因此仅用抗菌剂作为口腔生物膜的唯一治疗方法是不够的。 在牙周非手术治疗后,唾液中的代谢组成分发生了显著变化,然而牙周非手术治疗后的代谢物仍与健康人不同[35,44],治疗后牙周炎患者的乳酸盐的浓度较低,甲胺、脯氨酸的浓度较高,这可能与牙周炎时的细菌代谢及蛋白酶活性上调有关。而且仅牙周非手术治疗的疗效并不能确定,许多患者在治疗后3个月重新评估仍会发现一些持续炎症和残留牙石的部位。有研究表明,牙周手术治疗后检测的患者唾液特征与健康受试者相似,恢复了与健康对照组相似的代谢组学特征,说明重要代谢产物得到了修复,可能是因为患病受试者牙周手术后发生了牙周创伤修复和愈合,牙周手术的目的就是为了建立一个良性的细菌生物膜的共生环境[45]。因此,这些恢复的代谢物可被视为慢性牙周炎疾病的早期修复标志物。 一项长达6个月的靶向代谢组学研究表明,牙周基础治疗后2周患者龈沟液中乳酸、丙酸、丁酸和异戊酸的浓度降至健康对照组水平,而甲酸的浓度增加;在治疗后2,4,6个月丁酸和异戊酸的浓度增加到较高水平,并持续增加;而甲酸的浓度在整个研究期间逐渐降低,治疗后长期观察时丁酸和异戊酸浓度的升高可能是与牙周致病菌的再定植有关,这两种脂肪酸可用作牙周炎发展和进展的指标[46]。 以上研究表明代谢组学具有在个体水平上评估疗效的作用,具有观察组织修复过程中的代谢变化的潜力,可以区分活动性或既往牙周炎患者和健康个体。 2.4 代谢组学在牙周炎与全身疾病关系研究中的应用 见表6。"
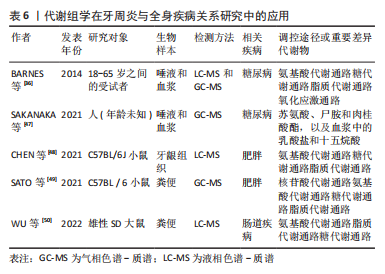

2.4.1 糖尿病 越来越多的证据表明牙周炎与2型糖尿病等各种代谢紊乱之间存在联系,两者是双向相关的。SAKANAKA等[47]使用非靶向气相色谱/质谱法对血浆和唾液代谢组进行综合分析,研究31例2型糖尿病患者和30名对照受试者的口腔和全身健康临床标志物的变化,发现两组中的牙周炎的严重程度与多种代谢物之间存在显著相关性,包括唾液中的苏氨酸、尸胺和肉桂酸酯,以及血浆中的乳酸盐和十五烷酸;在2型糖尿病组中与牙周炎严重程度相关的代谢物包括血浆磷酸盐和唾液苹果酸盐。BARNES等[36]的研究表明,糖尿病会增加牙周炎患者的氧化谷胱甘肽和半胱氨酸-谷胱甘肽二硫化物的水平,增加细胞能量应激标志物水平,增加嘌呤降解和谷胱甘肽代谢,增加嘌呤降解代谢物(例如鸟苷和肌苷),增加氨基酸水平,这些小分子代谢物可能有助于开发针对糖尿病人群的诊断和治疗方法。 2.4.2 肥胖 肥胖是一种慢性代谢性炎症,伴有多种免疫代谢失调,如全身炎症、胰岛素抵抗、血脂异常、高血糖和高尿酸血症,是许多代谢疾病的高危因素。CHEN等[48]通过16周喂养建立诱导的肥胖伴牙周炎小鼠模型,研究肥胖伴牙周炎小鼠的牙龈代谢组,与健康状况相比,牙周炎和高脂肪饮食对牙龈代谢组有明显影响,高脂饮食在强度和广度上放大了牙周炎对牙龈代谢组的影响,并且此研究通过靶向代谢组学的精氨酸代谢进一步验证了这一叠加效应。SATO等[49]的研究构建了粪便微生物群灌胃和结扎诱导的牙周炎模型,研究表明高脂肪饮食喂养小鼠的肠道生态失调相关代谢物会加重肺泡骨破坏;粪便代谢组学显示高脂肪饮食喂养小鼠的嘌呤降解途径活性升高,并且受体小鼠在牙周炎诱导时血清尿酸水平升高。因此,肥胖可能通过增加由肠道生态失调介导的尿酸的产生来增加牙周炎的风险。 此外还有学者研究了牙周炎和非酒精性脂肪肝的可能机制,发现牙周炎主要是通过改变脂肪酸生物合成和脂肪酸降解途径影响非酒精性脂肪肝[51]。一项多组学研究系统地分析了牙周炎对肠道微生物群,粪便代谢物及其富集途径的影响[50]。这些研究有助于进一步分析其他疾病与牙周炎的可能机制。肾病患者的唾液肌酐和尿素浓度与其血浆中的水平呈正相关[52]。牙周炎患者唾液尿素水平显著增高,肌酐浓度与健康对照组无显著区别,因此推测唾液肌酐浓度有可能是一种无侵犯性的肾病标志物。此外牙周炎与全身多种疾病存在密切相关,具体的代谢组学机制有待于继续探索。"

| [1] JIAO J, JING W, SI Y, et al. The prevalence and severity of periodontal disease in Mainland China: Data from the Fourth National Oral Health Survey (2015-2016). J Clin Periodontol. 2021;48(2):168-179. [2] WU L, ZHANG SQ, ZHAO L, et al.Global, regional, and national burden of periodontitis from 1990 to 2019: Results from the Global Burden of Disease study 2019. J Periodontol. 2022 Mar 19. doi: 10.1002/JPER.21-0469. [3] BATOOL H, NADEEM A, KASHIF M, et al. Salivary Levels of IL-6 and IL-17 Could Be an Indicator of Disease Severity in Patients with Calculus Associated Chronic Periodontitis. Biomed Res Int. 2018;2018:8531961. [4] YAN Y, ZHAN Y, WANG X, et al. Clinical evaluation of ultrasonic subgingival debridement versus ultrasonic subgingival scaling combined with manual root planing in the treatment of periodontitis: study protocol for a randomized controlled trial. Trials. 2020;21(1):113. [5] PLA-PAGÀ L, PEDRET A, VALLS RM, et al. Effects of Hesperidin Consumption on the Cardiovascular System in Pre- and Stage 1 Hypertensive Subjects: Targeted and Non-Targeted Metabolomic Approaches (CITRUS Study). Mol Nutr Food Res. 2021;65(17):e2001175. [6] GAO X, XU Y, CAI Y, et al. Effects of filtered fresh air ventilation on classroom indoor air and biomarkers in saliva and nasal samples: A randomized crossover intervention study in preschool children. Environ Res. 2019;179(Pt A):108749. [7] SENEVIRATNE CJ, BALAN P, KO KKK, et al. Efficacy of commercial mouth-rinses on SARS-CoV-2 viral load in saliva: randomized control trial in Singapore. Infection. 2021;49(2):305-311. [8] YEE EH, LATHWAL S, SHAH PP, et al. Detection of Biomarkers of Periodontal Disease in Human Saliva Using Stabilized, Vertical Flow Immunoassays. ACS Sens. 2017;2(11):1589-1593. [9] DE ARAÚJO SILVA DN, SILVA NTD, SENA IAA, et al. Efficacy of antimicrobial photodynamic therapy with chloro-aluminum phthalocyanine on periodontal clinical parameters and salivary GSH and MDA levels in patients with periodontitis. Photodiagnosis Photodyn Ther. 2020;31:101843. [10] YADAV VS, MIR RA, BHATIA A, et al. Metallothionein levels in gingival crevicular fluid, saliva, and serum of smokers and non-smokers with chronic periodontitis. J Periodontol. 2021;92(9):1329-1338. [11] NAIR V, GROVER V, ARORA S, et al. Comparative Evaluation of Gingival Crevicular Fluid Interleukin-17, 18 and 21 in Different Stages of Periodontal Health and Disease. Medicina (Kaunas). 2022;58(8):1042. [12] WOHLFAHRT JC, AASS AM, GRANFELDT F, et al. Sulcus fluid bone marker levels and the outcome of surgical treatment of peri-implantitis. J Clin Periodontol. 2014;41(4):424-431. [13] FATIMA T, KHURSHID Z, REHMAN A, et al. Gingival Crevicular Fluid (GCF): A Diagnostic Tool for the Detection of Periodontal Health and Diseases. Molecules. 2021;26(5):1208. [14] YANG QJ, ZHAO JR, HAO J, et al. Serum and urine metabolomics study reveals a distinct diagnostic model for cancer cachexia. J Cachexia Sarcopenia Muscle. 2018;9(1):71-85. [15] POURAFSHAR S, NICCHITTA M, TYSON CC, et al. Urine and Plasma Metabolome of Healthy Adults Consuming the DASH (Dietary Approaches to Stop Hypertension) Diet: A Randomized Pilot Feeding Study. Nutrients. 2021;13(6):1768. [16] MUKHERJEE PK, FUNCHAIN P, RETUERTO M, et al. Metabolomic analysis identifies differentially produced oral metabolites, including the oncometabolite 2-hydroxyglutarate, in patients with head and neck squamous cell carcinoma. BBA Clin. 2017;7:8-15. [17] MUSHARRAF SG, SHAHID N, NAQVI SMA, et al. Metabolite Profiling of Preneoplastic and Neoplastic Lesions of Oral Cavity Tissue Samples Revealed a Biomarker Pattern. Sci Rep. 2016;6:38985. [18] LEE CT, LI R, ZHU L, et al. Subgingival Microbiome and Specialized Pro-Resolving Lipid Mediator Pathway Profiles Are Correlated in Periodontal Inflammation. Front Immunol. 2021;12:691216. [19] YANG F, LI Q, XIANG J, et al. NMR-based plasma metabolomics of adult B-cell acute lymphoblastic leukemia. Mol Omics. 2021;17(1):153-159. [20] SU W, SHI J, ZHAO Y, et al. Gingival fibroblasts dynamically reprogram cellular metabolism during infection of Porphyromonas gingivalis. Arch Oral Biol. 2021;121:104963. [21] ROSLUND K, LEHTO M, PUSSINEN P, et al. Identifying volatile in vitro biomarkers for oral bacteria with proton-transfer-reaction mass spectrometry and gas chromatography-mass spectrometry. Sci Rep. 2021;11(1):16897. [22] CHATZIGIANNIDOU I, TEUGHELS W, VAN DE WIELE T, et al. Oral biofilms exposure to chlorhexidine results in altered microbial composition and metabolic profile. NPJ Biofilms Microbiomes. 2020;6(1):13. [23] VELSKO IM, FELLOWS YATES JA, ARON F, et al. Microbial differences between dental plaque and historic dental calculus are related to oral biofilm maturation stage. Microbiome. 2019;7(1):102. [24] TAKAHASHI N, WASHIO J, MAYANAGI G. Metabolomics of supragingival plaque and oral bacteria. J Dent Res. 2010;89(12):1383-1388. [25] CALIFF KJ, SCHWARZBERG-LIPSON K, GARG N, et al. Multi-omics Analysis of Periodontal Pocket Microbial Communities Pre- and Posttreatment. mSystems. 2017;2(3):e00016-17. [26] RODRIGUES WF, MIGUEL CB, AGOSTINHO F, et al. Metabolomic Evaluation of Chronic Periodontal Disease in Older Adults. Mediators Inflamm. 2021;2021:1796204. [27] 王辉,库莉博,徐国权,等.1HNMR代谢组学方法对牙周炎患者唾液代谢轮廓的分析[J].口腔医学研究,2017,33(4):412-415. [28] ANDORFER L, HOLTFRETER B, WEISS S, et al. Salivary metabolites associated with a 5-year tooth loss identified in a population-based setting. BMC Med. 2021;19(1):161. [29] PEI J, LI F, XIE Y, et al. Microbial and metabolomic analysis of gingival crevicular fluid in general chronic periodontitis patients: lessons for a predictive, preventive, and personalized medical approach. EPMA J. 2020;11(2):197-215. [30] ROMANO F, MEONI G, MANAVELLA V, et al. Analysis of salivary phenotypes of generalized aggressive and chronic periodontitis through nuclear magnetic resonance-based metabolomics. J Periodontol. 2018;89(12):1452-1460. [31] RZEZNIK M, TRIBA MN, LEVY P, et al. Identification of a discriminative metabolomic fingerprint of potential clinical relevance in saliva of patients with periodontitis using 1H nuclear magnetic resonance (NMR) spectroscopy. PLoS One. 2017;12(8):e0182767. [32] VAN DER VELDEN U. What exactly distinguishes aggressive from chronic periodontitis: is it mainly a difference in the degree of bacterial invasiveness? Periodontol 2000. 2017;75(1):24-44. [33] KUBONIWA M, SAKANAKA A, HASHINO E, et al. Prediction of Periodontal Inflammation via Metabolic Profiling of Saliva. J Dent Res. 2016;95(12):1381-1386. [34] SINGH MP, SAXENA M, SAIMBI CS, et al. Metabolic profiling by 1H NMR spectroscopy of saliva shows clear distinction between control and diseased case of periodontitis. Metabolomics. 2017;13(11):137. [35] ROMANO F, MEONI G, MANAVELLA V, et al. Effect of non-surgical periodontal therapy on salivary metabolic fingerprint of generalized chronic periodontitis using nuclear magnetic resonance spectroscopy. Arch Oral Biol. 2019;97:208-214. [36] BARNES VM, KENNEDY AD, PANAGAKOS F, et al. Global Metabolomic Analysis of Human Saliva and Plasma from Healthy and Diabetic Subjects, with and without Periodontal Disease. Plos One. 2014;9(8): e105181. [37] GARCÍA-VILLAESCUSA A, MORALES-TATAY JM, MONLEÓN-SALVADÓ D, et al. Using NMR in saliva to identify possible biomarkers of glioblastoma and chronic periodontitis. PLoS One. 2018;13(2):e0188710. [38] LIEBSCH C, PITCHIKA V, PINK C, et al. The Saliva Metabolome in Association to Oral Health Status. J Dent Res. 2019;98(6):642-651. [39] SHI M, WEI Y, NIE Y, et al. Alterations and Correlations in Microbial Community and Metabolome Characteristics in Generalized Aggressive Periodontitis. Front Microbiol. 2020;11:573196. [40] GAWRON K, WOJTOWICZ W, ŁAZARZ-BARTYZEL K, et al. Metabolomic Status of The Oral Cavity in Chronic Periodontitis. In Vivo. 2019;33(4): 1165-1174. [41] CHEN HW, ZHOU W, LIAO Y, et al. Analysis of metabolic profiles of generalized aggressive periodontitis. J Periodontal Res. 2018;53(5): 894-901. [42] ARIAS-BUJANDA N, REGUEIRA-IGLESIAS A, BALSA-CASTRO C, et al. Accuracy of single molecular biomarkers in saliva for the diagnosis of periodontitis: A systematic review and meta-analysis. J Clin Periodontol. 2020;47(1):2-18 [43] ZHANG H, LI Y, WANG C, et al. Understanding the high L-valine production in Corynebacterium glutamicum VWB-1 using transcriptomics and proteomics. Sci Rep. 2018;8(1):3632. [44] CITTERIO F, ROMANO F, MEONI G, et al. Changes in the Salivary Metabolic Profile of Generalized Periodontitis Patients after Non-surgical Periodontal Therapy: A Metabolomic Analysis Using Nuclear Magnetic Resonance Spectroscopy. J Clin Med. 2020;9(12):3977. [45] SINGH MP, SAXENA M, SAIMBI CS, et al. Post-periodontal surgery propounds early repair salivary biomarkers by (1)H NMR based metabolomics. Metabolomics. 2019;15(11):141. [46] QIQIANG L, HUANXIN M, XUEJUN G. Longitudinal study of volatile fatty acids in the gingival crevicular fluid of patients with periodontitis before and after nonsurgical therapy. J Periodontal Res. 2012;47(6):740-749. [47] SAKANAKA A, KUBONIWA M, KATAKAMI N, et al. Saliva and Plasma Reflect Metabolism Altered by Diabetes and Periodontitis. Front Mol Biosci. 2021;8:742002. [48] CHEN ZY, XU TT, LIANG ZJ, et al. Untargeted and targeted gingival metabolome in rodents reveal metabolic links between high-fat diet-induced obesity and periodontitis. J Clin Periodontol. 2021;48(8): 1137-1148. [49] SATO K, YAMAZAKI K, KATO T, et al. Obesity-Related Gut Microbiota Aggravates Alveolar Bone Destruction in Experimental Periodontitis through Elevation of Uric Acid. mBio. 2021;12(3):e0077121. [50] WU L, HAN J, NIE JY, et al. Alterations and Correlations of Gut Microbiota and Fecal Metabolome Characteristics in Experimental Periodontitis Rats. Front Microbiol. 2022;13:865191. [51] KOMAZAKI R, KATAGIRI S, TAKAHASHI H, et al. Periodontal pathogenic bacteria, Aggregatibacter actinomycetemcomitans affect non-alcoholic fatty liver disease by altering gut microbiota and glucose metabolism. Sci Rep. 2017;7(1):13950. [52] KAÁL KOVALČÍKOVÁ A, PANČÍKOVÁ A, KONEČNÁ B, et al. Urea and creatinine levels in saliva of patients with and without periodontitis. European Journal of Oral Sciences, 2019;127(5):417-424. |
| [1] | Li Mengfei, Zhang Hong, Zhao Shaojian, Yin Guanghao, Wang Qibao. Expression of forkhead box protein 3 in refractory periapical periodontitis in rats with Enterococcus faecalis infection [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(8): 1187-1192. |
| [2] | Zhao Yuan, Zhai Haoyan, Liu Chunyan. Activation of cannabinoid receptors promotes periodontal healing by regulating periodontal inflammation and bone remodeling [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(26): 4214-4222. |
| [3] | Fu Qiuyue, Lan Xingming, Xu Rongwei, Wang Hao, Yang Kun. Effects of different signaling pathways on osteogenic differentiation of periodontal ligament stem cells [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(24): 3910-3919. |
| [4] | He Bo, He Zhijun, Liu Tao, Ma Suilu. Mechanism of Xiaozhong Zhitong Mixture against ischemia-reperfusion injury of skin flaps based on metabolomics [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(23): 3653-3659. |
| [5] | Luo Tingyan, Gu Yu, Qin Xiaofei. Antibacterial mechanism and application of nanomaterials in oral infectious diseases [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(21): 3407-3414. |
| [6] | Yuan Shuyue, Liu Chunyan, Liu Bing, Zhao Fei. Macrophage polarization and periodontitis [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(17): 2699-2707. |
| [7] | Zhu Chan, Han Xuke, Yao Chengjiao, Zhou Qian, Zhang Qiang, Chen Qiu. Human salivary components and osteoporosis/osteopenia [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1439-1444. |
| [8] | Bo Yujia, Lin Jing, Wang Liping, Zhao Jin. Shikonin intervenes with osteoclast formation and osteoclast-related gene expression [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(32): 5126-5131. |
| [9] | Zhang Haiyong, Huang Jingwen, Xie Bingying, Chen Sainan, Xie Lihua, Chen Xuan, Li Shengqiang, Ge Jirong. Anti-osteoporosis effect of Gushukang in ovariectomized rats: a lumbar metabonomic analysis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(32): 5185-5190. |
| [10] | Wu Mengxin, Liang Wenhong, Yang Kun, Han Yingying. Influencing factors of periodontal ligament stem cells promoting periodontal tissue regeneration [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(30): 4912-4920. |
| [11] | Du Shasha, Cai Zhiguo, Yang Kun, Liu Qi. Pancreatic autophagy and protein expression of insulin-related genes in type 2 diabetic rats with periodontitis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(29): 4605-4610. |
| [12] | Gong Yuqing, Yao Wei, Li Ran. Osteoimmunological effect of tumor necrosis factor alpha in alveolar bone remodeling [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(26): 4242-4251. |
| [13] | Tang Jianhong, Zhang Nini, Huang Guilin, Lang Jiachan, Cui Tianning, Luo Qinliang. Role of mesenchymal stem cell-derived exosomes in tissue fibrosis repair [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(25): 4022-4027. |
| [14] | Li Xiaowen, Xu Yingjie, Jia Mengying, Shi Wei, Jia Xinyu, Gong Zhongcheng. Epithelial differentiation of adipose stem cells induced by saliva in vitro [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(24): 3865-3869. |
| [15] | Huang Jie, Ren Jing, Peng Pairan, Mu Yandong. Treatment of periodontitis in rats with a novel temperature-sensitive gel with immunomodulatory peptide [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(22): 3514-3520. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||