Chinese Journal of Tissue Engineering Research ›› 2022, Vol. 26 ›› Issue (25): 4022-4027.doi: 10.12307/2022.409
Previous Articles Next Articles
Role of mesenchymal stem cell-derived exosomes in tissue fibrosis repair
Tang Jianhong1, Zhang Nini2, Huang Guilin2, Lang Jiachan2, Cui Tianning2, Luo Qinliang2
- 1Zunyi Medical University, Zunyi 563000, Guizhou Province, China; 2Department of Oral and Maxillofacial Surgery, Affiliated Stomatological Hospital of Zunyi Medical University, Zunyi 563000, Guizhou Province, China
-
Received:2020-12-30Accepted:2021-02-10Online:2022-09-08Published:2022-01-26 -
Contact:Zhang Nini, Master, Associate professor, Department of Oral and Maxillofacial Surgery, Affiliated Stomatological Hospital of Zunyi Medical University, Zunyi 563000, Guizhou Province, China -
About author:Tang Jianhong, Master candidate, Zunyi Medical University, Zunyi 563000, Guizhou Province, China -
Supported by:National Natural Science Foundation of China, No. 81860198 (to ZNN); National Natural Science Foundation of China, No. 81960204 (to HGL); Science and Technology Foundation of Guizhou Provincial Health Commission, No. gzwjkj2020-1-165 (to HGL, ZNN, TJH)
CLC Number:
Cite this article
Tang Jianhong, Zhang Nini, Huang Guilin, Lang Jiachan, Cui Tianning, Luo Qinliang. Role of mesenchymal stem cell-derived exosomes in tissue fibrosis repair[J]. Chinese Journal of Tissue Engineering Research, 2022, 26(25): 4022-4027.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
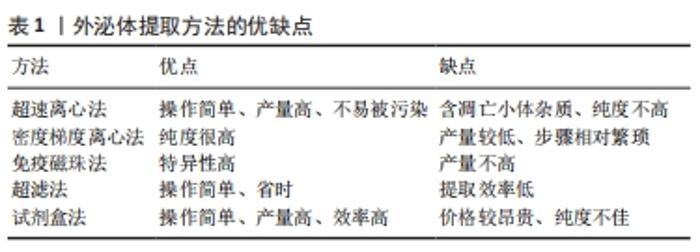
2.1 外泌体的定义及作用 根据细胞外囊泡的生物发生过程和生物物理性质(包括大小和表面蛋白标记物)而有所不同,包括微囊和外泌体。细胞外囊泡的概念最早出现于1983年,研究者们观察到网织红细胞中的多囊内小体将小泡释放到细胞外环境中,这些小泡随后被命名为外泌体。外泌体是通过内吞作用形成,即细胞外的成分与细胞膜上的蛋白分子一起通过内吞或者细胞膜内陷的方式,形成内吞小体或者早期核内体,当早期核内体趋于成熟并形成晚期核内体之后,发生在晚期核内体上的膜内陷导致了腔内小囊泡的出现,腔内小囊泡发芽进入细胞质内腔,这些多囊泡小体不与溶酶体融合,而是直接与质膜融合,并将外泌体释放到细胞外间隙。外泌体直径为30-100 nm[6],主要由三部分组成:①脂质构成外泌体的膜,起到稳定外泌体结构的作用;②蛋白质可以用来鉴定外泌体,被认为是外泌体的生物标志物[7];③核酸包括miRNA、microRNA等,当核酸物质与受体细胞结合后,可以参与受体细胞基因蛋白的编码,从而改变基因表达,发挥其特定的作用[8]。外泌体可以从间充质干细胞、内皮细胞、肿瘤细胞、心肌细胞等细胞中释放出来,此外,外泌体也广泛存在于体液中。 外泌体作为细胞或器官之间相互沟通的载体,以维持细胞/组织的动态平衡,并对病理性反应做出应激。间充质干细胞源性外泌体具有免疫调节特性、减少细胞凋亡和淋巴细胞浸润、抑制自身反应性淋巴细胞增殖以及促进抗炎细胞因子表达的能力,因此在抗炎、抗纤维化、免疫调节及血管再生方面发挥着重要作用[9]。近年来, 越来越多的实验显示间充质干细胞源性外泌体具有保护细胞免受破坏、抗细胞凋亡和抗组织纤维化用[10]。 2.2 外泌体提取、鉴定 随着外泌体在再生医学领域的兴起,大量、迅速提取高纯度、高质量的外泌体一直受到研究者们关注。目前,提取外泌体的方法多种多样,各有优劣势,见表1。"
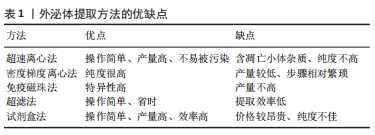

超速离心法是目前外泌体提取的金标准,其产量高、操作简单、不易被污染,但提取到的外泌体常含有凋亡小体等杂质,纯度不高等;密度梯度离心法是将干细胞上清液富集于不同密度梯度的蔗糖溶液中,然后通过超速离心力的作用提取外泌体,具有纯度高、产量低、步骤繁琐等特点[11];免疫磁珠法是将外泌体囊泡与包被抗标志物抗体的磁珠结合,磁珠将外泌体吸附并分离出来[12],此法提取的外泌体特异性高,但对产品要求严格、产量低等;超滤法是用超滤膜离心分离提取外泌体,具有操作简单、省时的特点;试剂盒法操作简单、效率高,深受人们喜欢,但价格较昂贵。如ExoQuick,是一种快速而简单的试剂盒,但它是一种相对粗糙的分离方法,导致许多可溶性蛋白质受到污染。 外泌体主要根据大小、形态以及表面标记蛋白等进行鉴定,采用的检测方法主要有电子显微镜、流式细胞术、纳米粒子示踪分析、蛋白质印迹法和酶联免疫吸附实验等,其中电子显微镜可直观地观察外泌体的体积大小、表面结构及内部结构;另外,外泌体携带的蛋白质可用流式细胞术、蛋白质印迹法以及酶联免疫吸附实验等方法进行检测。 2.3 组织纤维化 在组织修复或反应过程中,纤维结缔组织的增生和实质细胞的减少称为组织纤维化[13]。组织纤维化可以是生理性的,可以是反应性的,也可以是病理性的,可以发生在人体的所有器官或组织中。正常的组织纤维化具有自我限制性,以保持身体功能和结构的完整性[14]。然而,在病理情况下,正常的组织修复反应逃离了体内平衡调节机制,演变成一个不受控制的纤维化过程,其特征是进行性和病理性聚集大量的纤维组织,进而导致瘢痕形成和组织增厚,破坏正常的器官结构,最终导致器官衰竭。尽管纤维性疾病的发病机制和临床表现存在显著的异质性,但大量研究发现,活化的肌成纤维细胞是最终导致正常组织被无功能纤维组织取代的共同细胞因子。在细胞水平上,人们普遍认为肌成纤维细胞是组织纤维变性过程中最主要的细胞。肌成纤维细胞表达α-平滑肌肌动蛋白,且纤维胶原(Ⅰ型、Ⅲ型、Ⅴ型和Ⅵ型)和其他细胞外基质显著增加,同时抑制细胞外基质降解。然而,值得强调的是,不同类型细胞的转分化不是肌成纤维细胞的主要来源,但转分化细胞表型的改变可能导致包括转化生长因子β在内的促纤维化因子的产生和分泌,在纤维化过程中发挥重要作用。外泌体介导的细胞间信号传导参与了成纤维细胞的活化。转化生长因子β是最有效的促纤维化细胞因子,它直接诱导成纤维细胞分化为肌成纤维细胞;在一些实验模型中,已经证明抑制转化生长因子β信号通路可以改善纤维化。另外miRNA参与了纤维化疾病中转化生长因子β信号通路的调节。总之,外泌体可以调节纤维化效应细胞的活化、纤维化信号分子的表达以及相应信号通路的活化,从而参与纤维化的发展[15]。 2.4 外泌体在各纤维化疾病中研究进展 "

2.4.1 肺纤维化 特发性肺纤维化是一种慢性进行性疾病,其特征是呼吸功能不可避免地下降。特发性肺纤维化的病因尚未明确,危险因素包括病毒感染和吸烟等。特发性肺纤维化的特点是肺泡上皮细胞损伤、上皮/内皮-间充质转化、单核/巨噬细胞浸润、肌成纤维细胞活化和细胞外基质沉积。复发性肺泡上皮损伤引起巨噬细胞募集,触发促炎症和促纤维化信号,从而导致肺纤维化[16]。目前,患者可服用抗纤维化新型药物(尼达尼布和吡非尼酮)减轻肺活量的下降,但不能控制肺纤维化的进程,也不能逆转肺纤维化[17],无法从根本上恢复肺原有的功能 。研究发现,月经血干细胞来源外泌体将miRNA let-7转运至肺泡上皮细胞,下调活性氧水平和LOX1表达,减少线粒体DNA损伤及炎性小体NLRP3活化,从而减轻肺纤维化[18]。CHOI等[19]利用间充质干细胞及间充质干细胞源性外泌体治疗小鼠肺纤维化,通过相关实验检测可观察到小鼠肺部胶原纤维沉积降低并且肺部炎症反应减少,这些效果归功于间充质干细胞释放外泌体对其微环境产生的影响。WILLIS 等[20]研究表明,间充质干细胞源性外泌体可改善肺组织形态以及肺血管重塑,减轻肺纤维化。FUJITA 等[13]实验发现,对于博莱霉素诱导的肺纤维化小鼠,在第14天给予人骨髓间充质干细胞来源细胞外囊泡,显著下调了α-平滑肌肌动蛋白的表达,这些囊泡通过改变肌成纤维细胞表型对肺纤维化有治疗作用。SHENTU 等[21]研究报道,胸腺细胞表面糖蛋白1在间充质干细胞衍生的细胞外囊泡中起关键作用,它们通过整合素β1、β3或β5与成纤维细胞相互作用,降低转化生长因子 β1诱导的肺成纤维细胞中α-平滑肌肌动蛋白、纤维粘连蛋白和Ⅲ型胶原蛋白的表达, 抑制肺成纤维细胞向肌成纤维细胞分化,从而减轻了肺纤维化。总之,肺纤维化是以细胞外基质过度沉积、肺实质和上皮屏障破坏、成纤维细胞和肌成纤维细胞增生为特征的进行性肺部疾病,目前临床上没有特效治疗方法,相关的实验证明了间充质干细胞源性外泌体通过转化生长因子 β1信号通路抑制成纤维细胞和肌成纤维细胞的活性,进而减轻细胞外基质沉积和炎症反应,促进血管再生,从而减轻肺部纤维化。 2.4.2 肝纤维化 纤维化归因于过多的细胞外基质积聚,这损害了肝脏的正常形态和功能。细胞外基质沉积过多是由于成纤维细胞的持续活化所致,它会增殖并产生不同的基质成分(Ⅰ型和Ⅲ型胶原、纤连蛋白、层粘连蛋白和蛋白聚糖)。肝星状细胞是肝纤维化发展的关键因素,在生理条件下肝星状细胞是非增殖细胞,不同类型损伤可能会诱导肝星状细胞活化并产生细胞外基质成分和促炎性细胞因子。LI等[22]研究发现,人脐带间充质干细胞源性外泌体移植后减轻了四氯化碳诱导的肝脏炎症和胶原沉积,还能明显恢复血清天冬氨酸氨基转移酶活性,降低Ⅰ型和Ⅲ型胶原、转化生长因子β1和磷酸化Smad2的表达,减轻上皮-间充质转化,这些结果提示人脐带间充质干细胞源性外泌体可能通过抑制上皮间充质转化和保护肝细胞而减轻四氯化碳诱导的肝纤维化。有研究将绒毛膜间充质干细胞源性外泌体注射到四氯化碳诱导的肝纤维化大鼠体内,发现绒毛膜间充质干细胞源性外泌体所携带的microRNA-125b通过抑制Hedgehog(Hh)信号通路缓解肝脏纤维化并促进肝脏再生[23],说明Hedgehog信号通路在肝纤维化发展过程中发挥着重要作用。另外研究发现人脐血间充质干细胞源性外泌体可通过抑制上皮间质转化和抗氧化作用,改善四氯化碳诱导的肝纤维化[24]。含有 miR-181-5p的外泌体可以通过抑制STAT3/Bcl-2/Beclin 1途径来增加自噬并减轻肝纤维化[10]。总而言之,肝纤维化是由各种原因引起肝脏组织中细胞外基质过度沉积引起的纤维化,而活化肝星状细胞起着关键性的作用。正常情况下,处于静息状态的肝星状细胞受多种损伤及炎症因子的刺激而被活化,通过激活一系列信号通路,最终获得促纤维化表型向损伤部位迁移,分泌过量的细胞外基质导致肝纤维化。尽管有越来越多的研究深入探讨肝纤维化发展的分子机制,但仍缺乏抗肝纤维化药物。抗纤维化疗法集中于不同的作用机制:肝细胞保护、抑制肝星状细胞活化、减少纤维化分子沉积以及炎症调节。在肝纤维化的背景下,间充质干细胞源性外泌体已被证明通过调节不同的分子通路(如转化生长因子β和Wnt信号通路),改善肝脏炎症和胶原沉积,减轻肝纤维化。 2.4.3 心脏纤维化 心脏纤维化是指心肌组织中胶原纤维过度聚积,各型胶原比例失调以及排列紊乱引起的纤维化。心肌成纤维细胞可直接通过增殖、分化和分泌细胞外基质有效刺激心肌重塑,然而心肌成纤维细胞长期被激活可导致心肌纤维化的发生[25], 因此,心肌成纤维细胞过度增殖是心肌纤维化的重要因素[26]。ZHAO等[27]研究结果显示,人脐带间充质干细胞源性外泌体通过调节Bcl-2家族成员的表达,具有减少心肌细胞凋亡、增强心肌收缩功能和减轻心肌纤维化的作用。用DiI标记的外泌体被心脏干细胞内化,它们刺激心脏干细胞的增殖、迁移和血管形成。在大鼠心肌梗死模型中,间充质干细胞外泌体预处理的心脏干细胞存活率显著提高,毛细血管密度增加,心脏纤维化减少,并恢复了长期的心功能。MicroRNA图谱分析表明,经间充质干细胞外泌体处理后,心脏干细胞中的一组microRNA发生了明显变化。此外,miRNA可能调节心脏干细胞的增殖和分化[28]。对骨髓间充质干细胞源性外泌体中 miRNA 高通量基因表达分析发现,骨髓间充质干细胞源性外泌体中含量较高的前3种miRNA为miR-1246、miR-23a-3p和miR-451a,而且这些外泌体能明显抑制心肌纤维化胶原的生成[29]。SHAO等[30]利用骨髓间充质干细胞源性外泌体治疗心肌梗死大鼠, 发现大鼠心肌的炎症反应与纤维化均得到改善,心功能得到增强。最近有研究表明,间充质干细胞源性外泌体可通过抑制成纤维细胞的增殖,刺激梗死区血管新生进而抑制心肌纤维化[31]。人脐带间充质干细胞源性外泌体通过激活TGF-β1/Smad2/3信号通路,阻断上皮-间质转化,减少心肌纤维化[32]。炎症反应和心肌细胞死亡通常是刺激成纤维细胞分泌过量细胞外基质蛋白的促纤维化信号级联反应的最初因素。许多不同的生长因子(肿瘤坏死因子α、转化生长因子β)、细胞因子(白细胞介素1、白细胞介素10、白细胞介素11)和肾素血管紧张素系统是心肌纤维化发生和发展的关键调节因子,调节包括心肌细胞和成纤维细胞在内的各种细胞的功能。研究表明,间充质干细胞源性外泌体主要通过抑制成纤维细胞的活性,减少细胞外基质过度沉积和心肌炎症反应,最终改善心脏纤维化,恢复心功能。 2.4.4 肾脏纤维化 肾脏在机械损伤、持续感染、长期暴露于毒素或辐射、自身免疫反应的刺激下,肾实质内细胞外基质蛋白降解和合成异常,引起细胞外基质大量聚集,最终导致肾间质纤维化[33-34]。在临床上仍然没有特效的治疗方法可以治疗纤维化疾 病[35]。在小鼠单侧输尿管梗阻动物实验中发现骨髓间充质干细胞源性外泌体高表达miR-let7c,低表达Ⅳ型胶原、基质金属蛋白酶9和转化生长因子β1,肾脏损伤明显降低,具有抗纤维化作用[36]。另外表达miR-29的外泌体肌内注射能够有效缓肾纤维化,减少肾脏组织中转化生长因子β、α-平滑肌肌动蛋白和胶原的表达[37]。 人脂肪干细胞来源外泌体通过激活Sox9减轻缺血再灌注损伤向肾间质纤维化的转变[38]。EBRAHIM 等[39]发现骨髓间充质干细胞释放的外泌体能通过mTOR信号通路降低纤维化标志物的表达,从而减轻肾纤维化、改善肾功能并促进肾脏的组织学修复。NAGAISHI等[40]研究发现骨髓间充质干细胞来源外泌体能够发挥抑制糖尿病肾病模型小鼠肾小管上皮细胞凋亡、抗纤维化的作用。胡玉燕等[41]研究表明人脐带间充质干细胞源性外泌体能够抑制肾间质中转化生长因子β1等促纤维化因子的表达,并且能够逆转大鼠肾小管上皮细胞上皮间质转化,从而起到保护肾脏作用,延缓了大鼠肾间质纤维化的进展。综上所述,目前实验研究发现间充质干细胞源性外泌体可通过抑制转化生长因子β的表达以及高表达外泌体传递的miRNA或者其他分泌因子,使得细胞外基质沉积减少,具有抗炎、抗纤维化作用。 2.5 放射性唾液腺纤维化 唾液腺又称涎腺,产生唾液并维持口腔内环境稳定[42]。涎腺由三大细胞组成:腺泡细胞、肌上皮细胞和导管细胞,腺泡细胞主要功能是分泌唾液,导管细胞主要功能是控制唾液的分泌。头颈部恶性肿瘤患者在接受放射治疗时不仅杀死癌细胞,同时也会对周围正常组织(比如腺涎)造成损伤,导致细胞空泡性变、血管密度降低以及组织纤维化等,最终导致涎腺功能不可逆性损伤。最近有研究报道,60%-90%的头颈部肿瘤患者放疗后并发涎腺放射性损伤,引起口干症,出现咀嚼、吞咽困难等不良症状[43]。正常唾液腺组织中细胞外基质蛋白表达很少,放射性损伤唾液腺组织中细胞外基质蛋白表达明显增多,表达的量与辐射剂量相关,而且细胞外基质蛋白是放射性唾液腺损伤间质纤维化的分子标志物,表明唾液腺在放射后发生了纤维化性变。对于放射性唾液腺损伤引起的不良症状,目前临床上没有特效药物,主要使用促涎剂(毛果云香碱)、补充人工合成唾液来增加唾液量,但效果不佳并伴随着不良反应,无法恢复涎腺功能。最初,人们普遍认为间充质干细胞具有多向分化潜能,植入腺体后可以分化为涎腺上皮细胞(腺泡细胞)进而修复涎腺分泌障碍。然而,间充质干细胞在体内长期存活并分化为腺泡细胞的证据并不确切。据报道,间充质干细胞移植后1周,只有< 1%的细胞能存活下来[44]。代敏等[45]研究表明在体积分数为3%低氧条件下能提高人羊膜间充质干细胞的增殖活性及抗凋亡作用,同时分泌了更多的血管相关生成因子。王英鑫[46]将低氧预处理人羊膜间充质干细胞移植入放射损伤腺涎小鼠模型,结果发现腺涎腺泡细胞数目增多,间质纤维化明显改善。总之,目前大部分实验是用间充质干细胞移植修复放射性唾液腺损伤,虽然有一定的效果,但效果不确定,并且其安全性受到质疑,并不能在临床中运用。目前需要研究一种更好的治疗方法用于修复放射性唾液腺纤维化损伤。"

| [1] FRANGOGIANNIS NG. Fibroblast-Extracellular Matrix Interactions in Tissue Fibrosis. Curr Pathobiol Rep. 2016;4(1):11-18. [2] 李超然,黄桂林,王帅.间充质干细胞来源外泌体促进损伤组织修复与再生的应用与进展[J]. 中国组织工程研究,2018,22(1):133-139. [3] BERARDIS S, LOMBARD C, EVRAERTS J, et al. Gene expression profiling and secretome analysis differentiate adult-derived human liver stem/progenitor cells and human hepatic stellate cells. PLoS One. 2014;9(1): e86137. [4] XU S, LIU C, JI HL. Concise Review: Therapeutic Potential of the Mesenchymal Stem Cell Derived Secretome and Extracellular Vesicles for Radiation-Induced Lung Injury: Progress and Hypotheses. Stem Cells Transl Med. 2019;8(4):344-354. [5] YAO Y, CHEN R, WANG G, et al. Exosomes derived from mesenchymal stem cells reverse EMT via TGF-β1/Smad pathway and promote repair of damaged endometrium. Stem Cell Res Ther. 2019;10(1):225. [6] 张登沈,刘达兴,梁贵友.外泌体源性微RNA在心血管疾病发生机制中的研究进展[J].中华医学杂志,2018,98(46):3802-3804. [7] HURWITZ SN, CONLON MM, RIDER MA, et al. Nanoparticle analysis sheds budding insights into genetic drivers of extracellular vesicle biogenesis. J Extracell Vesicles. 2016;5:31295. [8] 刘亭亭,贾冬萍,王秀梅.外泌体源性 miRNAs 作为诊断标志物在肿瘤中的研究进展[J].国际遗传学杂志,2019,41(2):143-148. [9] HOSSEINI SHAMILI F, ALIBOLANDI M, RAFATPANAH H, et al. Immunomodulatory properties of MSC-derived exosomes armed with high affinity aptamer toward mylein as a platform for reducing multiple sclerosis clinical score. J Control Release. 2019;299:149-164. [10] QU Y, ZHANG Q, CAI X, et al. Exosomes derived from miR-181-5p-modified adipose-derived mesenchymal stem cells prevent liver fibrosis via autophagy activation. J Cell Mol Med. 2017;21(10):2491-2502. [11] XU R, GREENING DW, ZHU HJ, et al. Extracellular vesicle isolation and characterization: toward clinical application. J Clin Invest. 2016;126(4): 1152-1162. [12] TIAN YF, NING CF, HE F, et al. Highly sensitive detection of exosomes by SERS using gold nanostar@Raman reporter@nanoshell structures modified with a bivalent cholesterol-labeled DNA anchor. Analyst. 2018;143(20):4915-4922. [13] FUJITA Y, KADOTA T, ARAYA J, et al. Clinical Application of Mesenchymal Stem Cell-Derived Extracellular Vesicle-Based Therapeutics for Inflammatory Lung Diseases. J Clin Med. 2018;7(10):355. [14] ROCKEY DC, BELL PD, HILL JA. Fibrosis--A Common Pathway to Organ Injury and Failure. N Engl J Med. 2015;373(1):96. [15] QIN XJ, ZHANG JX, WANG RL. Exosomes as mediators and biomarkers in fibrosis. Biomark Med. 2020;14(8):697-712. [16] MEYER KC. Pulmonary fibrosis, part I: epidemiology, pathogenesis, and diagnosis. Expert Rev Respir Med. 2017;11(5):343-359. [17] MIKOLASCH TA, GARTHWAITE HS, PORTER JC. Update in diagnosis and management of interstitial lung disease. Clin Med (Lond). 2016; 16(Suppl 6):s71-s78. [18] SUN L, ZHU M, FENG W, et al. Exosomal miRNA Let-7 from Menstrual Blood-Derived Endometrial Stem Cells Alleviates Pulmonary Fibrosis through Regulating Mitochondrial DNA Damage. Oxid Med Cell Longev. 2019;2019:4506303. [19] CHOI M, BAN T, RHIM T. Therapeutic use of stem cell transplantation for cell replacement or cytoprotective effect of microvesicle released from mesenchymal stem cell. Mol Cells. 2014;37(2):133-139. [20] WILLIS GR, FERNANDEZ-GONZALEZ A, ANASTAS J, et al. Mesenchymal Stromal Cell Exosomes Ameliorate Experimental Bronchopulmonary Dysplasia and Restore Lung Function through Macrophage Immunomodulation. Am J Respir Crit Care Med. 2018;197(1):104-116. [21] SHENTU TP, HUANG TS, CERNELC-KOHAN M, et al. Thy-1 dependent uptake of mesenchymal stem cell-derived extracellular vesicles blocks myofibroblastic differentiation. Sci Rep. 2017;7(1):18052. [22] LI T, YAN Y, WANG B, et al. Exosomes derived from human umbilical cord mesenchymal stem cells alleviate liver fibrosis. Stem Cells Dev. 2013;22(6):845-854. [23] HYUN J, WANG S, KIM J, et al. MicroRNA125b-mediated Hedgehog signaling influences liver regeneration by chorionic plate-derived mesenchymal stem cells. Sci Rep. 2015;5:14135. [24] JIANG W, TAN Y, CAI M, et al. Human Umbilical Cord MSC-Derived Exosomes Suppress the Development of CCl4-Induced Liver Injury through Antioxidant Effect. Stem Cells Int. 2018;2018:6079642. [25] ZHANG W, CHEN XF, HUANG YJ, et al. 2,3,4’,5-Tetrahydroxystilbene-2-O-beta-D-glucoside inhibits angiotensin II-induced cardiac fibroblast proliferation via suppression of the reactive oxygen species-extracellular signal-regulated kinase 1/2 pathway. Clin Exp Pharmacol Physiol. 2012;39(5):429-437. [26] FENG Y, HUANG W, WANI M, et al. Ischemic preconditioning potentiates the protective effect of stem cells through secretion of exosomes by targeting Mecp2 via miR-22. PLoS One. 2014;9(2):e88685. [27] ZHAO Y, SUN X, CAO W, et al. Exosomes Derived from Human Umbilical Cord Mesenchymal Stem Cells Relieve Acute Myocardial Ischemic Injury. Stem Cells Int. 2015;2015:761643. [28] ZHANG Z, YANG J, YAN W, et al. Pretreatment of Cardiac Stem Cells With Exosomes Derived From Mesenchymal Stem Cells Enhances Myocardial Repair. J Am Heart Assoc. 2016;5(1):e002856. [29] FERGUSON SW, WANG J, LEE CJ, et al. The microRNA regulatory landscape of MSC-derived exosomes: a systems view. Sci Rep. 2018; 8(1):1419. [30] SHAO L, ZHANG Y, LAN B, et al. MiRNA-Sequence Indicates That Mesenchymal Stem Cells and Exosomes Have Similar Mechanism to Enhance Cardiac Repair. Biomed Res Int. 2017;2017:4150705. [31] KARANTALIS V, HARE JM. Use of mesenchymal stem cells for therapy of cardiac disease. Circ Res. 2015;116(8):1413-1430. [32] MEENA AS, SHUKLA PK, SHETH P, et al. EGF receptor plays a role in the mechanism of glutamine-mediated prevention of alcohol-induced gut barrier dysfunction and liver injury. J Nutr Biochem. 2019;64:128-143. [33] 杨晓颖,朱强强,黄业伟.肾脏纤维化的发病机制及治疗策略研究进展[J].健康之友,2019,30(11):161. [34] 姚小兵.肾纤维化的发病机制及治疗研究进展[J].国际泌尿系统杂志,2019,39(2):371-374. [35] LIU F, ZHUANG S. New Therapies for the Treatment of Renal Fibrosis. Adv Exp Med Biol. 2019;1165:625-659. [36] WANG B, YAO K, HUUSKES BM, et al. Mesenchymal Stem Cells Deliver Exogenous MicroRNA-let7c via Exosomes to Attenuate Renal Fibrosis. Mol Ther. 2016;24(7):1290-1301. [37] WANG H, WANG B, ZHANG A, et al. Exosome-Mediated miR-29 Transfer Reduces Muscle Atrophy and Kidney Fibrosis in Mice. Mol Ther. 2019; 27(3):571-583. [38] ZHU F, CHONG LEE SHIN OLS, Pei G, et al. Adipose-derived mesenchymal stem cells employed exosomes to attenuate AKI-CKD transition through tubular epithelial cell dependent Sox9 activation. Oncotarget. 2017;8(41):70707-70726. [39] EBRAHIM N, AHMED IA, HUSSIEN NI, et al. Mesenchymal Stem Cell-Derived Exosomes Ameliorated Diabetic Nephropathy by Autophagy Induction through the mTOR Signaling Pathway. Cells. 2018;7(12):226. [40] NAGAISHI K, MIZUE Y, CHIKENJI T, et al. Mesenchymal stem cell therapy ameliorates diabetic nephropathy via the paracrine effect of renal trophic factors including exosomes. Sci Rep. 2016;6:34842. [41] 胡玉燕,尹磊,张晨笑,等.脐带间充质干细胞外泌体对大鼠肾间质纤维化的抑制作用[J].江苏大学学报(医学版),2020,30(4):282-286. [42] 张林,王帅,张霓霓,等.脱细胞基质制备方法及其在涎腺组织工程中的应用[J].中国组织工程研究,2020,24(10):1597-1603. [43] VAN LUIJK P, PRINGLE S, DEASY JO, et al. Sparing the region of the salivary gland containing stem cells preserves saliva production after radiotherapy for head and neck cancer. Sci Transl Med. 2015;7(305): 305ra147. [44] EGGENHOFER E, BENSELER V, KROEMER A, et al. Mesenchymal stem cells are short-lived and do not migrate beyond the lungs after intravenous infusion. Front Immunol. 2012;3:297. [45] 代敏,王帅,张霓霓,等.低氧预处理人羊膜间充质干细胞的生物学特征[J].中国组织工程研究,2021,25(19):3004-3008. [46] 王英鑫.低氧预处理人羊膜间充质干细胞修复放射性涎腺损伤功能的研究[D].遵义:遵义医学院,2018. |
| [1] | Zhu Chan, Han Xuke, Yao Chengjiao, Zhou Qian, Zhang Qiang, Chen Qiu. Human salivary components and osteoporosis/osteopenia [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1439-1444. |
| [2] | Jin Tao, Liu Lin, Zhu Xiaoyan, Shi Yucong, Niu Jianxiong, Zhang Tongtong, Wu Shujin, Yang Qingshan. Osteoarthritis and mitochondrial abnormalities [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1452-1458. |
| [3] | Zhang Lichuang, Xu Hao, Ma Yinghui, Xiong Mengting, Han Haihui, Bao Jiamin, Zhai Weitao, Liang Qianqian. Mechanism and prospects of regulating lymphatic reflux function in the treatment of rheumatoid arthritis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1459-1466. |
| [4] | Chen Xianghe, Liu Bo, Yang Kang, Lu Pengcheng, Yu Huilin. Treadmill exercise improves the myocardial fibrosis of spontaneous type 2 diabetic mice: an exploration on the functional pathway [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1210-1215. |
| [5] | Xiang Xinjian, Liu Fang, Wu Liangliang, Jia Daping, Tao Yue, Zhao Zhengnan, Zhao Yu. High-dose vitamin C promotes the survival of autologous fat transplantation in rats [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1242-1246. |
| [6] | Wang Jing, Xiong Shan, Cao Jin, Feng Linwei, Wang Xin. Role and mechanism of interleukin-3 in bone metabolism [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1260-1265. |
| [7] | Xiao Hao, Liu Jing, Zhou Jun. Research progress of pulsed electromagnetic field in the treatment of postmenopausal osteoporosis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1266-1271. |
| [8] | Zhu Chan, Han Xuke, Yao Chengjiao, Zhang Qiang, Liu Jing, Shao Ming. Acupuncture for Parkinson’s disease: an insight into the action mechanism in animal experiments [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1272-1277. |
| [9] | Wen Dandan, Li Qiang, Shen Caiqi, Ji Zhe, Jin Peisheng. Nocardia rubra cell wall skeleton for extemal use improves the viability of adipogenic mesenchymal stem cells and promotes diabetes wound repair [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1038-1044. |
| [10] | Zhu Bingbing, Deng Jianghua, Chen Jingjing, Mu Xiaoling. Interleukin-8 receptor enhances the migration and adhesion of umbilical cord mesenchymal stem cells to injured endothelium [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1045-1050. |
| [11] | Luo Xiaoling, Zhang Li, Yang Maohua, Xu Jie, Xu Xiaomei. Effect of naringenin on osteogenic differentiation of human periodontal ligament stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1051-1056. |
| [12] | Wu Weiyue, Guo Xiaodong, Bao Chongyun. Application of engineered exosomes in bone repair and regeneration [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1102-1106. |
| [13] | Zhou Hongqin, Wu Dandan, Yang Kun, Liu Qi. Exosomes that deliver specific miRNAs can regulate osteogenesis and promote angiogenesis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1107-1112. |
| [14] | Zhang Jinglin, Leng Min, Zhu Boheng, Wang Hong. Mechanism and application of stem cell-derived exosomes in promoting diabetic wound healing [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1113-1118. |
| [15] | Huang Chenwei, Fei Yankang, Zhu Mengmei, Li Penghao, Yu Bing. Important role of glutathione in stemness and regulation of stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1119-1124. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||