Chinese Journal of Tissue Engineering Research ›› 2022, Vol. 26 ›› Issue (22): 3573-3579.doi: 10.12307/2022.287
Previous Articles Next Articles
Hydrogel-based adipose tissue engineering strategies for vascularization
Wu Shuhan1, 2, Zhu Xulong2, 3, Bai Lu1, 2, Zhang Feifei1, 2, Lin Guangshuai1, 2, Li Jiang1, 4, Du Jia1, 2, Li Jianhui2
- 1College of Medicine, Yan’an University, Yan’an 716000, Shaanxi Province, China; 2Department of Surgical Oncology, Shaanxi Provincial People’s Hospital, Xi’an 710068, Shaanxi Province, China; 3School of Life Science and Technology, Xi’an Jiaotong University, Xi’an 710049, Shaanxi Province, China; 4Xi’an Medical University, Xi’an 710068, Shaanxi Province, China
-
Received:2020-11-10Revised:2020-12-18Accepted:2021-04-09Online:2022-08-08Published:2022-01-12 -
Contact:Li Jianhui, MD, Chief physician, Master’s supervisor, Department of Surgical Oncology, Shaanxi Provincial People’s Hospital, Xi’an 710068, Shaanxi Province, China -
About author:Wu Shuhan, Master candidate, Physician, College of Medicine, Yan’an University, Yan’an 716000, Shaanxi Province, China; Department of Surgical Oncology, Shaanxi Provincial People’s Hospital, Xi’an 710068, Shaanxi Province, China -
Supported by:the Scientific and Technological Innovation Team Project in Shaanxi Province, No. 2014KCT-24 (to LJH); the Natural Science Basic Research Plan in Shaanxi Province, No. 2020JQ-936 (to ZXL)
CLC Number:
Cite this article
Wu Shuhan, Zhu Xulong, Bai Lu, Zhang Feifei, Lin Guangshuai, Li Jiang, Du Jia, Li Jianhui. Hydrogel-based adipose tissue engineering strategies for vascularization[J]. Chinese Journal of Tissue Engineering Research, 2022, 26(22): 3573-3579.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
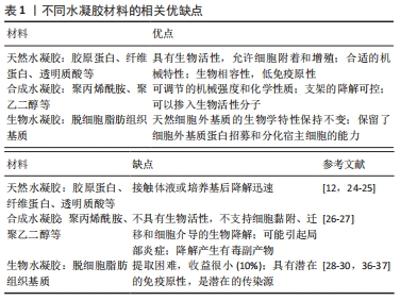
2.1 基于水凝胶的脂肪组织工程 2.1.1 脂肪组织及脂肪干细胞 脂肪组织是疏松的结缔组织,主要存在于皮下、真皮及腹膜组织中[13]。成熟的脂肪组织由成熟的脂肪细胞和基质血管组分组成,嵌入到由Ⅵ型胶原蛋白基膜组成的细胞外基质当中。成熟的脂肪细胞约占脂肪组织总质量的85%,然而由于其缺少增殖和分化的能力、无法黏附在培养板上吸收营养及易受到机械和生理压力影响等不良原因,大多数成熟脂肪细胞在体外培养72 h内均发生死 亡[14],因此成熟的脂肪细胞并不适用于脂肪组织工程。 脂肪组织工程学要求种子细胞具有分化为成熟脂肪细胞的能力,脂肪干细胞由于来源广泛、具有自我更新及多向分化潜能,在伤口愈合、组织再生及移植物存活方面具有有益效果,正迅速成为组织工程和再生医学细胞来源的金标准[8]。国际脂肪治疗与研究学会(IFATS)和国际细胞治疗学会(ISCT)关于脂肪干细胞的联合声明指出,脂肪干细胞的特征性细胞表型包括CD45(-)、CD235a(-)、CD31(-)和CD34(+)[15]。 相关研究表明,脂肪干细胞在脂肪移植中具有突出的促血管化作用,已被广泛应用于组织工程的各个领域[16]。YUAN等[17]指出脂肪干细胞可分泌多种促血管生成的生长因子,包括血管内皮生长因子、肝细胞生长因子和碱性成纤维细胞生长因子等,其早期成血管化作用主要是通过释放大量血管生成因子来诱导受体区域的新血管向周围及移植物内生长,缺氧可能会增强这种效果。不仅如此,脂肪干细胞除了分泌细胞因子外,还可以分泌囊泡或外泌体参与到血管化的信号转导通路中去,促进内皮细胞的增殖、迁移和血管形成[18]。KANG等[19]首次观察到脂肪干细胞中释放出了微囊泡,微囊泡能够增强人脐静脉内皮细胞的迁移和管状结构的形成,其潜在机制可能是脂肪干细胞通过释放微囊泡将microRNA-31传递至血管内皮细胞,从而靶向抑制了抗血管生成基因——缺氧诱导因子1,促进新血管形成。LIANG等[20]分离出脂肪干细胞分泌的外泌体,并研究了它们在血管生成中的作用,发现100 mg/L的外泌体体内外促血管生成能力最强,这可能是由于外泌体携带的miR-125a抑制了血管生成抑制因子DLL4的表达。由此可见,脂肪干细胞不仅是新生组织的组成部分,同时也是宿主反应的调节剂,在脂肪组织工程中起着双重作用[21]。然而,脂肪干细胞在脂肪组织微环境中通过与内皮细胞之间的信号交流促进血管生成的相关研究仍停留在体外实验,还需要进一步的动物模型加以验证。 2.1.2 水凝胶在脂肪组织工程中的应用 水凝胶由亲水性高分子聚合物链组成,是能够吸收和保留大量水和(或)生物液体的3D亲水网状交联结构[22]。理想的脂肪组织工程水凝胶材料应当有良好的组织相容性、可控的生物降解性、合适的力学强度及为种子细胞提供适当附着位点等特性[11,23]。目前,根据来源可以将水凝胶分为天然水凝胶、合成水凝胶及生物水凝胶三大类。天然水凝胶来源于天然细胞外基质成分,具有良好的组织相容性及生物活性,支持细胞的附着和增殖,但是在体内外易被相关的酶降解[12,24-25]。合成水凝胶由各种大分子单体通过化学反应交联而成,由于其化学和机械性质易于改变、允许添加生物活性分子等特性而备受欢迎,但需要进行表面修饰才能用于脂肪组织工程;另外,合成水凝胶的毒副降解产物也可能导致移植后延迟愈合及相关并发症的发生[26-27]。生物水凝胶是组织去除细胞内容物后的产物,具有招募和分化宿主细胞的能力,不足是其制备方法较为复杂、提取相对困难[28-30]。 除了为组织提供结构支持外,水凝胶的另一重要功能就是促进营养物质及代谢产物在支架内的交换。一般来说,水凝胶中的物质交换主要通过扩散来实现,聚合物的交联密度决定水凝胶的孔隙率,进而影响生物分子的扩散速率及血管形成。在无孔水凝胶中,血管的形成主要取决于支架的降解速率[31]。CLEVENGER等[32]设计出一种能够随着脂肪干细胞分化进行重塑的聚乙二醇水凝胶,该水凝胶在脂肪干细胞分化的过程中能够产生更多的孔来容纳成熟脂肪细胞,因而具有更大的促血管化作用。KIM等[33]将脱细胞脂肪基质交联甲基纤维素组成水凝胶,该凝胶具有与脂肪组织相似的刚度(约4 kPa),可促进脂肪干细胞的成脂分化;将其(3.5 g)皮下注入裸鼠背部,3周后发现移植物内部原位再生出完整的脂肪组织,证明了脱细胞水凝胶支架可以释放细胞外基质片段及生物活性分子,募集宿主脂肪干细胞并诱导其分化为成熟脂肪组织。 由于其特殊的“湿软”性质,水凝胶允许将活细胞封包在其中修复软组织缺损。将细胞封包入水凝胶中可以避免移植过程中干细胞的丢失或失活,另外也可以利用水凝胶微球技术制备出包裹两种或多种不同种类细胞的水凝胶载体,从而具有更大的应用范围。YAO等[34]的研究证明,胶原/海藻酸钠微球适用于脂肪干细胞的封包及缓释,体外成脂分化诱导培养4周后,水凝胶微球具有与脂肪组织小叶相似的大体结构,随后将水凝胶/细胞微球注射到小鼠皮下,可观察到血管化脂肪组织的形成。随着研究的深入,水凝胶也可以进一步作为生物反应器为脂肪干细胞的3D培养提供动态生理环境,不仅可以促进干细胞生长、增殖和分化,同时也能够模拟体内血管的生物力学条件促使脂肪干细胞向内皮细胞分化。国内王小红教授课题组制备出海藻酸钠/明胶双交联互穿网络水凝胶,利用3D打印技术构建的多通道3D网状模型,在其中动态培养的脂肪干细胞均具有良好的生长状态,同时在内皮诱导剂的参与下均可表达内皮细胞特异性Ⅷ因子[35]。 不同水凝胶材料的优缺点详见表1。"

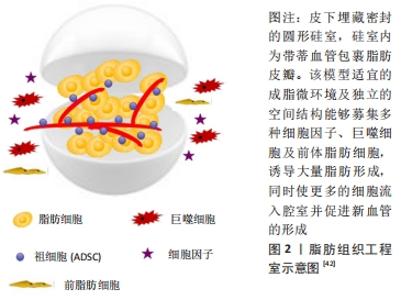
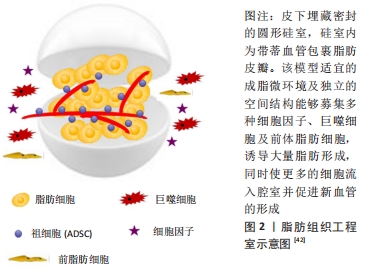
2.2 脂肪组织工程中的血管化问题 传统的脂肪组织工程技术已成功地在体内外构建出成熟的脂肪组织,尽管有一定程度的血管化,但构建出的脂肪组织仍然存在体积小、缺乏血供、长期转归不理想等问题[38-39],达不到临床所需的大体积工程化脂肪组织的标准。AGHA等[40]对3 624例乳腺癌术后自体脂肪移植进行乳房重建患者的临床资料进行分析,在18个月的随访中发现,最常见的移植后并发症是脂肪的坏死吸收,发生率大概为4.4%。为此,一些学者利用相关的组织工程技术来解决这一难题,目前常用的对移植物进行血管化的方法包括:使用组织工程室模型、将人脂肪源性干细胞与血管内皮细胞共培养、负载促血管生成因子及应用具有血管生成特性的水凝胶材料4种。 2.2.1 组织工程室模型 脂肪的组织工程室理论上是将带血管蒂的脂肪组织分离后直接包埋在中空圆柱样的组织工程室内,当加入细胞支架复合体后,埋入室内的血管能够以出芽的方式围绕轴心血管蒂发散形成微血管网,同时新生组织伴随新生血管向外周生长,从而产生大体积脂肪组织;中空支撑结构的植入,可保护发育中的脂肪组织免受机械力的影响[41-42],见图2。"
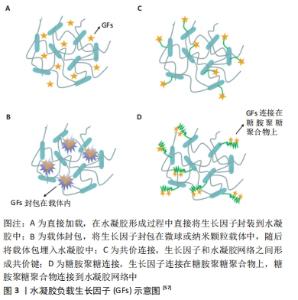
2007年,DOLDERER等[43]首次将小体积带血管蒂的脂肪瓣(0.04 mL)植入大鼠腹股沟区组织工程室内,并在6周后诱导出0.5 mL脂肪瓣,同时也观察到新生脂肪组织的高度血管化,证实了室内脂肪体积的增加是由于脂肪细胞数目增多而非脂肪体积的增大。从此,拉开了构建体内组织工程室模型的序幕。 STOSICH等[44]用聚乙二醇二丙烯酸酯制成水凝胶圆柱体,封装带血管蒂的脂肪组织构建组织工程室,将其皮下植入免疫缺陷小鼠体内后,苏木精-伊红染色可以观察到聚乙二醇微通道中有大量的血管生成,证明微通道结构有利于脂肪组织血管的形成;在兔模型中植入带蒂的脂肪组织皮瓣后,观察期间(第1,2,3,4,16周)脂肪量显著增加,最终达到初始体积的6倍[45]。组织工程室技术显示出在体内产生大体积脂肪组织的巨大潜力,为软组织缺损修复提供了新的思路。令人鼓舞的是,MORRISON等[46]已经率先将组织工程室模型进行了相关的临床研究,他们选择了5例乳房切除术后患者,将其胸背部带血管蒂的脂肪组织转移到患侧胸壁,并在表面覆盖丙烯酸穹隆状小室,6个月后将其取出,其中1 例患者小室内脂肪组织的体积由50 mL达到了210 mL,证明了利用组织工程室模型在人体内构建血管化大体积脂肪组织的可行性。 脂肪组织工程室模型应用范围广泛,随着技术的逐渐成熟,也有越来越多的研究开始探索移植物在室内存活的机制,并设法对其进行改进以更好地实现血管化作用[47]。这种技术的出现为在体内环境下构建出大体积脂肪组织带来了新的曙光。然而,组织工程室技术仍然面临许多问题,例如:外源性组织工程室材料常常会引起异物反应,使脂肪瓣表面囊化或挛缩,从而限制内部组织的生长;另外,如何避免植入物二次损伤及如何构建更适宜的内部微环境方面,仍需要更多的探索和实践。 2.2.2 联合血管内皮细胞共培养 血管内皮细胞是覆盖于血管最内壁的单细胞层,是人体重要的代谢和内分泌器官之一。内皮细胞不仅是血管壁和血管腔的机械及生物学屏障,还能促进新生血管的形成[48],已被广泛应用于脂肪组织工程化血管的生成当中。 研究表明,成熟的内皮细胞无法在成脂培养基中生存,与脂肪干细胞直接共培养也会导致其成脂分化的显著降 低[49]。为了解决这一问题,YAO等[50]制备出包裹脂肪干细胞的胶原蛋白-藻酸盐水凝胶微球,并在其表面包被Ⅰ型胶原蛋白以模拟天然脂肪小叶结构,形成物理分隔,在胶原蛋白涂层表面与脐静脉内皮细胞共培养;通过皮下注射到SD小鼠头部,12周后在水凝胶微球之间观察到了明显的血管生成和大量脂肪组织形成。另一种可行的办法是将预分化为脂肪细胞和内皮细胞谱系的间充质干细胞进行共培养,这种方法不会因存在其他类型的细胞而对脂肪形成或内皮细胞分化产生不利影响。KAYABOLEN等[51]构建了一种由丝素蛋白和脱细胞脂肪基质组成的水凝胶,通过在复合水凝胶中封装分化为前内皮细胞和前脂肪细胞的脂肪干细胞来产生血管化脂肪组织,他们发现脱细胞脂肪基质与丝素蛋白体积比为1∶3的水凝胶机械性能可以更准确地模拟天然脂肪组织,适宜脂肪组织的生成;将内皮细胞和脂肪形成的预分化干细胞一起封装到1∶3脱细胞脂肪基质-丝素蛋白水凝胶中后,两种细胞都继续分化为定型细胞谱系,并在2周内观察到血管生成,相比单纯水凝胶组要快的多;皮下植入小鼠体内后也观察到了相似的结论。除此之外,也有学者利用冻干的方法制备冷冻凝胶,与3D生物打印技术相结合,将分别负载脂肪干细胞与脐静脉内皮细胞的两种生物墨水3D打印到冷冻凝胶表面,以产生体积稳定的脂肪组织构建体,体外实验证明该结构支持血管的形成,为制造血管化脂肪组织提供了新的思路[52]。 由此可见,联合内皮细胞共培养的方法既适用于组织工程材料移植前的血管化,也适用于体内植入后的血管化,利用这种方法,共培养系统内的内皮细胞可以在不添加外源性生长因子的情况下进行自我促进和成熟。但是从临床应用的角度来说,由于共培养方法的复杂性及其制备价格相对昂贵,一定程度上限制了该方法的应用。 2.2.3 负载促血管生成因子 脂肪组织细胞外基质中存在多种生长因子,例如血管内皮生长因子、碱性成纤维细胞生长因子、肝细胞生长因子、胰岛素样生长因子1和血小板衍生生长因子等,各种细胞因子均能显著促进移植脂肪的血管化。然而有研究指出,这些具有促血管化作用的细胞因子只有在释放足够时间及量的条件下,才会诱导再生出功能化的血管网络[53]。将细胞因子负载于水凝胶支架中可以保持其活性不被破坏,从而达到缓慢释放的效果。ZHANG等[54]的实验证明,与不含碱性成纤维细胞生长因子的脱细胞脂肪组织基质水凝胶相比,载有碱性成纤维细胞生长因子的可注射脱细胞脂肪组织基质水凝胶具有显著的成脂及血管形成能力;小鼠背部注射后发现,实验组形成了明显的新生脂肪组织,并在6-12周内逐渐成熟,同时可见新生血管形成,新形成的脂肪组织表现出成熟的脂肪形态和细胞外基质成分,与内源性脂肪组织极为相似,相反,不含碱性成纤维细胞生长因子的脱细胞脂肪组织基质水凝胶中仅见到有限的新生脂肪组织形成,并在12周时被完全吸收。一些特殊类型的水凝胶如温敏性水凝胶在实现细胞因子缓释方面更加便捷和有效[55],因此得到了更为广泛的研究。温敏性水凝胶在室温下保持液体状态,在植入体内后随着温度的变化发生溶胶-凝胶转变。FADERA等[56]研制出的可注射温敏性透明质酸/壳聚糖/β-甘油磷酸二钠水凝胶,可以实现基质细胞衍生因子1α的局部缓释,通过基质细胞衍生因子1/CXCR4轴募集内源性脂肪干细胞,为血管生成提供了一种新的选择。目前,常见的水凝胶负载生长因子的方法主要有以下4种[57],见图3。 "
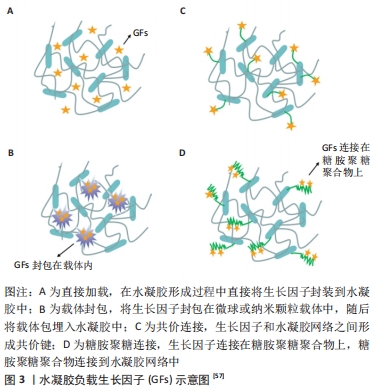

直接加载:此种方法较为简单,即在水凝胶形成过程中直接添加生长因子(图3A)。SARKANEN等[58]将从脂肪组织中提取的生物活性因子掺入透明质酸水凝胶中,皮下注入大鼠体内后追踪观察40周发现,该复合物在植入后早期即诱导微血管形成,并且从12周开始观察到了脂肪组织沉积及皮下组织体积增大,这种现象持续存在直至随访结束,证实了促血管生成因子具有持续重建软组织缺损的潜力。但是在这种方法中,由于没有与水凝胶网络形成有效连接,生长因子的释放主要是通过扩散及水凝胶的溶胀作用来实现的,因此一个非常不利的缺陷即生长因子在释放早期具有严重的突释现象,这将造成生长因子不必要的浪费[59-60],这使得该方法在组织工程中的应用受到极大限制。 载体封包:是通过将生长因子包裹在微球或纳米颗粒载体中,再将负载生长因子的载体系统掺入到水凝胶中的方法(图3B)。ARUNKUMAR等[61]制备了一种负载碱性成纤维细胞生长因子的聚己内酯微球,与对照组相比,碱性成纤维细胞生长因子的释放可长达30 d。因为附着于载体,可以有效避免生长因子失活,达到缓释的目的,在一定程度上减弱了突释现象。MOYA等[62]设计出负载碱性成纤维细胞生长因子1的藻酸盐微球,将其掺入到Ⅰ型胶原蛋白水凝胶中,在体外3D共培养模型中,加载碱性成纤维细胞生长因子1的微球比单次注入碱性成纤维细胞生长因子1的水凝胶刺激形成的血管网络更大;同样,在构建的大鼠组织工程血管蒂模型中也可以发现,新血管形成反应在负载碱性成纤维细胞生长因子1的微球中更加持久,血管密度也显著增加。然而,载体的意外破裂将导致生长因子的大量释放;使用疏水性聚酯封包生长因子的过程也可能导致生长因子的变性[63-64]。 共价连接:上述两种方法都不能完全消除生长因子的突释,但是当生长因子共价交联于水凝胶网络后,由于共价键的高度稳定性,可以有效避免生长因子早期爆发释放(图3C)。CHOI等[65]在壳聚糖水凝胶中利用共价连接的方法交联转化生长因子β1,避免了突释现象,在促进软骨形成中起到了关键作用。然而,形成共价连接的过程可能导致生长因子结构的破坏,进而影响生长因子的生物活性。 糖胺聚糖连接:是天然组织中生长因子与细胞外基质的结合方式,可以保护生长因子的稳定性和活性不被破坏(图3D)。肝素是高度磺酸化的糖胺聚糖,是细胞外基质的主要成分,多种生长因子(如血管内生长因子、碱性成纤维细胞生长因子等)都具有特定的肝素结合域,可以与肝素功能化的生物材料特异性结合。这一性能可以在不改变生长因子的前提下达到长期缓释的作用[66-67],已成为目前最常用负载生长因子的方法。KIM等[68]将肝素和明胶结合,负载血管内生长因子开发出可注射的冷冻凝胶,与阴性对照组(牛血清白蛋白)相比,该凝胶24 h的初始释放量减少了20%,3周的累计释放量减少了70%;相关实验证明,血管内生长因子的控释在体内外均引起有效的血管生成反应。目前,肝素负载生长因子促进新血管生成已成为组织工程领域最受欢迎的方法之一,美中不足的是,常用的肝素功能化水凝胶支架材料多为合成水凝胶材料,需要进行表面修饰以允许支架内细胞的附着和增殖,制备流程相对复杂。 负载生长因子的方法所形成的工程化脂肪组织具有长期的体积稳定性,不同类型的生长因子在促进脂肪组织血管化方面的潜力也各有差异。ZIERIS等[69]比较了碱性成纤维细胞生长因子和血管内皮生长因子交联水凝胶之后的释放率,发现碱性成纤维细胞生长因子的总体释放率高于血管内皮生长因子,他们认为可能的原因是血管内皮生长因子具有更大的直径,因此在通过水凝胶孔隙时扩散速度更慢;另外,将脐静脉内皮细胞培养到两种负载不同生长因子的水凝胶上时,也观察到添加碱性成纤维细胞生长因子的水凝胶中内皮细胞的存活率更高,说明碱性成纤维细胞生长因子可能诱导细胞增殖的能力更强。这些结论侧面反映出生长因子的种类、应用途径、剂量等均有可能影响最终的血管生成效果。因此,寻找更加理想的生长因子控释技术、根据组织生长特性调控释放特性,都是未来构建大体积脂肪组织亟待解决的挑战。 血小板因含有大量的细胞因子、生长因子和信号分子可在损伤部位聚集释放,具有促进组织修复、血管再生的功能。浓缩的血小板如富血小板血浆可提供大量的细胞因子而用于脂肪组织工程当中[70]。SAMBERG等[71]制备出聚乙二醇修饰的富血小板血浆水凝胶,与人脂肪干细胞一起体外接种,培养14 d后发现,脂肪干细胞的增殖及与血管相关的基因和蛋白质的表达均显著升高;在大鼠皮肤切除模型中也显著增加了伤口的血管数量(80.2血管/mm2 vs. 62.6血管/mm2)。因此,在水凝胶支架中添加富血小板血浆可有效促进体内外血管生成。然而,富血小板血浆的浓度与脂肪干细胞的活力及成脂分化能力密切相关,有研究指出,10%-20%浓度的富血小板血浆起促进作用,而大于20%则起抑制作用[72]。用于脂肪组织工程血管化中最适宜的富血小板血浆浓度还有待进一步的研究。 此外,近年来硫化氢(H2S)被证实是一种内源性神经调节剂,具有与一氧化氮(NO)相似的活性,能够参与血管舒张及血管生成过程[73]。研究表明,负载H2S的水凝胶不仅可以促进人脐静脉内皮细胞的增殖和迁移[74]、上调血管生成因子(血管内皮生长因子A、血管生成素1)的表达[75],同时可以促进损伤区巨噬细胞向M2表型转化,具有显著的抗炎及促愈合作用[76]。 2.2.4 应用具有血管生成特性的水凝胶材料 近年来随着对支架材料及细胞间相互作用的深入了解,制备具有血管生成特性的水凝胶材料逐渐成为研究者们关注的重点。生物活性离子(Si、Cu等)因具有良好的生物相容性及血管再生能力而广受关注[77]。研究证明,Si离子可以通过促进血管生成基因(血管内皮生长因子、碱性成纤维细胞生长因子和表皮生长因子)的表达而增强血管生成能力[78]。因此,制备含硅水凝胶材料可以调节细胞间相互作用、促进干细胞迁移分化及刺激血管生成等促进脂肪组织再生[79-80]。 WANG等[81]制备了硅酸钙/海藻酸盐复合水凝胶,体外实验证实Si离子可显著促进脐静脉内皮细胞毛细血管样网络的形成;体内研究进一步证明,植入裸鼠皮下8周后,相比单纯水凝胶,含Si离子水凝胶内可见大量的血管长入,血管直径均大于25 μm,形成的脂肪组织形态也更大更完整;Si离子激活血管生成主要与刺激VEGF/VEGFR2和IGF1/IGF1R信号转导通路有关。LI等[82]利用双离子交联法制备出可释放Zn、Si、Cu等多种离子的海藻酸钠/硬灰石复合水凝胶,复合水凝胶中的离子可通过添加天冬氨酸调节pH值来进一步控制释放,该水凝胶不仅可以抑制细菌生长、促进伤口愈合,同时具有显著刺激血管生成的能力;免疫组织化学染色显示,海藻酸钠/硬灰石复合水凝胶处理的创面新生血管数量显著高于对照组。应用可释放多种离子的生物活性水凝胶是设计促血管化支架材料的有效途径,在软组织修复方面具有很大的应用潜力。 除了富含生物活性离子的水凝胶支架以外,利用水凝胶在不同物理条件下凝胶-溶胶相变的特性,制备特殊反应性的智能水凝胶,能够随着光照、温度、电场、磁场、pH值等物理性质的改变,动态调节水凝胶与细胞之间的反应活性,从而实现可控的血管网络生成。ZHENG等[83]将光反应原件转化纳米颗粒嵌入具有光活化细胞黏附序列的聚乙二醇水凝胶中,在近红外光(974 nm)的照射下,光反应原件转化纳米颗粒中包裹的脐静脉内皮细胞及血管内皮生长因子可以实现特定区域及时间内激活,从而按需触发血管生成反应。LIN等[84]制备出包裹脐静脉内皮细胞的紫外光交联甲基丙烯酸酯水凝胶,皮下注射到免疫缺陷小鼠体内,局部紫外线照射后迅速交联成胶,7 d后观察到水凝胶内部产生均匀的新生血管并与宿主血管功能性吻合;值得注意的是,水凝胶内部血管化的程度可以通过改变紫外线照射时间(15-45 s)来直接调节,随着光照时间的延长,甲基丙烯酸酯水凝胶交联程度增加,而平均血管密度及管腔大小逐渐减低。利用水凝胶材料调控血管生成反应及血管化程度,使得再生个体化工程脂肪成为可能。近年来,水凝胶包埋磁性活性粒子(Fe3O4等)制备的磁响应性水凝胶[85]、电场响应性水凝胶等智能水凝胶,可以通过外部磁场或电场作用调控脂肪干细胞的生物学功能[86-87],进而影响血管生成及组织再生。然而,这些智能水凝材料目前的应用主要集中在骨组织工程及软骨组织工程方面[88],在脂肪组织工程方面的研究相对较少。精准调控智能水凝胶对组织的反应性,进一步探索其在脂肪组织工程中的应用将是未来需要继续探索的方向。"

| [1] WINOCOUR S, SAKSENA A, OH C, et al. A Systematic Review of Comparison of Autologous, Allogeneic, and Synthetic Augmentation Grafts in Nipple Reconstruction. Plast Reconstr Surg. 2016;137(1):14e-23e. [2] 谭秋雯,吕青.脂肪组织工程:软组织再生的新策略[J].中华乳腺病杂志(电子版),2019,13(4):242-244. [3] KOLLE SF, FISCHER-NIELSEN A, MATHIASEN AB, et al. Enrichment of autologous fat grafts with ex-vivo expanded adipose tissue-derived stem cells for graft survival: a randomised placebo-controlled trial. Lancet. 2013; 382(9898):1113-1120. [4] YU Y, ALKHAWAJI A, DING Y, et al. Decellularized scaffolds in regenerative medicine. Oncotarget. 2016;7(36):58671-58683. [5] GALLER KM, BRANDL FP, KIRCHHOF S, et al. Suitability of Different Natural and Synthetic Biomaterials for Dental Pulp Tissue Engineering. Tissue Eng Part A. 2018;24(3-4):234-244. [6] DZIKI JL, HULEIHEL L, SCARRITT ME, et al. Extracellular Matrix Bioscaffolds as Immunomodulatory Biomaterials. Tissue Eng Part A. 2017;23(19-20):1152-1159. [7] O’HALLORAN NA, DOLAN EB, KERIN MJ, et al. Hydrogels in adipose tissue engineering—Potential application in post‐mastectomy breast regeneration. J Tissue Eng Regen Med. 2018;12(12):2234-2247. [8] CHATTERJEE S, LALIBERTE M, BLELLOCH S, et al. Adipose-Derived Stromal Vascular Fraction Differentially Expands Breast Progenitors in Tissue Adjacent to Tumors Compared to Healthy Breast Tissue. Plast Reconstr Surg. 2015;136(4):414e-425e. [9] CHWALEK K, TSURKAN MV, FREUDENBERG U, et al. Glycosaminoglycan-based hydrogels to modulate heterocellular communication in in vitro angiogenesis models. Sci Rep. 2014;4:4414. [10] TAHRIR FG, GANJI F, AHOOYI TM. Injectable thermosensitive chitosan/glycerophosphate-based hydrogels for tissue engineering and drug delivery applications: a review. Recent Pat Drug Deliv Formul. 2015;9(2):107-120. [11] EL-SHERBINY IM, YACOUB MH. Hydrogel scaffolds for tissue engineering: Progress and challenges. Glob Cardiol Sci Pract. 2013;2013(3):316-342. [12] CHEUNG HK, HAN TT, MARECAK DM, et al. Composite hydrogel scaffolds incorporating decellularized adipose tissue for soft tissue engineering with adipose-derived stem cells. Biomaterials. 2014;35(6):1914-1923. [13] SHOHAM N, GEFEN A. Mechanotransduction in adipocytes. J Biomech. 2012;45(1):1-8. [14] KARAGOZ H, ZOR F, GOKTAS E, et al. Adipogenesis for soft tissue reconstruction. Curr Opin Organ Transplant. 2019;24(5):598-603. [15] BOURIN P, BUNNELL BA, CASTEILLAL, et al. Stromal cells from the adipose tissue-derived stromal vascular fraction and culture expanded adipose tissue-derived stromal/stem cells: a joint statement of the International Federation for Adipose Therapeutics and Science (IFATS) and the International Society for Cellular Therapy (ISCT). Cytotherapy. 2013;15(6): 641-648. [16] 尹钰佳,顾婕妤,李东,等.脂肪干细胞促进脂肪移植血管化的研究进展[J].组织工程与重建外科杂志,2019,15(2):119-124. [17] YUAN Y, GAO J, LIU L, et al. Role of adipose-derived stem cells in enhancing angiogenesis early after aspirated fat transplantation: induction or differentiation? Cell Biol Int. 2013;37(6):547-550. [18] 张静,易阳艳,阳水发,等.脂肪干细胞来源外泌体对人脐静脉血管内皮细胞增殖、迁移及管样分化的影响[J].中国修复重建外科杂志, 2018,32(10):1351-1357. [19] KANG T, JONES TM, NADDELL C, et al. Adipose-Derived Stem Cells Induce Angiogenesis via Microvesicle Transport of miRNA-31. Stem Cells Transl Med. 2016;5(4):440-450. [20] LIANG X, ZHANG L, WANG S, et al. Exosomes secreted by mesenchymal stem cells promote endothelial cell angiogenesis by transferring miR-125a. J Cell Sci. 2016;129(11):2182-2189. [21] FREESE KE, KOKAI L, EDWARDS RP, et al. Adipose-derived stems cells and their role in human cancer development, growth, progression, and metastasis: a systematic review. Cancer Res. 2015;75(7):1161-1168. [22] HE Z, WANG B, HU C, et al. An overview of hydrogel-based intra-articular drug delivery for the treatment of osteoarthritis. Colloids Surf B Biointerfaces. 2017;154:33-39. [23] CHEN C, SONG J, QIU J, et al. Repair of a Meniscal Defect in a Rabbit Model Through Use of a Thermosensitive, Injectable, In Situ Crosslinked Hydrogel With Encapsulated Bone Mesenchymal Stromal Cells and Transforming Growth Factor β1. Am J Sports Med. 2020;48(4):884-894. [24] FAN M, MA Y, ZHANG Z, et al. Biodegradable hyaluronic acid hydrogels to control release of dexamethasone through aqueous Diels-Alder chemistry for adipose tissue engineering. Mater Sci Eng C Mater Biol Appl. 2015;56: 311-317. [25] ZHAO W, LI X, LIU X, et al. Effects of substrate stiffness on adipogenic and osteogenic differentiation of human mesenchymal stem cells. Mater Sci Eng C Mater Biol Appl. 2014;40:316-323. [26] DELAITTRE G, GREINER AM, PAULOEHRL T, et al. Correction: Chemical approaches to synthetic polymer surface biofunctionalization for targeted cell adhesion using small binding motifs. Soft Matter. 2015;11(11):2314. [27] ZHU Y, HIDEYOSHI S, JIANG H, et al. Injectable, porous, biohybrid hydrogels incorporating decellularized tissue components for soft tissue applications. Acta Biomater. 2018;73:112-126. [28] 何天慧,冯锐,李玉璟,等.脱细胞异体真皮基质在乳腺癌术后即刻乳房假体重建中的研究进展[J].中华乳腺病杂志(电子版),2019,13(1):54-57. [29] KIM JS, CHOI JS, CHO YW, et al. Cell-Free Hydrogel System Based on Tissue-Specific Extracellular Matrix for In Situ Adipose Tissue Regeneration. ACS Appl Mater Interfaces. 2017;9(10):8581-8588. [30] TAN QW, ZHANG Y, LUO JC, et al. Hydrogel derived from decellularized porcine adipose tissue as a promising biomaterial for soft tissue augmentation. J Biomed Mater Res A. 2017;105(6):1756-1764. [31] LI Y, RODRIGUES J, TOMÁS H, et al. Injectable and biodegradable hydrogels: gelation, biodegradation and biomedical applications. Chem Soc Rev. 2012; 41(6):2193-2221. [32] CLEVENGER TN, LUNA G, BOCTOR D, et al. Cell-mediated remodeling of biomimetic encapsulating hydrogels triggered by adipogenic differentiation of adipose stem cells. J Tissue Eng. 2016;7:1546567406. [33] KIM JS, CHOI JS, CHO YW. Cell-Free Hydrogel System Based on a Tissue-Specific Extracellular Matrix for In Situ Adipose Tissue Regeneration. ACS Appl Mater Interfaces. 2017;9(10):8581-8588. [34] YAO R, ZHANG R, LIN F, et al. Injectable cell/hydrogel microspheres induce the formation of fat lobule-like microtissues and vascularized adipose tissue regeneration. Biofabrication. 2012;4(4):45003. [35] 陈秋宏.基于海藻酸钠/明胶双交联互穿网络水凝胶的血管网前体快速构建方法研究[D].沈阳:中国医科大学,2020. [36] ZHU J, MARCHANT RE. Design properties of hydrogel tissue-engineering scaffolds. Expert Rev Med Devices.2014;8(5):607-626. [37] YOUNG DA, IBRAHIM DO, HU D, et al. Injectable hydrogel scaffold from decellularized human lipoaspirate. Acta Biomater. 2011;7(3):1040-1049. [38] AÇIL Y, ZHANG X, NITSCHE T, et al. Effects of different scaffolds on rat adipose tissue derived stroma cells. J Craniomaxillofac Surg. 2014;42(6):825-834. [39] WITTMANN K, DIETL S, LUDWIG N, et al. Engineering vascularized adipose tissue using the stromal-vascular fraction and fibrin hydrogels. Tissue Eng Part A. 2015;21(7-8):1343-1353. [40] AGHA RA, FOWLER AJ, HERLIN C, et al. Use of autologous fat grafting for breast reconstruction: a systematic review with meta-analysis of oncological outcomes. J Plast Reconstr Aesthet Surg. 2015;68(2):143-161. [41] 何云帆,鲁峰.大体积工程化脂肪组织构建的研究进展[J].中华整形外科杂志,2016,32(6):475-477. [42] ZHAN W, TAN SS, LU F, et al. Adipose-Derived Stem Cell Delivery for Adipose Tissue Engineering: Current Status and Potential Applications in a Tissue Engineering Chamber Model. Stem Cell Rev. 2016;12(4):484-491. [43] DOLDERER JH, ABBERTON KM, THOMPSON EW, et al. Spontaneous large volume adipose tissue generation from a vascularized pedicled fat flap inside a chamber space. Tissue Eng. 2007;13(4):673-681. [44] STOSICH MS, BASTIAN B, MARION NW, et al. Vascularized adipose tissue grafts from human mesenchymal stem cells with bioactive cues and microchannel conduits. Tissue Eng. 2007;13(12):2881-2890. [45] ZHAN W, CHANG Q, XIAO X, et al. Self-synthesized extracellular matrix contributes to mature adipose tissue regeneration in a tissue engineering chamber. Wound Repair Regen. 2015;23(3):443-452. [46] MORRISON WA, MARRE D, GRINSELL D, et al. Creation of a Large Adipose Tissue Construct in Humans Using a Tissue-engineering Chamber: A Step Forward in the Clinical Application of Soft Tissue Engineering. EBioMedicine. 2016;6:238-245. [47] POST MJ, RAHIMI N, CAOLO V, et al. Update on vascularization in tissue engineering. Regen Med. 2013;8(6):759-770. [48] 李静.无创血管内皮功能评价,从科研到临床[J].中国心血管杂志,2019, 24(5):411-413. [49] RAJASHEKHAR G, TRAKTUEV DO, ROELL WC, et al. IFATS collection: Adipose stromal cell differentiation is reduced by endothelial cell contact and paracrine communication: role of canonical Wnt signaling. Stem Cells. 2008; 26(10):2674-2681. [50] YAO R, ZHANG R, LIN F, et al. Biomimetic injectable HUVEC-adipocytes/collagen/alginate microsphere co-cultures for adipose tissue engineering. Biotechnol Bioeng. 2013;110(5):1430-1443. [51] KAYABOLEN A, KESKIN D, AYKAN A, et al. Native extracellular matrix/fibroin hydrogels for adipose tissue engineering with enhanced vascularization. Biomed Mater. 2017;12(3):35007. [52] QI D, WU S, KUSS MA, et al. Mechanically robust cryogels with injectability and bioprinting supportability for adipose tissue engineering. Acta Biomater. 2018;74:131-142. [53] SILVA EA, MOONEY DJ, SILVA EA, et al. Effects of VEGF temporal and spatial presentation on angiogenesis. Biomaterials. 2010;31(6):1235-1241. [54] ZHANG S, LU Q, CAO T, et al. Adipose Tissue and Extracellular Matrix Development by Injectable Decellularized Adipose Matrix Loaded with Basic Fibroblast Growth Factor. Plast Reconstr Surg. 2016;137(4):1171-1180. [55] BHATTARAI N, GUNN J, ZHANG M. Chitosan-based hydrogels for controlled, localized drug delivery. Adv Drug Deliv Rev. 2010;62(1):83-99. [56] FADERA S, CHENG NC, YOUNG TH, et al. In vitro study of SDF-1alpha-loaded injectable and thermally responsive hydrogels for adipose stem cell therapy by SDF-1/CXCR4 axis. J Mater Chem B. 2020;8(45):10360-10372. [57] ZHU J, MARCHANT RE, ZHU J, et al. Design properties of hydrogel tissue-engineering scaffolds. Expert Rev Med Devices. 2011;8(5):607-626. [58] SARKANEN JR, RUUSUVUORI P, KUOKKANEN H, et al. Bioactive acellular implant induces angiogenesis and adipogenesis and sustained soft tissue restoration in vivo. Tissue Eng Part A. 2012;18(23-24):2568-2580. [59] SILVA A, RICHARD C, BESSODES M, et al. Growth factor delivery approaches in hydrogels. Biomacromolecules. 2009;10(1):9-18. [60] 李喆.可注射式明胶衍生类水凝胶用于软组织工程促血管化的研究[D].重庆:第三军医大学,2016. [61] ARUNKUMAR P, DOUGHERTY JA, WEIST J, et al. Sustained Release of Basic Fibroblast Growth Factor (bFGF) Encapsulated Polycaprolactone (PCL) Microspheres Promote Angiogenesis In Vivo. Nanomaterials (Basel). 2019;9(7):1037. [62] MOYA ML, CHENG MH, HUANG JJ, et al. The effect of FGF-1 loaded alginate microbeads on neovascularization and adipogenesis in a vascular pedicle model of adipose tissue engineering. Biomaterials. 2010;31(10):2816-2826. [63] LIM SM, OH SH, LEE HH, et al. Dual growth factor-releasing nanoparticle/hydrogel system for cartilage tissue engineering. J Mater Sci Mater Med. 2010;21(9):2593-2600. [64] HO YC, WU SJ, MI FL, et al. Thiol-modified chitosan sulfate nanoparticles for protection and release of basic fibroblast growth factor. Bioconjug Chem. 2010;21(1):28-38. [65] CHOI B, KIM S, FAN J, et al. Covalently conjugated transforming growth factor-β1 in modular chitosan hydrogels for the effective treatment of articular cartilage defects. Biomater Sci. 2015;3(5):742-752. [66] TANG DW, YU SH, HO YC, et al. Heparinized chitosan/poly(γ-glutamic acid) nanoparticles for multi-functional delivery of fibroblast growth factor and heparin. Biomaterials. 2010;31(35):9320-9332. [67] 朴明伟.负载bFGF氧化聚古洛糖醛酸水凝胶的血管化性能研究[D].天津:天津大学,2012. [68] KIM I, LEE SS, BAE S, et al. Heparin Functionalized Injectable Cryogel with Rapid Shape-Recovery Property for Neovascularization. Biomacromolecules. 2018;19(6):2257-2269. [69] ZIERIS A, PROKOPH S, LEVENTAL KR, et al. FGF-2 and VEGF functionalization of starPEG–heparin hydrogels to modulate biomolecular and physical cues of angiogenesis. Biomaterials. 2010;31(31):7985-7994. [70] JAIN E, CHINZEI N, BLANCO A, et al. Platelet-Rich Plasma Released From Polyethylene Glycol Hydrogels Exerts Beneficial Effects on Human Chondrocytes. J Orthop Res. 2019;37(11):2401-2410. [71] SAMBERG M, STONE R, NATESAN S, et al. Platelet rich plasma hydrogels promote in vitro and in vivo angiogenic potential of adipose-derived stem cells. Acta Biomater. 2019;87:76-87. [72] FELTHAUS O, PRANTL L, SKAFF-SCHWARZE M, et al. Effects of different concentrations of Platelet-rich Plasma and Platelet-Poor Plasma on vitality and differentiation of autologous Adipose tissue-derived stem cells. Clin Hemorheol Microcirc. 2017;66(1):47-55. [73] NAZARNEZHADA S, ABBASZADEH-GOUDARZI G, SAMADIAN H, et al. Alginate hydrogel containing hydrogen sulfide as the functional wound dressing material: In vitro and in vivo study. Int J Biol Macromol. 2020;164:3323-3331. [74] LONGCHAMP A, KAUR K, MACABREY D, et al. Hydrogen sulfide-releasing peptide hydrogel limits the development of intimal hyperplasia in human vein segments. Acta Biomater. 2019;97:374-384. [75] LIANG W, CHEN J, LI L, et al. Conductive Hydrogen Sulfide-Releasing Hydrogel Encapsulating ADSCs for Myocardial Infarction Treatment. ACS Appl Mater Interfaces. 2019;11(16):14619-14629. [76] WU J, CHEN A, ZHOU Y, et al. Novel H2S-Releasing hydrogel for wound repair via in situ polarization of M2 macrophages. Biomaterials. 2019; 222(C):119398. [77] SAGHIRI MA, ASATOURIAN A, ORANGI J, et al. Functional role of inorganic trace elements in angiogenesis-Part II: Cr, Si, Zn, Cu, and S. Crit Rev Oncol Hematol. 2015;96(1):143-155. [78] ZHANG FM, ZHOU L, ZHOU ZN, et al. Bioactive glass functionalized chondroitin sulfate hydrogel with proangiogenic properties. Biopolymers. 2019;110(12):e23328. [79] HAN Y, LI Y, ZENG Q, et al. Injectable bioactive akermanite/alginate composite hydrogels for in situ skin tissue engineering. J Mater Chem B. 2017;5(18):3315-3326. [80] LI H, CHANG J. Stimulation of proangiogenesis by calcium silicate bioactive ceramic. Acta Biomater. 2013;9(2):5379-5389. [81] WANG X, GAO L, HAN Y, et al. Silicon-Enhanced Adipogenesis and Angiogenesis for Vascularized Adipose Tissue Engineering. Adv Sci (Weinh). 2018;5(11):1800776. [82] LI Y, HAN Y, WANG X, et al. Multifunctional Hydrogels Prepared by Dual Ion Cross-Linking for Chronic Wound Healing. ACS Appl Mater Interfaces. 2017;9(19):16054-16062. [83] ZHENG Y, CHEN Z, JIANG Q, et al. Near-infrared-light regulated angiogenesis in a 4D hydrogel. Nanoscale. 2020;12(25):13654-13661. [84] LIN R, CHEN Y, MORENO-LUNA R, et al. Transdermal regulation of vascular network bioengineering using a photopolymerizable methacrylated gelatin hydrogel. Biomaterials. 2013;34(28):6785-6796. [85] ROSE JC, GEHLEN DB, HARASZTI T, et al. Biofunctionalized aligned microgels provide 3D cell guidance to mimic complex tissue matrices. Biomaterials. 2018;163:128-141. [86] YEO M, HA J, LEE H, et al. Fabrication of hASCs-laden structures using extrusion-based cell printing supplemented with an electric field. Acta Biomater.2016;38:33-43. [87] SILVA SS, POPA EG, GOMES ME, et al. Silk hydrogels from non-mulberry and mulberry silkworm cocoons processed with ionic liquids. Acta Biomater. 2013;9(11):8972-8982. [88] LIU Z, LIU J, CUI X, et al. Recent Advances on Magnetic Sensitive Hydrogels in Tissue Engineering. Front Chem. 2020;8:124. |
| [1] | Tan Xinfang, Guo Yanxing, Qin Xiaofei, Zhang Binqing, Zhao Dongliang, Pan Kunkun, Li Yuzhuo, Chen Haoyu. Effect of uniaxial fatigue exercise on patellofemoral cartilage injury in a rabbit [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(在线): 1-6. |
| [2] | Xu Xinzhong, Wu Zhonghan, Yu Shuisheng, Zhao Yao, Xu Chungui, Zhang Xin, Zheng Meige, Jing Juehua. Biomechanical analysis of different ways of inserting Steinmann Pins into the femoral head [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1313-1317. |
| [3] | Li Huo, Wang Peng, Gao Jianming, Jiang Haoran, Lu Xiaobo, Peng Jiang. Relationship between revascularization and internal microstructure changes in osteonecrosis of the femoral head [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1323-1328. |
| [4] | Yao Xiaoling, Peng Jiancheng, Xu Yuerong, Yang Zhidong, Zhang Shuncong. Variable-angle zero-notch anterior interbody fusion system in the treatment of cervical spondylotic myelopathy: 30-month follow-up [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1377-1382. |
| [5] | Zhu Chan, Han Xuke, Yao Chengjiao, Zhou Qian, Zhang Qiang, Chen Qiu. Human salivary components and osteoporosis/osteopenia [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1439-1444. |
| [6] | Jin Tao, Liu Lin, Zhu Xiaoyan, Shi Yucong, Niu Jianxiong, Zhang Tongtong, Wu Shujin, Yang Qingshan. Osteoarthritis and mitochondrial abnormalities [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1452-1458. |
| [7] | Zhang Lichuang, Xu Hao, Ma Yinghui, Xiong Mengting, Han Haihui, Bao Jiamin, Zhai Weitao, Liang Qianqian. Mechanism and prospects of regulating lymphatic reflux function in the treatment of rheumatoid arthritis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1459-1466. |
| [8] | Xiang Xinjian, Liu Fang, Wu Liangliang, Jia Daping, Tao Yue, Zhao Zhengnan, Zhao Yu. High-dose vitamin C promotes the survival of autologous fat transplantation in rats [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1242-1246. |
| [9] | Wang Jing, Xiong Shan, Cao Jin, Feng Linwei, Wang Xin. Role and mechanism of interleukin-3 in bone metabolism [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1260-1265. |
| [10] | Zhu Chan, Han Xuke, Yao Chengjiao, Zhang Qiang, Liu Jing, Shao Ming. Acupuncture for Parkinson’s disease: an insight into the action mechanism in animal experiments [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1272-1277. |
| [11] | Zhang Jinglin, Leng Min, Zhu Boheng, Wang Hong. Mechanism and application of stem cell-derived exosomes in promoting diabetic wound healing [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1113-1118. |
| [12] | Huang Chenwei, Fei Yankang, Zhu Mengmei, Li Penghao, Yu Bing. Important role of glutathione in stemness and regulation of stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1119-1124. |
| [13] | Hui Xiaoshan, Bai Jing, Zhou Siyuan, Wang Jie, Zhang Jinsheng, He Qingyong, Meng Peipei. Theoretical mechanism of traditional Chinese medicine theory on stem cell induced differentiation [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1125-1129. |
| [14] | An Weizheng, He Xiao, Ren Shuai, Liu Jianyu. Potential of muscle-derived stem cells in peripheral nerve regeneration [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1130-1136. |
| [15] | Fan Yiming, Liu Fangyu, Zhang Hongyu, Li Shuai, Wang Yansong. Serial questions about endogenous neural stem cell response in the ependymal zone after spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1137-1142. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||