Chinese Journal of Tissue Engineering Research ›› 2017, Vol. 21 ›› Issue (20): 3241-3247.doi: 10.3969/j.issn.2095-4344.2017.20.020
Previous Articles Next Articles
Roles of cytokines and three-dimensional printing technology in skeletal muscle repair
Wang Kang-kang
- Henan Normal University, Xinxiang 453002, Henan Province, China
-
Revised:2017-03-10Online:2017-07-18Published:2017-07-28 -
About author:Wang Kang-kang, Master, Lecturer, Henan Normal University, Xinxiang 453002, Henan Province, China -
Supported by:the General Project of Soft Science of Henan Province, No. 172400410381; the Humanities and Social Sciences Research Project for the Youth of the Education Department of Henan Province, No. 2016-qn-122
CLC Number:
Cite this article
Wang Kang-kang. Roles of cytokines and three-dimensional printing technology in skeletal muscle repair[J]. Chinese Journal of Tissue Engineering Research, 2017, 21(20): 3241-3247.
share this article
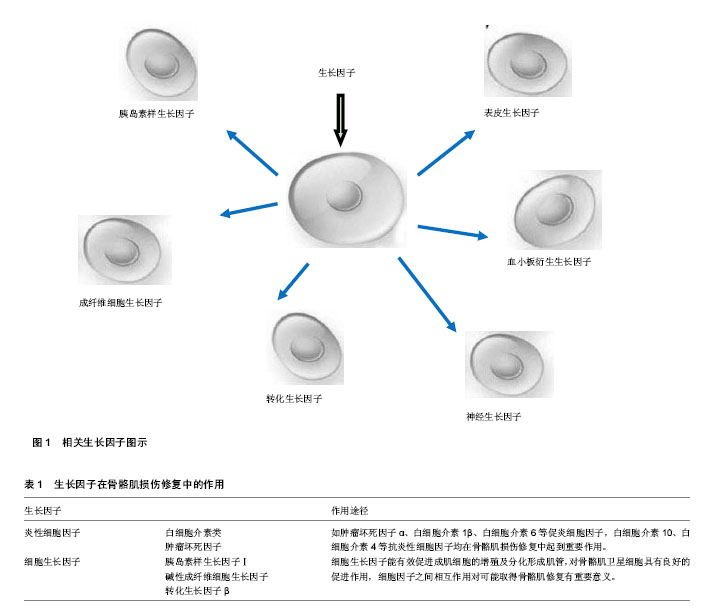
2.1 促炎性细胞因子在骨骼肌损伤修复中的表达 见表1。 2.1.1 白细胞介素类 白细胞介素是一类能在细胞间传递信息、具有免疫调节和效应功能的蛋白质或小分子多肽。同种白细胞介素在不同损伤患者或同一患者不同阶段发挥的作用不同。所有细胞因子都直接或间接影响炎症反应,它们对血管内皮细胞、白细胞、单核-巨噬细胞等具有广泛的调节和效应,在诱导炎症反应中,具有多效、高效、协同、相互诱生和激发其他炎性介质级联反应的特征,对疾病具有双重作用。白细胞介素1是重要的炎性介质之一,也是一种热原质成分,具有致热和介导炎症的作用。它主要在细胞免疫激活中发挥调节作用[11-13]。谭银玲等[14]实验研究发现白细胞介素1可以刺激烧伤后大鼠骨骼肌中 26S蛋白酶复合体及 19S调节复合体的活性和蛋白表达水平明显升高。说明白细胞介素1对烧伤后大鼠骨骼肌中 26S蛋白酶复合体系统的激活具有重要作用,从而加强蛋白质的分解代谢,这可能与烧伤后平衡负氮的发生密切相关。白细胞介素1还是一种高度活性的细胞因子。王全震等[15]研究发现靶肌肉局部注射白细胞介素1β能减轻失神经骨骼肌形态的改变,对失神经骨骼肌和运动终板具有保护作用,能在短时间内有效延缓失神经支配骨骼肌萎缩。 白细胞介素6以单体形式存在,是由不同种类细胞所分泌的一种多效性细胞因子,主要参与糖代谢和脂代谢,白细胞介素6发挥其生物学功能是通过结合白细胞介素6受体的双链系统来完成的。白细胞介素6受体基因的外显子和内含子中均存在单核苷酸多态性,白细胞介素6受体基因的单核苷酸多态性与2型糖尿病、肥胖、雄激素过多症和多囊卵巢综合征等代谢性疾病具有相关性。有关白细胞介素6在骨骼肌损伤中的作用研究显示骨骼肌损伤会产生大量的白细胞介素6,研究认为白细胞介素6可能与骨骼肌微损伤相关,白细胞介素6在骨骼肌中的出现不是偶然的,它能贯穿于肌肉损伤及修复的整个过程,特别是骨骼肌产生的白细胞介素6对于卫星细胞的增殖和融合具有重要作用。丹麦科学家曾认为骨骼肌损伤时血浆中的白细胞介素6增加[16]。白细胞介素6主要功能为刺激细胞成长、促进细胞分化,对维持机体生理平衡具有重要作用。而在运动过程中,运动对白细胞介素6的生物学功能的影响也十分明显,主要表现在运动训练、运动强度、运动损伤时白细胞介素6的影响等。因此白细胞介素6与运动的关系成为当今运动科学研究的重点话题。陈俊飞[17]的实验结果证实这一点,发现从事耐力性项目的运动员中白细胞介素6基因- 572C/G位点CC基因型女性人群有利于从事耐力性项目运动,白细胞介素6基因上rs1800796位点可作为耐力性项目运动员选材的候选分子遗传标记。王成艳等[18]研究结果显示经高强度运动训练后,大鼠骨骼肌细胞及外周血白细胞介素6含量均有所升高,说明高强度运动训练可以诱导大鼠骨骼肌细胞及外周血中白细胞介素6的表达,发挥抗炎作用。 2.1.2 肿瘤坏死因子 肿瘤坏死因子是一种具有多种生物学效应的多功能细胞因子,其生物学效应包括促进细胞生长、分化、凋亡及验证诱发等。研究表明,单核巨噬细胞、淋巴细胞均能产生肿瘤坏死因子[19-21],根据其来源和结构分为2种,即肿瘤坏死因子α、肿瘤坏死因子β,而由自然杀伤细胞产生的肿瘤坏死因子定名为肿瘤坏死因子γ,三者的氨基酸组成及细胞来源有差别,但基因结构、染色体定位和生物活性极为相似。肿瘤坏死因子其生物学效应包括促进细胞生长、分化、凋亡及炎症诱发等。肿瘤坏死因子的生物学效应都是通过细胞表面的两种肿瘤坏死因子受体引发的。肿瘤坏死因子的信号传导通路主要包括细胞凋亡及转录因子核因子κB和JNK蛋白激酶的激活。这3条信号传导通路之间及各通路内部含有各种调节机制,使肿瘤坏死因子的各种生物学功能协调发挥出来[22-24]。肿瘤坏死因子分子在细胞因子免疫调节网络中位于中枢环节,是重要的炎症介质,过量的肿瘤坏死因子导致炎症的发生。肿瘤坏死因子是机体炎症反应与免疫功能的重要调节因子,具有多种生物活性与临床意义,近年来有关肿瘤坏死因子的基因研究和临床应用日益受到重视。越来越多的的研究表明肿瘤坏死因子通过多种方式参与破骨细胞的分化及生物学活性的调控。郁永辉等[25]研究发现肿瘤坏死因子α是骨骼肌高分解代谢的重要调控因子,骨骼肌细胞凋亡可能是骨骼肌蛋白高分解代谢的重要机制之一,而肿瘤坏死因子α又可诱导骨骼肌细胞凋亡。 2.2 细胞生长因子与骨骼肌损伤修复 由于骨骼肌损伤后的修复主要是通过肌卫星细胞的分裂增殖来实现的。骨骼肌卫星细胞平时处于静止状态,被激活后可增殖分化。骨骼肌卫星细胞的增殖与分化是由细胞连接、细胞与细胞外间质的相互作用及生长因子决定的。肌卫星细胞作为生肌干细胞,参与司控生后骨骼肌的生长、修复和维持等重要过程。肌卫星细胞作为生肌干细胞,参与司控生后骨骼肌的生长、修复和维持等重要过程。卫星细胞的活性受多种因素影响。生长因子被认为是一种潜在的成肌细胞分裂素,包括胰岛素样生长因子、碱性成纤维细胞生长因子、转化生长因子、神经生长因子、血小板源生长因子、表皮生长因子等(图1)。这些细胞因子在骨骼肌损伤中所起作用比较重要的,其中胰岛素样生长因子最大限度的刺激星状细胞,在骨骼肌的生长中起关键作用。胰岛素样生长因子与胰岛素有明显的同源性,有两种类型,胰岛素样生长因子Ⅰ和胰岛素样生长因子Ⅱ。胰岛素样生长因子Ⅰ对血管内皮细胞有趋化作用,促进血管的形成[26-27]。虽然许多组织都能表达胰岛素样生长因子,但它们各自的功能不同。骨骼肌是胰岛素样生长因子的靶器官,同时也分泌胰岛素样生长因子。骨骼肌组织表达的胰岛素样生长因子对骨骼肌损伤后的再生、修复非常重要,也是通过适当干预保持肌肉质量的重要调节因素,见表1。 2.2.1 胰岛素样生长因子Ⅰ 胰岛素样生长因子Ⅰ是胰岛素类激素家族中的成员之一,是一种在分子结构上与胰岛素类似的多肽蛋白物质。胰岛素样生长因子Ⅰ在人体及动物体内具有极其重要并且丰富的生物学功能,如促生长、促分化、参与糖代谢、蛋白质代谢和脂肪代谢等,并对消化系统、泌乳及生殖有一定的影响。胰岛素样生长因子Ⅰ基因包含6个外显子。长期以来人们普遍关注由外显子3和4编码的循环型胰岛素样生长因子Ⅰ在生长发育中的作用。最近对肌肉组织自分泌/旁分泌的局部型胰岛素样生长因子Ⅰ研究发现,选择性剪接产生的胰岛素样生长因子Ⅰ变体具有外显子5和6编码的延伸肽,并表现出特殊的生物学功能,如胰岛素样生长因子ⅠEa、胰岛素样生长因子ⅠEb及其E肽在骨骼肌组织中表现出促进生长和损伤修复的功能,这些特殊功能可能通过细胞表面的一种特殊E肽受体介导。这种多功能细胞调控因子,它的结构特征为其促生长和物质代谢功能提供依据。大量基础和临床研究证明,胰岛素样生长因子Ⅰ是骨形成和骨重建过程中的关键蛋白[28-29]。同时也有相关研究已证明胰岛素样生长因子Ⅰ能够促进骨骼肌细胞的分裂和增殖,并可能成为治疗骨骼肌损伤的潜在药物,但局部直接注射胰岛素样生长因子Ⅰ效应往往短暂,给药困难等问题,效果并不理想。因此可以尝试基因治疗,也可以把康复训练和基因治疗结合在一起来探讨其对骨骼肌修复的影响[30-31]。 2.2.2 碱性成纤维细胞生长因子 碱性成纤维细胞生长因子是成纤维细胞生长因子家族的成员之一,由于它能刺激3T3成纤维细胞分裂增殖而得名。碱性成纤维细胞生长因子是第一个被分离的血管形成促进因子,在体内分布极为广泛,脑、心、肝、骨、眼、肾上腺、胎盘等处均有存在。人碱性成纤维细胞生长因子的基因位于染色体4q26-27。由于碱性成纤维细胞生长因子mRNA翻译起始点和剪接点的不同,单拷贝的碱性成纤维细胞生长因子基因能够编码产生相对分子质量18 000- 34 000多种形式的碱性成纤维细胞生长因子[32-34]。碱性成纤维细胞生长因子通过与细胞膜表面的特异性配体结合,进而引发细胞内的一系列级联反应,从而产生各种生物学效应。碱性成纤维细胞生长因子是细胞生长和分化的重要调节因子,张蔚然等[35]结果显示添加了碱性成纤维细胞生长因子培养基的细胞生长状态较对照组良好,细胞增殖速度快,细胞增殖率显著高于对照组,说明碱性成纤维细胞生长因子对牛骨骼肌卫星细胞在生长培养基和分化培养基中增殖都具有良好的促进作用。向峥等[36]研究碱性成纤维细胞生长因的mRNA在运动致骨骼肌损伤过程中不同阶段量的变化。结果表明,SD大鼠骨骼肌运动损伤过程中有内源性碱性成纤维细胞生长因子mRNA的表达。冯鑫等[37]研究也证实外源性碱性成纤维生长因子可以降低损伤肌肉组织中波形蛋白的特异性表达,降低肌组织纤维化程度,从而促进肌肉损伤后结构及功能的修复。 2.2.3 转化生长因子β 促纤维化发展的转化生长因子β参与该了骨骼肌损伤的修复,转化生长因子β是作为组织损伤后促使其再生的一种蛋白,是一种内源性的生长因子,在肌肉损伤后通过重新编码肌肉细胞基因,抑制生肌细胞基因的表达。于新凯等[38]通过观察大鼠骨骼肌损伤修复过程中转化生长因子β1基因的表达,研究转化生长因子β1在运动性骨骼肌损伤修复过程不同时刻的变化特征,结果说明运动性骨骼肌损伤修复过程中转化生长因子β1的表达受到抑制。且已发现转化生长因子β可以促进细胞外基质的形成,使多种胶原蛋白在损伤组织中沉积,导致瘢痕形成。转化生长因子β的生物学效应也受到其他生长因子的拮抗或协同作[39-42]。实验研究发现骨骼肌急性钝挫伤后,转化生长因子β逐渐分泌表达,其表达时间有一定的规律性和相似性,若早期施加运动干预,会促进转化生长因子β的高表达[43],提示骨骼肌损伤后早期运动会使瘢痕增生相关细胞因子过度表达,导致瘢痕组织过度增生,影响骨骼肌愈合质量。神经生长因子促进中枢及外周神经系统神经元细胞存活、分化、轴突再生等重要作用已得到临床的广泛证实。研究表明损伤神经远端局部注射神经生长因子对于神经再生与再分布有一定促进作用,目前临床上主要以局部或肌肉注射神经生长因子蛋白的方式修复骨骼肌损伤。碱性成纤维细胞生长因子和神经生长因子可以促进成肌细胞的增殖和融合。 2.3 细胞打印技术构建骨骼肌损伤模型的优势 细胞打印技术是一种在体外构造具有生物活性的三维多细胞体系的先进技术。近年来,有关细胞打印技术的研究引起广泛的关注,其原因在于该领域具有明显的学科交叉与渗透融合的特点,它处于生命科学与快速成型技术、生物制造技术、生物科学和材料科学的交汇点。器官或组织的血管化结构要求细胞打印技术能够高精度、高通量、高速度地将细胞、生物材料定位到预设的结构中,这对多样化的细胞打印技术提出了挑战。相对于其他成型方法,细胞打印技术依靠计算机辅助成像,以广泛使用的生物材料为打印介质,能够快速、精确的复制和重建缺损组织/器官的复杂结构,因此在组织工程领域的应用获得广泛关注。 曹庆雷等[44]采用文献资料法对现有急性骨骼肌损伤实验模型进行分析,认为目前使用的损伤模型存在一些不足,不能很好的满足实验研究的需要;细胞打印可常规应用于复杂的组织再生如骨、软骨、肌肉、血管和颅颌面复杂的神经和复杂的三维微结构复杂的器官如肝、淋巴器官。同样岳相辉等[45]初步建立一个细胞打印系统,进行细胞无损伤打印的可行性探讨,实验证实细胞无损伤打印是可行的,为进一步的组织、器官打印研究提供依据。近年来,随着细胞打印技术的不断发展与成熟,其在医学领域的应用大有增长的趋势,国内外不少专家、学者正在进行大量尝试,试图充分应用该技术服务人类的医疗行业。目前可用作医疗领域的细胞打印技术有熔融层积成型、立体平版印刷、选区激光烧结等。细胞打印的产品大小与结构符合人体正常结构的解剖模型,为医生制定疑难病例的手术术前计划提供了有力的帮助,手术操作步骤的减少和手术准确度的提高在精致的导板工具中得到了益处。然而该技术仍有很多问题需要解决,比如原材料的问题、不同细胞打印技术的不足问题及细胞打印机器的改进问题等。"
| [1] Cohen TV, Many GM, Fleming BD, et al. Upregulated IL-1β in dysferlin-deficient muscle attenuates regeneration by blunting the response to pro-inflammatory macrophages. Skelet Muscle. 2015;5:24.[2] Fabi? J, Szemraj J, Strek M, et al. Is resection of the tendon edge necessary to enhance the healing process? An evaluation of the expression of collagen type I, IL-1β, IFN-γ, IL-4, and IL-13 in the distal 1 cm of a torn supraspinatus tendon: part II.J Shoulder Elbow Surg. 2014;23(12):1779-1785.[3] Rybalko VY, Pham CB, Hsieh PL, et al. Controlled delivery of SDF-1α and IGF-1: CXCR4(+) cell recruitment and functional skeletal muscle recovery.Biomater Sci. 2015;3(11): 1475-1486. [4] Zhang M, Jiang SK, Tian ZL, et al. CB2R orchestrates fibrogenesis through regulation of inflammatory response during the repair of skeletal muscle contusion.Int J Clin Exp Pathol. 2015;8(4):3491-3502.[5] Fu X, Xiao J, Wei Y, et al. Combination of inflammation- related cytokines promotes long-term muscle stem cell expansion. Cell Res. 2015;25(6):655-673.[6] McGinnis GR, Ballmann C, Peters B, et al. Interleukin-6 mediates exercise preconditioning against myocardial ischemia reperfusion injury.Am J Physiol Heart Circ Physiol. 2015;308(11):H1423-1433.[7] 李世德,宗少晖,詹新立,等.肿瘤坏死因子、干扰素和化疗药物对正常骨骼肌细胞的作用研究[J].广西医科大学学报, 2007, 24(4): 511-514.[8] Yablonka-Reuveni Z, Danoviz ME, Phelps M, et al. Myogenic-specific ablation of Fgfr1 impairs FGF2-mediated proliferation of satellite cells at the myofiber niche but does not abolish the capacity for muscle regeneration.Front Aging Neurosci. 2015;7:85. [9] Ross D, Maerz T, Kurdziel M, et al.The effect of granulocyte-colony stimulating factor on rotator cuff healing after injury and repair.Clin Orthop Relat Res. 2015;473(5):1655-1664.[10] Song YH, Song JL, Delafontaine P,et al.The therapeutic potential of IGF-I in skeletal muscle repair.Trends Endocrinol Metab. 2013;24(6):310-319.[11] de Almeida P, Tomazoni SS, Frigo L, et al. What is the best treatment to decrease pro-inflammatory cytokine release in acute skeletal muscle injury induced by trauma in rats: low-level laser therapy, diclofenac, or cryotherapy?Lasers Med Sci. 2014;29(2):653-648.[12] Nagata K, Nakamura T, Fujihara S, et al.Ultrasound modulates the inflammatory response and promotes muscle regeneration in injured muscles.Ann Biomed Eng. 2013;41(6): 1095-1105. [13] Fernandes KP, Alves AN, Nunes FD, et al. Effect of photobiomodulation on expression of IL-1β in skeletal muscle following acute injury.Lasers Med Sci. 2013;28(3):1043-1046. [14] 谭银玲,汪仕良,董燕麟.IL-1对烫伤大鼠骨骼肌26S蛋白酶复合体及19S调节复合体的作用[J].中国烧伤创疡杂志,2002,14(2): 81-84.[15] 王全震,万圣祥,肖颖锋,等.白细胞介素1β对失神经肌肉保护作用的实验研究[J].重庆医学,2012,41(6):532-534.[16] Zeng L, Maruyama S, Nakamura K, et al. The injury-induced myokine insulin-like 6 is protective in experimental autoimmune myositis.Skelet Muscle. 2014;4:16.[17] 陈俊飞.耐力性和力量性项目运动员白细胞介素-6基因多态性研究[D].北京体育大学,2009.[18] 王成艳,叶路,李覃,等.高强度运动训练对大鼠骨骼肌细胞IL-6表达的影响[J].中国急救复苏与灾害医学杂志,2014,(9):830-832.[19] Gallo D, Gesmundo I, Trovato L, et al. GH-Releasing Hormone Promotes Survival and Prevents TNF-α-Induced Apoptosis and Atrophy in C2C12 Myotubes.Endocrinology. 2015;156(9):3239-3252. [20] Lemos DR, Babaeijandaghi F, Low M, et al. Nilotinib reduces muscle fibrosis in chronic muscle injury by promoting TNF-mediated apoptosis of fibro/adipogenic progenitors. Nat Med. 2015;21(7):786-794. [21] Kelc R, Trapecar M, Gradisnik L, et al. Platelet-rich plasma, especially when combined with a TGF-β inhibitor promotes proliferation, viability and myogenic differentiation of myoblasts in vitro.PLoS One. 2015;10(2):e0117302.[22] Accornero F, Kanisicak O, Tjondrokoesoemo A, et al. Myofiber-specific inhibition of TGFβ signaling protects skeletal muscle from injury and dystrophic disease in mice.Hum Mol Genet. 2014;23(25):6903-6915. [23] Liu X, Joshi SK, Ravishankar B, et al. Upregulation of transforming growth factor-β signaling in a rat model of rotator cuff tears.J Shoulder Elbow Surg. 2014;23(11):1709-1716.[24] Acharjee S, Chung TK, Gopinadhan S, et al. Sharp-1 regulates TGF-β signaling and skeletal muscle regeneration.J Cell Sci. 2014;127(Pt 3):599-608. [25] 郁永辉,柴家科,褚万立.肿瘤坏死因子α促进烧伤后蛋白高分解代谢的潜在机制[J].中华损伤与修复杂志:电子版, 2015,10(1): 62-64.[26] Rybalko VY, Pham CB, Hsieh PL, et al. Controlled delivery of SDF-1α and IGF-1: CXCR4(+) cell recruitment and functional skeletal muscle recovery.Biomater Sci. 2015;3(11): 1475-1486. [27] Ikemoto-Uezumi M, Uezumi A, Tsuchida K, et al. Pro-Insulin-Like Growth Factor-II Ameliorates Age-Related Inefficient Regenerative Response by Orchestrating Self-Reinforcement Mechanism of Muscle Regeneration.Stem Cells. 2015;33(8):2456-2468. [28] Tonkin J, Temmerman L, Sampson RD, et al. Monocyte/Macrophage-derived IGF-1 Orchestrates Murine Skeletal Muscle Regeneration and Modulates Autocrine Polarization.Mol Ther. 2015;23(7):1189-1200.[29] Nagata K, Itaka K, Baba M, et al. Muscle-targeted hydrodynamic gene introduction of insulin-like growth factor-1 using polyplex nanomicelle to treat peripheral nerve injury.J Control Release. 2014;183:27-34. [30] Park S, Brisson BK, Liu M, et al. Mature IGF-I excels in promoting functional muscle recovery from disuse atrophy compared with pro-IGF-IA.J Appl Physiol (1985). 2014;116(7): 797-806.[31] Zanou N, Gailly P.Skeletal muscle hypertrophy and regeneration: interplay between the myogenic regulatory factors (MRFs) and insulin-like growth factors (IGFs) pathways.Cell Mol Life Sci. 2013;70(21):4117-4130. [32] Yablonka-Reuveni Z, Danoviz ME, Phelps M, et al. Myogenic-specific ablation of Fgfr1 impairs FGF2-mediated proliferation of satellite cells at the myofiber niche but does not abolish the capacity for muscle regeneration.Front Aging Neurosci. 2015;7:85. [33] Yu X, Zuo Q, Chao W, et al. The Changes of Muscle FGF-6 Expression at Different Time Points after Exercise-induced Muscle Damage.West Indian Med J. 2013;62(9):793-798.[34] Hwang JH, Kim IG, Piao S, et al. Combination therapy of human adipose-derived stem cells and basic fibroblast growth factor hydrogel in muscle regeneration.Biomaterials. 2013; 34(25):6037-6045.[35] 张蔚然,代阳,王轶敏,等.碱性成纤维细胞生长因子对牛骨骼肌卫星细胞增殖的影响[J].中国畜牧兽医,2015,42(7):1763-1769.[36] 向峥,孙林辉,余斌.碱性成纤维细胞生长因子mRNA在运动性肌损伤骨骼肌中的表达[J].华南国防医学杂志,2007,21(3):28-30.[37] 冯鑫,王生,李国珍.碱性成纤维细胞生长因子对大鼠骨骼肌拉伤后纤维化的抑制作用[J].中华劳动卫生职业病杂志,2004, 22(2): 90-92.[38] 于新凯,石鹏超,左群.运动性损伤后大鼠骨骼肌转化生长因子-β1变化的研究[J].中国体育科技,2011,47(5):128-133.[39] DO MK, Suzuki T, Gerelt B, et al. Time-coordinated prevalence of extracellular HGF, FGF2 and TGF-β3 in crush-injured skeletal muscle.Anim Sci J. 2012;83(10):712-717.[40] Gumucio JP, Flood MD, Phan AC, et al. Targeted inhibition of TGF-β results in an initial improvement but long-term deficit in force production after contraction-induced skeletal muscle injury.J Appl Physiol (1985). 2013;115(4):539-545. [41] Lemos DR, Babaeijandaghi F, Low M, et al. Nilotinib reduces muscle fibrosis in chronic muscle injury by promoting TNF-mediated apoptosis of fibro/adipogenic progenitors.Nat Med. 2015;21(7):786-794.[42] Kelc R, Trapecar M, Gradisnik L, et al. Platelet-rich plasma, especially when combined with a TGF-β inhibitor promotes proliferation, viability and myogenic differentiation of myoblasts in vitro.PLoS One. 2015;10(2):e0117302. [43] 徐明明.跑台运动对大鼠骨髓肌急性钝挫伤后TGF-B1和bFGF表达的影响[D].江苏大学,2013.[44] 曹庆雷,李小兰.急性骨骼肌损伤实验模型构建新思路——利用细胞打印技术构建体外高通量三维功能性肌肉组织模型[J].辽宁体育科技,2013,35(3):46-48.[45] 岳相辉,曾甫清,陈宏翔,等.细胞打印的可行性研究[J].临床泌尿外科杂志,2006,21(10):782-784. |
| [1] | Yao Xiaoling, Peng Jiancheng, Xu Yuerong, Yang Zhidong, Zhang Shuncong. Variable-angle zero-notch anterior interbody fusion system in the treatment of cervical spondylotic myelopathy: 30-month follow-up [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1377-1382. |
| [2] | Zhang Jinglin, Leng Min, Zhu Boheng, Wang Hong. Mechanism and application of stem cell-derived exosomes in promoting diabetic wound healing [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1113-1118. |
| [3] | An Weizheng, He Xiao, Ren Shuai, Liu Jianyu. Potential of muscle-derived stem cells in peripheral nerve regeneration [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1130-1136. |
| [4] | He Yunying, Li Lingjie, Zhang Shuqi, Li Yuzhou, Yang Sheng, Ji Ping. Method of constructing cell spheroids based on agarose and polyacrylic molds [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 553-559. |
| [5] | He Guanyu, Xu Baoshan, Du Lilong, Zhang Tongxing, Huo Zhenxin, Shen Li. Biomimetic orientated microchannel annulus fibrosus scaffold constructed by silk fibroin [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 560-566. |
| [6] | Chen Xiaoxu, Luo Yaxin, Bi Haoran, Yang Kun. Preparation and application of acellular scaffold in tissue engineering and regenerative medicine [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 591-596. |
| [7] | Kang Kunlong, Wang Xintao. Research hotspot of biological scaffold materials promoting osteogenic differentiation of bone marrow mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 597-603. |
| [8] | Shen Jiahua, Fu Yong. Application of graphene-based nanomaterials in stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 604-609. |
| [9] | Zhang Tong, Cai Jinchi, Yuan Zhifa, Zhao Haiyan, Han Xingwen, Wang Wenji. Hyaluronic acid-based composite hydrogel in cartilage injury caused by osteoarthritis: application and mechanism [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 617-625. |
| [10] | Li Hui, Chen Lianglong. Application and characteristics of bone graft materials in the treatment of spinal tuberculosis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 626-630. |
| [11] | Gao Cangjian, Yang Zhen, Liu Shuyun, Li Hao, Fu Liwei, Zhao Tianyuan, Chen Wei, Liao Zhiyao, Li Pinxue, Sui Xiang, Guo Quanyi. Electrospinning for rotator cuff repair [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 637-642. |
| [12] | Guan Jian, Jia Yanfei, Zhang Baoxin , Zhao Guozhong. Application of 4D bioprinting in tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(3): 446-455. |
| [13] | Liu Jiali, Suo Hairui, Yang Han, Wang Ling, Xu Mingen. Influence of lay-down angles on mechanical properties of three-dimensional printed polycaprolactone scaffolds [J]. Chinese Journal of Tissue Engineering Research, 2022, 10(16): 2612-2617. |
| [14] | Huang Bo, Chen Mingxue, Peng Liqing, Luo Xujiang, Li Huo, Wang Hao, Tian Qinyu, Lu Xiaobo, Liu Shuyun, Guo Quanyi . Fabrication and biocompatibility of injectable gelatin-methacryloyl/cartilage-derived matrix particles composite hydrogel scaffold [J]. Chinese Journal of Tissue Engineering Research, 2022, 10(16): 2600-2606. |
| [15] | Li Xuan, Sun Yimin, Li Longbiao, Wang Zhenming, Yang Jing, Wang Chenglin, Ye Ling. Manufacturing of nano-modified polycaprolactone microspheres and its biological effects in dental pulp cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(10): 1530-1536. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||