Chinese Journal of Tissue Engineering Research ›› 2017, Vol. 21 ›› Issue (24): 3931-3936.doi: 10.3969/j.issn.2095-4344.2017.24.027
Electromechanical delay is a key to neuromuscular transmission
Pei Zi-wen1, Xu Xia2, 3, Chen Jian2, 3
- 1School of Graduate, 2School of Health Sciences, Wuhan Sports University, Wuhan 430079, Hubei Province, China; 3Key Laboratory of Sports Training and Monitoring in Hubei Province, Wuhan 430079, Hubei Province, China
-
Revised:2017-05-16Online:2017-08-28Published:2017-08-30 -
Contact:Chen Jian, M.D., Associate professor, School of Health Sciences, Wuhan Sports University, Wuhan 430079, Hubei Province, China; Key Laboratory of Sports Training and Monitoring in Hubei Province, Wuhan 430079, Hubei Province, China -
About author:Pei Zi-wen, Studying for master’s degree, School of Graduate, Wuhan Sports University, Wuhan 430079, Hubei Province, China
CLC Number:
Cite this article
Pei Zi-wen, Xu Xia, Chen Jian. Electromechanical delay is a key to neuromuscular transmission[J]. Chinese Journal of Tissue Engineering Research, 2017, 21(24): 3931-3936.
share this article
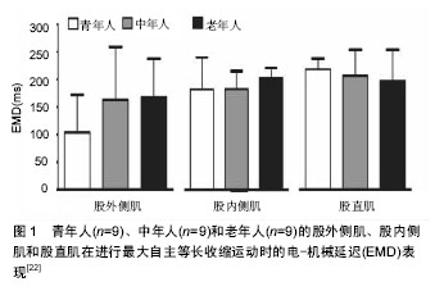
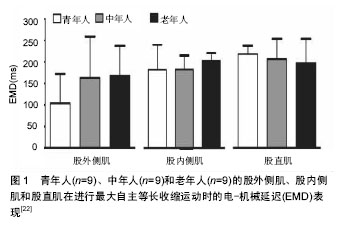
2.1 电-机械延迟发生机制 肌肉收缩过程中,引发电-机械延迟主要包括以下两个环节:①动作电位通过横管系统传导到肌细胞内的三联管,终池中的Ca2+释放,Ca2+与肌钙蛋白结合,引起肌钙蛋白的构型改变,原肌凝蛋白发生位移,暴露出细肌丝上与横桥结合位点,横桥从而与结合位点结合,进而横桥摆动引发肌肉内可收缩成分(contractile component,CC)收缩,即肌小节收缩;②可收缩成分牵拉肌肉内延长的串联弹性成分(series elastic component,SEC),当肌肉收缩产生的张力超过串联弹性成分的张力后,肌纤维缩短。因而,凡是能影响上述两个环节中任何一个都可能造成电-机械延迟发生改变[1,5]。 目前公认的计算电-机械延迟开始的时间节点为肌电图(EMG)采集到15 μV电信号(超出所设基线)的时刻,结束的时间节点为发力力矩达到9.6 N•m的时刻(使用等速测力系统同步测试),两个时刻间的时间间隔即电-机械延迟[6]。现有学者将肌动图(MMG)同时用于研究肌肉的收缩过程,在采集肌电信号的同时采集肌肉机械收缩信号[5,7-8]。肌肉机械收缩信号反映的是在肌肉激活后,在串联弹性成分拉紧前,肌纤维第一时间机械活动的信号,而肌电图信号和肌动图信号之间的时间间隔(EMDE-M)则可以反映环节一所耗时间,并对兴奋-收缩偶联过程所用时间具有指示作用。在此基础上同时采集力矩变化的时间信号,肌动图信号和力矩信号之间的时间间隔(EMDM-F)则可以反映牵拉串联弹性成分的时间,即环节二的时间。最近研究显示在自主肌肉收缩过程中,EMDE-M范围一般为10-25 ms,而EMDM-F范围一般为29-45 ms,因而EMDE-F(EMDM-F+EMDE-M)范围为39-70 ms[6,8]。 肌组织中主要包含两类串联弹性成分,其一是主动串联弹性成分(肌丝),其二是被动串联弹性成分(肌腱和腱膜),Nordez等[9]对两类串联弹性成分进一步研究发现,被动串联弹性成分所引发的延时占EMDE-F的(47.5±6.0)%,其中肌腱和腱膜分别占EMDE-F的(20.3±10.7)%和(27.6±11.4)%,而对于突触信号传递以及兴奋收缩偶联所引发的延时所占比例还有待进一步研究。 2.2 影响电-机械延迟的主要因素 2.2.1 性别因素 在体育活动过程中,女性发生肌腱和韧带损伤的频率相比男性更高,诸多学者认为男性和女性的电-机械延迟时间差异是导致这一情况发生的原因之一[10-14]。 Winter等[10]早期研究发现,女性受试者比目鱼肌在进行跖屈动作时电-机械延迟较男性更长,而前反应时无显著差异。Inglis等[12]也报道女性在进行等长运动时,其电-机械延迟较男性显著延长。研究者认为造成这种差异的原因可能是由于女性和男性的肌肉成分差异,然而,现在有限的研究认为肌纤维类型的分布差异并不足以造成这种差异,而是由于肌肉激活过程中的差异,例如兴奋-收缩偶联和肌纤维传导速率的不同[13-14]。并且Blackburn等[13]和Grosset等[14]已经发现男性肌腱的紧张度较女性高,因而在肌肉激活过程中,男性肌肉中可收缩成分牵拉被动串联弹性成分所耗费的时间更短,从而男性电-机械延迟较短。 虽然诸多研究认为女性电-机械延迟较男性更久,但是也有学者研究得出不同的结论。女性远动员前交叉韧带损伤的发生率是男性的4-6倍,因而Mark等[15]认为这可能与女性运动员腘绳肌电-机械延迟较男性更久有关,但是他们对110名受试者进行测试发现,女性在进行腘绳肌离心收缩运动过程中电-机械延迟较男性并没有显著性差异,因而他们认为是其他因素导致女性非接触性前交叉韧带损伤的发生率更高。Conchola等[16]在受试者运动性疲劳后测试大腿屈肌和伸肌电-机械延迟发现,男性和女性的电-机械延迟在疲劳后也不存在显著性差异。产生争论性研究结果的原因可能是由于测试电-机械延迟的方式(自主收缩 vs. 诱发收缩)存在差异,另外肌肉收缩方式和所动用的肌纤维收缩类型的不同也可能对测试结果造成影响。从目前研究结果来看,性别对电-机械延迟的影响及影响机制还并不明确,有待进一步研究。 2.2.2 年龄因素 随着年龄的增长,肌肉的黏弹性以及肌腱的强度会发生变化,这些变化都可能会造成电-机械延迟发生改变[17-21]。 Chung等[19]研究发现,(69.4±7.1)岁老年人较(29.9±6.5)岁青年人电-机械延迟更久,并且老年人肌肉发力率变慢,力量也更低。其原因可能是由于老年人肌腱强度降低,导致肌小节收缩牵拉肌腱耗时会有所增加。Grosset等[20]对青春期前儿童(年龄7-11岁)进行研究发现,随着年龄的增长,电-机械延迟逐渐下降,但是依然比成年人电-机械延迟高。这可能是由于青春期前,肌腱的强度会随着年龄增长而增强。De Ste Croix等[21]对13-17岁女子足球运动员进行研究也得出类似的结论,他们发现运动员在进行腘绳肌离心收缩时,13岁运动员组比15岁组和17岁组运动员的腘绳肌电-机械延迟更长。然而,最近也有研究发现,青年[年龄(23.44±4.74)岁]、中年[年龄(49.56±6.06)岁]和老年群体[年龄(68.67±9.06)岁]的股四头肌在进行最大自主等长收缩运动时,年龄因素并没有造成股外侧肌、股内侧肌和股直肌电-机械延迟发生显著改变(见图1),并认为这可能是由于未对性别因素加以控制或者是其他因素干扰所致[22]。近年来,国内外探讨年龄因素影响电-机械延迟的研究结果见表1。由于目前针对年龄因素的研究数量非常有限,尚难以明确其影响。"

2.2.3 疲劳因素 肌肉疲劳因素一直被认为是电-机械延迟的影响因素之一。不论是以何种方式导致肌肉疲劳,都会造成电-机械延迟显著延长[21,23-29]。 早在1996年,Zhou等[24]就发现肌肉疲劳程度越高,肌肉电-机械延迟就越长,并认为是由于疲劳后肌肉收缩时,动作电位在肌膜上传递过程中K+外流入T管,使Ca2+释放减少所致。Conchola等[16]在受试者大腿伸肌运动性疲劳后进行测试也发现,疲劳后大腿伸肌的电-机械延迟相比疲劳前立即延长。De Ste Croix等[21]也得出类似结论,他们发现女性运动员腘绳肌在疲劳后电-机械延迟显著延长(P=0.001),并认为这会增加运动员运动损伤的风险。Rampichini等[25]和Cè等[26]采用电刺激方式使受试者肌肉疲劳后测试发现EMDE-F延长,并且EMDE-M和EMDM-F均显著延长。Smith等[27]利用抗阻收缩的方式使受试者肌肉疲劳后测试也得出类似的结论。分析肌肉疲劳后电-机械延迟延长的原因主要分为两方面,一方面是由于肌肉疲劳后电信号在肌膜上传递速率下降、肌浆网Ca2+释放减少、Ryanodine受体功能改变以及横桥摆动频率下降等因素导致EMDE-M延长[29-31];另一方面是由于疲劳后肌肉肌腱单元紧张性降低,可收缩成分牵拉肌腱所耗费时间延长,从而导致EMDM-F延长[7,32]。尽管已经明确疲劳因素会造成电-机械延迟显著延长,但是其影响机制还有待进一步证实。 2.2.4 其他因素 肌纤维类型与电-机械延迟之间的关系已经明确,不考虑其他条件,快肌纤维百分比越高,电-机械延迟值会越小,反之越大。肌肉收缩程度对电-机械延迟也会造成影响[6-7]。Zhou等[6]在研究不同程度的肌肉收缩对电-机械延迟的影响时发现,30%最大自主收缩(MVC)相比60%MVC和80%MVC所造成电-机械延迟值最大。Yavuz等[7]也得出类似的结论,他们认为肌肉收缩力度的增加可以缩短拉紧肌肉和肌腱的时间,从而缩短EMDM-F。Cè等[5]研究温度对电-机械延迟的影响发现,组织温度降低会使EMDE-M延长,但是对EMDM-F和EMDE-F不造成影响。造成此结果的原因还有待进一步研究。而遗传因素对电-机械延迟的影响,目前只有国内学者马力宏开展过相关研究,但是由于样本量较小,相关研究数量较少,尚不足以明确其间关系[33]。 2.3 电-机械延迟在运动医学中的应用 2.3.1 在运动损伤机制研究中的应用 电-机械延迟的测量作为一种非侵入性了解神经肌肉功能状态的方法,在运动损伤机制的研究上应用得越来越广。Flevas等[4]研究慢性踝关节不稳的损伤机制时发现,慢性踝关节不稳患者的腓骨肌电-机械延迟相比健康受试者,无论是疲劳前还是疲劳后都显著延长。并认为患者腓骨肌电-机械延迟延长是诱发踝关节反复扭伤的原因之一。分析电-机械延迟延长的原因可能是踝扭伤后韧带的强度下降,从而导致EMDM-F延长。Hannah等[34]研究腘绳肌、股四头肌和爆发性收缩力与电-机械延迟间关系时发现,发现腘绳肌电-机械延迟远大于股四头肌电-机械延迟(44.0 vs 22.6 ms),并认为这是导致非接触性前交叉韧带损伤的原因之一。非接触性前交叉韧带损伤常发生在落地的瞬间,而在落地瞬间肌肉激活早期阶段(0-50 ms),腘绳肌肌肉收缩延迟会导致股四头肌爆发性收缩力远大于腘绳肌爆发性收缩力,二者间力量不平衡进而会导致膝关节不稳。另一方面,由于前交叉韧带是主要限制胫骨前移的韧带,当腘绳肌收缩延迟,不足以抵消股四头肌爆发性收缩力时,股四头肌会牵拉胫骨前移,进而增加前交叉韧带损伤的风险。Blackburn等[13]和Croix等[15]在研究中也发现腘绳肌离心收缩时电-机械延迟较长,并认为这会增加前交叉韧带损伤的风险。Chen等[35]在研究髌股关节疼痛综合征的发生机制时发现,患者的股内侧肌电-机械延迟显著长于健康受试者,而股外侧肌电-机械延迟短于健康受试者。并认为这可能与PFPS患者的肌肉肌腱的机械性能发生改变有关。王国祥等[36]对髌腱末端病患者膝关节动作反应的变化特征进行研究发现,患者股四头肌存在肌电激发和收缩时间延迟现象,并认为股四头肌电-机械延迟延长与肌肉内环境改变和肌腱传导应力能力减退有关,前者会影响神经肌肉接头处的兴奋收缩偶联过程,后者会影响肌肉收缩速度。 借助肌电图,肌动图和等速测力系统共同研究电机械延迟期间的肌力,关节活动角度的同步变化,进而分析运动损伤的机制的研究越来越多。由于EMDE-F、EMDE-M和EMDM-F等数据可以直接反映肌肉收缩过程中兴奋收缩偶联、Ca2+释放、横桥摆动,以及肌小节收缩等环节的时间信息,还可以间接反映肌腱紧张度。这为研究肌肉骨骼系统相关的运动损伤机制提供了新的途径。 2.3.2 在损伤后康复疗效评价方面的应用 现在越来越多的干预性研究将电-机械延迟作为评价术后功能恢复的指标之一。Linford等[37]将电-机械延迟作为评价神经肌肉训练对腓骨肌功能状态影响的指标。Begovic等[38]研究横向摩擦按摩对神经肌肉传导功能影响时,也将电-机械延迟作为评价指标之一。陈建等[3]研究神经肌肉电刺激对前交叉韧带重建术后腘绳肌功能的影响,将电-机械延迟作为评价神经肌肉电刺激疗效的指标之一。研究选取30例接受自体腘绳肌重建前交叉韧带的男性患者,比较不同治疗方式对患者半腱肌和股二头肌肌力和电-机械延迟的影响。研究结果表明,采用神经肌肉电刺激可以有效地预防术后早期腘绳肌肌力的下降以及电-机械延迟的延长,其疗效比常规治疗更好,但是目前神经肌肉电刺激对电-机械延迟的影响机制还暂不清楚。也有研究将电-机械延迟作为评价前交叉韧带重建术后患者屈膝肌群功能恢复状态的指标[39-40]。前交叉韧带重建术后患者屈膝肌群电-机械延迟的改变与屈膝肌群保护前交叉韧带重建物的能力息息相关,屈膝肌群电-机械延迟延长可能会导致伸肌/屈肌协同收缩能力下降,造成前交叉韧带重建物过度负荷,进而导致前交叉韧带损伤再一次发生[39-40]。Ristanis等[39]研究前交叉韧带重建术后患者发现,不同手术方式对膝关节屈肌电-机械延迟的影响不同。当同时取股薄肌和半腱肌肌腱重建前交叉韧带时会导致股二头肌和半腱肌电-机械延迟延长。而Freddolini等[40]对仅截取半腱肌肌腱进行前交叉韧带重建的患者进行研究发现,重建术后患者的股二头肌电-机械延迟相比正常人并未发生显著性改变,而只有半腱肌电-机械延迟显著延长。分析股二头肌电-机械延迟未发生改变的原因可能与膝关节内外侧屈肌共同收缩模式发生适应性改变有关。当同时取股薄肌和半腱肌肌腱进行前交叉韧带重建时,二者功能均受到影响,此时股二头肌可能会由于长期代偿内侧屈肌收缩导致其加速退化,而只取半腱肌进行前交叉韧带重建时,可以保留股薄肌协同半腱肌屈膝功能,从而不至于影响股二头肌功能。因而Freddolini等[40]认为仅使用半腱肌肌腱进行前交叉韧带重建对患者预后膝关节屈肌功能影响较小,并推荐外科手术采用此种重建方式进行前交叉韧带重建。也有学者研究力量训练对电-机械延迟的影响,试图将电-机械延迟作为肌肉功能恢复的指标之一[41-43]。Stock等[41]研究发现,女性受试者在进过短期抗阻训练后大腿伸肌电-机械延迟显著下降,并认为导致这种改变的原因主要是由于肌腱紧张度增加。然而Costa等[42]对男性受试者进行为期三天的抗组训练,却并没有发现大腿伸肌电-机械延迟发生改变。产生争论性结果的原因可能是测量电-机械延迟的方式存在区别,也可能是受到性别因素的干扰。 虽然电-机械延迟能够很好的反映损伤后肌肉肌腱组织的功能状态,但是由于影响电-机械延迟因素较多,因而将电-机械延迟作为损伤后疗效评价指标还有待进一步研究。"

| [1] Cavanagh PR, Komi PV. Electromechanical delay in human skeletal muscle under concentric and eccentric contractions. Eur J ApplPhysiolOccup Physiol. 1979;42(3):159-163.[2] Vos EJ,Harlaar J,van IngenSchenau GJ.Electromechanical delay during knee extensorcontractions. Med Sci Sports Exerc. 1991;23(10):1187-1193.[3] 陈建,周敬滨,解强,等.神经肌肉电刺激对前交叉韧带重建术后腘绳肌功能的影响[J].中国运动医学杂志. 2016; 35(8):750-753.[4] Flevas DA, Bernard M, Ristanis S, et al. Peroneal electromechanical delay and fatigue in patients with chronic ankle instability.Knee Surg Sports TraumatolArthrosc. Knee Surg Sports Traumatol Arthrosc. 2017;25(6):1903-1907.[5] Cè E,Rampichini S,Agnello L,et al.Effects of temperature and fatigue on the electromechanical delay components. Muscle Nerve. 2013;47(4):566-576.[6] Zhou S, Lawson DL, Morrison WE, et al. Electromechanical delay in isometric muscle contractions evoked by voluntary, reflex and electrical stimulation. Eur J Appl Physiol Occup Physio.1995;70(2):138-145.[7] Yavuz SU, Sendemir-Urkmez A, Türker KS. Effect of gender, age, fatigue and contraction level on electromechanical delay. ClinNeurophysiol. 2010;121(10):1700-1706.[8] Begovic H, Zhou GQ, Li T, et al. Detection of the electromechanical delay and its components during voluntary isometric contraction of the quadriceps femorismuscle.Front Physiol. 2014;5:494.[9] Nordez A, Gallot T, Catheline S, et al. Electromechanical delay revisited using very high frame rate ultrasound. J Appl Physiol. 2009;106(6):1970-1975.[10] Winter EM, Brookes FB.Electromechanical response times and muscle elasticity in men and women. Eur J Appl Physiol. 1991;63(2):124-128.[11] Szpala A, Rutkowska-Kucharska A, Stawiany M. Symmetry of electromechanical delay, peak torque and rate of force development in knee flexors and extensors in female and male subjects.ActaBioengBiomech. 2015;17(1):61-68.[12] Inglis JG, Vandenboom R, Gabriel DA.Sex-related differences in maximal rate of isometric torque development. J Electromyogr Kinesiol.2013;23(6):1289-1294.[13] Blackburn JT, Bell DR, Norcross MF, et al. Comparison of hamstring neuromechanical properties between healthy males and females and the influence of musculotendinous stiffness. J ElectromyogrKinesiol. 2009;19(5): 362-369.[14] Grosset JF, Piscione J, Lambertz D, et al. Paired changes in electromechanical delay and musculo-tendinous stiffness after endurance or plyometric training.Eur J Appl Physiol. 2009;105(1):131-139.[15] De Ste Croix MB, ElNagar YO, Iga J, et al. Electromechanical delay of the hamstrings during eccentric muscle actions in males and females: Implications for non-contact ACL injuries. J ElectromyogrKinesiol. 2015;25(6):901-906.[16] Conchola EC, Thiele RM, Palmer TB, et al. Effects of neuromuscular fatigue on the electromechanical delay of the leg extensors and flexors in young men and women. Muscle Nerve. 2015;52(5):844-851.[17] Karamanidis K, Arampatzis A. Mechanical and morphological properties of human quadriceps femoris and triceps surae muscle-tendon unit in relation to aging and running. J Biomech. 2006;39(3):406-417.[18] Reeves ND. Adaptation of the tendon to mechanical usage. J Musculoskelet Neuronal Interact. 2006;6(2):174-180.[19] Chung SG, Van Rey EM, Bai Z, et al. Aging-related neuromuscular changes characterized by tendon reflex system properties. Arch Phys Med Rehabil. 2005;86(2):318-327.[20] Grosset JF, Mora I, Lambertz D, et al. Age-related changes in twitch properties of plantar flexor muscles in prepubertalchildren. Pediatr Res. 2005;58(5):966-970.[21] De Ste Croix MB, Priestley AM, Lloyd RS, et al. ACL injury risk in elite female youth soccer: Changes in neuromuscular control of the knee following soccer-specific fatigue. Scand J Med Sci Sports. 2015;25(5): 531-538.[22] Libardi CA, Souza TM, Conceição MS, et al. Electromechanical delay of the knee extensor muscles: comparison among young, middle-age and older individuals. ClinPhysiolFunct Imaging. 2015;35(4):245-249.[23] Smith CM, Housh TJ, Hill EC, et al. Changes in Electromechanical Delay During Fatiguing Dynamic Muscle Actions. Muscle Nerve. Muscle Nerve. 2016 Dec 9.[24] Zhou S,McKenna MJ,Lawson DL,et al.Effects of fatigue and sprint training on electromechanical delay of knee extensor muscles.Eur J ApplPhysiolOccup Physiol. 1996;72(5-6): 410-416.[25] Rampichini S, Cè E, Limonta E, et al. Effects of fatigue on the electromechanical delay components in gastrocnemius medialis muscle. Eur J Appl Physiol. 2014;114(3):639-651.[26] Cè E, Rampichini S, Monti E, et al. Changes in the electromechanical delay components during a fatiguing stimulation in human skeletal muscle: an EMG, MMG and force combined approach. Eur J Appl Physiol. 2017;117(1):95-107.[27] Smith CM, Housh TJ, Hill EC, et al. Dynamic versus isometric electromechanical delay in non-fatigued and fatigued muscle: A combined electromyographic, mechanomyographic, and force approach. J ElectromyogrKinesiol. 2017;33:34-38.[28] Downey RJ, Merad M, Gonzalez EJ, et al. The Time-Varying Nature of Electromechanical Delay and Muscle Control Effectiveness in Response to Stimulation-Induced Fatigue. IEEE Trans Neural Syst Rehabil Eng. 2016 Nov 8. [Epub ahead of print].[29] Edwards JN, Cully TR, Shannon TR, et al. Longitudinal and transversal propagation of excitation along the tubular system of rat fast-twitch muscle fibres studied by high speed confocal microscopy. J Physiol. 2012;590(3):475-492.[30] Fitts RH. The cross-bridge cycle and skeletal muscle fatigue. J Appl Physiol. 2008;104(2):551-558.[31] Debold EP.Recent insights into the molecular basis of muscular fatigue. Med Sci Sports Exerc. 2012;44(8):1440-1452.[32] Zhang LQ, Rymer WZ. Reflex and intrinsic changes induced by fatigue of human elbow extensor muscles. J Neurophysiol. 2001;86(3):1086-1094.[33] 马力宏. 反应时、电-机械延迟之研究[J]. 天津体育学院学报. 1988;7(4):26-29.[34] Hannah R, Minshull C, Smith SL, et al. Longer Electromechanical Delay Impairs Hamstrings Explosive Force versus Quadriceps. Med Sci Sports Exerc. 2014;46(5):963-972.[35] Chen HY, Chien CC, Wu SK, et al. Electromechanical Delay of the VastusMedialisObliquus and VastusLateralis in Individuals With Patellofemoral Pain Syndrome. J Orthop Sports PhysTher. 2012;42(9):791-796.[36] 王国祥,张秋霞,鲍捷. 髌腱末端病运动员膝关节动作反应的变化特征[J].中国康复医学杂志,2011;26(9):838-842.[37] Linford CW, Hopkins JT, Schulthies SS, et al. Effects of neuromuscular training on the reaction time and electromechanical delay of the peroneus longus muscle.Arch Phys Med Rehabil. 2006;87(3):395-401.[38] Begovic H, Zhou GQ, Schuster S, et al. The neuromotor effects of transverse friction massage. Man Ther. 2016;26:70-76.[39] Ristanis S, Tsepis E, Giotis D, et al. Electromechanical delay of the knee flexor muscles is impaired after harvesting hamstring tendons for anterior cruciate ligament reconstruction. Am J Sports Med. 2009;37(11):2179-2186.[40] Freddolini M, Battaglioli A, Chiechi F, et al. Electromechanical delay of the knee flexor muscles after anterior cruciate ligament reconstruction using semitendinosus tendon. Sports Biomech. 2015;14(4):384-393.[41] Stock MS, Olinghouse KD, Mota JA, et al. Muscle group specific changes in the electromechanical delay following short-term resistance training.J Sci Med Sport. 2016;19(9):761-765.[42] Costa PB, Herda TJ, Walter AA, et al. Effects of short-term resistance training and subsequent detraining on the electromechanical delay. Muscle Nerve. 2013;48(1):135-136.[43] Szpala A, Rutkowska-Kucharska A, Drapala JElectromechanical delay of abdominal muscles is modified by low back pain prevention exercise.ActaBioengBiomech. 2014;16(3): 95–102.[44] Ristanis S,Tsepis E,Giotis D, et al. Knee flexor muscle responses under fatigue after harvesting the hamstrings for anterior cruciate ligament reconstruction. Clin J Sport Med. 2011;21(4):288-293. |
| [1] | Yao Xiaoling, Peng Jiancheng, Xu Yuerong, Yang Zhidong, Zhang Shuncong. Variable-angle zero-notch anterior interbody fusion system in the treatment of cervical spondylotic myelopathy: 30-month follow-up [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1377-1382. |
| [2] | Wu Bingshuang, Wang Zhi, Tang Yi, Tang Xiaoyu, Li Qi. Anterior cruciate ligament reconstruction: from enthesis to tendon-to-bone healing [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1293-1298. |
| [3] | Zhang Jinglin, Leng Min, Zhu Boheng, Wang Hong. Mechanism and application of stem cell-derived exosomes in promoting diabetic wound healing [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1113-1118. |
| [4] | An Weizheng, He Xiao, Ren Shuai, Liu Jianyu. Potential of muscle-derived stem cells in peripheral nerve regeneration [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1130-1136. |
| [5] | Yang Kuangyang, Wang Changbing. MRI evaluation of graft maturity and knee function after anterior cruciate ligament reconstruction with autogenous bone-patellar tendon-bone and quadriceps tendon [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(6): 963-968. |
| [6] | Li Jie, Zhang Haitao, Chen Jinlun, Ye Pengcheng, Zhang Hua, Zhou Bengen, Zhao Changqing, Sun Youqiang, Chen Jianfa, Xiang Xiaobing, Zeng Yirong. Anterior cruciate ligament rupture and patellofemoral joint stability before sagittal and axial measurement using MRI [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(6): 969-972. |
| [7] | He Yunying, Li Lingjie, Zhang Shuqi, Li Yuzhou, Yang Sheng, Ji Ping. Method of constructing cell spheroids based on agarose and polyacrylic molds [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 553-559. |
| [8] | He Guanyu, Xu Baoshan, Du Lilong, Zhang Tongxing, Huo Zhenxin, Shen Li. Biomimetic orientated microchannel annulus fibrosus scaffold constructed by silk fibroin [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 560-566. |
| [9] | Chen Xiaoxu, Luo Yaxin, Bi Haoran, Yang Kun. Preparation and application of acellular scaffold in tissue engineering and regenerative medicine [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 591-596. |
| [10] | Kang Kunlong, Wang Xintao. Research hotspot of biological scaffold materials promoting osteogenic differentiation of bone marrow mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 597-603. |
| [11] | Shen Jiahua, Fu Yong. Application of graphene-based nanomaterials in stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 604-609. |
| [12] | Zhang Tong, Cai Jinchi, Yuan Zhifa, Zhao Haiyan, Han Xingwen, Wang Wenji. Hyaluronic acid-based composite hydrogel in cartilage injury caused by osteoarthritis: application and mechanism [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 617-625. |
| [13] | Li Hui, Chen Lianglong. Application and characteristics of bone graft materials in the treatment of spinal tuberculosis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 626-630. |
| [14] | Gao Cangjian, Yang Zhen, Liu Shuyun, Li Hao, Fu Liwei, Zhao Tianyuan, Chen Wei, Liao Zhiyao, Li Pinxue, Sui Xiang, Guo Quanyi. Electrospinning for rotator cuff repair [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 637-642. |
| [15] | Guan Jian, Jia Yanfei, Zhang Baoxin , Zhao Guozhong. Application of 4D bioprinting in tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(3): 446-455. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||