Chinese Journal of Tissue Engineering Research ›› 2021, Vol. 25 ›› Issue (20): 3259-3266.doi: 10.3969/j.issn.2095-4344.3187
Previous Articles Next Articles
Significance of urinary proteomics assessing pathological changes in the body
Lin Haiqi1, Chen Liang2, Tang Lu3, Weng Xiquan4, Lin Wentao4
- 1School of Sports, South China University of Technology, Guangzhou 510641, Guangdong Province, China; 2School of Sports and Health, Guangzhou University of Chinese Medicine, Guangzhou 510006, Guangdong Province, China; 3School of Sports, South China Normal University, Guangzhou 510006, Guangdong Province, China; 4Guangzhou Sport University, Guangzhou 510500, Guangdong Province, China
-
Received:2020-08-21Revised:2020-09-02Accepted:2020-09-10Online:2021-07-18Published:2021-01-18 -
Contact:Lin Wentao, Professor, Doctoral supervisor, Guangzhou Sport University, Guangzhou 510500, Guangdong Province, China -
About author:Lin Haiqi, MD candidate, Experimentalist, School of Sports, South China University of Technology, Guangzhou 510641, Guangdong Province, China -
Supported by:Foundation for Humanities and Social Sciences Research of the Ministry of Education of China, No. 20YJCZH090 (to LHQ); the 13th Five-year Philosophy and Social Science Project of Guangdong Province, No. GD19YTY01 (to LHQ); the 13th Five-year Educational Science Planning Project of Guangdong Province, No. 2018GXJK001 (to LHQ)
CLC Number:
Cite this article
Lin Haiqi, Chen Liang, Tang Lu, Weng Xiquan, Lin Wentao. Significance of urinary proteomics assessing pathological changes in the body[J]. Chinese Journal of Tissue Engineering Research, 2021, 25(20): 3259-3266.
share this article
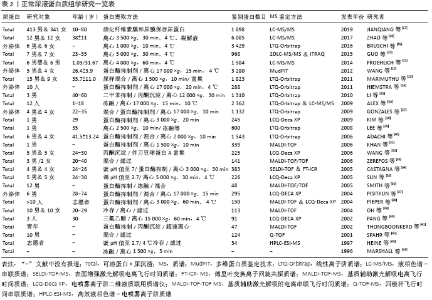
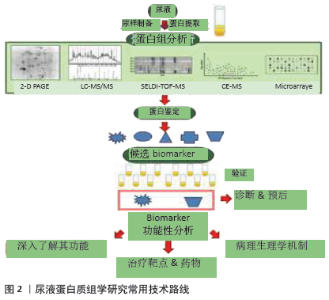
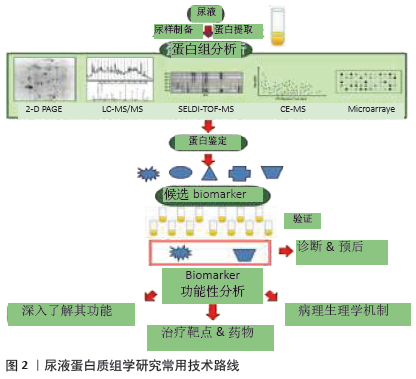
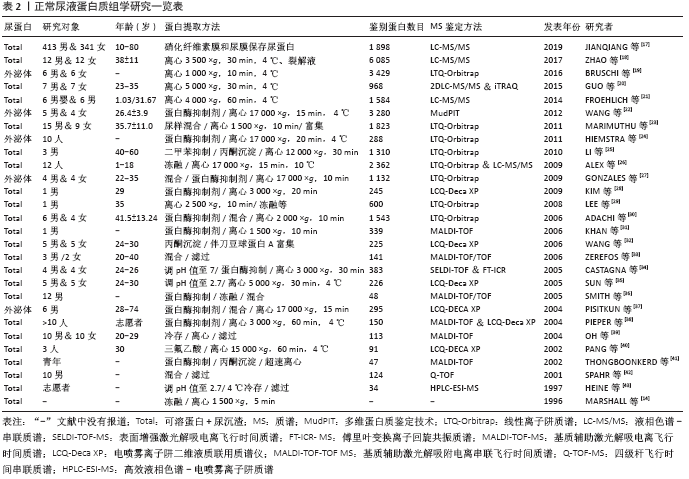
2.2.2 正常尿蛋白组学研究历程与现状 为寻找体育运动或疾病状态下有意义的蛋白生物标志物,首先需建立正常尿蛋白组图谱。近年来,众多学者致力于正常尿蛋白组学研究且成果显著(表2)[14,17-43]。 1996年MARSHALL等[14]首次应用双向凝胶电泳技术(two-dimensional gel electrophoresis,2-DE)建立了正常尿液蛋白组2-DE图谱,并提出了尿蛋白组学的概念,开启了尿蛋白组学研究的新里程。次年,HEINE等[43]用高效液相色谱-电喷雾离子阱质谱(high-performance liquid chromatography-electrospray ionization-MS,HPLC-ESI-MS)技术鉴定出了34个蛋白质,并获得了正常人尿蛋白片段图谱。随后,人们运用2-DE+基质辅助激光解吸电离飞行时间(matrix assisted laser desorption ionization time of flight,MALDI-TOF)/电喷雾离子阱二维液质联用质谱仪(LCQ-Deca XP)等多种蛋白组学技术在正常尿液中逐渐鉴定出近400个蛋白质[29-30]。LEE等[29]在1名35岁男子尿液中鉴定出600种蛋白质分子,扩展了尿蛋白组数据库,为后续的尿蛋白特异生物标志物的研究奠定了良好的理论与技术基础。随着实验技术和方法的改进,ADACHI等[30]在10名正常成人的尿液中应用线性离子阱质谱(linear ion trap-orbitrap,LTQ-Orbitrap)技术鉴定出1 543种蛋白质,且大部分蛋白为膜蛋白,这更加表明人尿蛋白组成分的复杂程度。从表2可见,正常尿蛋白组研究多集中于成年人,较少关注婴幼儿童。FROEHLICH等[21]通过一维凝胶电泳(one-dimensional gel electrophoresis,1-DE)+液相色谱-串联质谱(liquid chromatography-tandem MS,LC-MS/MS)技术首次对正常男婴和成人(各6人)的尿蛋白组深入对比研究,共获得1 584种蛋白质,并分为婴儿(648种)、成人(228种)和两者共有(708种)3个亚蛋白质组,表明正常尿蛋白组份存在年龄差异。ALEX等[26]应用2-DE+LTQ-Orbitrap&LC-MS/MS对正常人尿蛋白组分做了更为全面的分析,鉴定出2 362种蛋白分子。最近,ZHAO等[18]从尿中鉴定出6 085种蛋白质,进一步丰富了人类尿蛋白组数据库,揭示尿液有可能是特异蛋白标志物的巨大来源。 疾病状态下的尿液生物标志物很少,但正常人的尿液生物标志物确实是海量的,说明正常人有待精细分组。值得指出的是,正常人可以引入无标度功能网络和功能内稳态进行精细分类[8-10]。内稳态是经典的生理学概念之一,LIU等[10]将内稳态对状态的稳定推进为机体对功能的稳定发挥。功能内稳态是维持功能充分稳定发挥的负反馈机制,根据功能内稳态可以将功能和应激精细分类。处于/远离功能内稳态的功能称为正则/失调功能;正则/失调应激称为成功/慢性应激。根据无标度功能网络,机体的体外活动和体内功能可以分为必需、关键非必需和普通非必需三类。根据功能内稳态和无标度功能网络可以将正常人分为健康和亚健康两类,如果机体的必需功能和关键非必需功能都属于正则功能,即使遭遇应激,也属于成功应激,机体就属于健康。如果其中部分关键非必需功能轻度失调,机体就属于亚健康。功能内稳态的品质称为正则功能的功适能。根据功适能可以将正则功能进一步分级,功适能越高,正则功能的级别越高。机体的健康和亚健康也可以根据其正则功能的级别进行精细分级。从运动的角度可以将各个年龄段的人群分为不喜欢运动组和喜欢运动组,后者可以分为业余组和专业组,各个组中还可以根据运动成绩及其变异系数(coefficient of variation, CV)精细分组。按照这样的方法将正常人精细分组,就可以将尿液中海量的蛋白质分属各个精细分组。下面讨论尿蛋白组学在评估运动介导机体病理性变化中的应用。 "

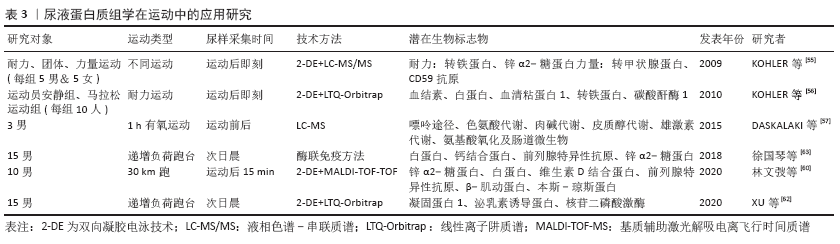
2.3 尿蛋白组学在评估运动介导机体病理性变化中的应用 体育运动是机体的体外功能,其内稳态称为项目内稳态(sport-specific homeostasis,SpSH)[9-10]。处于/远离SpSH的运动称为正则/失调运动。尿液采集简便、无创、可重复取材,不影响正常训练,较易被运动员接受。尿蛋白已被应用于运动训练身体机能评定中,尿蛋白组学在体育科学中得到逐步的应用,但尚未发展到研究正则运动生物标志物的高度。 自1878年Von Leube在士兵行军时发现尿蛋白以来,国内外在运动性蛋白尿方面进行诸多研究[44-45],主要集中在运用尿蛋白评定运动负荷大小、评定运动强度和身体机能。研究发现,运动后尿总蛋白、白蛋白、β2-微球蛋白显著增加,且具有明显的强度依赖[44-45],尿β2-微球蛋白是评定运动者身体机能的灵敏指标[46-47]。但是,上述尿蛋白评价均未区分正则运动与失调运动,相关研究有待进一步深入。运动应激程度不同,机能状态不同,尿蛋白组分表达差异不同[7]。现役军人连续3 d野外消防作业发现尿蛋白排泄依赖于活动强度[48],而尿蛋白评价没有区分成功应激与慢性应激。动物实验发现大鼠运动后尿总蛋白、白蛋白、β2-微球蛋白排出率增加[49]。值得指出的是,实验动物容易建立正则运动/失调运动和成功应激/慢性应激的模型,可以推动尿蛋白研究的纵深发展。当然,实验条件与运动现场有所不同,很难用动物模型的研究成果来预测和解释运动现场的复杂情况。动物模型虽然可以为临床研究提供大量的理论支持,但临床研究本身还是必须深入开展。 综上,运动性蛋白尿的研究较少,受传统蛋白分离与鉴定技术瓶颈的限制,多局限于白蛋白、β2-微球蛋白等个别指标,难以对运动后尿蛋白组进行整体、系统的研究和阐释机体适应运动应激的变化机制,阻碍了运动性尿蛋白在体育科研中的应用与发展。然而,体育运动中,尿蛋白不仅有量的改变且存在组分的差异,依赖于运动项目的种类、运动是否正则、应激是否成功和运动水平的高低。如何打破尿蛋白研究的技术瓶颈?Z-DE+MS的联合使用与飞速发展为蛋白组学研究提供了良好的技术平台,尤其是尿蛋白组学概念的提出[12-13],为在体育科学领域高通量、快速的从整体的角度对尿蛋白组分与运动间的关联进行研究奠定了基础,提供了重要的技术平台与实验依据。尿蛋白在体育科学中的研究在历经了萌芽期、发展期和长时间的停滞期后,迎来了应用蛋白质组学技术进行研究的重建期,并得到了逐步的发展。 在体育领域,有关运动与尿蛋白组学的研究很少。GAUDREAU等[50]将1 793名老年人分为3个年龄组(68-72岁、73-77岁和78-82岁),通过采集营养、功能、医疗和社会数据,同时应用蛋白质组学和基因组学等技术对血液、尿液、唾液分析,进行长达5年的纵向跟踪研究,发现营养在老龄化进程中起到决定性作用。研究显示,健康成人在生活参数(昼夜节律、摄水量、体力活动、饮食、温度及氧气和二氧化碳水平等)受控条件下与外界隔离105 d后,发现尿蛋白组存在高变异性[51],鉴定出尿蛋白组分600个,且新增或消失的蛋白点与钠的摄入量密切相关[52]。采矿工人连续工作12 h后,发现尿中LG3肽段可能是监测采矿工人体力活动出现疲劳的一个生物标志物[53]。近期研究指出,运用蛋白质组学技术筛选尿中特异生物标志物,在体育领域可作为一种新兴的反兴奋剂检测手段[54]。 可见,上述研究多局限于普通正常人,而真正意义上应用蛋白质组学技术对运动性蛋白尿的人体实验性研究较少。2009年,KOHLER等[55]运用2-DE+MS蛋白质组技术对耐力、团体和力量型运动员运动后的尿蛋白组分及其2-DE图谱进行了对比分析,发现不同运动项目之间的尿蛋白组分和2-DE图谱表达存在差异,此项研究是尿蛋白组学技术与方法应用于体育科研中的正式开端。随后又采用2-D聚丙烯酰胺凝胶电泳(polyacrylamide gelelectrophoresis,PAGE)与LTQ-Orbitrap质谱技术结合对耐力运动前后尿蛋白2-DE图谱做了进一步深入研究[56-57],认为尿蛋白组分的变化与脂代谢增强或红细胞损坏有关。但上述研究源于不同个体间的比较,存在个体差异。 课题组研究团队运用2-DE+MALDI-TOF-TOF质谱技术对男子30 km跑后尿液蛋白质组差异表达进行研究[58-61],发现男子30 km 跑后尿蛋白图谱呈现显著的差异性变化,共获得差异表达蛋白点110个,上调与下调各55个,质谱鉴定出锌α2-糖蛋白、白蛋白、维生素D 结合蛋白、前列腺特异性抗原、β-肌动蛋白和本斯-琼斯蛋白共6 种蛋白,这些蛋白与机体能量代谢方式的转变、物质的转运、应激保护等有关,差异表达蛋白可作为运动营养补剂的筛选、运动负荷评定、运动性疲劳及肌损伤诊断的潜在目标蛋白(表3)。随后,运用iTRAQ蛋白质组学技术进一步探讨了在运动性免疫机能低下发生过程中尿液蛋白质组分的变化特点[62-63],发现尿白蛋白、钙结合蛋白、前列腺特异性抗原和锌α2-糖蛋白显著性增加,有可能作为运动性免疫机能降低的尿液生物标志物,用来监控运动机体的免疫功能状态。当然,这些研究与尿蛋白研究一样没有区分正则运动与失调运动和成功应激与慢性应激,有待进一步深入。"
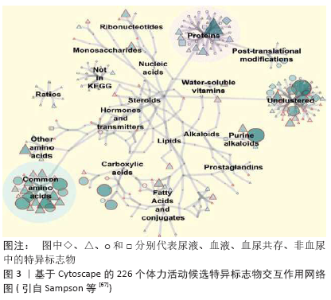
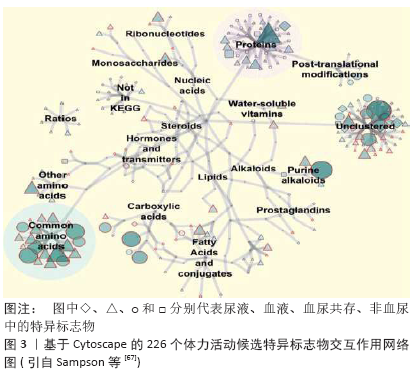
2.4 尿液蛋白质组学的应用领域 蛋白质组技术能够比较全面、综合和准确地分析运动对尿蛋白组的影响,突破了以往仅针对几个蛋白质进行研究的局限,为揭示机体适应运动应激的变化机制提供了新的视野和新的研究方向,但海量数据也为信息的提取提出了挑战。 2.4.1 作为生物标志物 生物标志物是评估和监测机体健康、训练状态和运动表现的有效指标[64-66]。正如表2所示,随着蛋白质组学技术的逐步改进,尿液中鉴定出来的蛋白质的数目越来越多。目前,人体中反映体力活动的候选特异标志物约226个,从基于Cytoscape的生物分子交互作用网络(图3)[67]可见,尿液中体力活动特异标志物主要以蛋白质、常见氨基酸、嘌呤生物碱、羧酸及非群集形式存在。 面临如此多的所谓生物标志物,尿蛋白组学必须解决信息提取的问题。功能内稳态概念的提出是一个很好的解决方案[8-11]。正则运动的功适能表现为运动成绩及其CV,运动成绩越高,CV越小,功适能越高。组学研究应该选择两组功适能不同的处于正则运动状态者,每人取样3次。正则运动的生物标志物应该至少满足2个条件:第一个是抗干扰特征,可以计算3次取样的CV,选取CV较小的尿液组分来体现正则运动的抗干扰特征;第二个是功适能特征,可以计算2组运动者的尿液组分的统计学差异,正则运动的生物标志物应该在2组之间有显著性差异。李江华等[68]首次成功地将SpSH与晨尿核磁共振的代谢组学研究结合起来,对1个月后准备参加2006年多哈亚运会的中国短距离游泳男运动员(18人),收集集训期的晨尿(每周1次,连续3次),每一个尿样的NMR可以获得409个数据。利用主成分(principal component,PC)分析可以将数据压缩到26个主成分。运动者即将参加比赛,处于正则运动状态,可以表征运动成绩的主成分应该有抗干扰能力。每个运动者的每个主成分有3个值,可以计算CV。要求表征运动成绩的主成分的CV应该比较小,可以将主成分的个数压缩到7个。该组运动者比赛后可以分为进入决赛/前3名和没有进入决赛/没有进入前3名两组,要求表征运动成绩的主成分应该在两组之间有显著性差异,最后满足要求的主成分只有2个,即PC3和PC25,这两个主成分不但可以将两组运动者很好分开,而且可以提取表征运动成绩的生物标志物,即甲基烟碱和氨基酸/蛋白质。研究发现,甲基烟碱越高,氨基酸/蛋白质越低,运动成绩越好。值得指出的是,进入决赛的运动员的PC3的CV显著低于没有进入决赛的运动员。 只要将SpSH与尿液蛋白质组学结合起来,研究处于正则运动的水平不同的两组运动者,就可以用类似的办法揭示正则运动的尿蛋白生物标志物。失调运动或慢性应激对各种干扰都非常敏感,但可以利用正则运动的尿蛋白生物标志物来研究其动力学演变。 2.4.2 作为运动营养补剂的筛选 使用运动营养补剂的运动训练可以分为正则运动、成功应激、失调运动和慢性应激四类。利用正则运动的尿蛋白生物标志物可以筛选相关的运动营养补剂。失调运动/慢性应激的运动营养补剂应该促进SpSH/成功应激的建立,只有一直跟踪到SpSH/成功应激建立之后的研究才对运动训练具有应用价值。尿蛋白组学的研究至少应该选择运动营养补剂补充前、补充中和SpSH/慢性应激建立后3个点。因为抗干扰特征,大部分运动营养补剂对正则运动/成功应激是没有意义的。正则运动的运动营养补剂应该可以提升功适能,这就具有兴奋剂的嫌疑。成功应激的运动营养补剂应该加快完成应激所需要的时间,这同样是一件非常困难的事情。 2.4.3 作为新兴的反兴奋剂检测利器 随着血液兴奋剂使用技术的发展,采用直接检测血液成分用于反兴奋剂的方法存在一定的局限性。近日,由世界反兴奋剂机构(world anti-doping agency,WADA)资助的研究项目,通过检测尿液中增塑剂增加的代谢水平,用于检测血液回输的间接替代性策略被提出,因为血液在血液袋内存储期间致增塑剂泄露于血液内而引起其水平增加。另外,运用蛋白质组学技术检测自体血液红细胞膜蛋白质的变化,筛选特异的生物标志物,也可作为一种新兴的血液反兴奋剂检测手段[69]。不同于人体兴奋剂问题,在赛马等动物竞赛运动中,兽药的滥用与反兴奋剂问题同样面临检测方法的挑战,应用蛋白质组学和代谢组学等新颖的生物分析技术,检测兽药滥用而出现的特异性生物标志物,用于反兴奋剂检测值得重视[70]。可见,蛋白质组学技术为体育运动中进行兴奋剂检测提供了可能,尿液蛋白质图谱可作为运动员生物护照(athlete biological passport, ABP)的补充用于反兴奋剂检测。 正如前所述,用尿蛋白组学方法筛选兴奋剂的生物标志物,必须选择处于正则运动的研究对象。只有确实可以提高正则运动功适能的方法才能称得上兴奋剂。选择功适能相当的研究对象,随机分为2组,一组服用兴奋剂,另一组作为对照组,当兴奋剂组功适能获得稳定提升后,每个运动者取样3次,重复前述建议的研究,就可以获得兴奋剂的尿蛋白生物标志物。 2.4.4 比较尿蛋白组和血蛋白组 尿液是血液经肾脏滤过、重吸收和分泌的最终代谢产物,因此利用蛋白组技术及黑箱理论,对比代表肾脏输入和输出的血蛋白组和尿蛋白组间的图谱差异,对研究肾脏在运动过程中的生理功能和运动性蛋白尿的生成机制具有重要意义[71]。PECHLIVANIS等[72]应用1H NMR技术分别对2种不同时间间隔运动前后的尿液和血液进行代谢图谱研究,发现二者之间存在一定的重叠代谢产物。另外,将来有可能通过比较蛋白在人体血、尿中丰度的比例,来判断身体机能的改变。 2.4.5 建立数据共享平台 目前,关于正常人及医学领域的尿蛋白组学研究数据已经相当丰富,但是,由于各个实验室条件和精力有限,单个实验室研究的对象和运动项目等受限;同时,不同研究者、不同技术与方法、不同个体、不同性别和不同年龄等之间的结果存在差异[23];另外,运动者从事的运动性质(正则/失调运动和成功/慢性应激等)不同,尿样采集、储存和处理方法不同,对实验结果也有影响。因而,尿蛋白组学研究亟需建立一个标准化的研究规范和操作流程,将所有的尿蛋白组研发成果整合为一个整体,建立尿蛋白组数据共享平台,实现不同研究数据间的比较,减少不必要的重复性研究,保障结果精确、可靠,增加研究结果的可信度,推动尿生物标志物在体育科研中的应用进展。 "
| [1] NICHOLAS SB. Use of urinary proteomics in diagnosis and monitoring of diabetic kidney disease. Lancet Diabetes Endocrinol.2020; 8(4):261-262. [2] GAO Y. Urine-an untapped goldmine for biomarker discovery?. Sci China Life Sci. 2013;56(12):1145-1146. [3] JING J, GAO Y. Urine biomarkers in the early stages of diseases: current status and perspective. Discov Med. 2018;25(136):57-65. [4] WU J, GAO Y. Physiological conditions can be reflected in human urine proteome and metabolome. Expert Rev Proteomics. 2015;12(6):623-636. [5] QIN W, DU Z, GAO Y. Collection and preservation of urinary proteins, using a fluff pulp diaper. Sci China Life Sci. 2018;61(6):671-674. [6] JIA L, LIU X, LIU L, et al. Urimem, a membrane that can store urinary proteins simply and economically, makes the large-scale storage of clinical samples possible. Sci China Life Sci. 2014;57(3): 336-339. [7] DASKALAKI E, BLACKBURN G, KALNA G, et al. A study of the effects of exercise on the urinary metabolome using normalisation to individual metabolic output. Metabolites. 2015;5(1):119-139. [8] LIU C, ZHENG T, DUAN R, et al. On the Biomarkers of Alzheimer’s Disease. Adv Exp Med Biol. 2020;1232:409-414. [9] LIU C, LIU G, HU S, et al. Quantitative Biology of Exercise-Induced Signal Transduction Pathways. Adv Exp Med Biol. 2017;977:419-424. [10] LIU C, TANG XM, DUAN R, et al. The Mitochondrial Na+/Ca2+ Exchanger is Necessary but Not Sufficient for Ca2+ Homeostasis and Viability. Adv Exp Med Biol. 2018;1072:281-285. [11] SUN SS, HU CL, PAN JH, et al. Trait Mindfulness Is Associated With the Self-Similarity of Heart Rate Variability. Front Psychol. 2019;10:314. [12] WASINGER VC, SMITH HI, WILLIAMS KL, et al. Progress with Gene-product Mapping of the Mollicutes:Mycoplasma Genitalium. Electrophoresis. 1995;16(7):1090-1094. [13] REUSZ GS. Urinary proteomics: fancy gadgetry or a clinically useful diagnostic instrument? The end-user’s perspective. Transpl Int. 2019;32(1):25-27. [14] MARSHALL T, WILLIAMS K. Two dimensional electrophoresis of human urinary proteins following concentration by dye precipitation. Electrophoresis. 1996;17(7):1265-1272. [15] JONATHAN B, PETER T. Urine proteomics: the present and future of measuring urinary protein components in disease. CMAJ. 2007;177(4): 361-368. [16] MOHAN SV, NAYAKANTI DS, SATHE G, et al. Targeted Proteomics as a Tool for Quantifying Urine-Based Biomarkers. Methods Mol Biol. 2020;2051:277-295. [17] JIANQIANG WU, WEIWEI QIN, LI PAN, et al. Regional Differences of the Urinary Proteomes in Healthy Chinese Individuals. Chin Med Sci J. 2019;34(3):157-167. [18] ZHAO M, LI M, YANG Y, et al. A comprehensive analysis and annotation of human normal urinary proteome. Sci Rep. 2017;7(1):3024. [19] BRUSCHI M, SANTUCCI L, RAVERA S, et al. Human urinary exosome proteome unveils its aerobic respiratory ability. J Proteomics. 2016; 136:25-34. [20] GUO Z, ZHANG Y, ZOU L, et al. A Proteomic Analysis of Individual and Gender Variations in Normal Human Urine and Cerebrospinal Fluid Using iTRAQ Quantification. PLoS One. 2015;10(7):e0133270. [21] FROEHLICH J W, VAEZZADEH A R, KIRCHNER M, et al. An in-depth comparison of the male pediatric and adult urinary proteomes. Biochim Biophys Acta. 2014;1844(5):1044-1050. [22] WANG Z, HILL S, LUTHER JM, et al. Proteomic analysis of urine exosomes by multidimensional protein identification technology (MudPIT). Proteomics. 2012;12(2):329-338. [23] MARIMUTHU A, O’MEALLY RN, CHAERKADY R, et al. A Comprehensive Map of the Human Urinary Proteome. J Proteome Res. 2011;10(6): 2734-2743. [24] HIEMSTRA TF, CHARLES PD, HESTER SS, et al. Uromodulin exclusion list improves urinary exosomal protein identification. J Biomol Tech. 2011; 22(4):136-145. [25] LI QR, FAN KX, LI RX, et al. A comprehensive and non-prefractionation on the protein level approach for the human urinary proteome: touching phosphorylation in urine. Rapid Commun Mass Spectrom. 2010;24(6):823-832. [26] ALEX K, FLAVIO M, KEVIN D, et al. Urine proteomics for profiling of human disease using high accuracy mass spectrometry. Proteomics Clin Appl. 2009;3(9):1052-1061. [27] GONZALES P A, PISITKUN T, HOFFERT JD, et al. Large-scale proteomics and phosphoproteomics of urinary exosomes. J Am Soc Nephrol. 2009;20(2):363-379. [28] KIM KH, MOON MH. High speed two-dimensional protein separation without gel by isoelectric focusing-asymmetrical flow field flow fractionation: application to urinary proteome. J Proteome Res. 2009;8(9):4272-4278. [29] LEE RS, MONIGATTI F, BRISCOE AC, et al. Optimizing sample handling for urinary proteomics. J Proteome Res. 2008;7(9):4022-4030. [30] ADACHI J, KUMAR C, ZHANG Y, et al. The human urinary proteome contains more than 1500 proteins, including a large proportion of membrane proteins. Genome Biol. 2006;7(9):R80. [31] KHAN A, PACKER NH. Simple urinary sample preparation forproteomic analysis. J Proteome Res. 2006;5(10):2824-2838. [32] WANG LJ, LI FX, SUN W, et al. Concanavalin A-captured Glycoproteins in Healthy Human Urine. Mol Cell Proteomics. 2006;5(3):560-562. [33] ZEREFOS PG, VOUGAS K, DIMITRAKI P, et al. Characterization of the human urine proteome by preparative electrophoresis in combination with 2-DE. Proteomics. 2006;6(15):4346-4355. [34] CASTAGNA A, CECCONI D, SENNESL I, et al. Exploring the hidden human urinary proteome via ligand library beads. J Proteome Res. 2005;4(6): 1917-1930. [35] SUN W, LI F, WU S, et al. Human urine proteome analysis by three separation approaches. Proteomics. 2005;5(18):4994-5001. [36] SMITH G, BARRATT D, ROWLINSON R, et al. Development of a high-throughput method for preparing human urine for two-dimensional electrophoresis. Proteomics. 2005;5(9):2315-2318. [37] PISITKUN T, SHEN RF, KNEPPER MA. Identification and proteomic profiling of exosomes in human urine. Proc Natl Acad Sci USA. 2004; 101(36):13368-13373. [38] PIEPER R, GATLIN CL, MCGRATH AM, et al. Characterization of the human urinary proteome: a method for high-resolution display of urinary proteins on two-dimensional electrophoresis gels with a yield of nearly 1400 distinct protein spots. Proteomics. 2004;4(4): 1159-1174. [39] OH J, PYO JH, JO EH, et al. Establishment of a nearstandard two-dimensional human urine proteomic map. Proteomics. 2004;4(11): 3485-3497. [40] PANG JX, GINANNI N, DONGRE AR, et al. Biomarker discovery in urine by proteomics. J Proteome Res. 2002;1(2):161-169. [41] THONGBONKERD V, MCLEISH KR, ARTHUR JM, et al. Proteomic analysis of normal human urinary proteins isolated by acetone precipitation or ultracentrifugation. Kidney Int. 2002;62(4):1461-1469. [42] SPAHR CS, DAVIS MT, MCGINLEY MD, et al. Towards defining the urinary proteome using liquid chromatography-tandem mass spectrometry.I.Profiling an unfractionated tryptic digest. Proteomics. 2001;1(1): 93-107. [43] HEINE G, RAIDA M, FOLRSSMANN WG. Mapping of peplide and protein fragments in human urine using liquid chromatography 2-mass spectrometry. J Chromatogr A. 1997;776(1):117-124. [44] POORMANS JR, ENGELS MF, SELLIER M, et al. Urine protein excretion and swimming events. Med Sci Sports Exerc. 1991;23(7):831-835. [45] POORTMANS J R, LABILLOY D. The influence of work intensity on postexercise proteinuria. Eur J Appl Physiol Occup Physiol. 1988;57: 260-263. [46] 冯美云, 冯炜权, 王民享. 足球训练和比赛时尿蛋白总量和β2-微球蛋白的变化[J].体育科学, 1988,8(2):52-55. [47] 冯炜权, 冯美云, 张爱芳, 等. 应用尿蛋白评定运动员身体机能状态[J]. 北京体育学院学报,1992,15(1):1-12. [48] YASUDA N, RUBY BC. Assessment of urinary protein composition in response to consecutive days of wildland firefighting. Int J Occup Saf Ergon. 2019;25(1):27-34. [49] LI X, GAO Y. Potential urinary aging markers of 20-month-old rats. PeerJ. 2016;4:e2058. [50] GAUDREAU P, MORAIS JA, SHATENSTEIN B, et al. Nutrition as a determinant of successful aging: description of the Quebec longitudinal study Nuage and results from cross-sectional pilot studies. Rejuvenation Res. 2007;10(3):377-386. [51] VALEEVA OA, PASTUSHKOV LK, PAKHARUKOVA NA, et al. Variability of urine proteome of healthy persons during 105-daily isolation. Fiziol cheloveka. 2011;37(3):98-102. [52] LARINA IM, KOLCHANOV NA, DOBROKHOTOV IV, et al. Reconstruction of associative protein networks connected with processes of sodium exchange’ regulation and sodium deposition in healthy volunteers by urine proteome analysis. Fiziol Cheloveka. 2012;38(3):107-115. [53] PARKER TJ, SAMPSON DL, BROSZCZAK D, et al. A fragment of the LG3 peptide of endorepellin is present in the urine of physically active mining workers: a potential marker of physical activity. PloS One. 2012;7(3):e33714. [54] FRAGKAKI AG, PETROPOULOU G, ATHANASIADOU I, et al. Determination of anabolic androgenic steroids as imidazole carbamate derivatives in human urine using liquid chromatography-tandem mass spectrometry. J Sep Sci. 2020;43(11):2154-2161. [55] KOHLER M, FRANZ S, REGENITER A, et al. Comparison of the urinary protein patterns of athletes by 2D-gel electrophoresis and mass spectrometry-a pilot study. Drug Test Anal. 2009;1(8):382-386. [56] KOHLER M, WALPURGIS K, THOMAS A, et al. Effects of endurance exercise on the urinary proteome analyzed by 2-D PAGE and Orbitrap MS. Proteomics Clin. 2010;4:568-576. [57] DASKALAKI E, BLACKBURN G, KALNA G, et al. A study of the effects of exercise on the urinary metabolome using normalisation to individual metabolic output. Metabolites. 2015;5(1):119-139. [58] 林文弢, 蔺海旗, 翁锡全. 蛋白质组学及其技术在运动人体科学中的研究[J]. 西安体育学院学报,2012,29(1):78-83. [59] 林文弢, 徐国琴, 翁锡全. 尿液蛋白质组学研究现状及其在体育科学中的应用[J]. 广州体育学院学报,2010,30(6):72-76. [60] 林文弢,蔺海旗,杨玲,等.男子30 km跑后尿液蛋白质组差异性表达的研究[J]. 天津体育学院学报,2020,35(1):7-12. [61] 蔺海旗,林文弢,翁锡全,等.男子30km跑对肾素-血管紧张素-醛固酮系统的影响[J]. 广州体育学院学报,2015,35(2):94-97. [62] XU G, LIN W, MCAINCH AJ, et al. Identification of Urinary Biomarkers for Exercise-Induced Immunosuppression by iTRAQ Proteomics. Biomed Res Int. 2020;2020:3030793. [63] 徐国琴,翁锡全,孟艳,等.运动性免疫机能低下发生过程中尿蛋白质组分变化特点研究[J]. 中国运动医学杂志,2018,37(11): 921-926. [64] REICHEL T, BOßLAU TK, PALMOWSKI J, et al. Reliability and suitability of physiological exercise response and recovery markers . Sci Rep. 2020;10(1):11924. [65] LEE EC, FRAGALA MS, KAVOURAS SA, et al. Biomarkers in Sports and Exercise: Tracking Health, Performance, and Recovery in Athletes. J Strength Cond Res. 2017;31(10):2920-2937. [66] 井健, 高友鹤. 尿液作为新型生物标志物来源的探索[J].生物化学与生物物理进展,2016,43(11):1019-1028. [67] Sampson DL, Broadbent JA, Parker AW, et al. Urinary biomarkers of physical activity: candidates and clinical utility. Expert Rev Proteomics. 2014;11(1):91-106. [68] 李江华, 刘承宜, 徐晓阳, 等. 2006年多哈亚运会短距离游泳男运动员代谢组学研究[J].体育科学,2008,28(2):42-46. [69] ATKINSON TS, KAHN MJ. Blood doping: Then and now. A narrative review of the history, science and efficacy of blood doping in elite sport. Blood Rev. 2020;39:100632. [70] WONG JKY, KWOK WH, CHAN GHM, et al. Doping control study of AICAR in post-race urine and plasma samples from horses. Drug Test Anal. 2017;9(9):1363-1371. [71] 刘永涛, 赵敏迪, 潘宣圳, 等. 健康人的尿液中为什么会有蛋白质?[J].中国科学:生命科学,2020,50(3):338-348. [72] PECHLIVANIS A, PAPAIOANNOU KG, TSALIS G, et al. Monitoring the Response of the Human Urinary Metabolome to Brief Maximal Exercise by a Combination of RP-UPLC-MS and (1)H NMR Spectroscopy. J Proteome Res. 2015;14(11):4610-4622. |
| [1] | Xu Bin, Yang Xiushu, Liu Xuan, Wang Zhenxing. Changes of intestinal epithelial cells and their apoptotic factors Caspase-3, Bax and Bcl-2 under urinary environment [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(20): 3173-3177. |
| [2] | Hu Wandong, He Jialin, Zhang Longsheng, Liao Wenbo. Differential proteomics study of patients with sternal ossification of the ligamentum flavum [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(17): 2625-2629. |
| [3] | Li Shengqiang, Xie Bingying, Chen Juan, Xie Lihua, Huang Jingwen, Ge Jirong. Interaction proteomics of long noncoding RNA uc431+ gene in postmenopausal osteoporosis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(11): 1641-1646. |
| [4] |
Zeng Zhaomu, Wen Xichao, Zhang Yuhao, Geng Lianting, Shen Yang, Zheng Kebin.
Role and application of exosomes-mediated miRNAs in the treatment of glioma [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(25): 4073-4080. |
| [5] | Zhu Haizhou, Zhao Zhankui, Wang Xinzhe, Liu Deqian, Yu Honglian. Urine-derived stem cells differentiate into urothelial cells and smooth muscle cells in vitro [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(19): 3010-3016. |
| [6] | Zhang Jiamo, Zhang Xuan, Luo Huaming, Zhao Tao, Chen Jiangchuan, Liu Juan, Wang Ke. Pathogenic distribution and drug resistance of bacterial biofilm on ureteral stent [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(16): 2556-2560. |
| [7] | Qin Danying, Zhang Yuheng, Li Xueyong, Yang Wenxian. Proteomics analysis of exosomes from adipose-derived stem cells in skin damage repair [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(13): 2011-2019. |
| [8] | Deng Ming, Xie Ping, Wu Fei, Ma Yonggang, Zhou Yan, Chen Qing, Liu Shiqing, Ming Jianghua. In vitro differentiation potential of human urine-derived stem cells into neuron-like cells and their protective effects against spinal cord injury in rats [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(1): 93-98. |
| [9] | Liu Sijie, E Xiaoqiang, Pan Qi, Yao Guijun. Standardized treatment of infection around the prosthesis after joint replacement [J]. Chinese Journal of Tissue Engineering Research, 2019, 23(32): 5195-5202. |
| [10] | Fan Siqi1, Zeng Ping2, Zhou Yi3, Qin Gang2, Liao Xiaobo2, He Kaiyi2. Screening differentially expressed proteins in the serum of patients with systemic lupus erythematosus combined with osteonecrosis of the femoral head by iTRAQ technology [J]. Chinese Journal of Tissue Engineering Research, 2019, 23(3): 476-481. |
| [11] | Ding Huan1, Chen Lihong1, Chen Yujing1, Yue Rongzhao1, Yang Min1, Xu Guihua2 . Efficacy of different scraping protocols in the intervention of rat models of lumbar disc herniation based on urine metabolomics [J]. Chinese Journal of Tissue Engineering Research, 2019, 23(23): 3654-3659. |
| [12] | Zhang Juanjuan, Li Ruiwei, He Jigang, Sa Yalian. Research progress in the roles of exosomal miRNA in leukemia [J]. Chinese Journal of Tissue Engineering Research, 2019, 23(17): 2776-2781. |
| [13] | Hamulati Tusong, Zhao Chang-hui, Maimaitiaili Maituoheti, Ma Jun, Wang Feng, Mulati Rexiati. Growth and proliferation of human urine derived stem cells in three kinds of culture media [J]. Chinese Journal of Tissue Engineering Research, 2018, 22(5): 723-728. |
| [14] | Sun He-yuan. Human urine-derived stem cells transplantation for treatment of myocardial infarction in rats [J]. Chinese Journal of Tissue Engineering Research, 2018, 22(33): 5303-5308. |
| [15] | Gui Yu-chang1, Xu Jian-wen2, Tai Zhi-hong1, Rao Yuan-sen1, Cao Yu-ju1, Yin Li-jun3. Non-surgical treatment of lumbar intervertebral disc protrusion without blood stasis: a serum proteomic analysis [J]. Chinese Journal of Tissue Engineering Research, 2018, 22(16): 2570-2576. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||