Chinese Journal of Tissue Engineering Research ›› 2020, Vol. 24 ›› Issue (25): 4073-4080.doi: 10.3969/j.issn.2095-4344.2088
Previous Articles Next Articles
Role and application of exosomes-mediated miRNAs in the treatment of glioma
Zeng Zhaomu1, Wen Xichao1, Zhang Yuhao1, Geng Lianting1, Shen Yang2, Zheng Kebin1
1Department of Neurosurgery, 2Central Laboratory, Affiliated Hospital of Hebei University, Baoding 071000, Hebei Province, China
-
Received:2019-09-26Revised:2019-09-28Accepted:2019-10-31Online:2020-09-08Published:2020-08-26 -
Contact:Zheng Kebin, MD, Chief physician, Department of Neurosurgery, Affiliated Hospital of Hebei University, Baoding 071000, Hebei Province, China -
About author:Zeng Zhaomu, Master candidate, Department of Neurosurgery, Affiliated Hospital of Hebei University, Baoding 071000, Hebei Province, China -
Supported by:the Natural Science Foundation Project of Hebei Province, No. H2016201238
CLC Number:
Cite this article
Zeng Zhaomu, Wen Xichao, Zhang Yuhao, Geng Lianting, Shen Yang, Zheng Kebin.
Role and application of exosomes-mediated miRNAs in the treatment of glioma [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(25): 4073-4080.
share this article
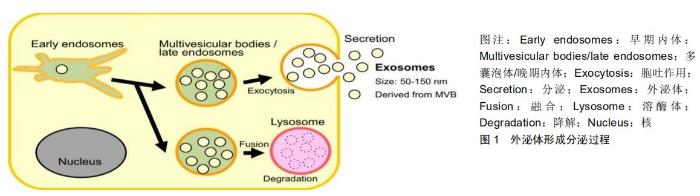
2 结果 Results 2.1 外泌体 外泌体是一种直径为30-90 nm的脂质双分子层小囊泡,电镜下呈杯状或茶托状[6]。与其他胞外囊泡不同的是,它的形成方式是通过细胞内多泡体中的小囊泡与细胞膜融合后释放至胞外实现的,见图1[7]。JOHNSTONE等于1983年首次在网织红细胞成熟过程中发现细胞会分泌出一种由转铁蛋白受体以及膜相关蛋白组成的膜性小体,随后将其命名为“外泌体”,但是当时该过程仅被认为是细胞消除废弃蛋白和分子的一种方式,外泌体作为细胞垃圾而被处理[8]。然而,随着外泌体提取和检测技术的不断发展,越来越多的研究证实肥大细胞、上皮细胞、神经元细胞等多种细胞均可释放外泌体[9],并且于多种体液中稳定存在,包括血液、尿液、脑脊液等,参与正常的生理过程以及疾病的发生和发展[9-10]。另外,外泌体作为连接细胞通讯的重要媒介,在国际上被广泛研究,得到越来越多科学研究者的青睐。 外泌体内成分丰富,富含多种蛋白质、核酸、脂质等[11]。根据ExoCarta数据库统计,目前已知外泌体中存在3 408种mRNAs、2 838种miRNAs、9 769种蛋白和 1 116种脂类,当外泌体接收到调控信号时,自身膜分子和靶细胞表面受体通过结合作用,将这些内容物递送至靶细胞,从而起到调控靶细胞的作用[12]。更为重要的一点,这些内容物的种类及含量与起源细胞有着密切联系,不同细胞来源甚至相同细胞来源的外泌体,其内所含成分也会随着机体生理状态的不同而发生变化。在胶质瘤的发生发展过程中,肿瘤细胞可通过外泌体的传递途径将miRNAs递送至其他靶细胞中,一起参与细胞间信息交流,使miRNA与靶向mRNA3'非翻译区(UTR)发生碱基配对,直接降解mRNA分子或阻止mRNA翻译,从而起到靶向调控肿瘤发生发展和诊治预后的作用[13]。此外,外泌体还具有独特的纳米直径,可以自由通过血脑屏障及血脑脊液屏障,更使得其近年来成为胶质瘤诊治的研究“宠儿”。 "
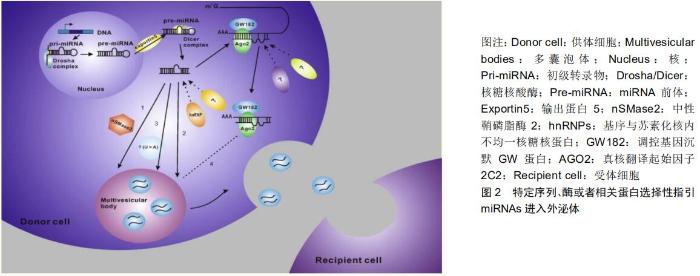
2.2 外泌体miRNAs及其分选机制 外泌体中包含以lncRNAs、circRNAs和miRNAs等非编码RNA为主的多种RNA分子,其中miRNAs的含量最高、种类最多[11],并且在基因表达调控过程中起着重要作用,因此受到最多的关注。ExoCarta数据库的相关检索结果显示,目前外泌体中已经发现的miRNAs达到2 838个,这其中与胶质瘤关系较密切的约有12个。miRNAs是一类长度约为22 nt的非编码小RNA,其之所以可以稳定存在于体液中,是因为它们可以进入外泌体,有的甚至还能被装载在高密度脂蛋白上,而其中脂质分子的存在保护它们不被RNA酶降解[14]。值得注意的是,GOLDIE等[15]在针对miRNAs表达的研究中发现外泌体内miRNAs的含量显著高于其来源细胞;类似的结果还有GUDURIC- FUCHS等[16]通过对比分析多种细胞系及其相应衍生的外泌体miRNAs的表达水平差异,发现miRNAs(如miR-150、miR-142、miR-451)可优先于其他RNA分子进入外泌体,这便是外泌体中miRNAs的表达量高于其来源细胞的重要原因之一。此外,还有研究表明机体在不同的生理状态下细胞分泌的外泌体miRNAs表达水平也各不相同。与恶性胶质瘤患者相比,健康人血浆外泌体miR-21的表达水平显著降低[17];同样在非小细胞肺癌患者血浆外泌体中miRNAs(如let-7f、miR-30-3p、miR-20b)的表达水平比健康人更低[18]。以上研究皆表明,miRNAs中存在的特定序列、酶或者相关蛋白可能会选择性地指引它们进入外泌体,而非随机装载,但其具体的装载机制尚不完全清楚,就目前已经取得的研究结论而言,可能与以下几种依赖途径有关,见图2[18]。 2.2.1 中性鞘磷脂酶2(neutral sphyngomyelinase 2,nSMase2)依赖性途径 KOSAKA等[19]证明外泌体miRNAs的分泌受神经酰胺依赖性途径调控,并且在其分泌过程中无需内吞体分选转运复合体(endosomal sorting complex required for transport,ESCRT)系统的参与。而神经酰胺生物合成又被限速酶中性鞘磷脂酶2所调节,当抑制中性鞘磷脂酶2的表达时,外泌体miRNAs的分泌量也会随之减少;反之亦然。 2.2.2 miRNAs基序与苏素化核内不均一核糖核蛋白(heterogeneous nuclear ribonucleoprotein,hnRNPs)依赖性途径 VILLARROYA-BELTRI等[20]发现,外泌体miRNAs上存在过度表达的特定短序列基序GGAG(EXOmotif GGAG),其主要分布在miRNAs序列的3'端;hnRNPA2B1是一种RNA结合蛋白,可以在外泌体中被小泛素样修饰物(small ubiquitin-like modifier,SUMO)化,并与EXOmotif GGAG发生特异性结合,最终使miRNAs特异性分选入外泌体中。当特定短序列发生突变或改变SUMO化修饰水平时,外泌体中miRNAs的含量将会因此受到影响。针对hnRNP家族中的其他蛋白,BALAGUER等[21]发现hnRNPC1参与子宫内膜外泌体中miRNA-30 d的分选;而SANTANGELO团队[22]也证明了hnRNPQ是肝细胞外泌体miRNAs分选机制的重要组成部分。hnRNPA1参与外泌体miRNA的分选也可能是通过类似的途径特异性结合miR-198来实现。 2.2.3 miRNAs序列3'末端依赖性途径 KOPPERS- LALIC团队[23]在研究中对人B细胞及其分泌的外泌体进行了miRNAs表达谱测序,并通过后续实验分析发现miRNAs末端核苷酸的类型是导致其在B细胞和外泌体中非随机性分布的主要原因。3'末端腺苷酸化的miRNAs在B细胞中相对富集,而3'末端尿苷酸化同种型miRNAs则在外泌体中表达过多。通过这种分选结果可以大胆提出假设,miRNAs序列的3'末端含有关键的外泌体miRNAs分选信号。 2.2.4 Y-box结合蛋白1(Y-box binding protein-1,YBX-1)依赖性途径 SHURTLEFF等[24]在所建立的无细胞反应体系中发现Y-box结合蛋白1作为一种RNA结合蛋白,是miR-223分选进入外泌体过程中的关键分子。即使无细胞反应,它也可以与RNA分子互相结合,使miR-223选择性地进入外泌体。通过质谱数据显示,未能检测到AGO2(Argonaute2,AGO2)蛋白,证明其并不直接参与miR-223分选进入外泌体的过程。 2.2.5 AGO2蛋白(AGO2)依赖性途径 众所周知,成熟的miRNAs可以通过与装配蛋白的结合作用,进而形成miRNA诱导的沉默复合体(miRNA-induced silencing complex,miRICS),而AGO2蛋白作为其关键组分之一,在miRNA 5'末端的U或A碱基处发挥作用,融合相关mRNAs和miRNAs,最终表现为mRNA的直接降解或mRNAs分子的翻译阻断。此外,已经有研究证明外泌体miRNA分选与AGO2蛋白有着密不可分的联系。GUDURIC-FUCHS等[16]发现敲除小鼠骨髓中AGO2基因表达时,外泌体中miR-451、miR-150及miR-486等相关miRNAs的表达量发生下降,并且本应优先进入外泌体的miRNAs类型也出现减少。在MCKENZIE等[25]研究中也证实了类似的发现,突变的Kras基因可以促进AGO2蛋白的磷酸化,并抑制AGO2蛋白定位于多囊泡内体及减少其在外泌体中的分泌,进而控制外泌体中3种候选miRNAs(let-7a、miR-100、miR-320a)的水平。以上所有的研究结果均表明AGO2蛋白是miRNAs分选到外泌体中的潜在主要参与者。 2.2.6 泛素连接酶E3(MEX3C)依赖性途径 LU等[26]通过研究发现RNA可结合泛素E3连接酶(E3 Ubiquitin Ligases,MEX3C)的3种变体(MEX3C-1、MEX3C-2、MEX3C-3)与转录因子激活蛋白2(transcription factor activat or protein-2,TFAP-2)复合物,在内溶酶体区室发生网格蛋白所介导的内吞过程进而完成外泌体miR-451a的分选。当敲低MEX3C或TFAP-2表达量时,外泌体中miR-451a表达量也明显降低。此外,LU还进一步证明了外泌体miR-451a的分选是神经酰胺依赖性而非ESCRT依赖性。 2.3 外泌体miRNAs在胶质瘤中的作用 胶质瘤作为一种实体肿瘤,肿瘤细胞可与细胞外基质、周围血管及免疫细胞等共同构成其自身发展的肿瘤微环境,并且在这个微环境中各组分彼此之间紧密相连、相互作用。miRNAs作为机体最为重要的一类基因调节因子,研究发现单个miRNA可以调节多个靶向mRNAs;同样,单个靶向mRNA也能被多个miRNAs所调节[27]。正是通过这种调节机制,当肿瘤发生时选择性富集的miRNAs可由外泌体释放,激活自身信号通路,将信息传递至靶细胞,影响胶质瘤的微环境,进而改变胶质瘤的生物学特性。因此,外泌体miRNAs在胶质瘤的增殖、转移、耐药及免疫过程中均扮演着至关重要的角色。 2.3.1 外泌体miRNAs参与胶质瘤发生发展 许多研究人员发现,胶质瘤在生长过程中会释放外泌体,而这些外泌体可通过胞吞或脂膜融合等方式,将内容物miRNAs递送至周围正常细胞,进而破坏正常细胞的稳态,在生物学行为上表现出肿瘤特性,同时还会促进胶质瘤细胞的恶性增殖及侵袭性生长。通过qPCR技术检测发现,相比于正常脑组织来源的外泌体,胶质瘤来源外泌体中miR-222、miR-9、miR-26a的表达量显著提高,并且共同表现在细胞周期相关蛋白的表达或活性改 变[28]。另外,许多信号传导通路的激活也刺激着肿瘤的生长。有研究报道,恶性胶质母细胞瘤分泌的外泌体中miR-1246表达量增多,其可作用于细胞黏附分子1 (CADM1)基因mRNA的3'非翻译端,阻断CADM1基因的mRNA翻译,进而促使胶质瘤细胞的增殖与迁移能力增强[29]。同样,FIGUEROA等[30]新发现了一种胶质母细胞瘤基质成分-胶质瘤相关人类间充质干细胞(GA-hMSCs),miR-1587在其衍生外泌体中高度富集,并可促进胶质瘤干细胞样细胞的增殖,加强胶质瘤干细胞样细胞的致瘤性。反之,在胶质瘤来源外泌体中同时还存在着抑制胶质瘤生长的miRNAs。研究证明,SAKR等[31]将miR-150-5p或miR-133a模拟物转染到神经胶质瘤细胞来源外泌体中,使得细胞中的膜型1基质金属蛋白酶(MT1-MMP)表达被抑制,进而诱导胶质瘤细胞发生凋亡。LEI等[32]先将间充质干细胞外泌体中过表达miR-199a,而后与神经胶质瘤细胞进行孵育,发现间充质干细胞衍生的外泌体miR-199a可通过降低Arf GTP酶激活蛋白2(AGAP2)的表达来抑制神经胶质瘤的生长。上述研究显示,外泌体miRNAs与脑胶质瘤的增殖及凋亡存在着密切关系,不仅为深入了解胶质瘤发生发展的相关机制提供了新的视角,同时还为胶质瘤的基因治疗提供了新的靶点。 2.3.2 外泌体miRNAs参与胶质瘤侵袭转移 研究表明,胶质瘤侵袭转移能力的改变是一个由多种因素导致的复杂过程,在这个过程中肿瘤细胞本身和周围基质细胞均可以分泌外泌体,通过其内含有的miRNAs来改变发生转移的微环境,进而调控肿瘤细胞的转移。如胶质母细胞瘤患者血清中循环的外泌体miR-148a水平显著升高,并且外泌体递送的miR-148a可通过抑制靶基因CADM1的表达而激活STAT3信号通路,增强胶质瘤细胞的增殖和转移能力,提示外泌体miR-148a是胶质母细胞瘤的治疗靶标[33]。同样,THURINGER等[34]研究发现胶质母细胞瘤来源外泌体miR-5096存在独特的正向反馈,外泌体被释放到胞外仍可以不断刺激肿瘤细胞分泌含有miR-5096的外泌体及增加细胞运动性丝状伪足突起的数量。此外,研究还证明了K+通道与胶质母细胞瘤的相关性,通过后续实验发现外泌体miR-5096可通过异细胞间隙连接从胶质母细胞瘤细胞转移到星形胶质细胞,特异性抑制细胞中的内向整流性钾离子通道(Kir4.1)蛋白,进而提高胶质母细胞瘤细胞的侵袭能力。相反,SHARIF等[35]提取了脐带华氏胶来源间充质干细胞(WJ-MSCs),结果发现其衍生的外泌体具有将miR-124递送至胶质母细胞的能力,进而促使胶质母细胞瘤的生物学活性改变,减弱肿瘤细胞对替莫唑胺化疗药物的耐药性并抑制肿瘤细胞的侵袭和迁移;同时,他们还在荧光素酶报告实验中证明这个生物学改变过程还需要靶基因周期蛋白依赖性激酶6(CDK6)来参与完成。综上,肿瘤细胞的高度侵袭性和转移能力是恶性肿瘤的重要标志,分子生物学技术的快速发展已经为发现肿瘤进展关键分子的过程扫除了众多障碍,通过精准筛选差异表达的外泌体miRNAs或其相关蛋白,进一步探究其功能及作用机制,将在抑制胶质瘤细胞侵袭、转移方面具有积极的意义。 2.3.3 外泌体miRNAs参与胶质瘤放化疗抵抗 替莫唑胺作为目前针对胶质瘤的一线化疗药,化疗抵抗是导致治疗失败最主要的原因。近年来研究表明,外泌体可以通过介导miRNAs等物质调控信号通路,进而成为胶质瘤细胞化疗抵抗的机制之一。YANG等[36]建立了体外细胞模型,采用流式细胞技术检测不同细胞模型组替莫唑胺处理48 h后的凋亡率,发现有外泌体共孵育的细胞模型组凋亡能力最弱,从而推测胶质瘤细胞中的外泌体可能参与增强替莫唑胺化疗抵抗的作用机制。同样,YIN等[37]检测了胶质母细胞瘤患者血浆及组织样本,发现肿瘤患者体内的循环外泌体相较健康成人拥有更高表达水平的miR-1238。此外,进一步研究表明转移至受体细胞的外泌体miR-1238可以诱导替莫唑胺敏感细胞中miR-1238水平的上调,进而使受体细胞中靶基因窖蛋白(CAV1)表达水平显著下降,并通过EGFR-PI3K- Akt-mTOR途径的激活最终导致替莫唑胺敏感细胞获得抗药性。在放射治疗方面也有类似的研究,YUE等[38]发现低氧肿瘤微环境中胶质母细胞瘤衍生的外泌体miR-301a,可以在受体细胞中靶向抑制TCEAL7的表达,并且在此过程中TCEAL7还可以阻断β-catenin从细胞质到细胞核的转运,进而负向调控Wnt/β-catenin信号通路,促进胶质母瘤细胞放疗抵抗的形成。总的说来,新兴研究揭示了外泌体源性miRNAs可能参与了胶质瘤放化疗抵抗的分子机制,随着基因芯片和高通量测序技术的快速发展,未来是否可以找到调控胶质瘤细胞放化疗机制的关键外泌体miRNAs或其相关通路,通过相关抑制剂的合理使用或者阻断某关键分子通路进而实现胶质瘤细胞的放化疗增敏。 2.3.4 外泌体miRNAs参与胶质瘤免疫 近年来,越来越多的研究者意识到外泌体miRNAs在免疫系统中的重要性。在肿瘤恶变的过程中,可释放外泌体中携带肿瘤特异性的miRNAs至免疫细胞,进而减弱宿主细胞的免疫功能,为胶质瘤细胞发生免疫抑制和免疫逃逸创造条件。研究报道,肿瘤来源外泌体可将其内高度富集的miR-203递送至免疫细胞,最终促使免疫细胞凋亡,发生免疫逃逸以及肿瘤快速增长。众所周知,髓源性抑制细胞(MDSCs)在免疫抑制环境的形成和肿瘤免疫逃逸过程中承担着重要角色。GUO等[39]通过研究发现外泌体miR-29a和miR-92a可以刺激功能性髓源性抑制细胞的分化。在此过程中,miR-29a和miR-92a分别沉默HMG盒转录因子1(Hbp1)及靶基因cAMP依赖性蛋白激酶调节亚基1α(Prkar1a),两者共同激活髓源性抑制细胞的扩增和活化,进而增强免疫抑制。GUO等[40]也证明了胶质瘤衍生的外泌体miRNAs参与了髓源性抑制细胞的分化,并从体外和体内2个方面共同探索了其改变肿瘤免疫抑制环境的机制。在体外细胞实验中,他们首先对低氧微环境中胶质母细胞瘤分泌的外泌体进行了miRNAs测序分析,发现可能介导髓源性抑制细胞扩增和活化的miR-10a和miR-21。在后续实验中进一步证明miR-10a和miR-21在诱导髓源性抑制细胞扩增和抑制宿主细胞免疫应答的过程中,分别需要Rora/IκBα/NF-κB和PTEN/PI3K/AKT两条信号通路的参与。相关结论在体内动物模型实验中也得到相应验证,接种沉默转染miR-10a或miR-21胶质瘤细胞的小鼠比接种正常胶质瘤细胞的小鼠脾脏中所诱导的髓源性抑制细胞较少。在另一项研究中,QIAN等[41]发现缺氧诱导胶质瘤细胞分泌的外泌体miR-1246可以结合人端粒重复结合因子2相互作用蛋白(TERF2IP)基因mRNA的3'末端,抑制其表达,同时激活STAT3信号通路和抑制NF-κB信号通路,最终诱导M2巨噬细胞极化,促进免疫抑制肿瘤微环境的生成。综上这些研究报道,均为外泌体miRNAs在胶质瘤细胞发生免疫逃逸及免疫抑制中的作用提供了新的见解。 2.4 外泌体miRNAs在胶质瘤中的应用 在中国,大多数胶质瘤患者到医院就诊时已是中晚期,缺少及时有效的治疗方法;虽然治疗手段也在不断改进,但预后仍然令人沮丧。找到能够早期监测胶质瘤病变的高敏感性及高特异性生物标志物仍是目前胶质瘤临床亟需解决的关键科学问题。近年来,通过科研工作者们的大量研究证明肿瘤患者比健康人体液中有更多的循环外泌体,而这些外泌体中还存在着显著差异性表达的miRNAs,并且与其来源的肿瘤组织类似[5]。因此,外泌体介导的miRNAs具有作为胶质瘤诊断和预后生物标志物的潜在价值,甚至可以被开发用作基因治疗的新靶点,为胶质瘤的创新治疗书写新篇章。 2.4.1 外泌体miRNAs参与胶质瘤的诊断 胶质瘤死亡率极高的重要原因之一就是缺乏特异性的早期诊断工具,使得患者缺乏有效的早期诊断和治疗。目前,胶质瘤的主要诊断方法是MRI和组织病理活检,MRI检测特异性不高,且容易漏诊2.0-3.0 mm的早期病变[42];而病理活检作为创伤性检查,取样的过程不仅容易影响正常脑组织功能,而且无法反映病变组织的动态变化。最新研究发现,胶质瘤来源的外泌体miRNAs可以稳定存在于体液中,并存在差异性高表达,具有精准、高效、微创等优势,或许能够补齐目前无法发现早期病变、手术禁忌或活检结果不确定的短板,因此越来越多地被研发用于胶质瘤的早期诊断。众所周知,miR-21是最早被发现与胶质瘤诊断相关的生物标志物,SHI等[43]针对脑胶质瘤患者与脑外伤非肿瘤患者的脑脊液样本进行外泌体miR-21表达量检测,qPCR检测结果显示脑胶质瘤患者脑脊液中外泌体miR-21的表达量远远高于对照组的非肿瘤患者。SANTANGELO等[44]从血浆样本外泌体中也检测出类似结果,高级别胶质瘤患者血清外泌体中的miR-21、miR-222、miR-124-3p显著高于低级别胶质瘤和健康对照组。YANG等[36]通过实验研究证明外泌体中miR-221表达量不仅与替莫唑胺化疗抵抗有关还与胶质瘤WHO分级呈递增趋势,越是病理分级高的胶质瘤,其外泌体中miR-221的表达量就越高。综上所述,越来越多的研究证实了外泌体源性miRNAs与胶质瘤的特异性诊断、病理分级存在确切的相关性,加之外泌体广泛稳定地存在于人体体液(血液、脑脊液、精液、乳汁等)中的这一特性,未来通过对外泌体中miRNAs的基因检测,将为胶质瘤的早期诊断以及确诊后的病理分级提供又一新思路和有力证据。 2.4.2 外泌体miRNAs参与胶质瘤的治疗 目前临床上针对胶质瘤的治疗方案,即使采取多种高强度的治疗措施,患者5年生存率仍然很低。外泌体作为miRNAs的天然载体,是一种纳米级膜性囊泡,具有循环稳定性、生物透过性、低免疫原性、低毒性的特性,并且能自由穿过血脑屏障及血脑脊液屏障,躲避机体自身的免疫排斥。近年来,随着对外泌体miRNAs分子调控网络研究的不断深入,国内外研究已经证实外泌体运送特异性的miRNAs可以调控和改变胶质瘤细胞的生物学特性,有效抑制胶质瘤的恶性发展,以此达到治疗目的。 骨髓间充质干细胞一直是国内外研究学者关注的焦点,其可以用于携带抗胶质瘤miRNAs外泌体的包装、生产和治疗用途。LANG等[45]用miR-124a的慢病毒载体转染骨髓间充质干细胞,并从培养基上清液中分离得到外泌体,使其与胶质瘤干细胞一同孵育,最终发现胶质瘤干细胞的存活率和增殖性显著降低,进一步用体外分离出的外泌体miR-124a治疗携带颅内胶质瘤干细胞移植瘤的小鼠,发现治疗组的小鼠存活时间较长,并且存活小鼠的颅内没有发现肿瘤。这一过程主要表现为miR-124a的过表达导致脂质在细胞内积累,使得胶质瘤干细胞不能有效地代谢脂质而导致中毒。KIM等[46]也进行了类似研究,用miR-584 mimics瞬时转染骨髓间充质干细胞,从培养基中分离得到过表达的外泌体miR-584,将其与U87细胞一起进行孵育培养,体外评估发现恶性胶质母细胞瘤的凋亡率增高,增殖和迁移能力均降低;进一步进行体内动物研究发现,暴露于外泌体过表达miRNA-584条件下的U87移植瘤小鼠出现肿瘤抑制性生长的情况,并且该治疗对动物的体质量没有影响。基于以上2个研究,提出一种新的靶向癌症疗法,miRNAs转染的骨髓间充质干细胞所分泌的外泌体可作为抗癌载体,用于调控肿瘤进展。细胞治疗作为一种新兴、安全、有效的生物治疗技术,如今也是受到许多科研工作者的青睐。最近,有研究学者还提出了一种新的治疗策略,直接对外泌体进行修饰,进而使其抑制胶质瘤的发展。MONFARED教授团队[47]构建了包装miR-21-sponge的“工程外泌体”,将其与神经胶质瘤细胞系U87MG和C6共孵育,发现共培养后的胶质瘤细胞增殖性下降、凋亡率升高。为了证实该结果,他们还在胶质瘤大鼠模型上进行了验证,与未修饰的外泌体注射组相比,载有miR-21-sponge的外泌体注射组肿瘤体积显著减小。除此之外,FAREH等[48]尝试通过利用胶质瘤细胞具有分泌外泌体miRNAs的能力来研制新的细胞疗法。他们将可以分泌过表达miR-302-367外泌体的胶质瘤干细胞和患者衍生的胶质瘤干细胞联合移植到免疫缺陷小鼠的大脑中,结果表明过表达miR-302-367的胶质瘤干细胞可在体内促进旁分泌进而抑制邻近肿瘤细胞。这一策略特别有效,因为它不仅影响了肿瘤的发生,还对已经形成的肿瘤具有长期抑制作用。总体说来,选择性地针对与肿瘤进展相关的基因进行敲除或抑制,或是过表达培养相关可能的关键抑癌基因,这将为胶质瘤的靶向治疗领域带来新希望。 2.4.3 外泌体miRNAs参与胶质瘤的预后评估 外泌体miRNAs除了可用做胶质瘤诊断生物标志物外,还可用做肿瘤预后评估生物标志物。ZHOU等[49]通过搜索PubMed、Embase和Web of Science数据库近10年的相关文献进行了一项荟萃分析,发现在所有实体瘤患者中,预后不良者与22种外泌体miRNAs的上调相关,其中不乏有胶质瘤患者。SHI等[43]通过对组织、脑脊液和血浆来源外泌体中miR-21表达水平的检测,分析发现患者总体生存时间与外泌体miR-21表达水平呈负相关,同时SHI的研究团队还比较了复发胶质瘤的解剖位置、复发时间和复发干扰3个临床特征,进一步表明脑脊液来源外泌体miR-21表达水平与肿瘤的脊柱/脑室转移及复发有一定的解剖位置相关性。另一项研究中,LAN等[50]发现胶质瘤患者的血清外泌体miR-301a表达水平与健康对照组相比显著上调,并且外泌体miR-301a表达水平升高与病理分级增高和卡氏功能状态评分(KPS)降低相关。更为重要的是,他们还发现原发肿瘤手术切除后血清外泌体miR-301a表达水平显著降低,而在复发期间其表达又再次增加。在随后的Kaplan-Meier生存曲线评估中证明血浆外泌体miR-301a低表达水平患者的总生存期率明显高于高表达水平患者。微血管密度作为胶质母细胞瘤预后的重要相关性指标,早在胃癌Cox风险模型研究中就发现其是一个比肿瘤类型、分期、分级等更好的预后指标[51]。WANG等[52]在针对这一方面进行了相关研究,他们发现胶质瘤干细胞衍生的外泌体miR-26a过表达,可以通过抑制蛋白酪氨酸磷酸酶(PTEN)基因在体外促进人脑微血管内皮细胞的增殖和微血管的生成,并且这一过程在体内也可以发生。因此,鉴于外泌体的上述特性,采集患者体液的外泌体并进行相关miRNAs检测,结合相关生物信息学分析处理,在评估胶质瘤治疗效果、生存期甚至包括预测复发肿瘤发生部位等方面都具有着光明的应用前景。 "

|
[1] POLIVKA J JR, POLIVKA J, HOLUBEC L, et al. Advances in Experimental Targeted Therapy and Immunotherapy for Patients with Glioblastoma Multiforme. Anticancer Res. 2017;37(1):21-33.
[2] RICE T, LACHANCE DH, MOLINARO AM, et al. Understanding inherited genetic risk of adult glioma - a review. Neurooncol Pract. 2016;3(1):10-16.
[3] GIAMMALVA GR, IACOPINO DG, AZZARELLO G, et al. End-of-Life Care in High-Grade Glioma Patients. The Palliative and Supportive Perspective. Brain Sci. 2018;8(7): E125.
[4] BASU B, GHOSH MK. Extracellular Vesicles in Glioma: From Diagnosis to Therapy. Bioessays. 2019;41(7):e1800245.
[5] CARUSO BAVISOTTO C, GRAZIANO F, RAPPA F, et al. Exosomal Chaperones and miRNAs in Gliomagenesis: State-of-Art and Theranostics Perspectives. Int J Mol Sci. 2018;19(9): E2626.
[6] KALLURI R. The biology and function of exosomes in cancer. J Clin Invest. 2016;126(4):1208-1215.
[7] AGETA H, TSUCHIDA K. Post-translational modification and protein sorting to small extracellular vesicles including exosomes by ubiquitin and UBLs. Cell Mol Life Sci. 2019;76(24):4829-4848.
[8] MINETTI G, ACHILLI C, PEROTTI C, et al. Continuous Change in Membrane and Membrane-Skeleton Organization During Development From Proerythroblast to Senescent Red Blood Cell. Front Physiol. 2018;9:286.
[9] SUN B, PENG J, WANG S, et al. Applications of stem cell-derived exosomes in tissue engineering and neurological diseases. Rev Neurosci. 2018;29(5):531-546.
[10] JAYASEELAN VP. Emerging role of exosomes as promising diagnostic tool for cancer. Cancer Gene Ther. 2019 Sep 3. doi: 10.1038/s41417-019-0136-4. [Epub ahead of print]
[11] SHEEHAN C, D'SOUZA-SCHOREY C. Tumor-derived extracellular vesicles: molecular parcels that enable regulation of the immune response in cancer. J Cell Sci. 2019;132(20): jcs235085.
[12] INDIRA CHANDRAN V, WELINDER C, Gonçalves de Oliveira K, et al. Global extracellular vesicle proteomic signature defines U87-MG glioma cell hypoxic status with potential implications for non-invasive diagnostics. J Neurooncol. 2019;144(3):477-488.
[13] ZHANG K, ZHANG X, CAI Z, et al. A novel class of microRNA- recognition elements that function only within open reading frames. Nat Struct Mol Biol. 2018;25(11):1019-1027.
[14] LEE SWL, PAOLETTI C, CAMPISI M, et al. MicroRNA delivery through nanoparticles. J Control Release. 2019;313:80-95.
[15] GOLDIE BJ, DUN MD, LIN M, et al. Activity-associated miRNA are packaged in Map1b-enriched exosomes released from depolarized neurons. Nucleic Acids Res. 2014;42(14):9195-9208.
[16] GUDURIC-FUCHS J, O'CONNOR A, CAMP B, et al. Selective extracellular vesicle-mediated export of an overlapping set of microRNAs from multiple cell types. BMC Genomics. 2012;13:357.
[17] ZHU Q, WANG Z, HU Y, et al. miR-21 promotes migration and invasion by the miR-21-PDCD4-AP-1 feedback loop in human hepatocellular carcinoma. Oncol Rep. 2012;27(5):1660-1668.
[18] ZHANG J, LI S, LI L, et al. Exosome and exosomal microRNA: trafficking, sorting, and function. Genomics Proteomics Bioinformatics. 2015;13(1):17-24.
[19] KOSAKA N, IGUCHI H, HAGIWARA K, et al. Neutral sphingomyelinase 2 (nSMase2)-dependent exosomal transfer of angiogenic microRNAs regulate cancer cell metastasis. J Biol Chem. 2013;288(15):10849-10859.
[20] VILLARROYA-BELTRI C, GUTIÉRREZ-VÁZQUEZ C, SÁNCHEZ-CABO F, et al. Sumoylated hnRNPA2B1 controls the sorting of miRNAs into exosomes through binding to specific motifs. Nat Commun. 2013;4:2980.
[21] BALAGUER N, MORENO I, HERRERO M, et al. Heterogeneous nuclear ribonucleoprotein C1 may control miR-30d levels in endometrial exosomes affecting early embryo implantation. Mol Hum Reprod. 2018;24(8):411-425.
[22] SANTANGELO L, GIURATO G, CICCHINI C, et al. The RNA-Binding Protein SYNCRIP Is a Component of the Hepatocyte Exosomal Machinery Controlling MicroRNA Sorting. Cell Rep. 2016;17(3): 799-808.
[23] KOPPERS-LALIC D, HACKENBERG M, BIJNSDORP IV, et al. Nontemplated nucleotide additions distinguish the small RNA composition in cells from exosomes. Cell Rep. 2014;8(6):1649-1658.
[24] SHURTLEFF MJ, TEMOCHE-DIAZ MM, KARFILIS KV, et al. Y-box protein 1 is required to sort microRNAs into exosomes in cells and in a cell-free reaction. Elife. 2016;5: e19276.
[25] MCKENZIE AJ, HOSHINO D, HONG NH, et al. KRAS-MEK Signaling Controls Ago2 Sorting into Exosomes. Cell Rep. 2016;15(5):978-987.
[26] LU P, LI H, LI N, et al. MEX3C interacts with adaptor-related protein complex 2 and involves in miR-451a exosomal sorting. PLoS One. 2017;12(10):e0185992.
[27] ZHANG Z, LI X, SUN W, et al. Loss of exosomal miR-320a from cancer-associated fibroblasts contributes to HCC proliferation and metastasis. Cancer Lett. 2017;397:33-42.
[28] RICHES A, CAMPBELL E, BORGER E, et al. Regulation of exosome release from mammary epithelial and breast cancer cells - a new regulatory pathway. Eur J Cancer. 2014;50(5):1025-1034.
[29] TŰZESI Á, KLING T, WENGER A, et al. Pediatric brain tumor cells release exosomes with a miRNA repertoire that differs from exosomes secreted by normal cells. Oncotarget. 2017;8(52):90164-90175.
[30] FIGUEROA J, PHILLIPS LM, SHAHAR T, et al. Exosomes from Glioma-Associated Mesenchymal Stem Cells Increase the Tumorigenicity of Glioma Stem-like Cells via Transfer of miR-1587. Cancer Res. 2017;77(21):5808-5819.
[31] SAKR M, TAKINO T, SABIT H, et al. miR-150-5p and miR-133a suppress glioma cell proliferation and migration through targeting membrane-type-1 matrix metalloproteinase.Gene.2016;587(2): 155-162.
[32] LEI W, YAN C, YA J, et al. MiR-199a-3p affects the multi-chemoresistance of osteosarcoma through targeting AK4. BMC Cancer. 2018;18(1):631.
[33] CAI Q, ZHU A, GONG L. Exosomes of glioma cells deliver miR-148a to promote proliferation and metastasis of glioblastoma via targeting CADM1. Bull Cancer. 2018;105(7-8):643-651.
[34] THURINGER D, CHANTELOUP G, BOUCHER J, et al. Modulation of the inwardly rectifying potassium channel Kir4.1 by the pro-invasive miR-5096 in glioblastoma cells. Oncotarget. 2017;8(23):37681-37693.
[35] SHARIF S, GHAHREMANI MH, SOLEIMANI M. Delivery of Exogenous miR-124 to Glioblastoma Multiform Cells by Wharton's Jelly Mesenchymal Stem Cells Decreases Cell Proliferation and Migration, and Confers Chemosensitivity. Stem Cell Rev Rep. 2018; 14(2):236-246.
[36] YANG JK, YANG JP, TONG J, et al. Exosomal miR-221 targets DNM3 to induce tumor progression and temozolomide resistance in glioma. J Neurooncol. 2017;131(2):255-265.
[37] YIN J, ZENG A, ZHANG Z, et al. Exosomal transfer of miR-1238 contributes to temozolomide-resistance in glioblastoma. EBioMedicine. 2019;42:238-251.
[38] YUE X, LAN F, XIA T. Hypoxic Glioma Cell-Secreted Exosomal miR-301a Activates Wnt/β-catenin Signaling and Promotes Radiation Resistance by Targeting TCEAL7. Mol Ther. 2019;27(11):1939-1949.
[39] GUO X, QIU W, WANG J, et al. Glioma exosomes mediate the expansion and function of myeloid-derived suppressor cells through microRNA-29a/Hbp1 and microRNA-92a/Prkar1a pathways. Int J Cancer. 2019;144(12):3111-3126.
[40] GUO X, QIU W, LIU Q, et al. Immunosuppressive effects of hypoxia- induced glioma exosomes through myeloid-derived suppressor cells via the miR-10a/Rora and miR-21/Pten Pathways. Oncogene. 2018; 37(31):4239-4259.
[41] QIAN M, WANG S, GUO X, et al. Hypoxic glioma-derived exosomes deliver microRNA-1246 to induce M2 macrophage polarization by targeting TERF2IP via the STAT3 and NF-κB pathways. Oncogene. 2019 Sep 4. doi: 10.1038/s41388-019-0996-y. [Epub ahead of print]
[42] SHBOUL ZA, ALAM M, VIDYARATNE L, et al. Feature-Guided Deep Radiomics for Glioblastoma Patient Survival Prediction. Front Neurosci. 2019;13:966.
[43] SHI R, WANG PY, LI XY, et al. Exosomal levels of miRNA-21 from cerebrospinal fluids associated with poor prognosis and tumor recurrence of glioma patients. Oncotarget. 2015;6(29):26971-26981.
[44] SANTANGELO A, IMBRUCÈ P, GARDENGHI B, et al. A microRNA signature from serum exosomes of patients with glioma as complementary diagnostic biomarker. J Neurooncol. 2018;136(1): 51-62.
[45] LANG FM, HOSSAIN A, GUMIN J, et al. Mesenchymal stem cells as natural biofactories for exosomes carrying miR-124a in the treatment of gliomas. Neuro Oncol. 2018;20(3):380-390.
[46] KIM R, LEE S, LEE J, et al. Exosomes derived from microRNA-584 transfected mesenchymal stem cells: novel alternative therapeutic vehicles for cancer therapy. BMB Rep. 2018;51(8):406-411.
[47] MONFARED H, JAHANGARD Y, NIKKHAH M, et al. Potential Therapeutic Effects of Exosomes Packed With a miR-21-Sponge Construct in a Rat Model of Glioblastoma. Front Oncol. 2019;9:782.
[48] FAREH M, ALMAIRAC F, TURCHI L, et al. Cell-based therapy using miR-302-367 expressing cells represses glioblastoma growth. Cell Death Dis. 2017;8(3):e2713.
[49] ZHOU J, GUO H, YANG Y, et al. A meta-analysis on the prognosis of exosomal miRNAs in all solid tumor patients. Medicine (Baltimore). 2019;98(16):e15335.
[50] LAN F, QING Q, PAN Q, et al. Serum exosomal miR-301a as a potential diagnostic and prognostic biomarker for human glioma. Cell Oncol (Dordr). 2018;41(1):25-33.
[51] SHI H, FANG X, LI Y, et al. High Expression of Serine Hydroxymethyltransferase 2 Indicates Poor Prognosis of Gastric Cancer Patients. Med Sci Monit. 2019;25:7430-7438.
[52] WANG ZF, LIAO F, WU H, et al. Glioma stem cells-derived exosomal miR-26a promotes angiogenesis of microvessel endothelial cells in glioma. J Exp Clin Cancer Res. 2019;38(1):201. |
| [1] | Gu Yubo, Zhang Dongliang, Yuan Wei, , Song Lujie. Exosomes from adipose-derived stem cells can promote cavernous nerve regeneration in rats [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(31): 4979-4985. |
| [2] | Li Zhenxiang, Jiang Xiaokui, Shen Fangfang, Li Shaoshan. Immuoregulatory effects of colorectal cancer cell-derived exosomes on CD8+ T cells [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(31): 5002-5006. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||