Chinese Journal of Tissue Engineering Research ›› 2020, Vol. 24 ›› Issue (20): 3275-3280.doi: 10.3969/j.issn.2095-4344.2647
Fibroblast growth factor 21 regulates browning of white fat: the role of exercise
Wang Lu, Yu Liang
- School of Sports and Human Sciences, Beijing Sport University, Beijing 100084, China
-
Received:2019-09-17Revised:2019-09-18Accepted:2019-11-15Online:2020-07-18Published:2020-04-14 -
Contact:Yu Liang, MD, Associate professor, School of Sports and Human Sciences, Beijing Sport University, Beijing 100084, China -
About author:Wang Lu, Master candidate, School of Sports and Human Sciences, Beijing Sport University, Beijing 100084, China -
Supported by:the Fok Ying Tung Education Foundation, No. 151095; the Self-Dependent Research Project of Beijing Sport University, No. 2016YB047 and 2017YB028
CLC Number:
Cite this article
Wang Lu, Yu Liang. Fibroblast growth factor 21 regulates browning of white fat: the role of exercise[J]. Chinese Journal of Tissue Engineering Research, 2020, 24(20): 3275-3280.
share this article
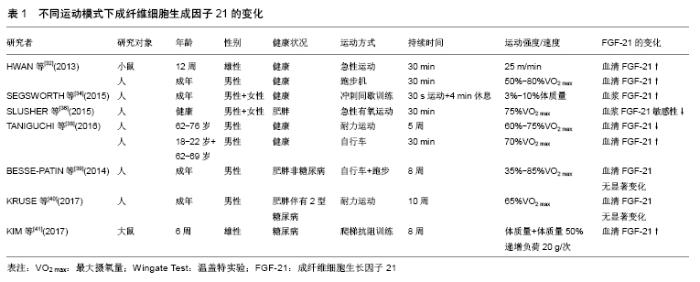
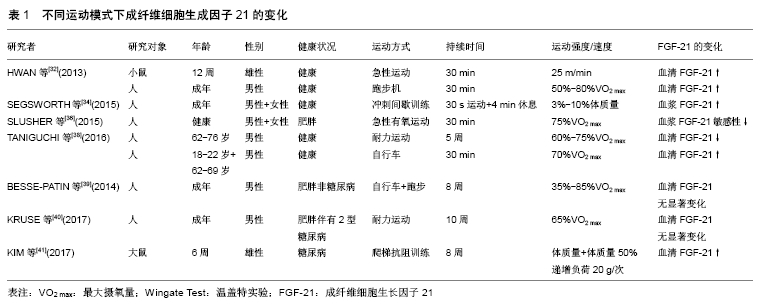
2.1 脂肪组织概述 脂肪是人体内一种维持能量代谢重要的内分泌组织,但若其在内脏器官或者皮下过度堆积,则会引起肥胖症、2型糖尿病和心血管疾病等一系列代谢类疾病。在哺乳动物体内,脂肪组织被分为:白色脂肪组织、棕色脂肪组织和米色脂肪组织3种[6]。 2.1.1 白色脂肪组织 白色脂肪组织来源于成肌调节因子5阴性祖细胞(Myf5-),是人体内存在最多的脂肪组织,以三酰甘油形式来储存能量,为单泡脂肪组织,所含线粒体较少,遍布于全身,主要分布在内脏和皮下脂肪组织,起到保温、储存脂肪和参与脂肪代谢的作用[7]。 2.1.2 棕色脂肪组织 棕色脂肪组织起源于成肌调节因子5阳性祖细胞(Myf5+),其中含有丰富的线粒体,可通过线粒体内膜表面的解偶联蛋白1的作用,使线粒体在氧化磷酸化的过程中解偶联,从而促进游离脂肪酸的代谢,起到消耗体内过剩能量的作用[8]。棕色脂肪组织相对白色脂肪组织来说分布较少,主要分布于锁骨、颈部和腹部等位置,当机体受到寒冷刺激时,易激活体内的棕色脂肪组织燃烧热量产热,从而起到御寒的作用。 2.1.3 米色脂肪组织 米色脂肪组织是一种介于白色脂肪组织和棕色脂肪组织之间解偶联蛋白1阳性的脂肪组织,与白色脂肪组织来源相同,但在形态功能上因和棕色脂肪组织相似,故又称其为“棕色样脂肪细胞”。当机体受到寒冷或过氧化物酶体增殖物激活受体γ(PPARγ)、瘦素、去甲肾上腺素等刺激后,会引起交感神经兴奋,这时这种脂肪细胞的数量会明显增加,使解偶联蛋白1基因高水平表达,从而使机体产热增加,促进能量的消耗[8-10],起到减脂的效果。 2.1.4 白色脂肪棕色化 白色脂肪棕色化的生理过程十分复杂,受转录因子、分泌因子及RNA等多种因素的调控。转录因子中PR结构域家族的第16个成员PRDM16(PR domain-containing 16),被冠以“棕色脂肪开关”一名,在白色脂肪细胞的祖细胞表达时,会激活棕色脂肪细胞的解偶联呼吸作用,增强线粒体的作用,调控过氧化物酶体增殖物活化受体γ协同刺激因子1α( peroxisome proliferator activated receptor gamma coactivator 1-alpha,PGC-1α)、解偶联蛋白1的表达[11],从而促进白色脂肪棕色化,是调控这一过程的核心转录因子。鸢尾素(Irisin)及Ⅲ型纤连蛋白组件包含蛋白5这两种分泌因子则均能通过促进白色脂肪组织中解偶联蛋白1的高表达来加快白色脂肪棕色化,且Ⅲ型纤连蛋白组件包含蛋白5可经过剪切后修饰成鸢尾素,从而促进棕色脂肪组织的形成[6]。miRNA是一种内源性非编码小RNA,可靶向调控多种基因。研究证实,在冷暴露刺激下,转录调节物Mef2的功能会受到抑制,通过下调miRNA-133的表达来减弱或消除对PRDM16的抑制作用,从而使脂肪和骨骼肌中的白色脂肪组织出现棕色化转变[12]。除此之外,与之相关的一些靶蛋白、信号分子(骨形态发生蛋白、mTOR)及氧化应激(硝酸盐、活性氧)等因素也参与白色脂肪棕色化的调控。FGF-21作为一种新发现的代谢调节因子,能在一定条件下促使PGC-1α、解偶联蛋白1高表达,因此,同样在白色脂肪棕色化的过程中发挥必不可少的作用。 2.2 FGF-21的生物学功能 FGF-21与FGF家族中的其他成员不同,它是FGF家族中目前发现的唯一不发生有丝分裂的蛋白,这就显著降低了它在临床用药方面的风险。FGF-21以自分泌、旁分泌和内分泌的形式入血,在体内发挥重要的代谢调节作用。 2.2.1 作为肌肉因子改善胰岛素抵抗 骨骼肌被认为是FGF-21的来源,其表达受到PI3K/Akt信号通路的调节,该通路与胰岛素信号转导及细胞肥大密切相关[13]。IZUMIYA等[14]报道在Akt特异性转基因小鼠中观察到骨骼肌纤维肥大的现象,同时发现肌肉和血清中FGF-21的表达增加。除此之外,FGF-21还被认为是由于不同类型的应激诱导产生的肌肉因子,运动会刺激循环FGF-21水平升高,从而有效改善自噬相关蛋白7基因缺陷诱导的小鼠胰岛素抵抗,抑制过度肥胖[15],与此同时还发现循环FGF-21水平的升高与胰岛素诱导肌肉FGF-21的表达密切相关;运动可通过上调心脏 FGF-21表达而有效改善自噬相关蛋白7 基因缺陷诱导的小鼠胰岛素抵抗及肥胖现象。以上实验在证实FGF-21改善胰岛素抵抗的同时也证实了其在调节能量代谢平衡、抑制肥胖方面起到的全身性作用。 作为肌肉因子,FGF-21不仅在改善胰岛素抵抗方面发挥作用,PLANAVILA等[16]发现敲除FGF-21的小鼠会出现心肌肥厚和心脏功能性障碍,这表明心肌细胞能产生并分泌FGF-21,从而预防心脏疾病的产生。 2.2.2 作为肝细胞因子发挥代谢调节作用 FGF-21在肝脏中大量表达,主要受过氧化物酶体增殖物激活受体(PPARs)以及Akt信号通路的调控。研究表明,长时间禁食会诱导啮齿类动物肝脏中FGF-21的表达[17],且这一过程主要受过氧化物酶体增殖物激活受体α(peroxisome proliferators activated receptorsα,PPARα)和 PPARγ介导[18]。由于FGF-21在肝脏中的大量表达使得其与肝脏疾病之间有着密切的联系,在未来对于肝脏疾病的预防及临床治疗方面具有很大的研究价值。 目前报道显示FGF-21在治疗酒精性脂肪肝病、病毒性肝炎及肝癌等肝脏类疾病方面起重要作用。LI等[19]研究报道酒精性脂肪肝病患者血清中FGF-21水平显著低于正常人,且长期的酒精摄入会引起糖代谢的紊乱,FGF-21可在不依赖胰岛素调节的前提下,通过调控葡萄糖转运体蛋白1的方式来调节糖代谢,保证糖代谢的稳态。众所周知,肝脏是酒精代谢的主要场所,但酒精在代谢过程中会引起肝脏脂代谢的紊乱。DESAI等[20]、LIU等[21]报道患有酒精性脂肪肝病的小鼠在注射 FGF-21后,肝脏脂肪变性和肝脏炎症得到缓解。此外,FGF-21还可调节全身糖皮质激素水平,抑制饥饿反应[22],辅助代谢毒性物质。CHENG等[23]报道在敲除FGF-21的小鼠发现其体内二恶英的毒性增强,这表明FGF-21具有代谢这种毒性的作用。 2.2.3 作为脂肪因子促进白色脂肪棕色化 FISHER等[4]报道FGF-21具有促进棕色脂肪组织、腹股沟及附睾白色脂肪组织中解偶联蛋白1等产热基因表达的作用,并能促进腹股沟内白色脂肪棕色化,这些作用主要依赖于PGC-1α。有报道称FGF-21对PGC-1α的调控作用可能是在蛋白水平,而并非基因水平。KEIPERT等[24]在解偶联蛋白1转基因小鼠中发现其脂肪分解能力、心肺功能及白色脂肪棕色化的能力都增加,这与FISHER等研究结果一致。VéNIANT等[25]发现缺乏白色脂肪组织而脂营养不良的小鼠使用FGF-21后对小鼠的代谢没有产生影响,将小鼠体内移植白色脂肪组织后同样使用FGF-21,发现其代谢活性增加,这表明白色脂肪组织是FGF-21表达代谢活性的主要场所。FGF-21作为一种脂肪因子,功能上有很多和脂联素相似的地方,脂联素是一种由白色脂肪组织产生的脂肪因子,可以内分泌的形式维持肝脏和骨骼肌中糖脂代谢的稳态,白色脂肪组织中产生的FGF-21会增强血清和白色脂肪组织中脂联素的表达。因此,脂联素作为白色脂肪组织中FGF-21的下游效应因子,介导FGF-21对肝脏和骨骼肌的能量代谢及对胰岛素的敏感性[26-27]。研究表明FGF-21可减少肥胖动物体内神经酰胺的积累,改善由于包括鞘脂神经酰胺在内的脂质的异常积累而产生的胰岛素抵抗现象。HOLLAND等[27]报道在敲除小鼠脂联素后,由FGF-21诱导的能量消耗和其对神经酰胺的降低作用受到影响,由此可见FGF-21-脂联素-神经酰胺轴在控制能量消耗、促进白色脂肪棕色化、调节胰岛素方面发挥重要作用。 2.3 FGF-21调控白色脂肪棕色化的诱导因素 2.3.1 冷暴露 目前的研究结果表明,冷暴露是促进白色脂肪棕色化效果最为明显的诱导因素。有研究发现经冷暴露诱导后的小鼠会产生米色脂肪,将产生米色脂肪的小鼠放置于温暖环境下生活5周后其体内产生的米色脂肪在逐渐消失[28]。LEE等[29]通过人体试验结果同样证实了这一点,健康年轻男性在19 ℃条件下连续1个月每天保持8 h睡眠时间,其体内米色脂肪组织会逐渐增加;保持其他条件不变升高温度,发现米色脂肪会逐渐减少。这表明冷暴露可以促进米色脂肪组织的生成,且这个过程是可逆的,在一定范围内,降低温度时米色脂肪生成增加,升高温度时米色脂肪组织会逐渐消失。 冷暴露会诱导白色脂肪组织中的FGF-21表达为Fgfr1c和β-Klotho,FISHER等[30]发现敲除FGF-21基因的小鼠体内米色脂肪细胞会受损,表明FGF-21可诱导米色脂肪产生和聚集。冷暴露同样也可诱导棕色脂肪组织中的FGF-21表达,激活棕色脂肪组织。在人体实验中证明,冷暴露会增加FGF-21循环水平,激活棕色脂肪组织,并通过白色脂肪棕色化提高脂肪的分解速度和热诱导反应[31]。 虽冷暴露会诱导FGF-21激活产热机制消耗能量产热,以达到御寒的作用,同时会因消耗脂肪而起到减脂的作用,但要想通过这一手段达到减脂的效果,并不切合实际需求,实用性差。目前国内外正在积极探索其他更切合实际需求的途径来诱导FGF-21的产生,尤其是通过的运动的方式,最终达到促进白色脂肪棕色化的积极效应。 2.3.2 药物 由于米色脂肪可有效抑制肥胖的发生,同时它还具备其他减肥产品或手术等方式不具备的无毒无害、无反弹效果的优势,所以近年来国内外越来越多的研究人员均在尝试通过药理学手段来加快米色脂肪的生成,促进白色脂肪棕色化,从而达到期望的减肥目的。目前被认为较有潜力的相关药物包括瘦素、PPAR-γ、β3肾上腺素能受体(β3-AR)激动剂等。瘦素是一种主要由白色脂肪组织分泌的脂肪因子,其生理功能主要包括增加能量消耗、抑制食欲、减少脂肪摄取及抑制脂肪合成等。VéNIANT等[25]研究发现FGF-21通过白色脂肪组织和瘦素在小鼠体内促进代谢稳态。脂营养不良小鼠体内注射FGF-21发现并未发挥作用,移植白色脂肪组织后注射FGF-21发现作用恢复,表明FGF-21依赖于白色脂肪组织而发挥作用。VéNIANT等还单纯将瘦素注入至脂营养不良小鼠体内,发现瘦素依然发挥作用,将瘦素和FGF-21同时注入至脂营养不良的小鼠体内发现作用产生叠加,由此证明FGF-21可能通过瘦素在白色脂肪组织中发挥其代谢调节的作用。因此在药理学方面,FGF-21也可为促进白色脂肪棕色化的药物研制方面提供新的理论依据。 2.3.3 运动 目前人体和动物实验中大部分表明,运动可诱导机体产生FGF-21,使其分泌量增加,从而在白色脂肪棕色化的过程中起到促进作用,不同的运动方式对于FGF-21表达水平的影响不尽相同。 (1)急性运动:FGF-21水平可能与急性运动强度相关。HWAN等[32]发现一次性急性运动后小鼠血清中FGF-21表达升高,并伴有游离脂肪酸和甘油水平升高。此外HWAN等还通过人体试验证实在以50%-80%最大摄氧量(VO2max)强度运动后,血清中FGF-21水平也会增加。有研究通过统计分析临床数据发现,急性运动后骨骼肌和血清中FGF-21表达升高,并且受试人群下肢肥胖指数(BMI)显著降低[33]。SEGSWORTH 等[34]发现冲刺跑间歇训练(SIT)与体脂含量的大量减少有关。最新研究表明,肌肉因子可能通过冲刺跑间歇训练的方式促进脂肪的减少。该研究比较了冲刺跑间歇运动(SIE)和连续运动(CE)后3种肌肉因子(白细胞介素15、鸢尾素和FGF-21)的变化,发现冲刺跑间歇运动能显著提高FGF-21水平,表明FGF-21可能与运动后脂肪的分解代谢有关。研究证明,长期的运动干预可上调β-Klotho与FGF-21受体2的表达[35],提高FGF-21的敏感性,使得其可与更多的受体结合而在体内发挥作用,并在长时间的运动干预中最终形成FGF-21调控脂代谢的稳定状态。相比之下,SLUSHER等[36]选取未经训练的受试者进行连续30 min的急性有氧运动,运动后肥胖受试者较正常受试者FGF-21的敏感性降低,表明急性运动可能影响肥胖个体FGF-21敏感性,导致代谢反应减弱(如葡萄糖、脂肪)和总运动能量的消耗减少,提示可以通过运动的方式增加FGF-21通量来调控肥胖人群能量代谢、改善心肺健康。综上所述,急性运动会增强机体FGF-21的循环水平,增加机体能量代谢,促进白色脂肪棕色化,但这种作用可能与肥胖及急性运动的强度等因素密切相关。 (2)耐力运动:TANIGUCHI等[37]经过对日本老年男性进行5周的耐力运动干预试验发现,定期耐力运动在不会降低体质量的前提下,显著降低老年人的肝脏脂肪含量及血清FGF-21水平,且血清FGF-21水平的变化与肝脏脂肪含量的变化呈正相关。这项研究结果表明,耐力运动诱导的肝脏脂肪含量减少介导了FGF-21的变化,定期的耐力运动可以通过改善FGF-21水平来降低肝脏脂肪含量。TANIGUCHI等[38]还发现耐力运动可调节餐后FGF-21代谢水平且不受年龄因素的限制。有关耐力运动能否介导FGF-21促进白色脂肪棕色化,目前研究结果仍存在争议,有待于进一步证实。BESSE-PATIN等[39]发现肥胖非糖尿病受试者在经过8周耐力运动后,体内脂肪含量显著减少,但肌肉中FGF-21、鸢尾素、白细胞介素6及肌肉生长抑制素并没有显著变化。KRUSE 等[40]同样证实了这一结论,胰岛素会诱导肌肉中FGF-21表达增加,且这种程度的增加与耐力运动、肥胖及2型糖尿病均无显著相关。超重/肥胖虽会引起白色脂肪组织中的KLB表达减少,但由于FGFR1c的高表达及其他机制的作用也可使白色脂肪组织中大多数FGF-21的靶基因充分表达。 (3)抗阻运动:目前国内外关于抗阻运动对FGF-21水平变化影响的研究相对较少。研究发现抗阻运动和有氧运动皆能显著提高FGF-21的表达水平,且抗阻运动效果更为明显。KIM等[41]研究证实,大鼠在进行8周的爬梯抗阻训练后,血清中的FGF-21和骨骼肌中的鸢尾素水平均有明显增加,表明抗阻训练可上调FGF-21和鸢尾素水平。最新研究表明,FGF-21和鸢尾素这两种肌肉因子均能调节PGC-1α的表达,促进白色脂肪棕色化,增加机体能量消耗,可能成为肥胖等代谢类疾病的潜在治疗靶点[42]。因此,结合相关研究,KIM等提出FGF-21-PGC-1α-Irisin轴可能在肥胖等代谢类疾病中发挥作用。FGF-21在肥胖小鼠中的代谢作用,与棕色脂肪的产热机制密切相关,目前临床试验中也正在积极探究这类分子的治疗效用。 综上所述,由于运动方式、运动时间及运动强度等因素的不同(表1),目前关于通过运动的方式介导FGF-21促进米色脂肪的生成及白色脂肪棕色化等问题仍存在较大争议,需进一步研究证实。 "
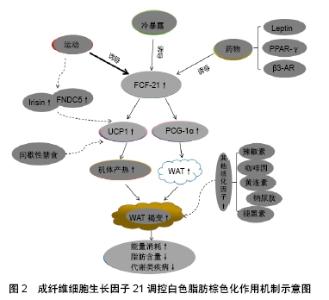
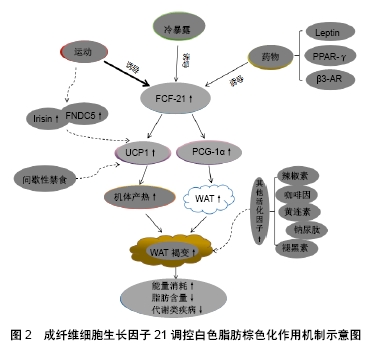
2.4 其他因素的调控作用 除FGF-21在白色脂肪棕色化的过程中发挥作用外,研究还发现白细胞介素6、鸢尾素等因子及间歇性禁食的方法都可以调控白色脂肪棕色化。目前国内外已有多人报道人体在运动时,体内白细胞介素6水平升高,KNUDSEN等[43]报道在小鼠腹股沟的白色脂肪组织中,白细胞介素6可以调节由于运动而引起的解偶联蛋白1的高表达,提示白细胞介素6在白色脂肪棕色化中发挥作用。LI等[44]发现隔日禁食的方法可以促进体内多余的脂肪消耗,从而达到减脂的效果。通过隔日禁食的方法会使白色脂肪组织中的解偶联蛋白1的表达增加,说明隔日禁食通过使白色脂肪棕色化发挥减脂作用,与此同时LI等还发现,隔日禁食的方法会使肠道菌群正常的小鼠白色脂肪棕色化,但不会对肠道菌群减少的小鼠产生的“棕色化”的作用,这表明隔日禁食法引起白色脂肪棕色化的作用是通过影响肠道菌群最终实现的。此外,另有研究表明,当辣椒素、褪黑素、黄连素、咖啡因、钠尿肽等一系列活化因子的水平上调时,同样会加快白色脂肪棕色化的进程[45](图2)。"
| [1] KLIEWER SA, MANGELSDORF DJ. A Dozen Years of Discovery: Insights into the Physiology and Pharmacology of FGF21.Cell Metab. 2019;29(2):246-253. [2] RODRÍGUEZ A, BECERRIL S, EZQUERRO S, et al. Crosstalk between adipokines and myokines in fat browning.Acta Physiol.2017; 219(2):362-381. [3] LEE P, SWARBRICK M, GREENFIELD J. The Sum of All Browning in FGF21 Therapeutics.Cell Metab.2015; 21(6):795-796. [4] FISHER FM, KLEINER S, DOURIS N, et al. FGF21 regulates PGC-1α and browning of white adipose tissues in adaptive thermogenesis. Genes Dev.2012;26(3):271-281. [5] HONDARES E, IGLESIAS R, GIRALT A, et al. Thermogenic Activation Induces FGF21 Expression and Release in Brown Adipose Tissue. J Biol Chem.2011;286(15):12983-12990. [6] WU J, BOSTRÖM P, SPARKS L, et al. Beige Adipocytes Are a Distinct Type of Thermogenic Fat Cell in Mouse and Human. Cell.2012; 150(2): 366-376. [7] THYAGARAJAN B, FOSTER MT. Beiging of white adipose tissue as a therapeutic strategy for weight loss in humans. Horm Mol Biol Clin Investig.2017;31(2):0016. [8] 张洁,牛燕媚,傅力.白色脂肪棕色化——运动减肥的新靶点[J].中国运动医学杂志, 2014,33(8):826-829+840. [9] BARTELT A, HEEREN J. Adipose tissue browning and metabolic health. Nat Rev Endocrinol.2014;10(1):24-36. [10] 高芸,庞卫军,杨公社.棕色和米色脂肪激活剂:潜在的减肥靶标[J].中国生物化学与分子生物学报, 2018, 34(4): 371-376. [11] SEALE P, KAJIMURA S, YANG W, et al. Transcriptional Control of Brown Fat Determination by PRDM16. Cell Metab. 2007;6(1):0-54. [12] TRAJKOVSKI M, AHMED K, ESAU CC, et al. MyomiR-133 regulates brown fat differentiation through Prdm16. Nat Cell Biol.2012;14(12): 1330-1335. [13] SEO YJ, LEE K, CHEI S, et al. Ishige okamurae Extract Ameliorates the Hyperglycemia and Body Weight Gain of db/db Mice through Regulation of the PI3K/Akt Pathway and Thermogenic Factors by FGF21.Mar Drugs.2019;17(7). [14] IZUMIYA Y, BINA HA, OUCHI N, et al. FGF21 is an Akt-regulated myokine. FEBS Letters. 2008;582(27):3805-3810. [15] YAN Z, KRONEMBERGER A, BLOMME J, et al. Exercise leads to unfavourable cardiac remodelling and enhanced metabolic homeostasis in obese mice with cardiac and skeletal muscle autophagy deficiency. Sci Rep.2017;7:7894. [16] PLANAVILA A, REDONDO I, HONDARES E, et al. Fibroblast growth factor 21 protects against cardiac hypertrophy in mice.Nat Commun. 2013;4(3):2019. [17] YU J, YU B, JIANG H, et al. Conjugated linoleic acid induces hepatic expression of fibroblast growth factor 21 through PPARalpha.Br J Nutr.2012;107(4):461-465. [18] YANG W, CHEN X, LIU Y, et al. N-3 polyunsaturated fatty acids increase hepatic fibroblast growth factor 21 sensitivity via aPPAR-gamma-beta-klotho pathway.Mol Nutr Food Res.2017; 61(9):1601075. [19] LI H, WU G, FANG Q, et al. Fibroblast growth factor 21 increases insulin sensitivitythrough specific expansion of subcutaneous fat.Nat Commun.2018; 9(1):272. [20] DESAI BN, SINGHAL G, WATANABE M, et al. Fibroblast growth factor 21 (FGF21) isrobustly induced by ethanol and has a protective role in ethanol associated liver injury. Mol Metab.2017;6(11):1395-1406. [21] LIU Y, ZHAO C, XIAO J, et al. Fibroblast growth factor 21 deficiency exacerbates chronic alcohol-induced hepatic steatosis and injury. Sci Rep.2016;6:31026. [22] BOOKOUT AL, DE GROOT MH, OWEN BM, et al. FGF21 regulates circadian behavior and metabolism by acting on the nervous system. Nat Med.2013;19(9):1147-1152. [23] CHENG X, VISPUTE SG, LIU J, et al. Fibroblast growth factor (Fgf) 21 is a novel target gene of the aryl hydrocarbon receptor (AhR). Toxicol Appl Pharm. 2014;278(1):65-71. [24] KEIPERT S, OST M, JOHANN K, et al. Skeletal muscle mitochondrial uncoupling drives endocrine cross-talk through the induction of FGF21 as a myokine. Am J Physiol Endocrinol Metab. 2014; 306(5):E469-482. [25] VÉNIANT MURIELLE M, CLARENCE H, JOAN H, et al. FGF21 Promotes Metabolic Homeostasis via White Adipose and Leptin in Mice. PLoS One.2012;7(7):e40164. [26] LIN Z, TIAN H, LAM KS, et al. Adiponectin mediates the metabolic effects of FGF21 on glucose homeostasis and insulin sensitivity inmice. Cell Metab.2013;17:779-789. [27] HOLLAND WL, ADAMS AC, BROZINICK JT, et al. An FGF21-adiponectin-ceramide axis controls energy expenditure and insulin action in mice. Cell Metab.2013;17:790-797. [28] CAO L, CHOI E, LIU X, et al. White to brown fat phenotypic switch induced by genetic and environmental activation of a hypothalamic- adipocyte axis.Cell Metab.2001;14(3):324-338. [29] LEE P, SMITH S, LINDERMAN J, et al. Temperature-acclimated brown adipose tissue modulates insulin sensitivity in humans.Diabetes.2014; 63:3686-3698. [30] FISHER FM, ESTALL JL, ADAMS AC, et al. Integratedregulation of hepatic metabolism by fibroblast growth factor 21 (FGF21) in vivo. Endocrinology. 2011;152(8):2996–3004. [31] LEE P, LINDERMAN JD, SMITH S, et al. Irisin and FGF21 Are Cold-Induced Endocrine Activators of Brown Fat Function in Humans. Cell Metab.2014;19(2):302-309. [32] HWAN KK, HUN KS, YOUNG-KI M, et al. Acute Exercise Induces FGF21 Expression in Mice and in Healthy Humans. PLoS One.2013; 8(5):e63517. [33] DA SILVEIRA CAMPOS RM, DMASO AR,MASQUIO DCL, et al. The effects of exercise training associated with low-level laser therapy on biomarkers of adipose tissue transdifferentiation in obese women. Lasers Med Sci.2018;33:1245-1254. [34] SEGSWORTH, BLAIR M. Acute Sprint Interval Exercise Induces a Greater FGF-21 Response in Comparison to Work-Matched Continuous Exercise. Elec Thesis Dis Rep.2015; 3254. [35] FLETCHER JA, MEERS GM, LAUGHLIN MH, et al. Modulating fibroblast growth factor 21 in hyperphagic OLETF rats with daily exercise and caloric restriction. Appl Physiol Nutr Metab.2012; 337(6): 1054-1062. [36] SLUSHER AL, WHITEHURST M, ZOELLER RF, et al. Attenuated fibroblast growth factor 21 response to acute aerobic exercise in obese individuals.Nutr Metab Cardiovasc Dis.2015; 25(9):839-845. [37] TANIGUCHI H,TANISAWA K, SUN X, et al. Endurance exercise reduces hepatic fat content and serum fibroblast growth factor 21 levels in elderly men.J Clin Endocrinol Metab.2016;101(1):191. [38] TANIGUCHI H, TANISAWA K, SUN X, et al. Acute endurance exercise lowers serum fibroblast growth factor 21 levels in Japanese men. Clin Endocrinol.2016;85(6): 861-867. [39] BESSE-PATIN A, MONTASTIER E, VINEL C, et al. Effect of endurance training on skeletal muscle myokine expression in obese men: identification of apelin as a novel myokine.Int J Obes.2014;38(5): 707-713. [40] KRUSE R, VIENBERG SG, VIND BF, et al. Effects of insulin and exercise training on FGF21, its receptors and target genes in obesity and type 2 diabetes. Diabetologia.2017;60(10):2042. [41] KIM HJ, SONG W. Resistance training increases fibroblast growth factor-21 and irisin levels in the skeletal muscle of Zucker diabetic fatty rats. J Exerc Nutrition Biochem.2017;21(3):50-54. [42] LEE P, LINDERMAN JD, SMITH S, et al. Irisin and FGF21 are cold-induced endocrine activators of brown fat function in humans. Cell Metab.2014;19: 302-309. [43] KNUDSEN JG, MURHOLM M, CAREY AL, et al. Role of IL-6 in Exercise Training- and Cold-Induced UCP1 Expression in Subcutaneous White Adipose Tissue. PLoS One.2014;9(1):e84910. [44] LI G, XIE C, LU S, et al. Intermittent Fasting Promotes White Adipose Browning and Decreases Obesity by Shaping the Gut Microbiota.Cell Metab.2017;26(5):801. [45] THYAGARAJAN B, FOSTER MT. Beiging of white adipose tissue as a therapeutic strategy for weight loss in humans. Horm Mol Biol Clin Investig.2017;31(2):1-13. |
| [1] | Shen Jinbo, Zhang Lin. Micro-injury of the Achilles tendon caused by acute exhaustive exercise in rats: ultrastructural changes and mechanism [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1190-1195. |
| [2] | Wang Mengting, Gu Yanping, Ren Wenbo, Qin Qian, Bai Bingyi, Liao Yuanpeng. Research hotspots of blood flow restriction training for dyskinesia based on visualization analysis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1264-1269. |
| [3] | Wang Yongsheng, Wu Yang, Li Yanchun. Effect of acute high-intensity exercise on appetite hormones in adults: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1305-1312. |
| [4] | Liu Bo, Chen Xianghe, Yang Kang, Yu Huilin, Lu Pengcheng. Mechanism of DNA methylation in exercise intervention for osteoporosis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(5): 791-797. |
| [5] | Zhao Xiang, Wei Cuilan, Zhang Yeting. Neurogenesis and neuroinflammation under exercise: alteration and regulation [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(5): 813-820. |
| [6] | Chen Ziyang, Pu Rui, Deng Shuang, Yuan Lingyan. Regulatory effect of exosomes on exercise-mediated insulin resistance diseases [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(25): 4089-4094. |
| [7] | Jiang Xiaoyan, Zhu Haifei, Lin Haiqi, Lin Wentao. Cold therapy promotes self-limited recovery of delayed-onset muscle soreness [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(23): 3609-3613. |
| [8] | Bai Shengchao, Gao Yang, Wang Bo, Li Junping, Wang Ruiyuan. Dynamic changes of mitochondrial function of the skeletal muscle after acupuncture intervention in rats with heavy load exercise-induced injury [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(23): 3648-3653. |
| [9] | Lu Jie, Li Xue, Wang Lu, Fan Jia, Zhang Yeting, Lu Xiaobin, Yuan Qiongjia. Effects of different-intensity swimming exercises on spatial learning and memory ability and the expression of Orexin A in the rat cerebellum [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(23): 3697-3703. |
| [10] | Wang Zhen, Lin Haiqi, He Fei, Lin Wentao. Exercise activates skeletal muscle satellite cells: exercise prevention and treatment for age-related sarcopenia and muscle injury [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(23): 3752-3759. |
| [11] | Wang Chaoge, Weng Xiquan, Lin Baoxuan, Chen Lina, Xu Guoqin. Exercises under cold exposure change fat type and function in obese rats [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(20): 3162-3167. |
| [12] | Liu Bo, Chen Xianghe, Yang Kang, Sun Changliang, Yu Huilin, Lu Pengcheng. Epigenetic reprogramming and exercise regulation of bone metabolism disorders [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(20): 3210-3218. |
| [13] | Wang Jing, Wu Jiangbo. Irisin mediates protective effects on failing heart via integrin alpha V receptors [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(20): 3219-3225. |
| [14] | Lu Yi, Deng Wenchong. Regulation and difference of different exercise styles on brain structure and cognitive function [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(20): 3252-3258. |
| [15] | Lin Haiqi, Chen Liang, Tang Lu, Weng Xiquan, Lin Wentao. Significance of urinary proteomics assessing pathological changes in the body [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(20): 3259-3266. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||